INTRODUCCIÓN
El cilio primario es un orgánulo apendicular, único e inmóvil, existente en numerosos tipos celulares, entre los que se encuentran las células óseas y donde ejerce funciones similares a una antena, recibiendo señales químicas y mecánicas (1). A pesar de estar presente en casi todas las células del ser humano, su presencia no es constante en ellas, sino que se ensambla y se reabsorbe en un proceso dependiente del ciclo celular: se forma durante la fase quiescente y desaparece antes de entrar en mitosis (1,2).
La carga mecánica es uno de los moduladores más relevantes para la formación y el mantenimiento de la masa y la arquitectura ósea (3). La presencia del cilio primario en los osteocitos es imprescindible para el desempeño de la función mecánica (4-6). Además de su papel como mecanorreceptor, el cilio primario acumula gran cantidad de receptores, entre los que se encuentra el receptor tipo 1 de la parathormona (PTH) y la proteína relacionada con la parathormona (PTHrP), PTH1R (7-9).
PTH1R se expresa en osteoblastos y osteocitos donde cumple funciones clave para la regulación del metabolismo óseo (10). La PTHrP es una citoquina que se expresa en numerosos tejidos. En el tejido óseo ejerce funciones locales, principalmente a través del receptor PTH1R, aunque se conocen otros efectos independientes de este receptor (11-14). PTH1R, además de ser activado tras la unión a sus agonistas, PTH y PTHrP, es sensible a los estímulos mecánicos. Se ha descrito que la estimulación mecánica puede activar directamente a PTH1R en ausencia de ligando, indicando la importancia del receptor de PTH como mecanosensor en osteocitos y osteoblastos (15,16). En este sentido, nuestro grupo ha demostrado que PTH1R es un componente fundamental en el proceso de transducción de señales mecánicas en las células osteocíticas MLO-Y4 (16,17). En estas células, la activación de PTH1R en ausencia de ligando ocurre inmediatamente después de la estimulación mecánica con flujo de fluido, gracias a un aumento de la afluencia de calcio intracelular (18). Además, el flujo de fluido induce un incremento de PTH1R en la membrana plasmática de las células MLO-Y4 (19).
Recientemente hemos demostrado que la estimulación mecánica por flujo de fluido en las células MLO-Y4, induce la traslocación de PTH1R al cilio primario (20). En estas condiciones, los osteocitos inhiben la migración y la diferenciación de los precursores osteoclásticos, a través de la alteración de la secreción de las citoquinas CXCL5 e IL-6 (21). A pesar de que la presencia del receptor PTH1R en el cilio primario es también relevante para las acciones de la PTHrP (22), se desconoce si la PTHrP (1-37) induce cambios en la traslocación del receptor al cilio primario de manera similar a los ejercidos por la estimulación mecánica.
En el presente trabajo nos planteamos estudiar los efectos de la estimulación con PTHrP (1-37) en la línea de osteocitos MLO-Y4 sobre la movilidad del receptor PTH1R en la membrana plasmática, analizando la posible colocalización del receptor en el cilio primario, así como la implicación de las citoquinas CXCL5 e IL-6, producidas por osteocitos tras el estímulo con PTHrP, en la diferenciación de los precursores osteoclásticos.
MATERIALES Y MÉTODOS
CULTIVO CELULAR
Las células osteocíticas de ratón MLO-Y4 (generosamente donadas por la Dra. Lynda Bonewald) se cultivaron en α-MEM suplementado con 2,5 % de suero fetal de ternera (SFT), 2,5 % de suero fetal bovino (SFB), penicilina (100 unidades/ml) y estreptomicina (100 µg/ml) en un incubador humidificado con un 5 % de CO2 a 37 °C. Las células se sembraron a una densidad de 25 000 células/cm2 en placas de cultivo convencionales o en portaobjetos de vidrio (FlexCell International Corp., Hillsborough, NC, EE. UU.), revestidas con una matriz de colágeno tipo I (Sigma Aldrich, St. Luis, MO, EE. UU.). Las células se mantuvieron en cultivo hasta que estuvieron casi totalmente confluentes. Al día siguiente, se reemplazó el medio de cultivo por medio α-MEM sin rojo fenol con 1 % de SFB y las células se mantuvieron en esta condición durante 24 horas. Posteriormente, las células se estimularon con el péptido exógeno PTHrP (1-37) (Bachem, Bubendorf, Suiza) a una concentración de 100 nM durante 10 minutos. Las células que no fueron estimulas serán los controles estáticos (CE). Después, las células se incubaron durante 18 horas con α-MEM sin rojo fenol, sin SFB y sin SFT. Transcurrido este tiempo se llevó a cabo la recogida de medios condicionados (MC). Además, se utilizó sangre obtenida del Centro de Transfusión de la Comunidad de Madrid. Las células mononucleares de sangre periférica (CMSP) para generar osteoclastos humanos in vitro se aislaron a partir de la capa leucocitaria. Estas células se cultivaron en medio α-MEM suplementado con un 10 % de SFT, 100 unidades/ml de penicilina y 100 µg/ml de estreptomicina, en atmósfera húmeda de 5 % de CO2 y a 37 °C. Los monocitos humanos se dejaron crecer hasta alcanzar una confluencia del 90 %.
INHIBICIÓN DEL CILIO PRIMARIO, PTH1R, GLI1, AMP CÍCLICO Y FOSFOLIPASA C
La formación del cilio primario y la actividad del PTH1R se inhibieron tratando a las células durante 1 h con hidrato de cloral acuoso 1 mM o con 100 nM de PTHrP (7-34), respectivamente. El factor de transcripción Gli se inhibió utilizando 10 µM de Gli-1-Antagonist 61 (GANT61; Santa Cruz Biotechnology) durante 1 h cuando fue apropiado. El AMPc y la fosfolipasa C se inhibieron durante 1 h con 100 μM del inhibidor del adenilato ciclasa SQ22536 o con 1 μM del inhibidor de la fosfolipasa C U73122, respectivamente.
TRANSFECCIÓN CELULAR
Las células MLO-Y4 se transfectaron de manera transitoria con un plásmido portador de ADN complementario (ADNc) codificante para PTH1R humano fusionado con el gen reportero proteína fluorescente verde (GFP) (GFPPTH1R) (generosamente donada por el Dr. Peter Friedman) utilizando lipofectamina 3000 (Life Technologies) durante 4 h a 37 °C, según las directrices del fabricante.
INMUNOFLUORESCENCIA
Las células se fijaron utilizando paraformaldehído (PFA) al 4 % en PBS, pH 7,4, durante 10 minutos y, posteriormente, se permeabilizaron con Tritón X-100 al 0,5 % en PBS, a pH 7,4 durante 5 minutos. Para el bloqueo de las uniones inespecíficas, las células se incubaron durante 1 hora con albúmina de suero bovino (BSA) al 10 % suplementado con un 5 % de suero de cabra. A continuación, se incubaron con el anticuerpo monoclonal producido en ratón antitubulina α-acetilada (Sigma Aldrich), diluido 1:1000 en BSA 1X (100 ml de BSA al 10 % diluido en 900 ml de PBS), durante toda la noche, a 4 °C y en agitación. Al día siguiente, se realizaron varios lavados con PBS 1X y se añadió el anticuerpo secundario antiinmunoglobulina G (IgG) de ratón conjugado con Alexa flúor 546 (Invitrogen, Waltham, MA, EE. UU.), diluido 1/1000 en BSA 1X, durante 1 hora a temperatura ambiente. Posteriormente, se realizaron varios lavados con PBS 1X, y se llevó a cabo el montaje con el reactivo FluorSafe (Calbiochem, La Jolla, CA, EE. UU.). Las muestras se analizaron con el microscopio confocal Leica DMI8, evaluándose la colocalización entre el cilio primario y el receptor PTH1R en las células que había sido transfectadas con el plásmido GFPPTH1R, teniéndose en cuenta si la colocalización se había producido solo en la base o a lo largo de todo el cilio primario. También se analizó la longitud del cilio primario, gracias al software ImageJ.
GENERACIÓN DE OSTEOCLASTOS PARA LA EVALUACIÓN DE LA OSTEOCLASTOGÉNESIS
Los monocitos humanos obtenidos del aislamiento de la capa leucocitaria fueron utilizados para el ensayo de diferenciación hacia osteoclastos. Una vez que alcanzaron el 90 % de confluencia, se retiró el medio de cultivo, se lavó dos veces con PBS 1X y se llevó a cabo la tripsinización (en 0,25 % v/v de tripsina y 1 mM de ácido etilendiaminotetraacético [EDTA]) durante 30 minutos, utilizando un rascador celular. Para el ensayo de diferenciación, se sembraron 20 000 células/pocillo en una placa de 96 pocillos con el medio de cultivo α-MEM suplementado con un 10 % de SFT, 100 unidades/ml de penicilina y 100 μg/ml de estreptomicina, además de 20 ng/ml de M-CSF y 20 ng/ml de RANKL (ProSpec, Ness-Ziona, Israel). Los controles fueron cultivados con el mismo medio de cultivo, pero sin RANKL. Pasados tres días, el medio de cultivo se reemplazó por medio fresco sin rojo fenol, conteniendo M-CSF y RANKL, según correspondiera, y añadiéndose además un 20 % de los distintos MC de las células MLO-Y4. A los controles se le añadió un 20 % de medio α-MEM sin SFT. Además, se añadieron anticuerpos neutralizantes; 2 μg/mL de anti-CXCL5 y 1 μg/ml de anti-IL-6. Los monocitos humanos estuvieron en contacto con los MC de las MLO-Y4 durante 3 días. Pasado este tiempo, se retiró el medio de cultivo y se lavó con PBS 1X para eliminar las células no adherentes. Las células fueron fijadas con PFA al 4 % durante 10 minutos, permeabilizadas con metanol al 100 % durante 20 minutos, y teñidas con hematoxilina durante 5 minutos. La diferenciación de los monocitos humanos hacia osteoclastos se determinó por la morfología de las células obtenidas, observándose la formación de células gigantes con tres o más núcleos. Las imágenes fueron realizadas gracias al microscopio Leica DMI1, evaluándose el número de células osteoclásticas con tres o más núcleos mediante el software ImageJ.
ANÁLISIS ESTADÍSTICO
Los datos están expresados como las medias ± desviaciones estándar (DE). El análisis estadístico se realizó con GraphPad Prism (software de GraphPad). Las diferencias entre condiciones se evaluaron mediante análisis de varianza no paramétrico (Kruskal-Wallis) seguido de la prueba de Mann-Whitney. La p < 0,05 se consideró significativa.
RESULTADOS
LOCALIZACIÓN DEL RECEPTOR PTH1R EN EL CILIO PRIMARIO DE OSTEOCITOS ESTIMULADOS CON PTHRP (1-37)
En primer lugar, se quiso comprobar cómo afecta el tratamiento con PTHrP a la movilidad del PTH1R hacia el cilio primario en células osteocíticas MLO-Y4. Mediante microscopía confocal se observó que PTH1R colocalizaba con el cilio primario en las células MLO-Y4. En condiciones estáticas, el 52 % de las células osteocíticas ciliadas mostraban cierta colocalización entre PTH1R y el cilio primario. De estas, solo el 33 % de las células mostraban colocalización a lo largo de todo el cilio primario, mientras que el 19 % mostraba colocalización solo en la base del cilio. Sin embargo, tras la estimulación con PTHrP, observamos un aumento significativo en la presencia de PTH1R a lo largo de todo el cilio primario (el 79 % de las células osteocíticas ciliadas manifestaron colocalización entre PTH1R y el cilio primario; de este porcentaje, el 50 % de las células ciliadas mostraron localización de PTH1R en toda la extensión del cilio, mientras que el 29 % mostraron colocalización solo en la base del cilio) (Fig. 1 A y B). El pretratamiento con HC anuló la formación del cilio primario, así como la movilización de PTH1R hacia él, mientras que el tratamiento con el antagonista PTHrP (7-34) no afectó de manera significativa a la movilización del PTH1R (Fig. 1 A y B). En condiciones estáticas e inhibición con PTHrP (7-34), el 58 % de las células osteocíticas ciliadas mostraban cierta colocalización entre PTH1R y el cilio primario. De esta, solo el 36 % de las células mostraron colocalización a lo largo de todo el cilio primario, mientras que el 22 % presentaron colocalización solo en la base del cilio. Tras el tratamiento con PTHrP, el 40 % de las células osteocíticas ciliadas manifestaron colocalización entre PTH1R y el cilio primario. De este porcentaje el 23 % de las células ciliadas mostraron localización de PTH1R en toda la extensión del cilio, mientras que el 17 % presentaron colocalización solo en la base del cilio (Fig. 1 A y B).
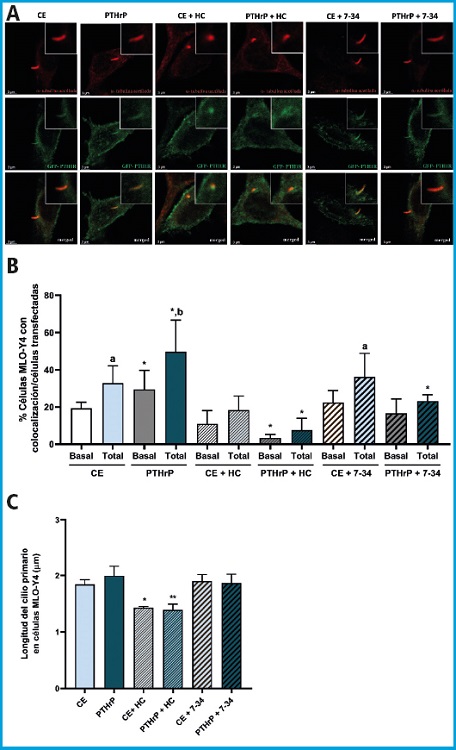
Figura 1. PTH1R colocaliza con el cilio primario en células MLO-Y4 estimuladas con PTHrP (1-37). Se transfectaron células MLO-Y4 con 1 μg del plásmido GFP-PTH1R utilizando lipofectamina 3000 durante 4 h a 37 °C. Posteriormente, las células se privaron de suero durante 6 h, se trataron con hidrato de cloral 1 mM o con 100 nM de PTHrP (7-34) durante 1 h y se estimularon con 100 nM de PTHrP (7-34) durante 1 h. Después se estimularon con 100 nM de PTHrP (1-37) durante 10 min. Para evaluar la colocalización de PTH1R con el cilio primario, las células se fijaron, permeabilizaron, bloquearon e incubaron durante toda la noche a 4°C con el anticuerpo antitubulina α-acetilada de ratón. A continuación, las células se incubaron durante 1 h con el anticuerpo secundario IgG antirratón conjugado con Alexa fluor 546. Se muestran imágenes representativas de cada condición (A). El porcentaje de células con colocalización de PTH1R justo en la base (basal) y en todo el cilio primario (total) se analizó en cada condición en células MLO-Y4 transfectadas con el plásmido GFP-PTH1R (B). Se representa la evaluación de la longitud del cilio primario en células MLO-Y4 utilizando el software ImageJ (C). Los resultados son la media ± DE de triplicados. *p < 0,05 vs. control correspondiente; **p < 0,01 vs. control correspondiente; ap < 0,05 vs. condición basal correspondiente; bp < 0,001 vs. condición basal correspondiente (CE: control estático; PTHrP: proteína relacionada con la PTH; HC: hidrato de cloral; 7-34: PTHrP (7-34); GFP-PTH1R: proteína verde fluorescente-PTH1R; PTH1R: receptor de tipo 1 de la PTH; IgG: inmunoglobulina G; DE: desviación estándar).
También se quiso comprobar si la longitud del cilio experimentaba algún cambio cuando se estimulaba con PTHrP (1-37) en comparación con condiciones estáticas. En ambos casos el cilio primario presentaba una longitud similar (Fig. 1C). Con el pretratamiento con HC este efecto fue inhibido, pero no se vio afectado por el antagonista de PTH1R, la PTHrP (7-34) (Fig. 1C).
Estos resultados muestran que el estímulo con PTHrP desencadena una movilización significativa del receptor PTH1R al cilio primario en células osteocíticas MLO-Y4.
IMPLICACIÓN DE LAS PROTEÍNAS CXCL5 E IL-6 EN LA DIFERENCIACIÓN DE LOS OSTEOCLASTOS
La regulación, a través del estímulo mecánico, de la secreción de las citoquinas CXCL5 e IL-6 en osteocitos MLO-Y4, ha demostrado tener un papel en el reclutamiento y diferenciación de los precursores osteoclásticos (21). Esta regulación asociada a la mecanotransducción es mediada por el cilio primario y la activación del PTH1R (21). En base a estos antecedentes y a los resultados obtenidos en cuanto a la traslocación del PTH1R al cilio (Fig. 1) quisimos comprobar si las citoquinas CXCL5 e IL-6 median también las acciones desempeñadas por la PTHrP en la comunicación entre osteocitos y osteoclastos utilizando anticuerpos neutralizantes específicos (Figs. 2 y 3). Los resultados mostraron que los medios condicionados (MC) de osteocitos en condiciones estáticas provocaron un aumento de la diferenciación de osteoclastos; un efecto que fue inhibido por el pretratamiento de los MC de los osteocitos con el anticuerpo neutralizante CXCL5 o el anticuerpo neutralizante IL-6. Además, el MC de osteocitos tratados con PTHrP (1-37) disminuyó la diferenciación hacia osteoclastos con o sin neutralización de CXCL5 o IL-6 (Figs. 2 y 3). La neutralización de CXCL5 no causó ningún efecto sobre la diferenciación de osteoclastos cuando se inhibió el cilio primario o PTH1R de los osteocitos con HC o PTHrP (7-34), respectivamente (Fig. 2 A y B). Así mismo, la neutralización de CXCL5 tampoco causó ningún efecto en la osteoclastogénesis cuando las vías GLI, PKA y PKC fueron inhibidas con GANT61, SQ22536 y U73122, respectivamente (Fig. 3 A y B). Por el contrario, el anticuerpo anti-IL-6 no solo revirtió la osteoclastogénesis en condiciones estáticas, sino también en presencia de HC o PTHrP (7-34) (Fig. 2 A y B). De igual forma, la inhibición de las vías GLI, PKA y PKC también revierte la osteoclastogénesis (Fig. 3 A y B).
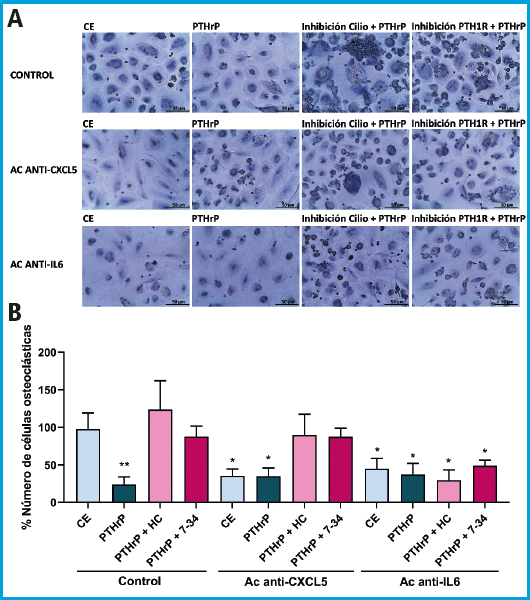
Figura 2. El estímulo con PTHrP (1-37) inhibe la diferenciación de los osteoclastos mediante un mecanismo dependiente de CXCL5 e IL-6. Las células osteocíticas MLO-Y4 se privaron de suero durante 24 h y, posteriormente se trataron con hidrato de cloral 1 mM o con 100 nM de PTHrP (7-34) durante 1 h. Luego, las células se estimularon con 100 nM de PTHrP (1-37) durante 10 minutos. El MC se recogió al cabo de 18 h y se añadió 2 μg/mL de anticuerpo neutralizante anti-mCXCL5 o 1 μg/mL de anti-mIL-6. Para evaluar la diferenciación de las células monocíticas a osteoclastos, los monocitos humanos se trataron con 20 ng/ml de M-CSF y 20 ng/ml de RANKL más los correspondientes MC de las células MLO-Y4 al 20 % con el anticuerpo neutralizante correspondiente. A continuación, se fijaron las células, se permeabilizaron y se tiñeron con hematoxilina. Se muestran imágenes representativas de cada condición (A). Se representa el porcentaje de células con tres o más núcleos evaluado con el software ImageJ (B). Los resultados representan la media ± DE de 2 experimentos por triplicado de cada condición experimental. *p < 0,05 vs. CE o vs. correspondiente inhibición del cilio o PTH1R; **p < 0,01 vs. CE (MC: medio condicionado; M-CSF: factor estimulante de colonias de macrófagos; RANKL: ligando del receptor activador del factor nuclear kappa-B; CXCL5: quimioquina 5 con motivo C-X-C; IL-6: interleuquina-6; Ac: anticuerpo; CE: control estático; PTHrP: proteína relacionada con la PTH; HC: hidrato de cloral; 7-34: PTHrP (7-34); DE: desviación estándar).
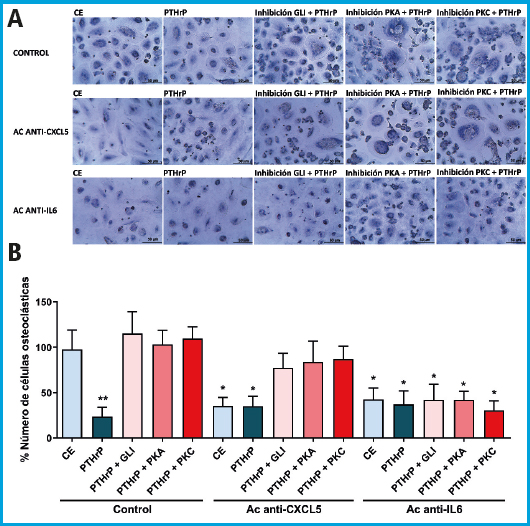
Figura 3. El estímulo con PTHrP (1-37) inhibe la diferenciación de los osteoclastos mediante un mecanismo dependiente de CXCL5 e IL-6. Las células osteocíticas MLO-Y4 se privaron de suero durante 24 h y, posteriormente se trataron con 10 μM de GANT61, 100 μM del inhibidor del adenilato ciclasa SQ22536 o con 1 μM del inhibidor de la fosfolipasa C U73122 durante 1 h. Luego, las células se estimularon con 100 nM de PTHrP (1-37) durante 10 minutos. El MC se recogió al cabo de 18 h y se añadió 2 μg/mL de anticuerpo neutralizante anti-mCXCL5 o 1 μg/mL de anti-mIL-6. Para evaluar la diferenciación de las células monocíticas a osteoclastos, los monocitos humanos se trataron con 20 ng/ml de M-CSF y 20 ng/ml de RANKL más los correspondientes MC de las células MLO-Y4 al 20 % con el anticuerpo neutralizante correspondiente. A continuación, se fijaron las células, se permeabilizaron y se tiñeron con hematoxilina. Se muestran imágenes representativas de cada condición (A). Se representa el porcentaje de células con tres o más núcleos evaluado con el software ImageJ (B). Los resultados representan la media ± DE de 2 experimentos por triplicado de cada condición experimental. *p < 0,05 vs. CE o vs. correspondiente inhibición de GLI, PKA o PKC; **p < 0,01 vs. CE (MC: medio condicionado; M-CSF: factor estimulante de colonias de macrófagos; RANKL: ligando del receptor activador del factor nuclear kappa-B; CXCL5: quimioquina 5 con motivo C-X-C; IL-6: interleuquina-6; Ac: anticuerpo; CE: control estático; PTHrP: proteína relacionada con la PTH; GANT61: GLI1-antagonista 61; GLI: factor de transcripción de glioma 1; PKA: proteína quinasa A; PKC: proteína quinasa C; DE: desviación estándar).
Estos hallazgos indican que es necesaria la presencia tanto de un cilio primario funcional como del receptor PTH1R en los osteocitos para una correcta comunicación con los osteoclastos, y sugieren que la estimulación con PTHrP en osteocitos inhibe la diferenciación de los osteoclastos a través de CXCL5, mientras que la activación de PTH1R y del cilio primario en osteocitos regulan a los osteoclastos a través de IL-6.
DISCUSIÓN
El cilio primario es un conocido mecanosensor presente en los osteocitos entre otras células. Sin embargo, sus funciones en las células óseas parecen no limitarse únicamente a favorecer la mecanotransducción. En este trabajo, nuestros resultados indican que el cilio primario expone a lo largo de toda su extensión el receptor tipo 1 de la PTH y la PTHrP, PTH1R, tras la estimulación con el péptido PTHrP (1-37). Además, observamos que las citoquinas CXCL5 e IL-6 parecen regular los efectos que ejerce la PTHrP en la comunicación de los osteocitos con los osteoclastos, concretamente afectando a la diferenciación de estos últimos.
El PTH1R se expresa en osteoblastos y osteocitos, y es clave para la formación del tejido y el mantenimiento de la homeostasis ósea (23). La señalización de PTHrP a través del PTH1R en osteocitos promueve la inhibición de la síntesis de esclerostina, lo que se traduce en un aumento de la formación ósea, pero también activa el remodelado óseo, a través de la regulación de RANKL (24). El PTH1R puede ser activado por sus dos agonistas, la PTH secretada por las glándulas paratiroides, o bien por la PTHrP, secretada por una gran variedad de tejidos, como el hueso, donde actúa de forma local (10). Varios trabajos indican que este receptor puede actuar como mecanorreceptor, siendo activado directamente por estímulos mecánicos, en ausencia de sus agonistas (25). También se ha descrito que la carga mecánica como el ejercicio físico y los péptidos PTH/PTHrP pueden potenciar sinérgicamente sus acciones entre sí (13,26). De hecho, la actividad física como correr o nadar induce la secreción transitoria de PTH (27), y la estimulación mecánica aumenta la producción de PTHrP en los osteocitos, lo que podría inducir la activación de PTH1R (18,28).
El cilio primario también actúa como mecanorreceptor en células óseas, recibiendo señales mecánicas. El cilio primario presenta numerosos receptores y canales capaces de activarse ante diferentes estímulos. En este trabajo, nuestros resultados muestran que tras la estimulación con el péptido de la PTHrP (1-37) existe una migración del PTH1R hacia el cilio primario, aumentando la presencia del receptor dispuesto a lo largo de toda la proyección ciliar (Fig. 1). Un efecto muy similar al aquí descrito se observa al estimular estas mismas células MLO-Y4 con un estímulo mecánico por flujo de fluido (21). Además, otro estudio ha demostrado que el estímulo mecánico promueve el transporte de PTH1R al cilio primario, aumentando la señalización de PTH en células del núcleo pulposo del disco intervertebral (9).
Los experimentos de neutralización apuntan a CXCL5 como una citocina regulada por los osteocitos que, cuando es secretada, controla la diferenciación de los osteoclastos. CXCL5 es una quimioquina implicada en el reclutamiento de leucocitos (29,30). Esta quimioquina se une al receptor CXC1 y al receptor CXC2, ambos expresados en los precursores de osteoclastos (31,32). Además, se ha descrito que CXCL5 modula la expresión de CXC1 y puede tener un papel funcional en el aumento de los niveles de expresión de RANKL en las células estromales/preosteoblásticas de médula ósea humana (33). Sundaram y cols. mostraron que CXCL5 podría tener un papel funcional en el aumento de los niveles de expresión de RANKL asociados a la enfermedad ósea de Paget en humanos, la cual presenta zonas muy localizadas de recambio óseo con una mayor actividad de los osteoclastos (33).
Con respecto a IL-6, es bien conocido su papel como inductor de la osteoclastogénesis mediada por osteocitos mediante la actividad de JAK2 y RANKL (34). Un estudio ha demostrado que el aumento en la secreción de IL-6 por células osteocíticas apoptóticas promueve el reclutamiento de precursores osteoclásticos. Esto es debido a que la secreción de IL-6 promueve la expresión endotelial de ICAM-1 y la adhesión de los precursores osteoclásticos (35). El estudio de Kazuhiro demostró que la combinación de TNF e IL-6 puede inducir la reabsorción ósea en células similares a los osteoclastos (36). De hecho, IL-6 desempeña un papel importante como regulador durante la osteoclastogénesis, resorción y regeneración óseas (35). De forma similar a este estudio, la formación de osteoclastos se vio potenciada tras la secreción tanto de IL-6 como del receptor soluble de IL-6 (37). En concordancia, nuestros resultados (Fig. 2 y 3) muestran que el anticuerpo neutralizante de IL-6 disminuyó la diferenciación celular cuando se inhibió el cilio y el receptor PTH1R. De igual forma ocurre cuando se inhibe las vías Hedgehog, adenilato ciclasa y fosfolipasa C. Sin embargo, el anticuerpo neutralizante de CXCL5 no tuvo ningún efecto a este respecto.
Datos previos de nuestro grupo de investigación muestran que el silenciamiento de Pth1r se asocia a un aumento de la migración de monocitos y de la osteoclastogénesis, así como a un aumento de la secreción de IL-6 por parte de los osteocitos, a pesar de que las células fueron estimuladas por FF. Dado que la neutralización de IL-6 en estas condiciones disminuye tanto la migración como la diferenciación de osteoclastos, estos datos sugieren que la secreción de altos niveles de IL-6 puede superar la baja secreción de CXCL5 dependiente de FF y mantener la migración de monocitos y la osteoclastogénesis (20). De igual forma, ocurriría cuando se produce la estimulación con PTHrP en el proceso de osteoclastogénesis (Fig. 2).
Además, demostramos que la inhibición del cilio primario también se asoció con un aumento de la función osteoclástica, incluso en condiciones de estimulación con PTHrP (1-37), y la neutralización de la IL-6 revirtió este efecto. Colectivamente, estos datos sugieren que la inhibición del cilio primario podría inducir una elevada secreción de IL-6 que supere la baja secreción de CXCL5, como ocurre cuando se inhibe el receptor PTH1R (Fig. 4). Sin embargo, también es posible que el cilio primario en condiciones de estimulación con PTHrP (1-37) module otras citoquinas alternativas implicadas en la comunicación osteoclástica. Aun así, la neutralización de IL-6 fue suficiente para prevenir la diferenciación de los precursores de osteoclastos.
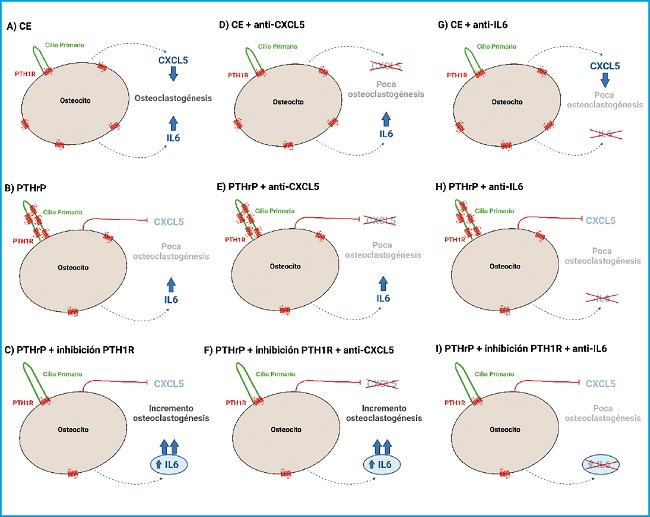
Figura 4. Mecanismo propuesto para la regulación de la diferenciación de osteoclastos por el cilio primario y PTH1R en osteocitos. La presencia tanto de un cilio primario funcional como de PTH1R en los osteocitos es necesaria para una correcta comunicación con los osteoclastos. La estimulación con PTHrP (1-37) inhibe la diferenciación de los osteoclastos a través de CXCL5, mientras que la activación de PTH1R regula a los osteoclastos a través de IL-6 (CE: control estático; PTHrP: proteína relacionada con la hormona paratiroidea; CXCL5: ligando de quimioquinas con motivo C-X-C 5; IL-6, interleuquina-6; PTH1R: receptor de tipo I de la hormona paratiroidea).
Nuestros hallazgos apoyan que el cilio primario funcional y PTH1R son necesarios en los osteocitos para regular el secretoma de estas células y su comunicación con los osteoclastos. Así, los osteocitos estimulados con PTHrP (1-37) inhiben la diferenciación de osteoclastos mediante la disminución de la secreción de CXCL5, mientras que la activación de PTH1R y del cilio primario en los osteocitos regulan a los osteoclastos a través de la modulación de la secreción de IL-6.











 texto en
texto en 


