CASO CLÍNICO
Presentamos el caso de un varón de 28 años, con antecedentes de tiroidectomía total por carcinoma papilar de tiroides estadio II a la edad de 17 años. Tras la cirugía desarrolló un hipoparatiroidismo de difícil control, motivo por el cual se inició tratamiento sustitutivo con teriparatida 20 mcg s.c. cada 12 horas en febrero 2022, con normalización del metabolismo fosfocálcico que permaneció estable durante 18 meses desde el inicio del mismo (1). Desde agosto del año 2021, volvió a presentar alteraciones analíticas compatibles con hipoparatiroidismo, con correcciones parciales precisando en ocasiones asociar de nuevo calcitriol y carbonato de calcio o ajustar la dosis de teriparatida hasta los 0,8 mcg/kg/día en 3 dosis (20-20-20 mcg s.c.) siguiendo lo descrito por el estudio de K.K. Winer en los que la dosis de teriparatida para conseguir normocalcemia sin necesidad de utilizar calcitriol ni sales de calcio oscilaba entre 0,47 + 0,33 mcg/kg/día (2). Las evoluciones analíticas y los cambios terapéuticos se presentan en la figura 1. Dadas las dosis alcanzadas bajo tratamiento sustitutivo con teriparatida (iguales a las dosis máximas presentadas en las series de casos conocidas hasta la fecha), nos planteamos la posibilidad de fallo primario del tratamiento sustitutivo una vez descartada la posibilidad de falta de adherencia terapéutica, dado el patrón de resistencia al mismo.
DISCUSIÓN
Sabemos que la PTH es una hormona peptídica de 84 aminoácidos producida en las glándulas paratiroideas. Su extremo amino terminal 1-34 constituye la fracción activa. Su receptor membrana PTH-PTHrp está acoplado a una proteína G estimuladora de adenilato-ciclasa que genera AMPc como segundo mensajero. A nivel renal, inhibe la expresión de los cotransportadores Na-P 2A y 2C, induciendo una respuesta fosfatúrica. Ambas respuestas (fosfatúrica y aumento de la excreción de AMPc en orina) han sido la base del estudio de funcionalidad de la PTH. En los años 70, Broadus (3) delimitó aún más la respuesta renal a la PTH con la determinación del AMPc nefrogénico (NAMPc) eliminando factores que podían interferir en la interpretación de la excreción urinaria de AMPc (otras hiperfunciones hormonales o respuestas farmacológicas mediadas por AMPc). La génesis de NAMPc es en su práctica totalidad secundaria a la acción renal de la PTH, con un componente debido a vasopresina prácticamente despreciable a niveles fisiológicos (3). Estos conocimientos llevaron a la estandarización del test de Ellsworth-Howard (4) para la determinación de la respuesta orgánica a la PTH. Posteriormente, apareció la estandarización del mismo con teriparatida en vez de utilizar extracto de PTH purificada (5). Se considera normal un aumento de la respuesta fosfatúrica de, al menos, 200 % y de la de AMPc nefrogénico de al menos 1000 % (6); esta respuesta es más llamativa en los pacientes con hipoparatiroidismo. Por otra parte, una respuesta inferior se describe en estados de resistencia a la PTH (pseudohipoparatiroidismo).
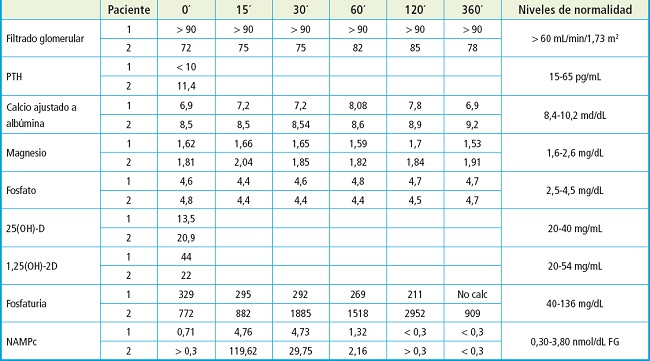
Se realizó un test de Ellsworth-Howard (E-H) al enfermo objeto del caso (paciente 1) administrando 20 mcg de teriparatida endovenosa en infusión lenta durante 15 minutos; paralelamente, se realizó el mismo test a una paciente control (paciente 2) afecta igualmente de hipoparatiroidismo posquirúrgico y osteoporosis, en la que se indicó tratamiento con teriparatida 20 mcg diarios como tratamiento de la misma. Ambos test siguieron el mismo protocolo y se administró la misma biomolécula (teriparatida Movymia [Laboratorios STADA]). Las respuestas del metabolismo fosfocálcico de ambos pacientes se recogen en la siguiente tabla (Tabla I).
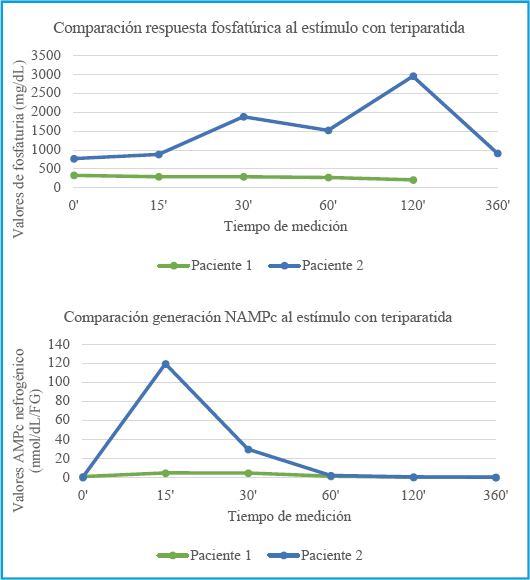
Analizando la respuesta al estímulo con PTH 1-34 del paciente 1, observamos una respuesta fosfatúrica bloqueada, así como un aumento subóptimo del AMPc nefrogénico. La paciente 2 sin embargo presenta una respuesta fosfatúrica óptima, así como un gran aumento en la génesis de AMPc nefrogénico (Fig. 2).
En el caso del paciente 1, enfermo afecto de hipoparatiroidismo crónico, con una respuesta inicial óptima a teriparatida, la disminución de la efectividad del tratamiento sustitutivo y la respuesta al test de Ellsworth-Howard, es compatible con un fallo primario al tratamiento sustitutivo con teriparatida con patrón de resistencia a la acción de la misma. Esta conclusión se ve refrendada por la respuesta adecuada de una paciente control (paciente 2) con la misma patología de base (hipoparatiroidismo crónico bajo tratamiento sustitutivo con PTH 1-34), al test de E-H con una dosis de teriparatida extraída del mismo lote y pluma que el caso objeto de la publicación, lo cual excluye la posibilidad de fármaco adulterado o inactivo.
En el desarrollo clínico de teriparatida Movymia se describió la presencia de anticuerpos antiteriparatida en 2 de los 126 individuos incluidos en el grupo de teriparatida Forsteo, ninguno de ellos bloqueante y no se describió desarrollo de autoanticuerpos en el grupo asignado a teriparatida Movymia (7). Debemos destacar que los estudios de desarrollo clínico de teriparatida Movymia se realizaron en pacientes con osteoporosis sin hipoparatiroidismo, por lo que no podemos extrapolar los resultados de autoinmunidad a nuestro paciente.
Para esclarecer la naturaleza de la sustancia bloqueante se intentó solicitar un kit de determinación de anticuerpos antiteriparatida (no comercializado) o determinaciones seriadas de PTH 1-34 en soluciones diluidas o precipitación en polietilenglicol para eliminar la interferencia de anticuerpos bloqueantes, si bien los actuales ensayos comerciales de tercera generación para determinación de PTH presentan una doble unión a los fragmentos 1-38 y 38-84, no pudiéndose llevar a cabo estas pruebas. Aun así, el desarrollo de autoanticuerpos supone la principal hipótesis de la génesis del bloqueo a la acción de teriparatida, siguiendo los modelos de fallo primario a la respuesta a tratamientos con otras moléculas como, por ejemplo, los fármacos biológicos.
En conclusión, presentamos nuestro primer caso de fallo primario al tratamiento sustitutivo con teriparatida en un varón con hipoparatiroidismo crónico posquirúrgico de larga evolución, con respuesta compatible a resistencia a la misma probablemente inducida por autoanticuerpos bloqueantes frente a la teriparatida. Sería de interés estudiar la pérdida de efectividad del tratamiento sustitutivo en pacientes de estas características a largo plazo y esclarecer su origen, considerando la determinación de anticuerpos antiteriparatida en caso de pérdida de actividad.











 texto en
texto en