INTRODUCCIÓN
El importante papel de la vitamina D en la prevención y el tratamiento de condiciones clínicas, óseas y extraóseas, y enfermedades crónicas, así como la alta prevalencia de su deficiencia a nivel mundial, incluso en países desarrollados con alta exposición solar, como EspaÑa (1), ha provocado un aumento de las solicitudes analíticas para su determinación en los últimos aÑos, tanto a nivel nacional como internacional (2-6). Asimismo, se ha observado un incremento en la prescripción de tratamientos de vitamina D (4,7,8). Sin embargo, no existe un consenso unánime en las sociedades médicas, que contemplan distintas pautas y recomendaciones según del grado de deficiencia y el perfil del paciente (9-14); tampoco sobre el nivel óptimo de vitamina D, evaluado por el nivel sérico de 25 hidroxivitamina D (25[OH]D) (2,15,16), con un debate sobre el valor de corte para definir la deficiencia, la insuficiencia o la sobredosis (17,18). Aunque en última instancia la elección sobre el manejo del déficit de vitamina D viene dada según el criterio del profesional sanitario, los determinantes y las características de la prescripción de vitamina D en la práctica clínica habitual han sido vagamente investigados.
Con este estudio hemos pretendido evaluar el conocimiento y las características de prescripción de vitamina D en la práctica clínica habitual de los profesionales sanitarios en EspaÑa y valorar si existen diferencias en el manejo por parte de las distintas especialidades relacionadas: Atención Primaria, Medicina Interna, Endocrinología, Traumatología, Ginecología, Reumatología y Geriatría. Para ello, realizamos una encuesta nacional con cuestiones específicas sobre el diagnóstico, el tratamiento y la monitorización del déficit de vitamina D.
MATERIAL Y MÉTODOS
Estudio no intervencionista basado en una encuesta cuantitativa online realizada entre septiembre y noviembre de 2022.
Participantes
Médicos especialistas en Atención Primaria, Medicina Interna, Reumatología, Traumatología, Endocrinología, Ginecología o Geriatría que ejercieran su práctica clínica el ámbito público o privado nacional, con una experiencia mínima de un aÑo en el manejo de pacientes con déficit de vitamina D. Para su participación, debían firmar un consentimiento de participación en el estudio.
CUESTIONARIO Y RECOPILACIÓN DE DATOS
El cuestionario comprendía 8 preguntas con respuestas cerradas (algunas de elección múltiple) sobre el diagnóstico, el tratamiento y la monitorización del déficit de vitamina D (Tabla I). Este cuestionario fue diseÑado y consensuado por un grupo de médicos expertos en metabolismo mineral óseo y de las especialidades englobadas en este estudio. También se recogieron las características sociodemográficas de los participantes (especialidad, edad, sexo, ámbito y localización de la práctica clínica).
Tabla I. Cuestionario sobre el diagnóstico, el tratamiento y la monitorización del déficit de vitamina D.
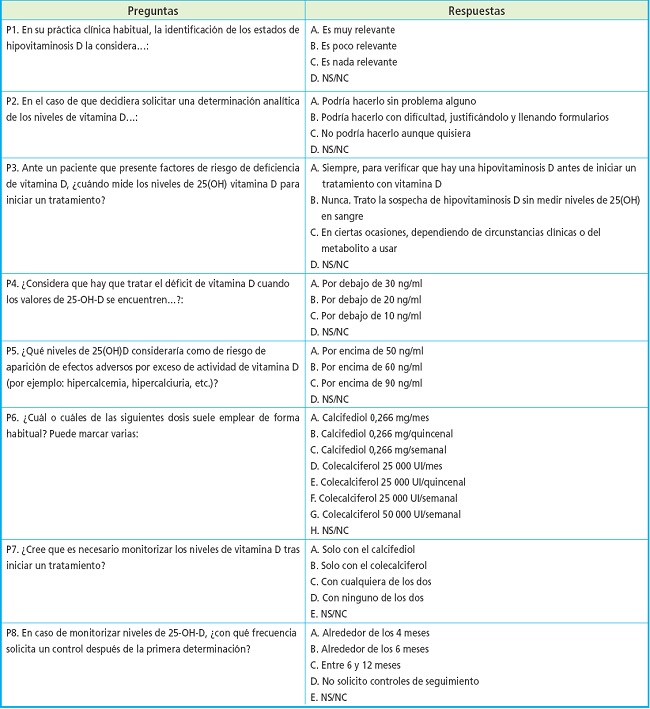
NS/NC: no sabe/no contesta.
Se contactó con profesionales pertenecientes a una base de datos de profesionales de la salud (OneKey, IQVIA) que cumplieran los criterios de inclusión. Los médicos que aceptaron participar en el estudio accedieron al cuestionario a través de la plataforma CAWI-NET.
El estudio se llevó a cabo de conformidad con el protocolo, los principios establecidos en la declaración de Helsinki (19), las directrices para la buena práctica farmacoepidemiológica y los procedimientos de calidad, así como con las directrices pertinentes en relación al tratamiento y a la protección de datos personales. El protocolo del estudio fue aprobado por el Comité de Ética de Investigación del Hospital Universitario Puerta de Hierro de Majadahonda de Madrid (47/770284.9/22).
TAMAÑO MUESTRAL
Teniendo en cuenta el universo de especialistas, con un nivel de confianza del 95 % (p = q = 50 %), con el objetivo de no superar el 10 % de error muestral en ninguna de las especialidades consultadas, fueron necesarias un total de 698 encuestas: 110 de Atención Primaria, 100 de Medicina Interna, 98 de Endocrinología, 100 de Traumatología, 100 de Ginecología, 95 de Reumatología y 95 de Geriatría. Se garantizó la representatividad de todas las zonas geográficas del país. La distribución a nivel nacional por comunidades autónomas (CC. AA.) se hizo de manera proporcional al universo objeto de estudio. posteriormente se realizó una división geográfica en 5 zonas (norte, noreste, centro, este y sur) para el correspondiente análisis de subgrupos.
ANÁLISIS ESTADÍSTICO
Todos los participantes fueron identificados con un código anonimizado. Los cuestionarios incompletos se invalidaron y se sustituyeron hasta alcanzar la muestra total de 698. No se realizó la imputación de valores perdidos para ninguna variable.
El número de casos y el porcentaje se utilizaron para describir las variables categóricas. Se utilizó la media, la desviación estándar, la mediana, los cuartiles (Q1 y Q3) y el mínimo y el máximo para describir las variables continuas (edad).
Se realizó un análisis descriptivo para el total de la muestra, así como para cada una de las especialidades. Se realizó un análisis comparativo entre especialidades, así como entre el global de especialidades frente a Atención Primaria a través de la prueba de χ2. Dentro de cada especialidad se realizaron subanálisis con la misma metodología en función de las características demográficas: edad (< 40 aÑos / ≥ 40 aÑos), género, ámbito donde se ejerce la práctica clínica y localización geográfica. El análisis estadístico se realizó utilizando el programa Gandía BarbWin. Un valor p < 0,05 se consideró estadísticamente significativo.
RESULTADOS
Un total de 698 profesionales sanitarios completaron satisfactoriamente la encuesta y fueron incluidos en el análisis. En la tabla II se muestran las características sociodemográficas de los participantes. La media (desviación estándar) de edad de los participantes fue de 42 aÑos (10,4), de los que el 56 % eran mujeres, con algunas variaciones en función de la especialidad. El 66,9 % ejercía su profesión exclusivamente en el sector público y el 7,4 %, en el privado, mientras que el 25,7 % lo hacía en ambos sectores.
Tabla II. Características sociodemográficas.
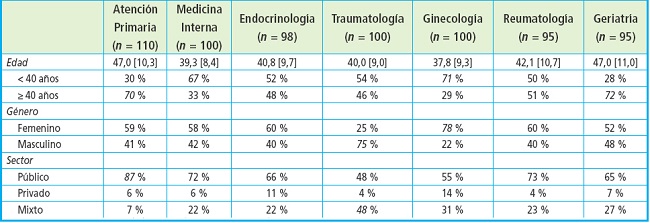
Los datos se muestran como n (%) o media [desviación estándar].
Las respuestas a cada pregunta realizada a los encuestados se muestran en la figura 1 y en la tabla III para el total de la muestra e individualizadas por especialidades, respectivamente.
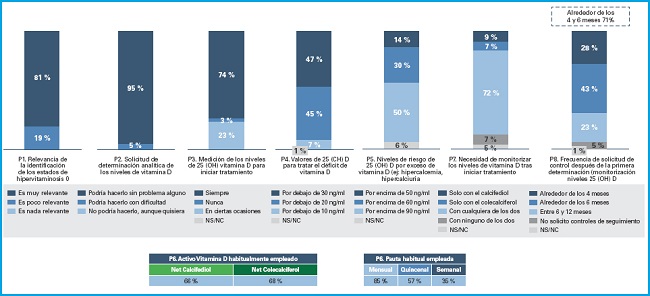
Figura 1. Cuestiones relacionadas con el diagnóstico, el tratamiento y la monitorización del déficit de vitamina D. Se muestran los resultados para el total de la muestra. Los datos se muestran como porcentaje. #Diferencias significativas entre periodos (p < 0,05): S = semanal; Q = quincenal; NS/NC: no sabe/no contesta.
Tabla III. Cuestiones relacionadas con el diagnóstico, el tratamiento y la monitorización del déficit de vitamina D.

Tabla III (cont). Cuestiones relacionadas con el diagnóstico, el tratamiento y la monitorización del déficit de vitamina D.
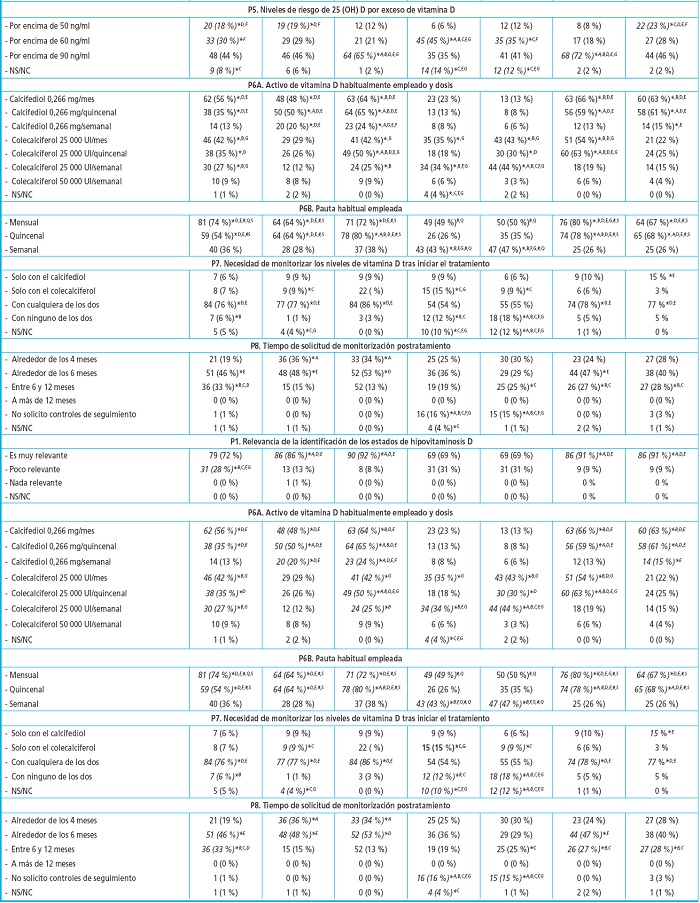
Se muestran los resultados individualizados por especialidad. Los datos se muestran como tanto por ciento sobre la n de la especialidad. *A-G: Diferencias estadísticamente significativas entre especialidades (p < 0,05); #Diferencias significativas entre periodos (p < 0,05); S = semanal; Q = quincenal; NS/NC: no sabe/no contesta.
La gran mayoría de los especialistas consultados declararon que la identificación de los estados de hipovitaminosis D era muy relevante (globalmente, un 81 %). Esta consideración fue significativamente menor en Atención Primaria (72 %), Traumatología (69 %) y Ginecología (69 %) en comparación con el resto de especialidades (86-92 %) (p < 0,05).
Prácticamente la totalidad de profesionales pueden solicitar una analítica para determinar los niveles de 25(OH)D sin restricción (globalmente, el 95 %). Atención Primaria destaca como la especialidad con más dificultad para realizar esta determinación: el 12 % podría hacerlo con dificultad y el 1 % indica que no podría (p < 0,05 frente al resto de especialidades).
La mayoría de las especialidades suelen medir los niveles de vitamina D para iniciar el tratamiento (siempre, el 74 %; en ciertas ocasiones, el 23 %, y nunca, el 3 %). Traumatología y Ginecología destacan por ser las especialidades que en menos ocasiones determinan los niveles de 25(OH)D de manera sistemática para iniciar tratamiento (Traumatología: 43 % en ciertas ocasiones y 14 % nunca; Ginecología: 32 % en ciertas ocasiones y 4 % nunca; p < 0,05 frente a otras especialidades).
De manera global se evidencia una falta de consenso en el punto de corte para tratar el déficit de vitamina D. El 47 %, 45 % y 7 % considera valores de 25(OH)D de 30 ng/ml, 20 ng/ml y 10 ng/ml, respectivamente, como puntos de corte para comenzar a tratar el déficit de vitamina D. En otras palabras, el 99 % trataría con niveles por debajo de 10 ng/ml, el 92% por debajo de 20 ng/ml y el 47% ante una determinación por debajo de 30 ng/ml. Estos porcentajes varían en función de la especialidad consultada. Endocrinología, Ginecología, Reumatología y Geriatría consideran mayoritariamente el valor de 30 ng/ml (> 50 %). En cambio, internistas y traumatólogos establecen en mayor medida (> 50 %) el valor umbral en 20 ng/ml. Cabe destacar que el 7 % de traumatólogos indicaron que no sabían qué contestar en esta pregunta.
También existe falta de consenso en la consideración del riesgo de aparición de efectos adversos por exceso de actividad de vitamina D (por ejemplo, hipercalcemia o hipercalciuria). Globalmente, el nivel máximo aceptable de 25(OH)D se establece a partir de 50, 60 o 90 ng/ml por el 14 %, el 30 % y el 50 % de los prescriptores, respectivamente. Es decir, el 14 % advertiría riesgo de aparición de efectos adversos por exceso de actividad de vitamina D con valores por encima de 50 ng/ml, el 44 % por encima de 60 ng/ml y el 94 % por encima de 90 ng/ml. Cabe de nuevo destacar que el 6 % de especialistas no supieron la respuesta a esta pregunta. Estos valores varían en función de la especialidad consultada. Reumatología y Endocrinología consideran mayoritariamente el valor de 90 ng/ml (> 50 %).
Tanto colecalciferol como calcifediol son moléculas que se emplean habitualmente para el tratamiento del déficit de vitamina D (el 66 % y el 68 % de profesionales los utilizan, respectivamente); la pauta mensual (65 %) es la más empleada frente a la quincenal (57 %) y la semanal (35 %) (p < 0,05). Traumatología y Ginecología emplean preferentemente el colecalciferol como principio activo (p < 0,05 frente a calcifediol). Asimismo, hacen mayor uso de la pauta semanal (p < 0,05 frente a otras especialidades) en comparación con otras especialidades como Medicina Interna, Endocrinología o Geriatría. Se observa que entre los especialistas que tratan la sospecha de hipovitaminosis D sin medir niveles de 25(OH)D en sangre el uso de colecalciferol es significativamente superior al de calcifediol (p < 0,05).
En todas las especialidades se considera necesario monitorizar los niveles de vitamina D tras iniciar el tratamiento (88 %, independientemente del principio activo), generalmente entre los 4 y los 6 meses (71 %). No obstante, Ginecología y Traumatología son las especialidades que muestran mayor divergencia (un 15% y un 16 %, respectivamente, no solicitan controles de seguimiento; p < 0,05 frente al resto de especialidades).
Se realizaron análisis de subgrupos en función de las características demográficas de los participantes (Anexo 1). Algunos especialistas con edad ≥ 40 aÑos mostraron divergencias en algunos aspectos del manejo de la vitamina D con respecto a sus compaÑeros de profesión de menor edad. Ciertos colectivos notificaron mayor dificultad para solicitar determinaciones de 25(OH)D, lo que se correlacionó con un tratamiento empírico (en ausencia de determinación) significativamente mayor.
DISCUSIÓN
La deficiencia de vitamina D se reconoce como un importante problema de salud pública y es altamente prevalente a nivel mundial (20,21), incluso en países del Mediterráneo, como EspaÑa (1), lo que ha llevado a la implementación de programas de fortificación de alimentos y recomendaciones de suplementación y tratamiento del déficit. La fortificación de alimentos con vitamina D ofrece una oportunidad para mejorar la ingesta de vitamina D en la población. No obstante, en muchos países, entre los que se encuentra EspaÑa, es voluntaria y no está ampliamente extendida (22). La dosificación de la vitamina D puede llegar a ser compleja debido a la existencia de distintas indicaciones, diferentes valores umbrales para su tratamiento, principios activos disponibles, instrucciones galénicas o posologías y diversos entornos existenciales. Este estudio tuvo como objetivo evaluar las prácticas de prescripción de distintas especialidades médicas en toda EspaÑa. Un total de 698 especialistas, de 7 especialidades médicas, participaron en el estudio.
En primer lugar, los resultados de nuestro estudio demuestran que los especialistas médicos en EspaÑa son conscientes de la relevancia clínica del déficit de vitamina D (el 81 % considera que la hipovitaminosis D es muy relevante). El desarrollo de guías y la creciente evidencia científica han aumentado la conciencia médica sobre la vitamina D y la posible suplementación para apoyar una condición saludable en general y mejorar ciertas condiciones clínicas y enfermedades crónicas vistas en múltiples especialidades (8).
Prácticamente la totalidad de profesionales puede solicitar una analítica para determinar los niveles de 25(OH)D sin restricción (globalmente, el 95 %). Este hallazgo es sin duda sorprendente, considerando los protocolos de cribado y las estrategias para limitar las determinaciones de vitamina D (23,24), que pueden variar en función de las áreas de salud. Aunque en el estudio se identificaron algunas especialidades con mayor dificultad para realizar determinaciones en función de la zona geográfica, estos resultados no siguieron un patrón concluyente.
La mayoría de las especialidades suelen medir los niveles de vitamina D para iniciar el tratamiento (siempre el 74 %, en ciertas ocasiones o nunca, el 26 %). Este hallazgo, por un lado, pone de manifiesto que el tratamiento del déficit de vitamina D generalmente se asocia a una hipovitaminosis confirmada analíticamente. La tasa obtenida es inferior a estudios similares realizados con médicos de AP sobre el tratamiento en ancianos institucionalizados (el 94 % comenzaba el tratamiento tras confirmar la hipovitaminosis D frente al 83 % en nuestro estudio) (25) o para el manejo de la COVID-19 (26), pero superior a un trabajo previo realizado en EspaÑa (55 % de n = 50 AP) (27).
Sin embargo, existe un cierto porcentaje de los profesionales sanitarios que pautan un tratamiento en ausencia de determinación (empírico). Este resultado es similar al trabajo de Machattou y cols. (30 % de tratamiento empírico) (27). En este sentido, varias sociedades médicas y organizaciones de salud ya aconsejan iniciar la suplementación de vitamina D en ausencia de pruebas en diferentes poblaciones, entre las que se incluyen las recomendaciones del grupo de trabajo de la European Society of Clinical and Economical Aspects of Osteoporosis, Osteoarthritis and Musculoskeletal Diseases (ESCEO) (28). Las razones subyacentes a estas recomendaciones son que hay suficiente evidencia de los beneficios y esta estrategia es generalmente simple, efectiva y económica. Ejemplos de ello es la suplementación en individuos con insuficiente exposición solar, niÑos y adolescentes, mujeres embarazadas y lactantes para alcanzar las cantidades diarias recomendadas (28-31). La Sociedad Americana de Geriatría indica que la determinación de 25(OH)D antes de iniciar el tratamiento no sería necesaria en adultos mayores (≥ 65 aÑos), más aún si la exposición solar es insuficiente, como ocurre con los ancianos institucionalizados (28,30,32.33). Distintas sociedades a nivel nacional e internacional también establecen que la detección rutinaria de vitamina D puede ser innecesaria en pacientes con osteoporosis o fractura por fragilidad, a quienes se les debe pautar un tratamiento de vitamina D (a menudo con calcio) de manera coadyuvante al tratamiento antirresortivo (28,34). Se recomienda el uso de colecalciferol como la molécula de elección en el caso del tratamiento en ausencia de determinación de 25(OH)D (35,36).
De manera global se evidencia una falta de consenso en el punto de corte para tratar el déficit de vitamina D. El 47 %, el 45 % y el 7 % consideran valores de 25(OH)D de 30 ng/ml, 20 ng/ml y 10 ng/ml, respectivamente, como los puntos de corte para iniciar tratamiento.
La heterogeneidad en las respuestas proporcionadas se alinea perfectamente con la falta de consenso evidenciada entre las diversas organizaciones y sociedades científicas, que establecen distintas concentraciones para hablar de deficiencia, insuficiencia o valores óptimos de vitamina D, también en función del perfil del paciente (2,18,28.37).
Sobre el valor mínimo recomendable se ha descrito una asociación entre los niveles séricos de 25(OH)D, la densidad mineral ósea (DMO) y parámetros musculoesqueléticos. Algunos estudios sugieren que con valores por debajo de 20 ng/ml existe un aumento del riesgo de fracturas (28,38,39). Otros estudios apuntan a niveles de 25(OH)D por encima de 24 ng/mL para reducir el riesgo (40,41). A partir de 30 ng/ml, los niveles de PTH se estabilizan (42), disminuyendo el riesgo de caídas y de fracturas de manera relevante (43). Es posible que sean necesarios mayores niveles para obtener otros beneficios más allá de la salud musculoesquelética.
La controversia sobre la definición de la deficiencia de vitamina D y los niveles máximos de 25(OH)D se debe, también en parte, a la notificación de resultados no estandarizados (44). Está ampliamente aceptado que la medición de la concentración circulante de 25(OH)D es la mejor medida del estado de vitamina D de un individuo (45), pero se reconoce que el valor de 25(OH)D obtenido en una sola muestra puede variar sustancialmente en función del ensayo utilizado. Históricamente, las mediciones de 25(OH)D se realizaban en centros de investigación mediante cromatografía líquida de alta presión (HPLC, por sus siglas en inglés) o con métodos competitivos de unión a proteínas. En la década de los noventa del siglo pasado se desarrollaron radioinmunoensayos validados y otros métodos, como el ensayo de inmunoabsorción enzimática (ELISA, por sus siglas en inglés) o la quimioluminiscencia. La reciente disponibilidad clínica de la cromatografía líquida, la espectroscopia de masas en tándem (LC-MS/MS, por sus siglas en inglés) y las tecnologías de HPLC han mejorado el rendimiento de los ensayos de 25(OH)D (46,47). También se han desarrollado distintos programas de estandarización: vitamin D External Quality Assessment Scheme (DEQAS) (48) o el Programa de Estandarización de la Vitamina D (VDSP) (44). Desafortunadamente, a pesar de estos esfuerzos, la variabilidad sustancial entre y dentro de los ensayos persiste hasta el día de hoy.
Cabe también destacar que un porcentaje considerable de los especialistas considera que solo hay que tratar el déficit de vitamina D cuando los valores se encuentran por debajo de 10 ng/ml, lo que ya es ampliamente reconocido como una situación de deficiencia de vitamina D severa y de riesgo para el paciente (9,13,49-51).
De manera similar, el nivel máximo aceptable de 25(OH)D para considerar que hay riesgo de aparición de efectos adversos (por ejemplo, hipercalcemia o hipercalciuria) se estableció a partir de 50, 60 o 90 ng/ml por el 14 %, el 30 % y el 50 % de los prescriptores, respectivamente. También existe divergencia en las guías de práctica clínica, en un intervalo que abarca desde los 50 a los 100 ng/ml, según la referencia consultada (9,13, 36,37,42,49,51,52). La toxicidad por vitamina D, aunque poco frecuente, puede cursar con hipercalcemia severa, hipercalciuria y manifestaciones clínicas potenciales como confusión, apatía, vómitos recurrentes, dolor abdominal, poliuria, polidipsia o deshidratación. Esta está relacionada con una ingesta excesiva de vitamina D a largo plazo, el uso de ciertos metabolitos (como se verá a continuación), disfunciones de la vía metabólica de la vitamina D o la existencia de una enfermedad concomitante que produce localmente 1,25(OH)2D (47). Además de la descrita toxicidad por vitamina D, distintos estudios clínicos han demostrado que el riesgo de caídas o de mortalidad comienza a incrementarse moderadamente cuando los niveles de 25(OH)D ascienden por encima de 40-60 ng/ml, al igual que en situaciones de deficiencia (42,53,54). Estas observaciones se conocen comúnmente como efecto de curva J o U, y ya se recogen como niveles no fisiológicos o de “posible daÑo” por distintas sociedades nacionales e internacionales (13,28).
Tanto colecalciferol como calcifediol son moléculas que se emplean habitualmente para el tratamiento del déficit de vitamina D (el 66 % y el 68 % de los profesionales los utilizan, respectivamente), con distintas dosis y pautas; la pauta mensual es la más empleada (65 %). La preferencia por la pauta mensual podría ser un reflejo de las indicaciones posológicas de las guías nacionales para el tratamiento de la deficiencia no severa de vitamina D (13,51). Las guías internacionales de práctica clínica se decantan por una mayor recomendación del tratamiento semanal (11,34,52). No obstante, la variedad de dosis y de posologías reportadas indica que los médicos podrían variar su pauta de elección en función del grado de deficiencia, siguiendo las recomendaciones (12,13,49.51).
Se observa que, entre los especialistas que tratan la sospecha de hipovitaminosis D sin medir niveles de 25(OH)D en sangre, el uso de colecalciferol es significativamente superior al de calcifediol (p < 0,05), lo que podría justificarse dado su perfil farmacocinético y de seguridad. Los estudios farmacocinéticos han determinado que la vida media del colecalciferol es de 60 días, ya que su naturaleza lipofílica y liposoluble permite el almacenamiento de tejidos (55-57). Esta característica de colecalciferol favorecería que el 25(OH)D se genere a partir de colecalciferol tisular de acuerdo con los requisitos del organismo (55).
La tasa de conversión de colecalciferol en 25(OH)D sigue un aumento no lineal, lo que da lugar a una curva plasmática de 25(OH)D que alcanza una meseta a niveles de aproximadamente 30-50 ng/ml (56,58-64). Es decir, se produce un mayor aumento (curva más pronunciada) en el 25(OH)D sérico en caso de deficiencia más grave de vitamina D y se observa una tasa de conversión más baja una vez que los niveles de 25(OH)D se acercan a un cierto umbral o en pacientes con niveles suficientes (58,59,61-64). Este perfil farmacocinético también evita las fluctuaciones de 25(OH)D en suero después de administraciones individuales; por el contrario, se obtienen niveles de 25(OH)D sostenidos en el tiempo (60). En conjunto, la etapa de hidroxilación hepática (63,65), junto con la producción no lineal de 25(OH)D, puede evitar un aumento indefinido de los valores séricos una vez bajo tratamiento, así como obtener niveles más predecibles y estables en el tiempo a un nivel objetivo dado. En otras palabras, la evidencia seÑala que la eficacia de la suplementación con colecalciferol en pacientes suficientes se reduce fisiológicamente por el organismo, posiblemente para evitar sobredosis e intoxicación.
Por último, en todas las especialidades se considera necesario monitorizar los niveles de vitamina D tras iniciar el tratamiento, generalmente entre los 4 y los 6 meses (71 %). Este resultado se alinea con las recomendaciones de las guías de práctica clínica, que sugieren monitorizar las concentraciones séricas cada 3-4 meses (13,14,32). Existe un porcentaje relevante que espacia esta monitorización (6-12 meses o no solicita controles de seguimiento: 28 %). Según algunas guías de práctica clínica, la monitorización puede considerarse innecesaria en algunas poblaciones, siempre que el tratamiento se realice dentro de unos límites recomendados (13,32,34,66,67). En los casos en los que no pueda monitorizarse, las sociedades médicas han recomendado el uso de colecalciferol (13,32), justificado por el metabolismo descrito anteriormente.
Hasta donde sabemos, esta encuesta es la primera de sus dimensiones a nivel nacional, y también la primera de ámbito internacional: estas son sus principales fortalezas. El diseÑo del estudio y el tamaÑo muestral han garantizado la representatividad geográfica de especialistas a nivel nacional, así como de cada una de las especialidades incluidas. No obstante, también presenta limitaciones, ya que no incluyó otras especialidades, como pediatría, y no se evaluó la coprescripción con otros tratamientos.
RECOMENDACIONES DE PANEL MULTIDISCIPLINAR DE EXPERTOSc
La deficiencia de vitamina D se ha relacionado ampliamente con enfermedades óseas como el raquitismo, la osteomalacia, la osteopenia o la osteoporosis. Distintos ensayos clínicos que han evaluado los efectos extraóseos de la vitamina D han mostrado resultados variables, lo que se ha relacionado con la inclusión de pacientes con niveles suficientes. De hecho, los análisis en pacientes deficientes sí han mostrado resultados favorables en patologías extraóseas, como el riesgo cardiovascular, enfermedades autoinmunes, diabetes, etc. Parece entonces recomendable de manera general mantener unos niveles adecuados de vitamina D en la población (47).
Con base en los resultados obtenidos en el presente trabajo, así como en la evidencia científica disponible, el panel multidisciplinar de expertos realizó las siguientes recomendaciones:
– A nivel multidisciplinar, existen poblaciones de alto riesgo de padecer déficit de vitamina D (49), personas con debilidad muscular o riesgo de fracturas/caídas, en las que estaría indicada la determinación de niveles de 25(OH)D.
– Existen pacientes que, por sus características y condición clínica, podrían recibir tratamiento con vitamina D sin necesidad de determinación previa: exposición limitada al sol, ingesta insuficiente de vitamina D, piel pigmentada, niÑos y adolescentes, embarazadas y lactantes, adulto mayor (≥ 65 aÑos) y ancianos (especialmente si presentan riesgo de fracturas), individuos institucionalizados, sujetos en riesgo o diagnosticados con osteoporosis, especialmente con tratamiento antiosteoporótico y con fracturas por fragilidad, pacientes obesos y antes/después de cirugía bariátrica, malabsorción e hipovitaminosis D documentada, entre otros.
– De manera global, pueden establecerse intervalos de 25(OH)D que indican deficiencia de vitamina D en < 20 ng/mL (< 50 nmol/L), insuficiencia en 20-30 ng/mL (50-75 nmol/L) e intervalo óptimo en 30-50 ng/mL (75-125 nmol/L). En cualquier caso, el nivel objetivo puede variar en función del grupo poblacional y la condición clínica que subyace al tratamiento de vitamina D. En la población general, pero especialmente en pacientes de alto riesgo, como el adulto mayor, mujer posmenopáusica o pacientes con patologías óseas, como la osteoporosis, se sugiere mantener niveles de 25(OH)D superiores a 30 ng/ml para maximizar el beneficio en la salud ósea.
– Debido a que el riesgo de mortalidad tiende a aumentar discretamente, no parece recomendable aumentar los niveles por encima de 60 ng/ml.
-
– De manera general, puede utilizarse colecalciferol o calcifediol para tratar a los pacientes con déficit de 25(OH)D, moléculas con distintas propiedades farmacocinéticas y farmacodinámicas.
Debido a que los tratamientos con colecalciferol administrados de forma diaria, semanal o mensual son igualmente efectivos para lograr las concentraciones séricas objetivo, los médicos deberían discutir con sus pacientes qué posología logrará la mejor adherencia. No se ha demostrado esta equivalencia para los tratamientos basados en calcifediol.
El calcitriol y los análogos activos de la vitamina D quedarían reservados para poblaciones con patologías especiales, como insuficiencia renal avanzada o hiperparatiroidismo secundario.
– Si el profesional sanitario decide monitorizar los niveles de 25(OH)D, sería recomendable hacerlo a los 3-4 meses de iniciar el tratamiento y, posteriormente, cada 6-12 meses. En el caso de no realizar determinación o monitorización de niveles de 25(OH)D, o realizarla en intervalos > 6 meses, podría ser preferible el tratamiento con colecalciferol debido a su metabolismo y a su perfil plasmático.
-
– La monitorización de niveles a pacientes en tratamiento sería aconsejable en las siguientes situaciones: deficiencia sintomática de vitamina D, uso de metabolitos distintos del colecalciferol (por ejemplo, calcifediol o calcitriol), suplementación en dosis altas (> 2000 UI/día en aquellos pacientes que toman medicamentos que interfieren con la absorción o el metabolismo de la vitamina D o inducen efectos secundarios), pacientes con baja adherencia al tratamiento, antecedentes de hipervitaminosis D, hipo- o hipercalcemia o hipercalciuria e hiperfosfatemia, síndromes de malabsorción y cirugía bariátrica, obesidad (índice de masa corporal >30 kg/m2), enfermedades granulomatosas, hepáticas y renales crónicas, enfermedades óseas metabólicas, particularmente pacientes con tratamientos antiosteoporóticos o con antecedentes de caídas y fracturas, hiperparatiroidismo e hipertiroidismo y pacientes hipersensibles a la vitamina D, entre otros.
Para maximizar la salud ósea, junto a la suplementación con vitamina D, se necesita asegurar una ingesta de calcio diaria de 1000-1200 mg, especialmente en pacientes con osteoporosis o riesgo de sufrir caídas o fracturas. Sugerimos el uso combinado de calcio y la vitamina D como terapia coadyuvante a los tratamientos de la osteoporosis.
CONCLUSIÓN
En conclusión, el número de solicitudes y de tratamientos de vitamina D se ha incrementado en los últimos aÑos. Este estudio pone de manifiesto la conciencia que el profesional sanitario ya tiene sobre el déficit de vitamina D. A su vez, la encuesta identificó algunas lagunas en el conocimiento de los médicos y una heterogeneidad en el manejo del déficit, especialmente en los valores umbral y en la monitorización del tratamiento. Los resultados de este estudio ofrecen perspectivas al desarrollo de guías clínicas nacionales, con recomendaciones basadas en la evidencia científica.











 texto en
texto en 



