INTRODUCCIÓN
Las enfermedades crónicas no transmisibles son la causa más importante de muerte a nivel mundial1. En este contexto, las medidas tendientes a favorecer la adopción de estilos de vida saludable, así como aquellas vinculadas con el mejoramiento en la prestación de los servicios de salud, han mostrado ser determinantes para la reducción del impacto de estas patologías1-2.
En los últimos años un subtipo de proceso inflamatorio crónico, sistémico y no resolutivo ha sido sugerido como uno de los posibles mecanismos biológicos involucrados en la etiología de las enfermedades crónicas no transmisibles3-4. El exceso de peso, las dietas inadecuadas, el sedentarismo, el estrés psicosocial, la privación del sueño, los contaminantes del medio ambiente, etc., han sido reportados como los principales factores desencadenantes de este proceso biológico particular3-4.
En lo que respecta a la dieta, la promoción del consumo de frutas y verduras ha sido considerada como una de las estrategias en salud pública fundamentales para evitar la aparición de las enfermedades crónicas no transmisibles1-2, aspecto que está sustentado en las características nutricionales de este grupo de alimentos tales como su bajo contenido calórico y su importante aporte de agua, fibra, vitaminas, minerales y compuestos bioactivos5-6.
Si bien diversas disciplinas científicas han respaldado la adopción de esta medida en salud pública por parte de los individuos, es realmente muy poco lo que se sabe acerca de los mecanismos biológicos que explican su impacto epidemiológico. En este contexto, los aportes de las disciplinas científicas fundamentadas en la genética molecular son indispensables y relevantes para desentrañar muchos de estos aspectos7-8.
Teniendo en cuenta lo anterior, este estudio pretendió indagar sí la ingesta diaria de frutas enteras, en una cantidad equivalente a la establecida en la medida en salud pública relacionada con la promoción del consumo de frutas y verduras (±400g/día)1-2, tiene algún efecto sobre la expresión de ARNm de un conjunto de genes vinculados con el proceso de inflamación crónica en las células mononucleares de sangre periférica de un grupo de adultos jóvenes sanos.
MATERIAL Y MÉTODOS
Diseño del estudio y población
La investigación consistió en un ensayo controlado aleatorizado abierto de diseño paralelo. La población de estudio estuvo constituida por los estudiantes de la Facultad de Medicina de la Universidad Nacional de Colombia Sede Bogotá.
Muestra
El tamaño de la muestra se estableció de acuerdo con lo señalado en la tabla Nº 8 del artículo de Whitehead AL, et al. (2016), donde se indica la muestra requerida para estudios piloto considerando aspectos como el poder (P) y el tamaño de efecto estandarizado (δ)9. Con base en ello, la muestra necesaria para el desarrollo de esta investigación fue de 15 individuos por grupo de tratamiento (P=90%; δ=0,38), siendo el valor de δ estimado a partir de los datos reportados en el estudio de Hermsdorff HH, et al. (2010)10.
Reclutamiento de los sujetos de estudio
Los estudiantes fueron reclutados para el estudio entre enero y junio de 2016 por medio de una convocatoria electrónica enviada a través del correo masivo de la Facultad de Medicina de la Universidad Nacional de Colombia Sede Bogotá. Los individuos interesados en ser parte de la investigación fueron citados en las instalaciones del Instituto de Genética de la Universidad Nacional de Colombia Sede Bogotá, donde se les dio una explicación detallada de los objetivos, procedimientos y compromisos requeridos para el estudio, tras lo cual los mismos firmaron el consentimiento informado en caso de estar de acuerdo con las condiciones indicadas.
Selección de los sujetos de estudios
Los sujetos seleccionados para el estudio fueron aquellos aparentemente sanos con edades comprendidas entre los 18 y 30 años. Los individuos con un IMC <18,5 o ≥30,0; en condición de embarazo o lactancia; con antecedentes de enfermedades crónicas, intolerancias y/o alergias a alimentos; sometidos a cirugías mayores; que donaron sangre en un periodo menor de 6 meses; que reportaron el uso de tabaco, el consumo excesivo de alcohol, la ingesta de medicamentos antiinflamatorios, el consumo de suplementos nutricionales, la práctica actividad física intensa o el seguimiento de cualquier tipo de tratamiento tendiente a la reducción del peso corporal fueron excluidos de la investigación.
Cuestionarios
La información sobre algunos aspectos relacionados con el estado de salud y los estilos de vida de los sujetos de estudio fue obtenida por medio de un cuestionario general y una frecuencia de consumo de alimentos. El primero fue construido con base en los cuestionarios de las universidades de la Florida11 y Nebraska12, mientras que para el segundo se consideraron las frecuencias de consumo de alimentos de la ENSIN 201013 y del estudio de Monsalve-Álvarez JM, et al. (2011)14, así como los grupos de alimentos descritos en las Guías Alimentarias para la Población Colombiana15.
Medidas antropométricas
Las medidas antropométricas establecidas para esta investigación fueron peso, talla y circunferencia de la cintura, las cuales fueron estimadas por un profesional idóneo en el área.
Alimentos y comidas de prueba
Las frutas enteras suministradas en la intervención (banano, mandarina, manzana, fresa, naranja, durazno, uva y mango) fueron seleccionadas con base en el criterio de “mayor frecuencia de consumo poblacional”, tomando como fuente de información los datos de un reporte técnico del Ministerio de Salud y Protección Social de Colombia16 y considerando que dichas frutas no requirieran ningún tipo de manipulación antes de su entrega a los sujetos de estudio.
Las comidas de prueba A y B consistieron de una combinación de 4 frutas enteras distintas (±400g netos) mientras que la comida C estuvo constituida por una bebida láctea (150g) y un derivado de cereal (20g). Los alimentos incluidos en cada comida de prueba, así como los aportes de energía y macronutrientes de las mismas, son indicados en la Tabla 1.
Tabla 1. Aporte de energía y macronutrientes de las comidas de prueba
| Comida de prueba | Alimentos componentes | Promedio de la porción neta suministrada | Aporte nutricional de la porción* | |||
|---|---|---|---|---|---|---|
| Energía (kcal) | Proteína (g) | Grasas (g) | Carbohidratos (g) | |||
| A | Banano | 410 g | 245 | 3,24 | 0,50 | 58,54 |
| Manzana | ||||||
| Naranja | ||||||
| Uva | ||||||
| B | Mandarina | 421 g | 207 | 3,40 | 1,27 | 47,66 |
| Fresa | ||||||
| Durazno | ||||||
| Mango | ||||||
| C | Kumis | 150 g | 216 | 6,27 | 5,15 | 35,94 |
| Galletas de soda | 20 g | |||||
*Para el cálculo del aporte nutricional se utilizó la información registrada en la Tabla de composición de alimentos colombianos 2015 (ICBF) y en la Tabla de composición de alimentos de Centroamérca 2012 (INCAP).
Asignación de los tratamientos
Los individuos seleccionados fueron asignados al grupo control o tratamiento a través de un procedimiento de aleatorización por bloques, no obstante, fue necesario ajustar la relación entre los grupos de 1:1 a 1:3 debido al bajo reclutamiento y a la alta proporción de abandonos.
Las comidas de prueba A y B fueron distribuidas entre los sujetos del grupo tratamiento por medio de un procedimiento de aleatorización simple mientras que la comida de prueba C fue asignada de forma conveniente a los individuos del grupo control.
Intervención nutricional
La intervención nutricional fue dividida en 3 momentos dentro un periodo de 15 días. En el Momento 1 (día 1), se obtuvo una muestra de sangre periférica (T0) de todos los participantes luego de un ayuno de 10-12 horas. Seguidamente, en el Momento 2 (día 1), los voluntarios de cada grupo consumieron una comida de prueba: A o B para el grupo tratamiento y C para el grupo control, tras lo cual se obtuvo una segunda muestra de sangre periférica (T1) 2 horas después de la ingesta de dichas comidas.
En el Momento 3 (días 2-15), se instruyó a los individuos del grupo control a mantener su alimentación habitual. Por otro lado, se indicó a los participantes del grupo tratamiento sustituir las frutas enteras de su dieta habitual por la porción diaria suministrada por los investigadores, la cual constó de una combinación de 3 frutas enteras distintas por día (±400g netos), así como a enviar evidencia diaria de la ingesta de dicha porción a través de fotografías o vídeos. Por último, en el día 15 se obtuvo una tercera muestra de sangre periférica (T2) de todos los voluntarios luego de un ayuno de 10-12 horas.
Muestras biológicas
Las muestras de sangre fueron extraídas por venopunción al vacío del antebrazo de cada uno de los participantes, actividad que fue realizada por un profesional idóneo en el área. De las muestras obtenidas, dos fueron enviadas a un laboratorio especializado en la ciudad de Bogotá para la determinación de los niveles séricos de glucosa y lípidos.
Las muestras restantes, recolectadas en tubos que contenían el anticoagulante EDTA, fueron inmediatamente procesadas con el reactivo Histopaque-1077 (Sigma-Aldrich) para la obtención de las células mononucleares, las cuales fueron almacenadas a -80°C hasta su uso posterior.
Genes
Los genes inflamatorios analizados fueron seleccionados con base en la revisión de la información científica disponible. Dentro de éstos, se incluyeron genes que codifican para importantes receptores celulares (IL1R, IL6R, TLR2, TLR4 y TNFR) y para una de las subunidades del factor de transcripción nuclear NFκB (RELA), el cual es un regulador clave del proceso inflamatorio.
Por otro lado, para la estimación de las tasas de expresión relativa de los genes inflamatorios se emplearon los genes de referencia ACTB y ARNr 18S, los cuales mostraron un comportamiento estable y uniforme independientemente de las distintas intervenciones aplicadas (dato no mostrado).
Extracción de ARN total
El reactivo PureLink® RNA Mini Kit (Thermo Fischer Scientific) fue empleado para extraer el ARN total de las células mononucleares. Durante el proceso de extracción se incluyó un paso de tratamiento con la enzima desoxirribonucleasa (ADNasa), esto con el fin de eliminar las moléculas de ADN que pudiesen estar presentes en la muestra. Tras la extracción, el ARN total obtenido fue almacenado a -80°C hasta su uso posterior.
La cantidad y pureza de ARN total fue determinada a través de los espectrofotómetros NanoDrop 2000 y NanoVue Plus, en todos los casos la relación de absorbancia 260/280nm fue mayor de 1,8.
La integridad del ARN total fue establecida por medio de la técnica de electroforesis en gel de agarosa (Figura 1). En síntesis, 10µl de ARN total fueron desnaturalizados con 0,5-1,0µl de urea 4M (55°C x 10 minutos), sometidos a choque térmico e inmediatamente sembrados en un gel de agarosa al 1,2%, el cual fue teñido con el colorante SYBR SAFE, sumergido en búfer TBE 1X y corrido a 55 V x 45 minutos.

Muestras de 10μl de ARN total (±1μg) fueron desnaturalizadas con urea 4M (55°C x 10 minutos), tras cual fueron sometidas a choque térmico. Inmediatamente, las muestras fueron sembradas en un gel de agarosa al 1,2%, el cual fue teñido con el colorante SYBR SAFE, sumergido en búfer TBE 1X y corrido a 50 V x 45 minutos.
Las flechas indican las bandas correspondientes a las subunidades 28S y 18S del ARN ribosomal humano. Las bandas indicadas en el recuadro corresponden a ADN genómico, cuya presencia pudo ser producto de una insuficiente digestión por parte de la enzima desoxirribonucleasa (ADNasa) o por contaminación de la muestra luego de la extracción de ARN total.
Las bandas ubicadas en el extremo inferior corresponden a productos de PCR de 192pb (izquierda) y 175pb (derecha), respectivamente.
Figura 1. Integridad del ARN total
Transcripción reversa (RT)
El reactivo High Capacity cDNA Reverse Transcription Kit (Thermo Fischer Scientific) fue utilizado para la obtención de ADN complementario (ADNc) a partir del ARN total. En resumen, un máximo de 2µg de ARN total fue retrotranscrito en un termociclador Bio-Rad T100 bajo las siguientes condiciones: I) 25°C x 10 minutos; II) 37°C x 120 minutos; III) 85°C x 5 minutos y IV) 4°C x ∞. El ADNc obtenido de esta reacción fue almacenado entre -25 y -15°C hasta su uso posterior.
Cebadores
Se diseñaron cebadores para el ARN de los genes inflamatorios IL1R, IL6R, TLR2, TLR4, TNFR y RELA, así como para los genes de referencia ACTB y rRNA 18S (Material Adicional - MA1: http://www.renhyd.org/index.php/renhyd/article/view/746/568), empleando las herramientas bioinformáticas Primer-Blast17y Primer3 Input18.
Durante el proceso de diseño se aseguró que los cebadores tuviesen una longitud entre 18 y 25 nucleótidos, un contenido de guanina-citosina entre el 40 y 60%, una temperatura de fusión entre el 55 y 65°C y una baja complementariedad. Por otro lado, se procuró que cada par de cebadores generaran productos de PCR de un tamaño ≤400pb. Por último, se garantizó que los cebadores flanquearan las uniones exón-exón de la secuencia de ARNm, esto con el fin de incrementar la especificidad y evitar la amplificación de secuencias de ADN.
Estandarización
Se llevó a cabo un conjunto de ensayos con el fin de estandarizar la técnica de PCR cuantitativa (qPCR). En primer lugar, se determinó que una concentración de cebadores de 0,5-0,8µM y de ADNc de 2ng/µl eran óptimos para la reacción (dato no mostrado). En segundo lugar, la electroforesis en gel de agarosa mostró que los distintos cebadores, excepto los del gen IL1R, generaron los productos de PCR esperados (dato no mostrado). En tercer lugar, la curva de fusión evidenció que los distintos cebadores produjeron picos únicos y específicos (Material Adicional - MA2: http://www.renhyd.org/index.php/renhyd/article/view/746/568). Finalmente, la curva estándar indicó que la eficiencia de reacción de los diferentes cebadores fue la adecuada (Material Adicional - MA3: http://www.renhyd.org/index.php/renhyd/article/view/746/568), salvo por el gen IL1R, ya que en cada caso está mostró valores cercanos al estándar recomendado de 2 (Material Adicional - MA1: http://www.renhyd.org/index.php/renhyd/article/view/746/568).
PCR cuantitativa (qPCR)
El ensayo de qPCR se llevó a cabo utilizando el reactivo FastStart Essential DNA Green Master (Roche). En síntesis, 18µl de una solución compuesta por búfer, cebadores y agua libre de nucleasas fue mezclada con 2µl de ADNc en cada uno de los pozos de la placa de reacción. Posteriormente, la placa de reacción fue cargada en el termociclador LigthCycler 96 (Roche) utilizando la siguiente programación: I) un ciclo de pre-incubación a 95°C x 600 segundos; II) 40 ciclos con desnaturalización a 95°C x 30 segundos; hibridación de los cebadores a 55°C x 30 segundos y extensión a 72°C x 45 segundos; III) un ciclo de fusión (melting) a 95°C x 5 segundos, 55°C x 60 segundos y 98°C x 1 segundo; y IV) un ciclo de enfriamiento a 40°C x 10 segundos.
En cada una de las placas de reacción se montaron las muestras de los individuos voluntarios por triplicado. Adicionalmente, en todas las placas de reacción se incluyó una muestra calibradora, la cual fue obtenida de un individuo sano no relacionado con la investigación, esto con el fin de ajustar los datos a las variaciones entre ensayos.
Análisis estadísticos
A partir de los datos del cuestionario de frecuencia de consumo de alimentos se derivó una puntuación de ingesta, con valores comprendidos entre 0 y 1, para cada uno de los grupos de alimentos establecidos en dicho instrumento (Material Adicional - MA4: http://www.renhyd.org/index.php/renhyd/article/view/746/568).
Los valores del ciclo de cuantificación (Cq), obtenidos del ensayo de qPCR en las muestras biológicas de los voluntarios y en la muestra calibradora, fueron utilizados para el cálculo de la tasa de expresión relativa con base en la siguiente ecuación19:
Donde ET y ER representan la eficiencia de reacción del gen de interés y de los genes de referencia. CqT y CqR simbolizan el ciclo de cuantificación del gen de interés y de los genes de referencia en la muestra de estudio. CqT,cal y CqR,cal indican el ciclo de cuantificación del gen de interés y de los genes de referencia en la muestra calibradora (normalizadora)19.
Dado que los datos crudos de la tasa de expresión relativa obtenidos de la ecuación son números adimensionales, fue necesario realizar una transformación de estos a valores de la escala logarítmica, en este caso en base 2, con el fin de facilitar su análisis e interpretación.
Los análisis estadísticos fueron realizados en el programa SPSS versión 22 (IBM), estableciendo un nivel de significación de α=0,05 y un nivel de confianza del 95% en todos los casos. La normalidad y la homocedasticidad de las variables fueron determinadas a través de las pruebas de Shapiro-Wilk y Levene/Mauchly, respectivamente. La comparación de medias de las variables entre los grupos fue estimada por medio de la prueba T de Student o la prueba de ANOVA de un factor. El contraste de medias de las variables entre los grupos, en los que se obtuvieron medidas repetidas, fue definido a través de la prueba de ANOVA factorial mixto. Finalmente, la prueba de comparaciones múltiples, ajustada por el método de Bonferroni, fue utilizada en los casos en los que la prueba de ANOVA indicó diferencias estadísticamente significativas.
RESULTADOS
Un total de 49 individuos fueron reclutados para el desarrollo de la investigación, de los cuales el 62% completó el protocolo de estudio (Figura 2). De este último conjunto de sujetos se destacó una participación predominante de las mujeres (76%) respecto de los hombres (24%).

Los sujetos de estudio fueron reclutados entre enero y junio de 2016. La intervención tuvo una duración de 2 semanas, periodo en el cual los individuos del grupo tratamiento consumieron una porción diaria de frutas enteras mientras los sujetos del grupo control continuaron con su alimentación habitual. Se obtuvieron muestras de sangre periférica de cada uno de los voluntarios de ambos grupos en tres momentos principales: en el día 1 tras un periodo de ayuno de 10-12 horas (T0), en el día 1 luego de 2 horas del consumo de una comida de prueba (T1) y en el día 15 tras un periodo de ayuno de 10-12 horas (T2).
Figura 2. Selección de los individuos participantes en la investigación
Al comparar algunas características basales entre los individuos de ambos grupos de estudio se observaron similitudes en términos de la edad, la circunferencia de la cintura, el índice de masa corporal y la ingesta de los grupos de alimentos más representativos de la dieta (Tabla 2).
Tabla 2. Características basales de los sujetos de estudio
| Ítem | Grupo | Diferencia entre los grupos | ||
|---|---|---|---|---|
| Control | Tratamiento | |||
| M ± DE | M ± DE | DM [IC 95%] | p | |
| Edad (años) | 23,9 ± 2,8 | 24,2 ± 4,0 | -0,3 [-3,7; 3,0] | 0,84 |
| Circunferencia de la cintura (cm) | 73,0 ± 8,1 | 73,7 ± 9,3 | -0,6 [-8,7; 7,4] | 0,87 |
| IMC (kg/m2) | 21,0 ± 2,2 | 22,2 ± 2,7 | -1,1 [-3,5; 1,2] | 0,32 |
| Cereales y derivados (PI) | 0,051 ± 0,021 | 0,060 ± 0,028 | -0,009 [-0,033; 0,015] | 0,46 |
| Raíces, tubérculos y plátanos (PI) | 0,057 ± 0,038 | 0,034 ± 0,032 | 0,022 [-0,007; 0,052] | 0,13 |
| Hortalizas, verduras y legumbres (PI) | 0,039 ± 0,047 | 0,038 ± 0,031 | 0,001 [-0,030; 0,032] | 0,94 |
| Frutas enteras (PI) | 0,036 ± 0,028 | 0,039 ± 0,022 | -0,004 [-0,024; 0,017] | 0,72 |
| Carnes, huevos y leguminosas (PI) | 0,035 ± 0,018 | 0,035 ± 0,031 | 0,000 [-0,026; 0,026] | 1,00 |
| Leche y derivados (PI) | 0,092 ± 0,068 | 0,121 ± 0,064 | -0,029 [-0,087; 0,029] | 0,32 |
La puntuación de ingesta (PI) fue calculada a partir de los datos del cuestionario de frecuencia de consumo de alimentos y representa la ingesta diaria de cada uno de los grupos de alimentos analizados.M: Media; DE: Desviación estándar; DM: Diferencia de medias; IC: Intervalo de confianza; p: Valor de probabilidad para la prueba T de Student. Control (n=7); Tratamiento (n=22).
Respecto de algunos factores del estilo de vida, considerando los sujetos de ambos grupos de estudio como un único conjunto de individuos, no se evidenciaron diferencias estadísticamente significativas en la expresión de ARNm de los genes inflamatorios al contrastar el autorreporte de actividad física y calidad del sueño (Tabla 3). En el caso del autorreporte de estrés, se notaron variaciones estadísticamente significativas en la expresión de ARNm del gen RELA, particularmente al comparar entre el nivel más bajo y el nivel más alto registrado (Figura 3).
Tabla 3. Expresión de ARNm de los genes inflamatorios de acuerdo con algunos factores del estilo de vida
| Gen | Gen | Autorreporte | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| No | Sí | Diferencias | |||||||||
| n | M | DE | n | M | DE | DM | IC 95% | p | |||
| Calidad del sueño | IL6R | 10 | -0,346 | 0,808 | 19 | -0,143 | 1,009 | -0,203 | -0,962 | 0,556 | 0,59 |
| RELA | 10 | -0,218 | 0,681 | 19 | -0,056 | 0,969 | -0,162 | -0,870 | 0,546 | 0,64 | |
| TLR2 | 10 | -1,385 | 0,764 | 19 | -0,741 | 1,803 | -0,645 | -1,876 | 0,587 | 0,29 | |
| TLR4 | 10 | -0,793 | 0,767 | 19 | -0,403 | 2,128 | -0,391 | -1,828 | 1,047 | 0,58 | |
| TNFR | 10 | -1,710 | 0,490 | 19 | -1,224 | 1,207 | -0,486 | -1,308 | 0,336 | 0,24 | |
| Actividad física | IL6R | 13 | -0,391 | 0,870 | 16 | -0,068 | 0,988 | -0,323 | -1,041 | 0,395 | 0,36 |
| RELA | 13 | -0,218 | 0,824 | 16 | -0,025 | 0,924 | -0,193 | -0,868 | 0,482 | 0,56 | |
| TLR2 | 13 | -1,276 | 1,428 | 16 | -0,709 | 1,627 | -0,567 | -1,748 | 0,614 | 0,33 | |
| TLR4 | 13 | -0,600 | 2,067 | 16 | -0,486 | 1,558 | -0,114 | -1,495 | 1,267 | 0,87 | |
| TNFR | 13 | -1,226 | 1,095 | 16 | -1,527 | 0,996 | 0,301 | -0,497 | 1,098 | 0,45 | |
Los valores representan la tasa de expresión relativa del ARNm de los genes inflamatorios en la muestra biológica T0 (Día 1 - 0h).IL6R: Interleukin 6 receptor; RELA. RELA proto-oncogene, NF-kB subunit; TLR2: Toll-like receptor 2; TLR4: Toll-like receptor 4; TNFR TNF receptor superfamily member 1A. M: Media; DE: Desviación estándar; DM: Diferencia de medias; IC: Intervalo de confianza; p: Valor de probabilidad para la prueba T de Student.

Los datos representan la tasa de expresión relativa del mRNA de los genes inflamatorios evaluados en la muestra biológica T0 (Día 1 – 0h).
UA: Unidades arbitrarias; N2: Nivel de estrés 2 (n=7); N3: Nivel de estrés 3 (n=14). N4: Nivel de estrés 4 (n=7). IL6R: Interleukin 6 receptor; TLR2: Toll-like receptor 2; TLR4: Toll-like receptor 4; TNFR: TNF receptor superfamily member 1A; RELA: RELA proto-oncogene, NF-kB subunit.
§ Prueba de ANOVA de un factor (p=0,037); ʘ Prueba de comparaciones múltiples (DMN4-N2=1,173; IC95% [0,078; 2,268]; p=0,033).
Figura 3. Expresión de ARNm de los genes inflamatorios de acuerdo con el autorreporte de estrés
La expresión de ARNm de los genes inflamatorios no mostró modificaciones estadísticamente significativas luego de la ingesta de cada una de las comidas de prueba suministradas, además, no se observó ninguna diferencia estadísticamente significativa en la expresión de ARNm de estos genes al comparar entre dichas comidas (Tabla 4).
Tabla 4. Expresión de ARNm de los genes inflamatorios luego de la ingesta de las comidas de prueba
| Gen | Comida de prueba | n | Muestra biológica | pC | pT | pC*T | Diferencia entre las comidas por tiempo | Diferencia por tiempo dentro de las comidas | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| T0 | T1 | Parejas | T0 | T1 | ||||||||||||||||
| M | DE | M | DE | DM | IC 95% | DM | IC 95% | Parejas | DM | IC 95% | ||||||||||
| IL6R | A | 10 | -0,258 | 1,103 | -0,418 | 0,627 | 0,838 | 0,173 | 0,678 | C vs. A | 0,021 | -1,201 | 1,243 | -0,232 | -1,477 | 1,012 | A (T1 vs. T0) | -0,160 | -0,686 | 0,366 |
| B | 12 | -0,161 | 0,658 | -0,235 | 0,741 | C vs. B | -0,076 | -1,256 | 1,103 | -0,415 | -1,616 | 0,786 | B (T1 vs. T0) | -0,075 | -0,554 | 0,405 | ||||
| C | 7 | -0,237 | 1,204 | -0,650 | 1,620 | B vs. A | 0,097 | -0,964 | 1,159 | 0,182 | -0,899 | 1,264 | C (T1 vs. T0) | -0,413 | -1,041 | 0,215 | ||||
| RELA | A | 10 | -0,263 | 0,960 | -0,144 | 0,918 | 0,966 | 0,119 | 0,294 | C vs. A | 0,256 | -0,874 | 1,386 | -0,467 | -1,904 | 0,971 | A (T1 vs. T0) | 0,120 | -0,553 | 0,792 |
| B | 12 | -0,046 | 0,731 | -0,516 | 1,102 | C vs. B | 0,038 | -1,053 | 1,129 | -0,094 | -1,481 | 1,293 | B (T1 vs. T0) | -0,471 | -1,085 | 0,143 | ||||
| C | 7 | -0,008 | 1,058 | -0,611 | 1,464 | B vs. A | 0,218 | -0,764 | 1,199 | -0,373 | -1,622 | 0,876 | C (T1 vs. T0) | -0,603 | -1,407 | 0,201 | ||||
| TLR2 | A | 10 | -0,624 | 2,079 | -0,884 | 1,129 | 0,800 | 0,409 | 0,247 | C vs. A | -0,512 | -2,501 | 1,478 | 0,401 | -0,902 | 1,704 | A (T1 vs. T0) | -0,260 | -0,960 | 0,441 |
| B | 12 | -1,144 | 0,836 | -1,021 | 0,729 | C vs. B | 0,008 | -1,912 | 1,929 | 0,538 | -0,719 | 1,796 | B (T1 vs. T0) | 0,123 | -0,517 | 0,763 | ||||
| C | 7 | -1,136 | 1,738 | -0,483 | 1,319 | B vs. A | -0,520 | -2,249 | 1,209 | -0,137 | -1,269 | 0,995 | C (T1 vs. T0) | 0,653 | -0,185 | 1,490 | ||||
| TLR4 | A | 10 | -0,358 | 2,019 | -0,580 | 1,312 | 0,786 | 0,605 | 0,591 | C vs. A | -0,061 | -2,365 | 2,244 | 0,630 | -1,128 | 2,388 | A (T1 vs. T0) | -0,222 | -1,119 | 0,675 |
| B | 12 | -0,756 | 0,771 | -0,589 | 1,029 | C vs. B | 0,336 | -1,887 | 2,560 | 0,639 | -1,058 | 2,336 | B (T1 vs. T0) | 0,166 | -0,652 | 0,985 | ||||
| C | 7 | -0,419 | 2,695 | 0,049 | 1,975 | B vs. A | -0,397 | -2,399 | 1,605 | -0,009 | -1,536 | 1,519 | C (T1 vs. T0) | 0,469 | -0,603 | 1,540 | ||||
| TNFR | A | 10 | -1,499 | 1,000 | -1,535 | 0,476 | 0,714 | 0,823 | 0,863 | C vs. A | 0,031 | -1,314 | 1,376 | 0,253 | -0,364 | 0,870 | A (T1 vs. T0) | -0,036 | -0,640 | 0,568 |
| B | 12 | -1,259 | 0,601 | -1,289 | 0,486 | C vs. B | -0,209 | -1,507 | 1,089 | 0,008 | -0,588 | 0,603 | B (T1 vs. T0) | -0,030 | -0,582 | 0,521 | ||||
| C | 7 | -1,468 | 1,662 | -1,282 | 0,513 | B vs. A | 0,240 | -0,928 | 1,408 | 0,246 | -0,290 | 0,781 | C (T1 vs. T0) | 0,186 | -0,535 | 0,908 | ||||
Los valores representan la tasa de expresión relativa del ARNm de los genes inflamatorios en las muestras biológicas T0 (Día 1 - 0h) y T1 (Día 1 - 2h).
IL6R: Interleukin 6 receptor; RELA: RELA proto-oncogene, NF-kB subunit; TLR2: Toll-like receptor 2; TLR4: Toll-like receptor 4; TNFR: TNF receptor superfamily member 1A. M: Media; DE: Desviación estándar; DM: Diferencia de medias; IC: Intervalo de confianza. pC: Valor de probabilidad del factor comida; pT: Valor de probabilidad del factor tiempo; pC*T: Valor de probabilidad de la interacción comida*tiempo.
El análisis estadístico fue realizado a través de la prueba de ANOVA factorial mixto.
Durante el periodo de intervención de 2 semanas, no se notaron cambios estadísticamente significativos en la expresión de ARNm de los genes inflamatorios en los individuos del grupo control ni al contrastar entre los sujetos de ambos grupos de estudio, no obstante, se evidenció que el consumo de frutas enteras indujo una reducción estadísticamente significativa en la expresión de ARNm de los genes IL6R y RELA en los individuos del grupo tratamiento (Figura 4).
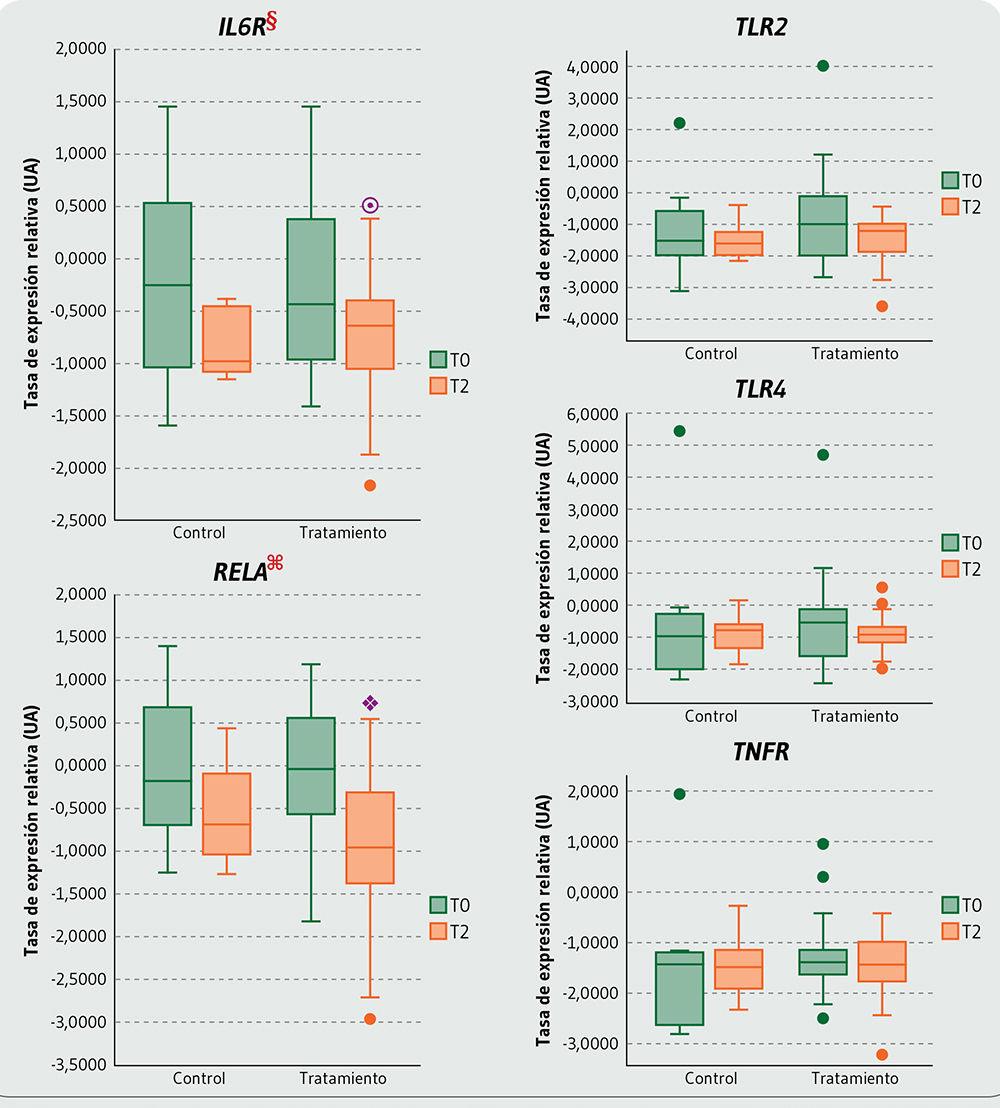
Los datos representan la tasa de expresión relativa del mRNA de los genes inflamatorios evaluados en las muestras biológicas T0 (Día 1 – 0h) y T2 (Día 15 – 0h).
UA: Unidades arbitrarias; IL6R: Interleukin 6 receptor; TLR2: Toll-like receptor 2; TLR4: Toll-like receptor 4; TNFR: TNF receptor superfamily member 1A; RELA: RELA proto-oncogene, NF-kB subunit.
§ Prueba de ANOVA factorial mixto (pFactor tiempo=0,020); ʘ Prueba de comparaciones múltiples (DMT2-T0=-0,565; IC95% [-1,039; -0,090]; p = 0,021);
Figura 4. Expresión de ARNm de los genes inflamatorios luego de la intervención de 2 semanas
Finalmente, se observó que durante la intervención de 2 semanas no se presentaron variaciones estadísticamente significativas en los niveles séricos de glucosa y lípidos en los individuos del grupo control ni al comparar entre los sujetos de ambos grupos de estudio, sin embargo, se notó que la ingesta de frutas enteras promovió un aumento estadísticamente significativo en los niveles séricos de colesterol HDL en los individuos del grupo tratamiento (Figura 5).

Los datos representan los niveles séricos de glucosa y lípidos en las muestras biológicas T0 (Día 1 – 0h) y T2 (Día 15 – 0h).
§ Prueba de ANOVA factorial mixto (pFactor tiempo=0,014). ʘ Prueba de comparaciones múltiples (DMT2-T0=3,50; IC95% [1,12; 5,88]; p = 0,005).
Control (n=7). Tratamiento (n=22).
Figura 5. Niveles séricos de glucosa y lípidos luego de la intervención de 2 semanas
DISCUSIÓN
La inflamación crónica ha suscitado gran interés científico debido a su aparente disociación causal de los agentes infecciosos, aspecto característico de la inflamación clásica, ya que está íntimamente ligada con factores relacionados con la calidad del ambiente y los estilos de vida3-4. Esta marca distintiva es sumamente relevante en el contexto de las enfermedades crónicas no transmisibles dado que la alteración sistémica y persistente de los mecanismos de inflamación parece ser un evento fundamental dentro del desarrollo de estas patologías3-4.
En esta investigación se evaluó la posible influencia de la ingesta de frutas enteras, así como de otros factores del estilo de vida, sobre la expresión de ARNm de un conjunto de genes vinculados con el proceso de inflamación crónica en las células mononucleares de sangre periférica de un grupo de adultos jóvenes sanos. En síntesis, los hallazgos de este estudio sugieren que el estrés psicosocial y la ingesta diaria de frutas enteras podrían tener un rol potencial sobre la regulación de la expresión de ARNm de los genes RELA e IL6R, los cuales codifican para dos proteínas inflamatorias esenciales: el factor de transcripción nuclear NFκB y el receptor de la proteína pleoitrópica IL6, respectivamente20-21.
En el caso del estrés, la variación en la expresión de ARNm del gen RELA es un resultado muy interesante puesto que evidencia que un determinante psicosocial es capaz de modular la función inflamatoria. En concordancia con estos hallazgos, investigaciones previas han reportado que los individuos sometidos a pruebas de estrés psicosocial muestran una mayor expresión de ARNm de algunos genes inflamatorios, además, exhiben un incremento en la actividad de unión al ADN del factor de transcripción nuclear NFκB22-23. Considerando este fenómeno, es importante que en futuras exploraciones se indague acerca de las posibles interacciones entre el estrés y otros elementos involucrados en el proceso de inflamación crónica.
Respecto del consumo de frutas enteras, las reducciones postratamiento en la expresión de ARNm de los genes RELA e IL6R constituyen un hallazgo sustancial, del cual no se tiene antecedente conocido, dado que denota una respuesta activa de los mecanismos de inflamación ante una intervención basada en la adopción de una medida en salud pública. Si bien es posible que la disminución en la expresión de ARNm de estos genes haya sido secundaria a la variación en la producción de otras moléculas por parte de genes del huésped o de su microbiota, a la regulación de los mecanismos epigenéticos o a algún otro factor desconocido, es necesario que estudios robustos exploren estos aspectos y precisen en qué punto del tiempo los cambios persistentes en la expresión de ARNm de los genes inflamatorios cobran relevancia a nivel proteico, metabólico y fisiológico.
Otras variables examinadas en esta investigación fueron la autopercepción de calidad del sueño y de actividad física, para los cuales no se identificó ningún tipo de interacción significativa con la expresión de ARNm de los genes inflamatorios analizados, no obstante, en estudios previos se ha indicado que los adultos sometidos a distintos periodos de restricción del sueño24-25, así como aquellos expuestos a diferentes tipos de actividad física y/o deportiva26-27, presentan variaciones notables en la expresión de ARNm de genes relacionados con la función inmune e inflamatoria.
El impacto postprandial de la ingesta de comidas de prueba de distinta naturaleza fue también valorado dentro de esta investigación, sin embargo, este ensayo no mostró ningún tipo de cambio significativo en la expresión de ARNm de los genes inflamatorios evaluados. Cabe resaltar que el bajo contenido calórico de estas comidas, así como el análisis de la expresión de ARNm de los genes inflamatorios en un único punto de tiempo, pudo haber condicionado este resultado. Aunque para el caso de las frutas enteras no se tiene conocimiento de antecedentes similares, estudios previos han señalado que la ingesta de alimentos lácteos es capaz de generar alteraciones postprandiales en el transcriptoma de sujetos sanos, siendo la respuesta inmune e inflamatoria uno de los procesos principalmente afectados28-29.
Complementario a los análisis de expresión de ARNm, en esta investigación se evaluó el comportamiento sérico de la glucosa, el colesterol y los triglicéridos, revelándose un aumento significativo en los niveles de colesterol HDL tras la intervención con las frutas enteras. Este hallazgo es destacable ya que se ha reportado que bajas concentraciones de colesterol HDL parecen estar vinculadas con modificaciones en la expresión de ARNm de algunos genes inflamatorios, así como con variaciones en los niveles plasmáticos de importantes marcadores de inflamación30. En este contexto, es indispensable que en abordajes futuros se explore a profundidad sobre los mecanismos que explican las interrelaciones entre el colesterol HDL y la expresión génica inflamatoria tras estímulos nutricionales.
En esta investigación se presentó una serie de limitaciones que es necesario señalar. En primer lugar, la expresión de los genes inflamatorios fue evaluada únicamente a nivel del ARNm, esto debido a la naturaleza exploratoria del estudio, razón por la cual se desconoce si los efectos observados se manifestaron también a nivel de las proteínas. Por otro lado, el reducido número de individuos impidió explorar el papel de otras variables relevantes tales como edad, sexo, actividad física, patrón alimentario, entorno ambiental, etc., así como las posibles interacciones de éstas con la ingesta de frutas enteras. Por otro parte, el bajo número de genes considerados no permitió establecer si otros componentes de la vía inflamatoria pudieron ser potencialmente afectados por la intervención. Por último, no se tiene certeza acerca del grado de efectividad de la estrategia de verificación de consumo empleada en comparación con los métodos tradicionalmente utilizados.
CONCLUSIONES
Los hallazgos de este estudio constituyen un primer aporte al conocimiento genético-molecular de los posibles mecanismos biológicos regulados tras la adopción de una medida en salud pública, representado en este caso por la reducción en la expresión del ARNm del gen RELA tras la ingesta de frutas enteras. Por otro lado, se espera que los resultados de esta investigación impulsen el desarrollo de estudios en los que se explore el papel de la dieta, y de los estilos de vida en general, bajo las condiciones naturales a las que están expuestos los individuos de la población.














