Mensajes Clave
Este estudio reveló una asociación entre un mayor porcentaje de grasa corporal y un aumento de hasta tres veces, en la prevalencia del fenotipo delgado metabólicamente obeso.
Se identificaron puntos de corte óptimos para el porcentaje de grasa corporal que permiten diagnosticar el fenotipo delgado metabólicamente obeso de manera efectiva, estableciendo valores del 20,70% para hombres y del 32,45% para mujeres.
Los resultados destacan la importancia de una evaluación integral de la composición corporal, incluso en individuos con un IMC normal, para prevenir eficazmente las alteraciones metabólicas asociadas al fenotipo delgado metabólicamente obeso.
Esta investigación proporciona evidencia crucial que puede informar estrategias de salud pública en la detección temprana y la prevención de problemas metabólicos en una población peruana diversa.
Introducción
El aumento de la prevalencia de obesidad en las últimas décadas ha impactado negativamente en la salud y calidad de vida de la población a nivel mundial. Los años de vida ajustados por discapacidad relacionados con la obesidad experimentaron un aumento anual del 0,48% entre 2000 y 2019, con una proyección de incremento del 39,8% desde 2020 hasta 20301.Entre los efectos deletéreos para la salud a causa de la obesidad se encuentra el aumento de riesgo de enfermedades cardio-metabólicas, musculoesqueléticas, depresión y algunos tipos de cáncer2, así como el aumento de la mortalidad y discapacidad prematura1.
Globalmente, el índice de masa corporal (IMC) ≥30kg/m2se emplea como diagnóstico de obesidad. Sin embargo, a pesar de sus ventajas como la rapidez y bajo costo, no logra diferenciar entre la masa grasa y la muscular al usar el peso como numerador del índice3. Por ello, un resultado dentro de los rangos normales no garantiza la salud metabólica. De hecho, la presencia de alteraciones metabólicas en aquellos con IMC normal es conocido desde la década de los 80 y se ha seguido reportando sistemáticamente4. A este fenotipo se le denomina delgado metabólicamente obeso (DMO)5y su prevalencia global se estima en 26,78%6.
Aunque no existe consenso sobre los criterios diagnósticos para el fenotipo DMO5, sus características genotípicas, como las de composición corporal han sido previamente descritas5,7. Dentro de las últimas, se incluyen un incremento del tejido adiposo, con baja acumulación en la región glúteo-femoral, pero alta adiposidad visceral e hígado graso8. Aunque la valoración de la adiposidad corporal puede abordarse con técnicas de referencia como la absorciometría de rayos X de energía dual (DEXA); estas, rara vez se encuentran a disposición en la práctica clínica7. En contraposición, la medición de pliegues cutáneos es un buen predictor de la densidad corporal, posee una alta correlación con la grasa subcutánea y masa grasa total, además de ser no invasiva y de bajo costo9,10. Sin embargo, su uso en la valoración de la salud metabólica no ha sido suficientemente estudiada, con solo algunos estudios al respecto en población latinoamericana11,12.
Analizar la interacción de este fenotipo con indicadores utilizados en la valoración clínica, y potencialmente superiores en precisión al IMC, resulta relevante en la práctica clínica, particularmente en el contexto peruano, donde se ha reportado que un 43,1% adultos presentan el fenotipo DMO13. En este escenario, la falta de un diagnóstico de obesidad podría disminuir la conciencia de las personas sobre su salud y la adopción de medidas preventivas. Por ello, el objetivo del estudio fue analizar la asociación entre el porcentaje de grasa corporal estimado por la técnica de pliegues cutáneos y el diagnóstico de fenotipo DMO.
Metodología
Diseño
Se realizó un estudio analítico de corte transversal usando la base de datos del estudio de cohorte PERU MIGRANT (estudio primario), publicado por el Centro CRÓNICAS entre los años 2007-2008. El objetivo principal del estudio primario fue evaluar las diferencias en los factores de riesgo cardiovascular entre poblaciones urbanas, rurales y migrantes urbanos-rurales.
Población y muestra
Los participantes del estudio original fueron residentes de San José de Secce, población rural de Ayacucho, provincia ubicada en los Andes del Perú y residentes de Pampas de San Juan de Miraflores, ubicado en una zona urbana de Lima, capital del Perú. Se incluyeron en el estudio original a sujetos de 30 años o más, sin antecedentes de enfermedad mental o embarazo, fueron elegidos mediante muestreo aleatorio simple basado en censos realizados en 2006 y 2007. La información detallada sobre los criterios de selección, las variables evaluadas, el tamaño de la muestra y tasas de participación ha sido publicada en el protocolo del estudio originario14.
Para el presente estudio, del total de participantes del estudio original se incluyeron a individuos con IMC entre 18,5 y 24,9 kg/m2. Como criterios de exclusión se consideró los antecedentes de diabetes mellitus, hipertensión arterial y valores faltantes de interés. El número final de participantes incluidos para el presente estudio fue de 321. Se realizó el análisis post hocpara la potencia estadística en el programa GPower 3.1 con tamaño de muestra=321, significancia=0,05 para dos colas, tamaño de efecto=6.59 (odds ratio equivalente a razón de prevalencia de 3,09), R2=0,15 para 9 variables predictoras, probabilidad de variable respuesta=0,2 y distribución Poisson. La potencia observada fue de 99,9%.
Variables y medidas
Variable respuesta:La variable respuesta fue el diagnóstico del fenotipo DMO. Se utilizó los criterios de la Federación Internacional de Diabetes para el síndrome metabólico15, y estudios previos para la evaluación del modelo homeostático para resistencia a la insulina (HOMA-IR) y proteína C reactiva (PCR)7. Se clasificó como DMO si presentara dos o más de los siguientes criterios: perímetro de cintura (PC) ≥80 cm para mujeres o ≥90 cm para hombres, triglicéridos ≥150 mg/dL, glucosa en ayunas ≥100 mg/dL o en tratamiento hipoglicemiante, presión arterial sistólica (PAS) ≥130 mmHg o presión arterial diastólica (PAD) ≥85 mmHg o en tratamiento para disminuir los niveles de presión arterial, HDL-colesterol <50 mg/dL en mujeres o <40 mg/dL en hombres, resistencia a la insulina (RI) medida a través del índice HOMA-IR≥2,80 y PCR≥3 mg/dl.
Variable de exposición:La variable de exposición fue el nivel de grasa corporal expresada como porcentaje de grasa corporal (%GC). Esta fue calculada con la sumatoria de pliegues cutáneos (bíceps + tríceps + subescapular + supra-espinal), para estimar densidad corporal (DC) con la ecuación de Durnin & Womersley16. Se calculó el %GC con la ecuación de Siri17: % Masa grasa = (495/DC) - 450. Posteriormente, se realizó un análisis de la curva de característica operativa del receptor (COR) para definir los puntos de corte óptimos y con estos categorizar la variable como %GC alto (mayor o igual al punto de corte para cada sexo) o normal.
Covariables:Se consideró como covariables el sexo, edad categorizada, grupo de migración, estado actual de fumador, consumo de alcohol, nivel de actividad física, nivel de educación y estado socioeconómico. Para la variable grupo de migración el grupo rural comprendió a aquellos que nacieron y vivían en Ayacucho; el grupo urbano a quienes nacieron y vivían en Lima y el grupo migrante a aquellos nacidos en Ayacucho pero que residían en Lima en el momento de la recolección de información. Las variables tabaquismo y el consumo de alcohol se reportaron utilizando una versión adaptada del cuestionario del método paso a paso de la OMS para la vigilancia de factores de riesgo para las enfermedades crónicas no trasmisibles (STEPS)18, mientras que los niveles de actividad física se definieron mediante el Cuestionario Internacional de Actividad Física (IPAQ)19.
Las mediciones de PAS y PAD se realizaron en sedestación, en el brazo derecho localizado a nivel del tórax. Se registraron tres mediciones separadas de al menos 5 minutos cada una, con un oscilómetro validado previamente en población adulta (Omron M5-i, Omron, Japón). Se utilizó la media de las dos últimas mediciones de PAS y PAD para el análisis.
Medidas antropométricas:Se midieron cuatro pliegues cutáneos (bicipital, tricipital, subescapular, suprailíaco y su suma combinada) realizados en triplicado por un trabajador de campo utilizando un calibrador HoltainTanner/Whitehouse calibrado a 0,2 mm más cercano. Todos los pliegues cutáneos fueron medidos hasta completar un circuito de mediciones, por triplicado. Se garantizó que no se midiera el mismo pliegue cutáneo de manera consecutiva, para evitar posibles sesgos en la medición. Se calculó y se utilizó el promedio de las tres mediciones de cada pliegue cutáneo para las estimaciones posteriores.
El perímetro de cintura fue medido en el punto medio entre la costilla inferior y la cresta ilíaca con una cinta antropométrica SECA 201, diseñada para medir perímetro de cintura con precisión de 1 mm20. La estatura fue medida tras realizar una espiración máxima con el participante ubicado en el plano de Frankfurt y con una precisión de 0,1 cm utilizando un estadiómetro de madera, móvil y multiusos con las especificaciones técnicas del Centro Nacional de Alimentación y Nutrición (CENAN)21. El peso se registró con una precisión de 0,05 kg, y se evaluó al individuo vestido con ropa ligera, mediante el uso de una balanza electrónica (marca SECA modelo 940). El IMC se calculó aplicando la fórmula: peso/talla en metros2. El proceso de estandarización de las mediciones antropométricas se basó en la metodología de calcular el promedio de todas las observaciones realizadas por el mismo observador de forma mensual antes del inicio del estudio, y se estableció como requisito que cada observador en el campo realizara mediciones en duplicado en un mínimo de 10 sujetos.
Medidas invasivas:Las evaluaciones de laboratorio fueron llevadas a cabo por personal capacitado. Las muestras venosas fueron recolectadas en la mañana, tras un ayuno mínimo de 8 horas. Las mediciones de glucosa e insulina en ayunas se realizaron en plasma y sangre total, respectivamente. Se emplearon las técnicas enzimáticas colorimétricas (GOD-PAP; modular P-E/Roche-cobas, Grenzach-Wyhlen, Alemania) y electro quimioluminiscencia (modular P-E/Roche-cobas)22para medir glucosa e insulina. La resistencia a la insulina se determinó mediante el índice HOMA-IR, calculado como [Glucosa (mg/dL) * Insulina (uU/ml)] / 405. Los niveles de triglicéridos y HDL-colesterol se determinaron en suero utilizando un analizador automatizado Cobas® Modular Platform con reactivos Roche Diagnostic23. La PCR se midió mediante látex (Tina-quant CRP-HS Roche/Hitachi analyzer, Indianápolis, IN, EE. UU.)22.
Análisis estadístico
Se empleó STATA versión 17.0. Los análisis descriptivos se presentaron como frecuencias absolutas y porcentajes para las variables categóricas, y con la mediana y rango intercuartil para las variables numéricas. El análisis bivariado se realizó con la prueba de Chi-cuadrado de independencia y la prueba de la mediana, para las variables categóricas y numéricas, respectivamente.
La determinación del punto de corte óptimo del %GC se evaluó con el análisis de curva de la característica operativa del receptor (COR) estratificado por sexo, y se calculó el área bajo la curva correspondiente, la sensibilidad, especificidad, valores predictivos positivos y negativos, así como la razón de verosimilitud positiva y negativa. El punto de corte óptimo se determinó utilizando el índice de Youden.
Para el análisis de regresión, se ajustó un modelo lineal generalizado con enlace log y familia Poisson para la totalidad de la muestra y estratificada por sexo. Se obtuvo razones de prevalencia crudas y ajustadas (RPc y RPa) por las covariables de estudio, con IC95%. Se consideró significativo p<0,05 para todos los análisis.
Consideraciones éticas
El estudio original, PERU MIGRANT, obtuvo aprobación ética de la Universidad Peruana Cayetano Heredia (Código 60014). En el estudio original se obtuvo el consentimiento de los participantes y para el uso de datos posteriores. Se cumplieron los estándares éticos de la Declaración de Helsinki.
Dado que el presente estudio consistió en un análisis de datos secundarios derivados del estudio original, mismo que es de acceso abierto24, no hubo interacción directa con los participantes, evitando riesgos potenciales, por lo cual no se requirió de aprobación de comité de ética.
Resultados
Características de población de estudio
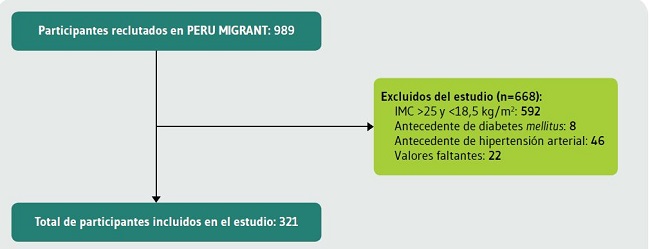
Se incluyeron 321 sujetos tras excluir a 668 participantes del estudio original. Las razones se detallan en la Figura 1.
El 54,52% de los participantes fueron varones y el grupo de edad de 30 a 44 años representó el 53,27%. En relación con el estilo de vida, el hábito tabáquico, consumo de alcohol y el bajo nivel de actividad física fueron poco prevalentes (11,21%, 9,97% y 18,68%, respectivamente). Respecto al nivel de adiposidad, poco más de la mitad de los participantes presentó un alto %GC, mientras que la prevalencia del fenotipo DMO fue de 32,09%. El análisis bivariado evidenció que las variables asociadas al fenotipo DMO fueron el sexo, grupo de edad y el %GC alto. Así mismo, el valor del %GC fue mayor entre aquellos con fenotipo DMO respecto de aquellos sin él (Tabla 1).
Tabla 1. Características de la muestra estratificado por diagnóstico de fenotipo DMO.
| Características | Total | Fenotipo DMO | p-valor* | |
|---|---|---|---|---|
| (n=321) | No (n=218) | Sí (n=103) | ||
| n (%) | n (%) | n (%) | ||
| Sexo | 0,007 | |||
| Femenino | 146 (45,48) | 88 (60,27) | 58 (39,73) | |
| Masculino | 175 (54,52) | 130 (74,29) | 45 (25,71) | |
| Grupo de edad | < 0,001 | |||
| 30 a 44 años | 171 (53,27) | 134 (78,36) | 37 (21,64) | |
| 45 a 59 años | 119 (37,07) | 68 (57,14) | 51 (42,86) | |
| 60 años a más | 31 (9,66) | 16 (51,61) | 15 (48,39) | |
| Grupo de migración | 0,916 | |||
| Rural | 130 (40,50) | 88 (67,69) | 42 (32,31) | |
| Migrante | 150 (46,73) | 101 (67,33) | 49 (32,67) | |
| Urbano | 41 (12,77) | 29 (70,73) | 12 (32,09) | |
| Fumador activo | 0,557 | |||
| No | 285 (88,79) | 192 (67,37) | 93 (32,63) | |
| Sí | 36 (11,21) | 26 (72,22) | 10 (27,78) | |
| Consumo de alcohola | 0,489 | |||
| Bajo | 289 (90,03) | 198 (68,51) | 91 (31,49) | |
| Alto | 32 (9,97) | 20 (62,50) | 12 (37,50) | |
| Nivel de actividad física† | 0,623 | |||
| Bajo | 59 (18,38) | 37 (62,71) | 22 (37,29) | |
| Moderado | 72 (22,43) | 49 (68,06) | 23 (31,94) | |
| Alto | 190 (59,19) | 132 (69,47) | 58 (30,53) | |
| Nivel de educación | 0,153 | |||
| Ninguna/Primaria incompleta | 116 (36,14) | 71 (61,21) | 75 (38,79) | |
| Primaria completa | 45 (14,02) | 32 (71,11) | 13 (28,89) | |
| Secundaria completa/incompleta | 160 (49,84) | 115 (71,88) | 45 (28,13) | |
| Nivel socioeconómico¶ | 0,719 | |||
| Bajo | 171 (53,27) | 115 (67,25) | 56 (32,75) | |
| Medio | 74 (23,05) | 53 (71,62) | 21 (28,38) | |
| Alto | 76 (23,68) | 50 (57,79) | 26 (34,21) | |
| %GC§ | < 0,001 | |||
| Normal | 144 (44,86) | 119 (82,64) | 25 (17,36) | |
| Alto | 177 (55,14) | 99 (55,93) | 78 (44,07) | |
| %GC¥ | 26,17 | 24,74 | 30,95 | < 0,001ǂ |
| (20,64-32,90) | (19,36-30,93) | (23,53-35,25) | ||
*Realizado con la prueba de Chi-cuadrado de independencia.
aSe consideró alto al consumo de 6 o más porciones de bebidas alcohólicas en una o más veces al mes durante el último año.
†Se categorizó según las guías de puntuación del Cuestionario Internacional de Actividad Física (IPAQ)19
¶Evaluado a través del índice de bienes construido a partir del ponderado de la posesión de bienes del hogar1
§Se categorizó como alto si el %GC ≥20,70% y 32,45% en varones y mujeres, respectivamente.
¥%GC: Porcentaje de grasa corporal, se expresa como mediana (rango intercuartílico).
ǂRealizado con la prueba de la mediana.
El análisis de curvas COR mostró que los puntos de corte óptimos del %GC para el fenotipo DMO, fueron de 20,70% y 32,45%, con un área bajo la curva de 0,64 y 0,66, para los varones y mujeres, respectivamente. Los puntos de corte obtenidos se utilizaron para categorizar la variable %GC como alta o normal. Los demás valores diagnósticos (sensibilidad, especificidad, valor predictivo positivo y negativo y razón de verosimilitud positivo y negativo) se presentan en la Tabla 2.
Tabla 2. Valores diagnósticos del porcentaje de grasa corporal para fenotipo DMO, estratificado por sexo.
| Punto de corte | Área bajo la curva (IC95%) | Sens (%) | Esp (%) | VPP (%) | VPN (%) | LR+ (%) | LR- (%) | |
|---|---|---|---|---|---|---|---|---|
| %GC | ||||||||
| Varones | 20,70 | 0,64 (0,56-0,72) | 75,60 | 53,10 | 35,80 | 86,30 | 1,61 | 0,46 |
| Mujeres | 32,45 | 0,66 (0,58-0,74) | 75,90 | 56,80 | 53,70 | 78,10 | 1,76 | 0,43 |
%GC:Porcentaje de grasa corporal; Sens:Sensibilidad; Esp:Especificidad; VPP:Valor predictivo positivo; VPN:Valor predictivo negativo; LR+:Razón de verosimilitud positivo; LR-:Razón de verosimilitud negativo; IC95%:Intervalo de confianza al 95%.
El análisis de regresión múltiple reveló que un %GC alto aumentó la razón de prevalencia en 3,09 veces (RP=3,09; IC95%: 2,04-4,67) para el fenotipo DMO, ajustado por múltiples variables. Además, la estratificación por sexo mostró que tanto en varones como en mujeres un %GC alto se asoció positivamente a la prevalencia de DMO (Tabla 3).
Tabla 3. Análisis de regresión crudo y ajustado del porcentaje de grasa corporal y fenotipo DMO del total de la muestra y estratificado por sexo.
| Total (n=321) | ||||
|---|---|---|---|---|
| %GC alto | RP crudo | IC95% | RP ajustado* | IC95% |
| No | Ref. | Ref. | ||
| Sí | 2,54 | (1,71-3,76) | 3,09 | (2,04-4,67) |
| Varones (n=175) | ||||
| %GC alto | RP crudo | IC95% | RP ajustado** | IC95% |
| No | Ref. | Ref. | ||
| Sí | 2,6 | (0,08-0,24) | 2,65 | (1,37-5,12) |
| Mujeres (n=146) | ||||
| %GC alto | RP crudo | IC95% | RP ajustado** | IC95% |
| No | Ref. | Ref. | ||
| Sí | 2,45 | (1,48-4,07) | 3,54 | (2,14-5,84) |
*Ajustado por sexo, grupo de edad, grupo de migración, fumador activo, consumo de alcohol, nivel de actividad física, nivel de educación y nivel socioeconómico.
**Ajustado por grupo de edad, grupo de migración, fumador activo, consumo de alcohol, nivel de actividad física, nivel de educación y nivel socioeconómico
Discusión
El presente estudio reveló que un alto nivel de grasa corporal, evaluado a través de pliegues cutáneos, se asoció con una mayor prevalencia, de hasta tres veces, de presentar el fenotipo DMO.
La prevalencia de DMO en el presente estudio fue de 32,09%, valor consistente con lo reportado en una revisión sistemática que estimó una prevalencia global de 26,78% (IC95%: 18,45-36,03), con mayor afectación en población asiática seguida de la región de América6. El único estudio previo en población latinoamericana encontró una prevalencia del 43%14. Las diferencias en las prevalencias de este fenotipo pueden ser explicadas por los años en los que se realizaron los estudios ya que los patrones alimentarios en América Latina y el mundo continúan cambiando en cada país a velocidades diferentes, llevando un impacto en el estado nutricional de la población25. Otra explicación a las diferencias entre regiones es la variabilidad de adiposidad entre etnias. Por ejemplo, un estudio reportó mayores valores de %GC en México-Americanos comparados con blancos y afroamericanos no hispanos26, mientras que otra investigación halló que el ratio masa grasa/masa magra en nativo americanos y asiáticos del sur es mayor en comparación con los pares europeos27. Además, entre individuos de Latinoamérica la presencia de genómica ancestral nativo americana se ha encontrado positivamente asociada a un mayor IMC en adultos peruanos de ambos sexos (β=0,586, p<0,001 y β=0,421, p<0,001 para mujeres y varones, respectivamente)28. Considerando lo anterior, la valoración de adiposidad en poblaciones latinoamericanas, así como la definición de puntos de corte, resultan de interés para la práctica clínica.
Los puntos de corte del %GC con mayor capacidad diagnóstica para el fenotipo DMO fueron de 20,70% y 32,45% para hombres y mujeres, respectivamente. Estos resultados concuerdan con resultados de un estudio realizado en población adulta joven colombiana para el diagnóstico del síndrome metabólico (puntos de corte de 25,5% y 38,9% para varones y mujeres, respectivamente)12. De forma similar, otros estudios utilizaron un rango de %GC de 20 a 25% para hombres y de 30 hasta 37% para mujeres29,30como parte de los criterios para definir al fenotipo DMO. Aunque estos estudios evaluaron el %GC con bioimpedancia eléctrica (BIA), se ha reportado que la medición de pliegues cutáneos y BIA guardan concordancia en su estimación de la grasa corporal cuando se les compara con el DEXA9. A pesar de que no existe un consenso en la literatura sobre la incorporación del %GC ni de los puntos de corte para la definición del DMO, la valoración de este componente puede mejorar el tamizaje en sujetos con IMC normal para la identificación de individuos con mayor riesgo de anormalidades cardio metabólicas31.
En el presente trabajo, un alto %GC se asoció con un aumento de tres veces la prevalencia del fenotipo DMO. Antecedentes en diferentes poblaciones han reportado una asociación positiva entre altos %GC y la presencia de alteraciones cardio metabólicas en sujetos con IMC normal de entre 2 a 4 veces respecto a los pares con menor %GC30-32. Más aún, un alto %GC se ha encontrado inversamente asociado con la fuerza de prensión manual, indicador de la funcionalidad muscular, y con incrementos en marcadores de adiposidad abdominal31.Esto sugiere que un alto %GC no solo se relaciona con mayor riesgo cardiovascular, sino también con una menor funcionalidad muscular. De hecho, tanto una elevada adiposidad, así como su regionalización visceral se han relacionado con la infiltración de lípidos intramiocelulares, generando alteraciones en la función metabólica normal del músculo esquelético33.
En el presente estudio se encontró que la asociación entre un %GC elevado y el fenotipo DMO afectó tanto a hombres como a mujeres, aunque la relación fue mayor para las últimas. Esto contrasta con estudios previos30,32que observaron que la magnitud de asociación entre un %GC alto y el fenotipo DMO fue mayor para los varones. Sin embargo, es de destacar que estos estudios se realizaron en poblaciones de Canadá y China, que difieren étnicamente de la población de nuestro estudio. En respaldo de lo hallado en esta investigación, se ha reportado en población peruana que las mujeres sufren de manera más severa la adiposidad abdominal y las alteraciones metabólicas en comparación con los hombres14,34. Más aún, la distribución de grasa corporal varía entre países de Latinoamérica, donde las mujeres peruanas muestran una mayor asociación entre la genómica ancestral nativo americana y la relación cintura-cadera (β=0,014; p<0,001), respecto de sus pares colombianas y chilenas (β=0,005; p=0,003 y β=0,008; p=0,001, respectivamente)28.
Los hallazgos del presente estudio respaldan la consideración esencial de la asociación entre el %GC y las alteraciones cardiometabólicas en la práctica clínica, incluso en sujetos con IMC normal. Además, ya que la capacidad diagnóstica del %GC es significativamente superior al del IMC para el fenotipo DMO32se subraya la importancia de reevaluar las métricas convencionales para valorar riesgo metabólico.
Los resultados presentados sugieren que la inclusión del %GC como indicador de evaluación rutinario podría ser valiosa para la identificación e intervención desde una perspectiva nutricional sobre todo en países de Latinoamérica con una alta prevalencia del fenotipo DMO y posible subdetección. Es de reconocer que los resultados adquieren mayor relevancia en el contexto peruano, cuyas guías de valoración nutricional consideran como indicadores al IMC y el perímetro de cintura35y enfatizan en el mantenimiento del peso en individuos con IMC normal sin abordar la evaluación de la adiposidad. Este enfoque limitado, junto con los recursos restringidos en países de medianos a bajos ingresos como Perú, destaca la necesidad crítica de incorporar métodos más sensibles, como el %GC, para una evaluación más integral y precisa de la salud metabólica. Es recomendable desarrollar estudios más amplios y en una muestra representativa que soporten y validen esta recomendación.
Es importante reconocer las limitaciones del presente estudio. El diseño transversal impide establecer relaciones de causalidad entre las variables de estudio. La valoración del consumo de alcohol, tabaco y el nivel de actividad física se basó en el autorreporte lo cual podría estar sujeto a sesgos de información y subestimación de los valores reales. Sin embargo, dichas variables se evaluaron con cuestionarios validados previamente18,19. Por otro lado, a pesar de que la dieta tiene un papel importante en la composición corporal y la salud metabólica31, no se evaluaron variables dietéticas, siendo un posible factor asociado al fenotipo DMO. Sin embargo, es posible que aun ajustando por estos factores se mantuviera la dirección de los hallazgos. Un estudio realizado en población colombiana encontró que la elevada adiposidad entre los sujetos con IMC normal mantuvo asociación significativa con el riesgo cardiovascular después de ajustar por variables dietéticas31.
La evaluación del %GC se basó en la medición de pliegues cutáneos, mismos que miden la adiposidad subcutánea pero no la visceral que es la que guarda estrecha relación con las alteraciones metabólicas. Adicionalmente, aunque la medición de pliegues cutáneos es de bajo costo, poco invasiva y transportable, tiene otras limitaciones como la compresión del panículo adiposo y piel, así como la variabilidad de medición realizada por evaluadores con formación y experiencia limitadas36. Finalmente, ya que se usaron métodos validados tanto para la evaluación del %GC como del fenotipo DMO y se controlaron diferentes covariables de potencial interés que pudieran modificar la asociación entre las variables de estudio, se puede considerar que el estudio guardó validez interna. Por otro lado, si bien el tamaño de muestra fue pequeño y podría subrepresentar algunas poblaciones del Perú, la consistencia de los resultados del presente trabajo con estudios previos, indica que existe de forma general validez externa de los mismos en relación con los grupos considerados en este estudio. Futuras investigaciones podrían considerar estas limitaciones para una evaluación más completa.
Conclusiones
El presente estudio proporciona evidencia de la asociación entre el porcentaje de grasa corporal estimado por la técnica de pliegues cutáneos y el diagnóstico del fenotipo delgado metabólicamente obeso. Los resultados resaltan la necesidad de una evaluación integral de la composición corporal en la práctica clínica, incluso en individuos normopeso, para identificar de manera efectiva y prevenir las alteraciones metabólicas asociadas.