INTRODUCCIÓN
La Medicina Nuclear es la especialidad médica que emplea isótopos radiactivos para el diagnóstico y tratamiento de patologías. Los isótopos son variedades de un elemento químico, que teniendo el mismo número atómico poseen distinto número másico. Algunos de los isótopos son capaces de emitir espontáneamente radiación y por eso se denominan isótopos radiactivos, radioisótopos, radionúclidos o radionucleidos [1].
En Medicina Nuclear la fuente radiactiva (radiofármaco) se administra al paciente, habitualmente, por vía intravenosa. Este trazador se fija en el órgano diana y emite radiación g, que es detectada externamente por equipos denominados gammacámaras. Con esta emisión radiactiva se forma una imagen que refleja la distribución del radiofármaco en el órgano a estudio. Dicha imagen se denomina gammagrafía y puede ser planar o tomográfica (tomografía computarizada por emisión de fotón único –SPECT–) [1].
Otra forma de tomografía es el PET (tomografía por emisión de positrones), que consiste en la administración de un fármaco marcado con un isótopo emisor de positrones (b+). Una vez que el radiofármaco se encuentra en el interior del paciente, los positrones emitidos, tras un recorrido de unos 2-3 mm, son atraídos fuertemente por electrones del medio (e-), que los aniquilan. De la aniquilación de los b+ con los e-, se genera energía en forma de un par de fotones de 511 keV, de la misma dirección y sentidos opuestos, que son detectados por una cámara PET para formar la correspondiente imagen [2].
La combinación de dos tecnologías de imagen se denomina imagen de fusión o imagen híbrida, que permite visualizar la información proporcionada por dos tipos diferentes de imagen en una única exploración. La combinación del PET o el SPECT con el TC (PET-CT y SPECT-CT) se han convertido en técnicas diagnósticas de uso cotidiano, al proporcionar información detallada tanto de la anatomía como de la funcionalidad de órganos y tejidos.
En este trabajo revisaremos las aplicaciones de la Medicina Nuclear en el diagnóstico de la patología tiroidea y paratiroidea.
ESTUDIO DEL NÓDULO TIROIDEO
PET-CT CON 18F-FDG
Aunque el PET con 18F-FDG no está recomendado para la evaluación de nódulos de tiroides previamente diagnosticados, se puede detectar, de forma casual, captación tiroidea anormal en un estudio realizado por otra causa. La captación puede ser focal o difusa [3]. La captación focal de 18F-FDG en el tiroides es incidentalmente detectada en un 1-2 % de los pacientes. Mientras que un 2 % de los pacientes muestran una captación difusa por el tiroides [4].
La captación focal tiroidea corresponde frecuentemente a un nódulo tiroideo clínicamente relevante, y se recomienda la realización de una ecografía para definir la anatomía del nódulo. La captación focal de FDG aumenta el riesgo de malignidad del nódulo y, por tanto, se recomienda la evaluación clínica y la PAAF de los nódulos ≥1 cm. Los nódulos menores de 1 cm, que no cumplen criterios para PAAF, deben ser monitorizados de forma similar a los patrones ecográficos de alto riesgo que no cumplen criterios para realización de PAAF [3].
Una revisión sistemática [4] señala que aproximadamente uno de cada tres nódulos positivos en PET son cáncer, con mayor SUVmax en nódulos malignos que en los benignos (6.9 vs 4.8, p> 0.001). Por el contrario, la captación tiroidea difusa representa en la mayoría de las ocasiones enfermedad benigna, correspondiente a captación inflamatoria en el contexto de Enfermedad de Hashimoto u otra enfermedad tiroidea difusa.
GAMMAGRAFÍA DE TIROIDES
La gammagrafía de tiroides se puede realizar con 123I o 99mTcO4. El 131I no se recomienda para uso diagnóstico de rutina, a menos que se sospeche tirotoxicosis con baja captación [5]. El radiofármaco más empleado, debido a su mayor disponibilidad, menor coste, mejor calidad de imagen y menor exposición a la radiación es el 99mTcO4. Este trazador es administrado de forma intravenosa (de 74 a 370 MBq) y las imágenes se adquieren de 5 a 30 minutos tras su administración. El paciente debe colocarse en posición supina con el cuello en hiperextensión. Existen algunos componentes que pueden disminuir la captación tiroidea y que deben suspenderse antes de la realización de la gammagrafía; fundamentalmente son: Metimazol (una semana antes), tratamiento hormonal sustitutivo (hasta cuatro semanas, en el caso de T4) o contrastes intravenosos (uno o dos meses) [6].
Las indicaciones que recoge la guía para el diagnóstico y manejo de los nódulos tiroideos, de la Asociación Americana de Endocrinología Clínica (AACE), la Asociación de Médicos Endocrinólogos (AME) y la Asociación Europea de Tiroides (ETA), son [5] (Figuras 1 y 2):
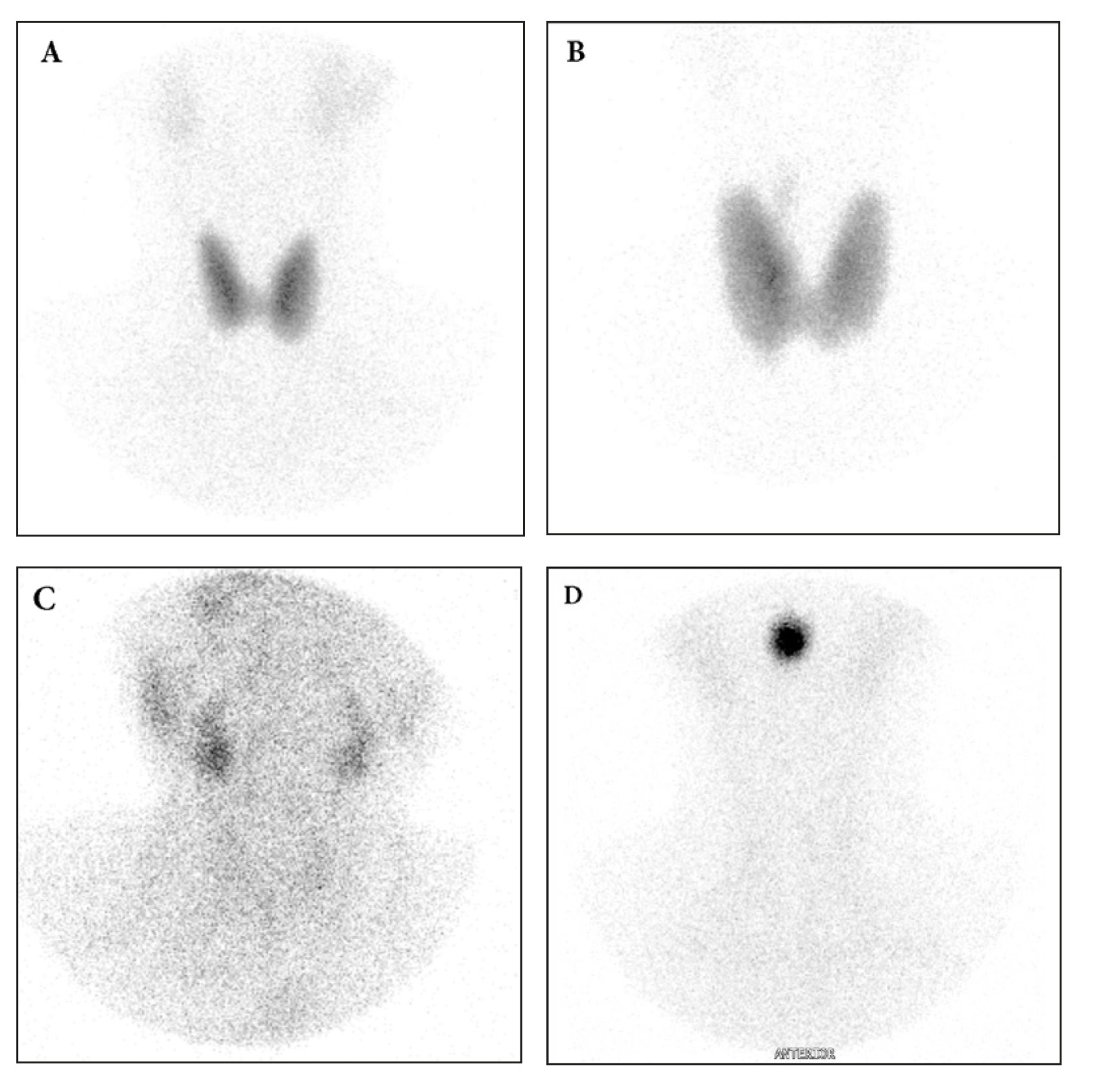
Figura 1. Gammagrafía de tiroides con 99mTcO4 con colimador pinhole: A) Tiroides normal B) Bocio difuso C) Tiroides suprimido D) Tiroides sublingual.
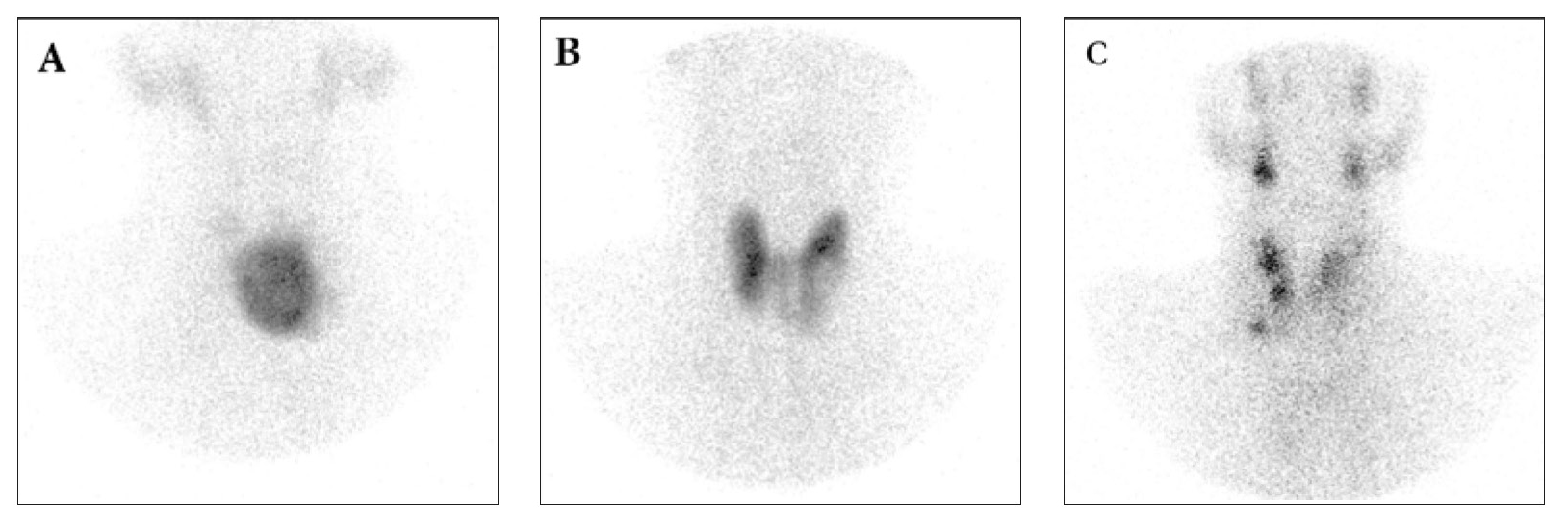
Figura 2. Gammagrafía de tiroides con 99mTcO4 con colimador pinhole: A) Nódulo autónomo B) Nódulo frío en polo inferior del lóbulo tiroideo izquierdo C) Bocio multinodular.
Nódulo tiroideo único y TSH suprimida (PAAF no necesaria en nódulos calientes).
Bocio multinodular (BMN), incluso sin TSH suprimida, para identificar áreas frías o indeterminadas para PAAF y áreas calientes sin necesidad de evaluación citológica.
Grandes BMN, especialmente con extensión subesternal.
Diagnóstico de tejido tiroideo ectópico.
Hipertiroidismo subclínico, para identificar tejido hiperfuncionante oculto.
Lesiones foliculares, para identificar un adenoma funcionante que puede ser benigno; sin embargo, la mayoría de estos nódulos son fríos en la gammagrafía.
Determinar idoneidad para tratamiento con radioyodo.
Esta guía recalca que los nódulos funcionantes en gammagrafía y que no presentan características ecográficas sospechosas pueden ser excluidos de la PAAF [5].
HIPOTIROIDISMO CONGÉNITO
Los recién nacidos con hipotiroidismo congénito, detectado en el screening, deben derivarse para valoración clínica y de la función tiroidea, en muestra venosa, en ese mismo día o al día siguiente. Las pruebas de imagen (gammagrafía o ecografía) son útiles para ayudar a determinar la causa de hipotiroidismo, pero nunca deben retrasar el inicio de tratamiento. La ecografía es operador dependiente y puede ser particularmente difícil en niños. Sin embargo, puede realizarse cuando el acceso a la gammagrafía es limitado. El tratamiento con levotiroxina es de elección y debe iniciarse tan pronto como sea posible [7].
GAMMAGRAFÍA DE TIROIDES
La actividad administrada en los niños debería basarse en el peso corporal y ser tan baja como sea posible para alcanzar una calidad de imagen óptima para el diagnóstico. El cálculo de la dosis pediátrica de 99mTcO4 se basaría en una dosis del adulto reducida (74 a 185 MBq) [6].
La gammagrafía puede identificar [8]:
Atireosis (ausencia de captación).
Hipoplasia glandular in situ.
Glándula normal o aumentada in situ, con o sin niveles anormalmente elevados de captación.
Tiroides ectópico.
La gammagrafía podría mostrar ausencia de captación, a pesar de la presencia de una glándula tiroidea eutópica, por [8]:
Exceso de yodo, a través de exposición materna (antisépticos, etc.).
Ac maternos que bloquean el receptor de la TSH.
Supresión de TSH por tratamiento materno con T4.
Mutaciones que inactivan el receptor de la TSH y el Na/I simporter (NIS).
Cuando el tiroides está en una posición normal, una descarga >10 % de la dosis de 123I, a las 2 horas de administrar perclorato, indica un defecto de organificación [8].
CÁNCER DE TIROIDES. CÁNCER DIFERENCIADO DE TIROIDES (CDT)
RASTREO CORPORAL TOTAL (RCT) CON RADIOYODO
Consiste en un estudio de cuerpo entero, en proyecciones anterior y posterior, tras la administración, vía oral, de una dosis de radioyodo, variable en función del momento de realización de la prueba. La dosis en los RCT no posterapéuticos varía entre 37-185 MBq de 131I. La imagen se adquiere 48-96 h después, con un colimador HEHR (High Energy High Resolution). Después de un tratamiento con radioyodo, el tiempo de realización de la prueba, suele ser entre 5 y 7 días después de la administración del radiofármaco.
En cualquier RCT con radioyodo se requiere la supresión del tratamiento hormonal sustitutivo durante 4 semanas o la administración de tirotropina recombinante humana (rhTSH), para conseguir un nivel de TSH >30 mU/L. El uso de una dieta baja en yodo puede aumentar la sensibilidad de la prueba, comenzando 15 días antes de la administración de radioyodo y continuando durante la realización de la imagen [6].
RCT diagnóstico preablación con radioyodo. El RCT diagnóstico, posoperatorio, puede ser útil cuando la extensión del remanente tiroideo o la enfermedad residual no puede obtenerse con exactitud del informe quirúrgico o de la ecografía cervical, y cuando sus resultados pueden alterar la decisión de tratar o la actividad del radioyodo que debe administrarse. Se debe utilizar 123I (55,5-111 MBq) o, en su defecto, una baja actividad de 131I (37-111 MBq), administrando la dosis terapéutica dentro de las 72 horas después de la dosis diagnóstica [3]
RCT posterapéutico. Se recomienda realizar un RCT posterapéutico, después de la ablación del remanente tiroideo o del tratamiento con radioyodo, para estadificación de la enfermedad y para documentar la avidez de radioyodo de cualquier lesión estructural [3].
-
RCT diagnóstico de seguimiento. Se realiza en pacientes a los que se les haya efectuado tiroidectomía total o casi total y tratamiento con radioyodo, para valorar la presencia o ausencia de enfermedad.
Después del primer RCT postratamiento con radioyodo, los pacientes de riesgo bajo o intermedio (características de bajo riesgo), con tiroglobulina (Tg) indetectable bajo tratamiento hormonal, Ac anti-Tg negativos y ecografía cervical negativa, no requieren RCT diagnóstico durante el seguimiento.
-
El RCT diagnóstico, 6-12 meses después del tratamiento con radioyodo, puede ser útil en el seguimiento de pacientes con riesgo alto o intermedio (con características de mayor riesgo) de enfermedad persistente [3]. El RCT con radioyodo continúa siendo una herramienta esencial para evaluar a los pacientes con cáncer diferenciado de tiroides, no solo para detectar enfermedad residual, sino para catalogar a un paciente de respuesta excelente. Los criterios de ausencia de tumor persistente son [3]:
SPECT-CT CON 131 I
La identificación y localización del foco de captación de radioyodo, puede ser potenciada con el SPECT-CT (Figura 3).

Figura 3. Paciente con cáncer diferenciado de tiroides metastásico: RCT con radioyodo A) en proyección anterior y B) en proyección posterior, observándose múltiples depósitos patológicos del trazador en tórax y uno en abdomen. SPECT-CT (cortes axiales del CT, del SPECT y de la fusión): C) centrado en tórax, donde se aprecian metástasis pulmonares con captación de radioyodo; D) centrado en abdomen, visualizándose una metástasis vertebral con captación de radioyodo.
En una revisión sistemática [9] sobre el valor del SPECT-CT con 131I para la evaluación del CDT, se extraen numerosos beneficios de la adición de esta técnica al RCT con radioyodo. El SPECT-CT, comparado con el RCT:
Mejora el diagnóstico en 48-88 % de los pacientes.
Modifica las estrategias terapéuticas en 23.5 %-25 % de los pacientes.
Mejora la localización en 44 % de las lesiones.
Aumenta la confianza del médico que interpreta la prueba en 71 %.
Desciende el número de casos indeterminados de 29 % a 7 %.
Es más exacto en la evaluación de la afectación linfática, durante el tratamiento con radioyodo.
En el seguimiento, mejora el diagnóstico en 58 % al 74 % de los pacientes, mediante una localización más precisa y una mejor caracterización de los focos de captación.
En un estudio prospectivo, más reciente (2017), que incluye 365 pacientes a los que se les realizaron RCT y SPECT-CT post-terapéuticos, los autores demuestran que la interpretación de un foco de captación equívoco en el RCT fue clasificada por el SPECT-CT en 22.5 % de los pacientes. Además, la estadificación clínica (TNM) y la planificación terapéutica fue modificada en 3.6 % de los casos. Los autores discuten los criterios de selección de pacientes para realizar el SPECT-CT después del tratamiento con radioyodo, defendiendo la realización en todos los casos, o, al menos, en los pacientes con hallazgos equívocos o positivos para lesiones ganglionares o metastásicas a distancia. Concluyen que el SPECT-CT es una potente herramienta diagnóstica, que permite la localización anatómica exacta y la caracterización de los focos radiactivos, aumentando la exactitud diagnóstica, reduciendo pitfalls, y modificando la clasificación TNM y el manejo clínico determinado en base a la imagen planar. No obstante, los autores también señalan las desventajas del SPECT-CT, que incluyen tiempo de imagen adicional, posible incomodidad del paciente, aumento de la claustrofobia, y radiación adicional por el CT [10].
PET-CT CON 18F-FDG
Las principales indicaciones del PET en el CDT son las siguientes [11]:
Paciente con Tg elevada y RCT con 131I negativo. Es la principal indicación del PET con 18F-FDG en el CDT. En el síndrome de TENIS (Thyroglobulin elevated negative radioiodine scintigraphy) disminuye la expresión del simportador de membrana para el yoduro de sodio en las células tumorales, disminuyendo, por tanto, su capacidad para incorporar radioyodo. Simultáneamente, aumenta el metabolismo glucolítico celular, lo que conlleva un incremento de la incorporación de 18F-FDG, que permite detectar las lesiones tumorales no captantes de yodo (fenómeno flip-flop) [12]. En un metaanálisis reciente [13], que incluía 17 estudios y 1195 pacientes, para evaluar la exactitud de la PET-CT con 18F-FDG en la detección de enfermedad recurrente o metastásica, pese a la heterogeneidad de los resultados, la sensibilidad acumulada, y la especificidad fueron 86 % y 84 %, respectivamente.
Pacientes de alto riesgo y variantes histológicas de mal pronóstico. En las guías ATA [3], se propone, así mismo, el PET con 18F-FDG en pacientes con CDT de alto riesgo con Tg elevada (> 10 ng/ml) e imagen con radioyodo negativa. También se recomienda que se considere dicha técnica como parte de la estadificación inicial en cánceres de tiroides pobremente diferenciados y carcinomas de células de Hürtle invasivos, especialmente aquellos con alguna evidencia de enfermedad en las pruebas de imagen o niveles elevados de Tg. Igualmente, se recomienda como herramienta pronóstica en pacientes con enfermedad metastásica, para identificar las lesiones y un mayor riesgo de progresión rápida de la enfermedad y mortalidad, así como para la evaluación de la respuesta al tratamiento con terapia sistémica o local de enfermedad localmente invasiva o metastásica.
Evaluación de la respuesta a nuevas terapias en carcinoma diferenciado de tiroides refractario al 131I. Ésta es una indicación que requiere más estudios, con mayor número de pacientes para establecer de forma clara su impacto clínico.
CÁNCER MEDULAR DE TIROIDES. PET-CT
La PET-CT con 18F-FDG no debe considerarse un método diagnóstico de primera línea en la evaluación del CMT recurrente [11]. Según la guía ESMO-2012, en pacientes con calcitonina sérica <150 pg/ml, la localización de enfermedad debe limitarse a una ecografía, porque dichos niveles de calcitonina habitualmente se asocian con enfermedad locorregional y raramente con enfermedad a distancia. En ocasiones, además de la ecografía cervical, sobre todo si los niveles de calcitonina se elevan a lo largo del tiempo –aun permaneciendo <150 pg/ml–, se pueden considerar otras pruebas de imagen adicionales, como CT, RM, o PET 18F- FDG, aunque suelen resultar negativas.
La evaluación de pacientes con calcitonina basal >150 pg/ml es similar, pero la búsqueda de enfermedad a distancia con las técnicas de imagen antes mencionadas es obligatoria. En aquellos casos en los que los niveles de calcitonina son marcadamente elevados, la PET-CT con 18F-DOPA es más útil para la localización de CMT recurrente [11].
En las guías NCCN-2019 [14], ante el diagnóstico mediante PAAF de cáncer medular de tiroides, se incluye como procedimiento diagnóstico el PET-CT con 68Ga DOTATATE; si este no se halla disponible, se recomiendan gammagrafía ósea o RM esquelética. Así mismo, en el manejo posoperatorio –a los 2 o 3 meses–, cuando la calcitonina basal es ≥150 pg/ml o el CEA está elevado, se debe realizar CT con contraste endovenoso con o sin PET con 18F-FDG o 68Ga-DOTATATE. No obstante, estas guías indican que existen diferentes técnicas de imagen que pueden emplearse para examinar el tumor metastásico o residual pero no hay suficiente evidencia para apoyar el uso de una técnica en particular o combinación de técnicas.
CÁNCER DE TIROIDES POBREMENTE DIFERENCIADO
La mayoría de los estudios demuestran que el cáncer de tiroides pobremente diferenciado responde escasamente al radioyodo y es frecuentemente positivo en PET-CT con 18F-FDG [15] (Figura 4).
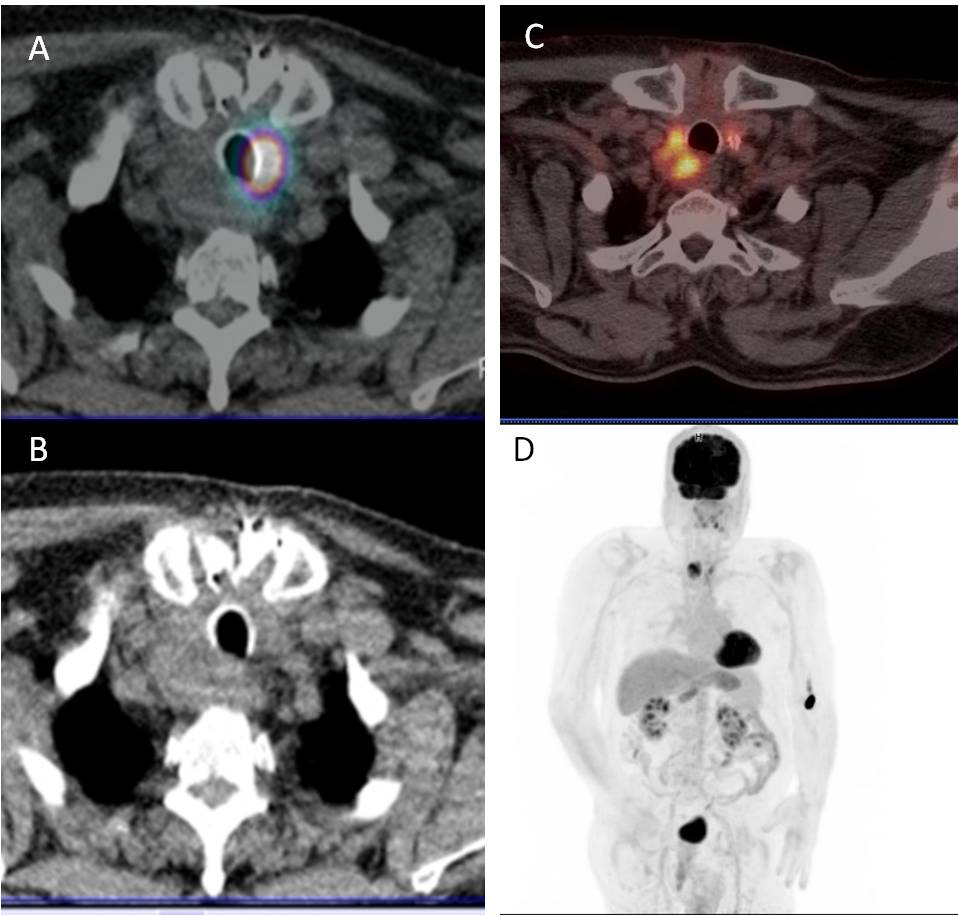
Figura 4. Paciente con cáncer indiferenciado de tiroides: A) SPECT-CT con radioyodo (corte axial), observándose un depósito patológico del trazador en resto tiroideo paratraqueal izquierdo; no se aprecia captación en resto tumoral tiroideo derecho; B) CT donde se aprecian restos postiroidectomía subtotal que infiltran ligeramente la tráquea; C) PET-CT con 18F-FDG (corte axial), visualizándose captación patológica de FDG en resto tumoral paratraqueal derecho; D) MIP (proyección de máxima intensidad) del PET con FDG, identificándose captación del trazador en región cervical.
CÁNCER ANAPLÁSICO DE TIROIDES
PET-CT CON 18F-FDG
Según la guía ATA [16], la PET-CT con 18F-FDG es muy útil en la evaluación de enfermedad metastásica a distancia, así como para diferenciar las metástasis cervicales hipermetabólicas del cáncer anaplásico, de otras menos agresivas, propias del CDT u otros tipos de cáncer. También recomienda la guía que la estadificación radiológica preoperatoria no retrase el inicio de la terapia y que debería realizarse con ecografía cervical, CT o RMN (para cuello y tórax) y PET-CT [16].
En la guía NCCN, también se incluye el PET-CT con 18F-FDG entre las técnicas a realizar en la estadificación inicial [14].
Además, ambas guías recomiendan que el PET-CT con 18F-FDG debería considerase –de 3 a 6 meses tras la terapia inicial–, en pacientes sin evidencia clínica de enfermedad para identificar enfermedad de pequeño tamaño que pueda requerir un cambio en el manejo terapéutico [14, 16]. Lo que, es más, en pacientes con enfermedad estructural persistente, debería considerarse, a intervalos de 3 a 6 meses, como guía de la respuesta al tratamiento y para identificar nuevos sitios de enfermedad que puedan necesitar un cambio en el manejo [16].
HIPERPARATIROIDISMO PRIMARIO
DENSIOMETRÍA ÓSEA
El hiperparatiroidismo primario (HPTp) causa reducción de la densidad mineral ósea (DMO) y puede predisponer al paciente a fracturas por fragilidad.
Según la guía de la American Association of Endocrine Surgeons [17], la densitometría (DEXA) es apropiada para todos los pacientes con HPTp y debería realizarse como screening de manifestaciones esqueléticas clínicamente relevantes (grado de recomendación fuerte; evidencia de alta calidad).
Entre las indicaciones de la cirugía para el tratamiento del HPTp, según el 4th International guidelines for the management of asymotomatic pHPT [18], se encuentra la siguiente: T-score menor o igual a 2.5 desviaciones estándar inferior respecto al valor medio de la población en columna lumbar, cuello femoral, cadera total, o 1/3 proximal del radio para mujeres posmenopáusicas u hombres mayores de 50 años.
GAMMAGRAFÍA DE PARATIROIDES
Todas las guías y consensos concuerdan en que no es una técnica diagnóstica en sí, sino una prueba localizadora prequirúrgica [17, 19].
Radiofármacos y técnica. Aunque tradicionalmente se han utilizado otras técnicas, las dos más utilizadas en la actualidad son [20]:
-
Técnica de doble fase con 99mTc-metoxiisobutilisonitrilo (99mTc-MIBI): Se administran 740 a 1.110 MBq de 99mTc-MIBI, vía intravenosa. Este radiofármaco se localiza tanto en el tejido tiroideo como paratiroideo, pero, habitualmente, el tejido tiroideo lava su actividad de forma más rápida que el tejido paratiroideo anormal. Por tanto, la técnica consiste en la adquisición de dos imágenes planares, precoz y tardía, centradas en regiones cervical y mediastínica. La precoz, a los 10 a 30 minutos de la inyección del trazador y la tardía, a las 1.5 a 2.5 h de la inyección (Figura 5).
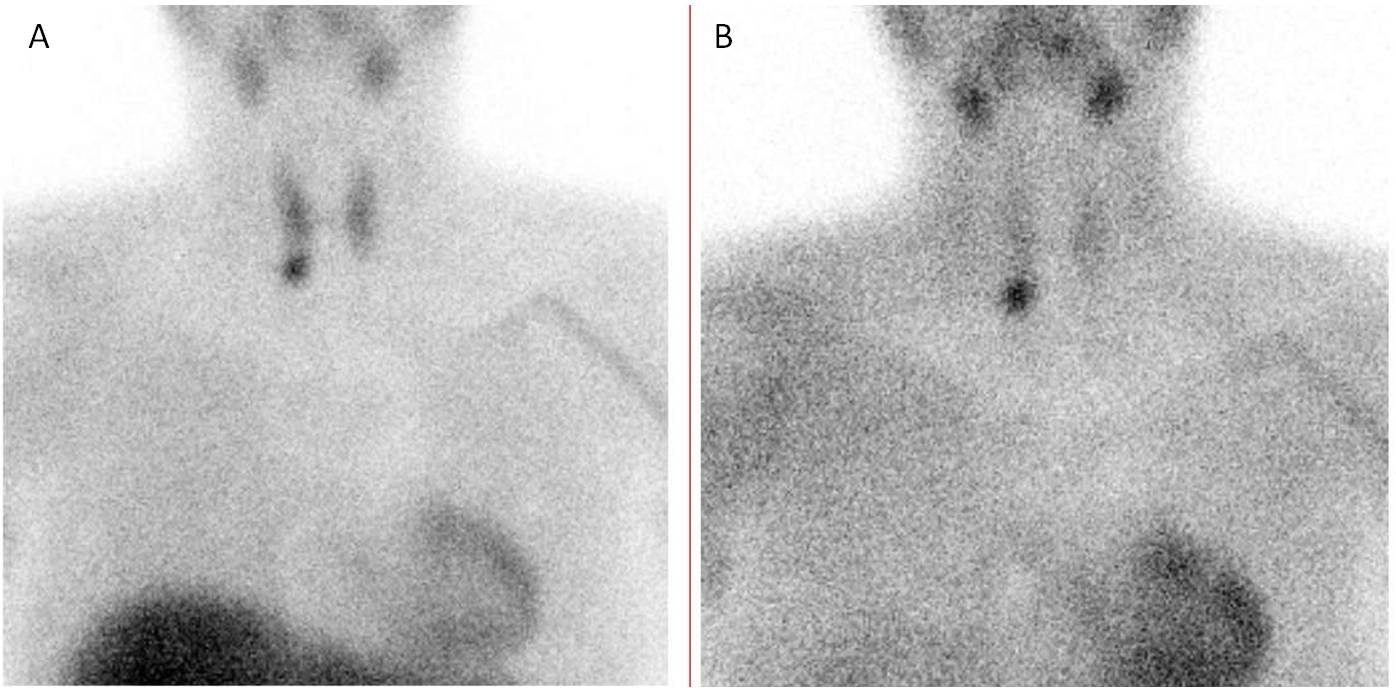
Figura 5. Gammagrafía planar de doble fase con 99mTc-MIBI: A) Imagen precoz a los 10 minutos posinyección del trazador, donde se aprecia actividad del radiofármaco en glándula tiroides, con mayor captación en polo inferior derecho; B) Imagen tardía, a las 2 horas posinyección, visualizándose lavado de la actividad tiroidea, con persistencia de un foco hiperactivo en polo inferior derecho, compatible con adenoma de paratiroides.
Técnica de doble trazador con 99mTc-MIBI y 99mTcO4: El pertecnetato es captado únicamente por el tejido tiroideo, a diferencia del 99mTc-MIBI. En esta técnica se adquieren dos imágenes planares, una con cada trazador, y se sustrae mediante un programa informático la imagen del pertecnetato de la imagen con 99mTc-MIBI. La actividad residual se debería a un adenoma de paratiroides. La actividad de pertecnetato administrada en de 74 a 370 MBq.
Ambas técnicas se han demostrado útiles en el diagnóstico de localización del HPTp. Generalmente, la utilización de una u otra técnica depende de la preferencia de cada centro. Una clara ventaja de la gammagrafía de doble fase es su sencillo protocolo. Sin embargo, en las guías de la EANM, se apoya la realización de la técnica de doble trazador frente a la de doble fase, en primer lugar en pacientes con patología tiroidea asociada, ya que con esta técnica es posible distinguir de forma más adecuada los nódulos tiroideos, y diferenciar la captación de sestamibi en ellos de la captación en las glándulas paratiroideas patológicas. Por otro lado, facilita la toma de decisiones sobre si realizar o no cirugía tiroidea el mismo día de la cirugía de paratiroides [21].
SPECT O SPECT-CT CON 99mTC-MIBI
Las guías EANM recomiendan la utilización del SPECT para definir mejor la localización de cualquier foco ectópico. La técnica hibrida es de mayor utilidad, en este sentido. En la gammagrafía de doble fase, es mejor realizar las imágenes SPECT a continuación de la fase precoz, para no perder las glándulas paratiroides hiperfuncionantes de lavado rápido [21].
Ventajas sobre la imagen planar [22]:
Es de ayuda, en especial en [23]:
Adenomas ectópicos (Figura 6).
Patología tiroidea asociada.
Situación prequirúrgica (cirugía radioguiada).
Cirugía cervical previa.
HPT recurrente o persistente.
Exploraciones con imágenes estáticas normales.
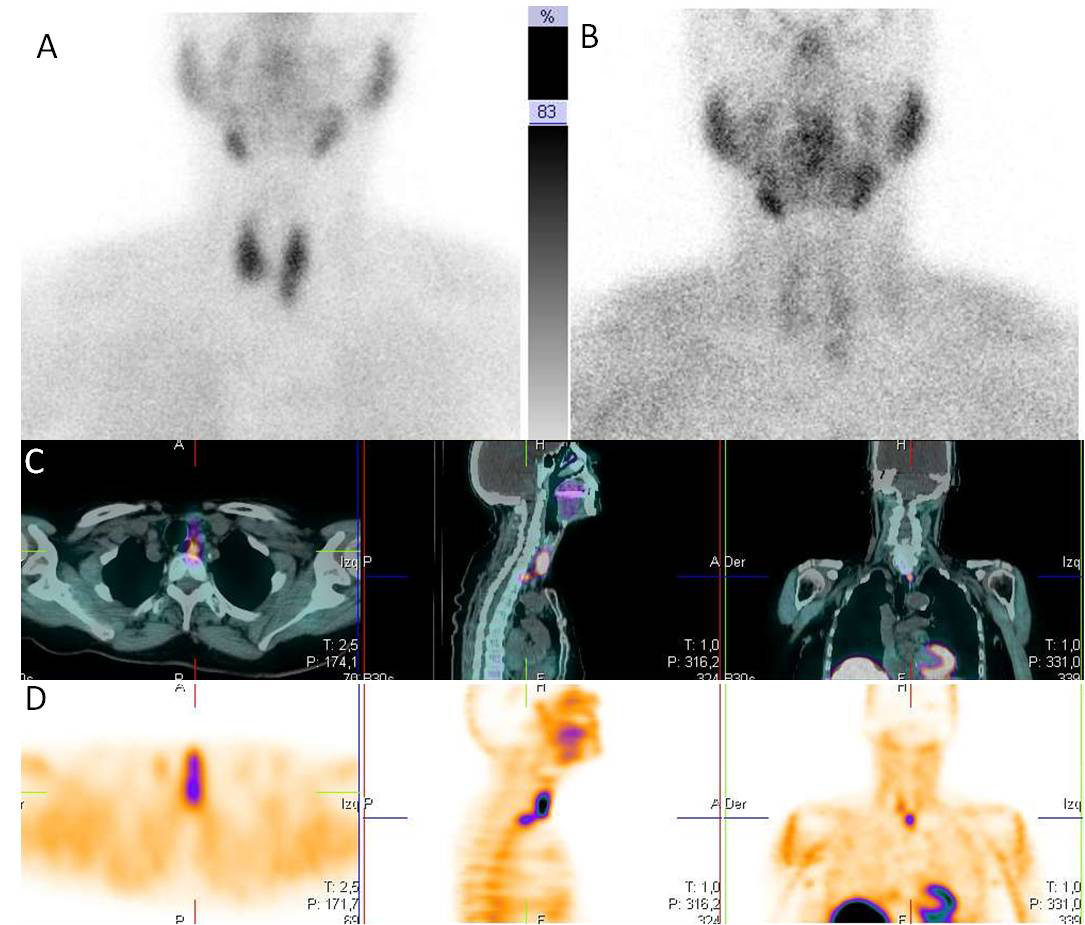
Figura 6. Gammagrafía planar de doble fase y SPECT-CT en tiempo precoz con 99mTc-MIBI: A) Imagen precoz a los 10 minutos posinyección del trazador, donde se aprecia actividad del radiofármaco en glándula tiroides; B) Imagen tardía, a las 2 horas posinyección, observándose lavado casi total de la actividad de la glándula tiroides, con dudosa imagen de persistencia de actividad en polo inferior izquierdo. C y D) Cortes axiales, sagitales y coronales de la fusión y del SPECT, respectivamente, donde se visualiza un depósito del trazador de localización paraesofágica izquierda, compatible con adenoma ectópico de paratiroides de lavado rápido.
En la Tabla 1 se muestran los resultados de un metanálisis publicado en 2015, que compara la imagen planar, el SPECT y el SPECT-CT con 99mTc-MIBI en el diagnóstico de localización prequirúrgico del HPTp.
Tabla 1. Comparación de las técnicas planar y SPECT en el diagnóstico de localización del HPTp (Wei WJ et al) [24]
| Planar | SPECT | SPECT-CT | |
| Sensibilidad | 63 % | 66 % | 84 % |
| VPP | 90 % | 82 % | 95 % |
Falsos positivos y negativos de la gammagrafía:
PET-CT
Indicación: Prequirúrgica, tras localización inicial negativa o no concluyente con pruebas convencionales.
-
Trazadores:
CIRUGÍA RADIOGUIADA
Esta técnica utiliza un isótopo radiactivo, el 99mTc-MIBI, para facilitar la localización intraoperatoria del tejido paratiroideo hiperfuncionante. Antes de la cirugía se requiere la inyección del trazador, en una dosis habitualmente menor que la de la gammagrafía, y en un intervalo de tiempo variable, según diferentes autores. Durante la intervención, se emplea una sonda gammadetectora, que mediante una señal acústica y numérica detectará la emisión radiactiva del tejido paratiroideo hiperfuncionante (contaje in vivo). Además, se debe medir el contaje ex vivo del tejido extirpado y realizar un contaje del lecho quirúrgico tras la exéresis, para garantizar el éxito de la cirugía. Esta técnica tiene una sensibilidad entre el 84.6 % y 93 % en la localización de adenomas y 63 % en la enfermedad multiglandular.
Existen otras herramientas, que se pueden emplear de forma intraoperatoria, como es la gammacámara portátil, que permite la realización imágenes durante el acto quirúrgico [27].
CONCLUSIONES
A pesar de los avances en las técnicas de imagen, la gammagrafía planar de tiroides sigue siendo una técnica útil en el diagnóstico de la patología tiroidea.
La imagen híbrida ha supuesto un notable avance en el diagnóstico de la patología tiroidea y paratiroidea. En concreto el SPECT-CT, como complemento del rastreo corporal con radioyodo, mejora el diagnóstico y cambia el manejo terapéutico.
Así mismo, aumenta la sensibilidad de la gammagrafía de paratiroides, y mejora la localización de las glándulas ectópicas, facilitando así la planificación de la cirugía.
El PET/CT ha mejorado el diagnóstico de recidiva tanto en el carcinoma diferenciado como en otros tipos de cáncer de tiroides.
El PET/CT constituye una nueva herramienta en el diagnóstico de localización prequirúrgico del HPTp con pruebas de imagen convencionales negativas.














