Abreviaturas
IM: |
insuficiencia mitral. |
RMP: |
rotura del músculo papilar. |
TEER: |
tratamiento de reparación percutánea de borde a borde. |
VI: |
ventrículo izquierdo. |
SELECCIÓN DEL PACIENTE, MOMENTO ÓPTIMO Y CUIDADOS EN LA UNIDAD DE CUIDADOS AGUDOS CARDIOLÓGICOS
En la insuficiencia mitral (IM) aguda grave, el incremento brusco en el volumen telediastólico del ventrículo izquierdo (VI) conduce a un aumento rápido de la presión telediastólica del VI y de la aurícula izquierda, que resulta en última instancia en una marcada congestión pulmonar y el desarrollo de edema agudo de pulmón1. Paralelamente, el gran volumen de regurgitación conduce a una reducción del flujo anterógrado y del gasto cardiaco. En los pacientes con IM previa y ventrículo normal, la tolerancia hemodinámica será mejor, mientras que la situación se agrava en los pacientes con isquemia asociada y disfunción ventricular1,2.
La etiología de la IM aguda se puede agrupar en dos categorías (tabla 1): isquémica, bien por isquemia aguda del músculo papilar e incluso rotura de este en el contexto del infarto agudo de miocardio, o por remodelado ventricular y aumento de la tracción de los velos y tethering; y no isquémica, como la rotura de cuerdas en la enfermedad valvular mixomatosa o asociada a procedimientos de cardiología intervencionista. Otras causas son la endocarditis, los traumatismos o la IM dinámica por movimiento sistólico anterior mitral en un paciente con miocardiopatía hipertrófica o de estrés2,3.
Tabla 1. Etiología, fisiopatología y presentación clínica de la insuficiencia mitral aguda
| Etiología | Fisiopatología | Presentación | Tratamiento |
|---|---|---|---|
| Isquemia del músculo papilar Rotura del músculo papilar por infarto Rotura de cuerdas Movimiento sistólico anterior (miocardiopatía hipertrófica obstructiva, síndrome de tako-tsubo) Miocardiopatía dilatada-insuficiencia mitral secundaria Endocarditis Traumatismo Complicación periprocedimiento |
Aumento de presión telediastólica del ventrículo izquierdo Aumento de presión de la aurícula izquierda Aumento de presión capilar pulmonar Bajo gasto por disminución del flujo anterógrado |
Insuficiencia cardiaca aguda/edema agudo de pulmón Edema agudo de pulmón flash Shock cardiogénico |
Diuréticos Inotrópicos (dobutamina, milrinona) Vasodilatadores (nitroprusiato)/vasopresores Revascularización Soporte circulatorio mecánico (balón de contrapulsación intraaórtico, oxigenador extracorpóreo de membrana, Impella) Reparación de borde a borde Cirugía |
Los pacientes con IM aguda estarán típicamente sintomáticos. La presentación clínica varía dependiendo del mecanismo, la rapidez de la instauración, la presencia de IM previa y la función ventricular. El edema agudo de pulmón flash puede ocurrir en pacientes con IM dinámica y función ventricular normal, en relación con el aumento de la poscarga. En estos casos, la presión arterial pue- de ser normal o estar elevada1-4. El shock cardiogénico es la forma de presentación más extrema de la IM aguda grave. Habitualmente ocurre en pacientes con disfunción sistólica del VI, pero puede desarrollarse incluso en aquellos con función ventricular conservada, en quienes la IM se instaura de forma muy brusca por rotura de músculo papilar (RMP). En los estadios intermedios, los pacientes pueden presentar edema agudo de pulmón con presión arterial mantenida sin llegar a la situación de shock3,5.
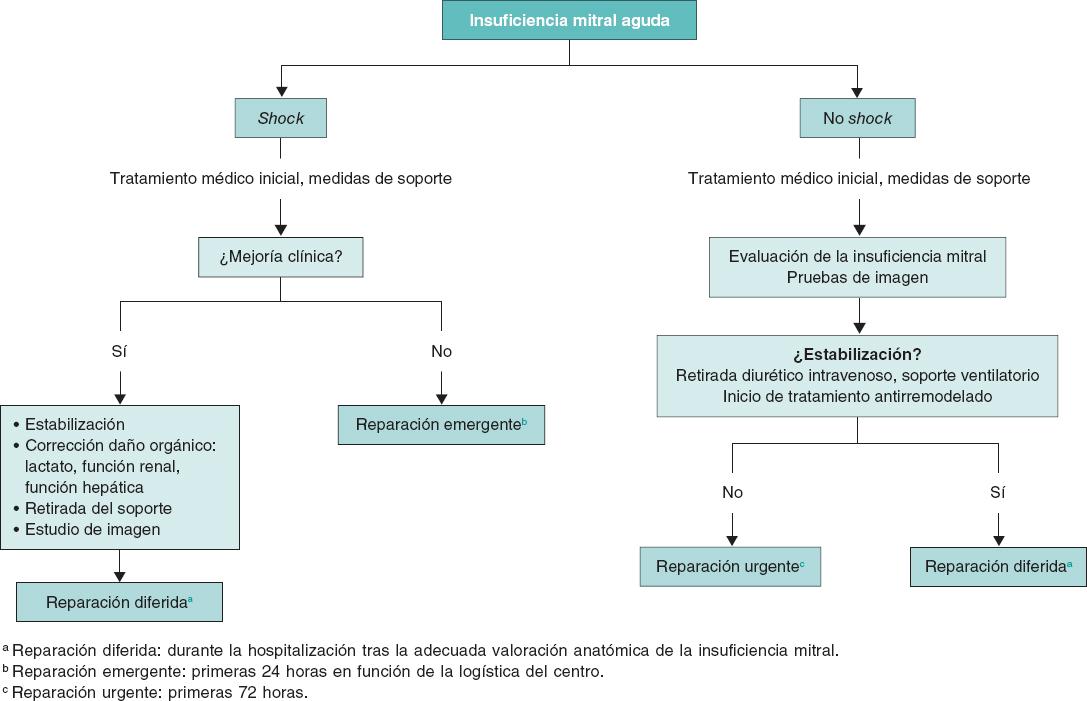
El primer objetivo del tratamiento debe ser la estabilización clínica y hemodinámica del paciente (figura 1). Estos pacientes deberían trasladarse lo antes posible a un centro de referencia con unidad de cuidados agudos/intensivos cardiológicos especializados y disponibilidad de unidad de hemodinámica y cirugía cardiaca. Los diuréticos de asa por vía intravenosa a altas dosis son la base del tratamiento médico, preferiblemente en infusión continua. Los fármacos inotrópicos se recomiendan en pacientes con disfunción sistólica del VI. En aquellos con presión arterial normal o elevada se aconseja el empleo de vasodilatadores por vía intravenosa, fundamentalmente nitroprusiato o nitroglicerina, ya que disminuyen la poscarga del VI y con ello el grado de regurgitación mitral6-8. El empleo de vasopresores se restringe a aquellos pacientes en situación de shock cardiogénico con hipotensión e hipoperfusión mantenida a pesar del empleo de inotrópicos. Estos fármacos aumentan la poscarga y pueden contribuir a aumentar el grado de IM, por lo que deben emplearse a la mínima dosis posible que permita mantener una adecuada presión de perfusión a los tejidos1,7,8.
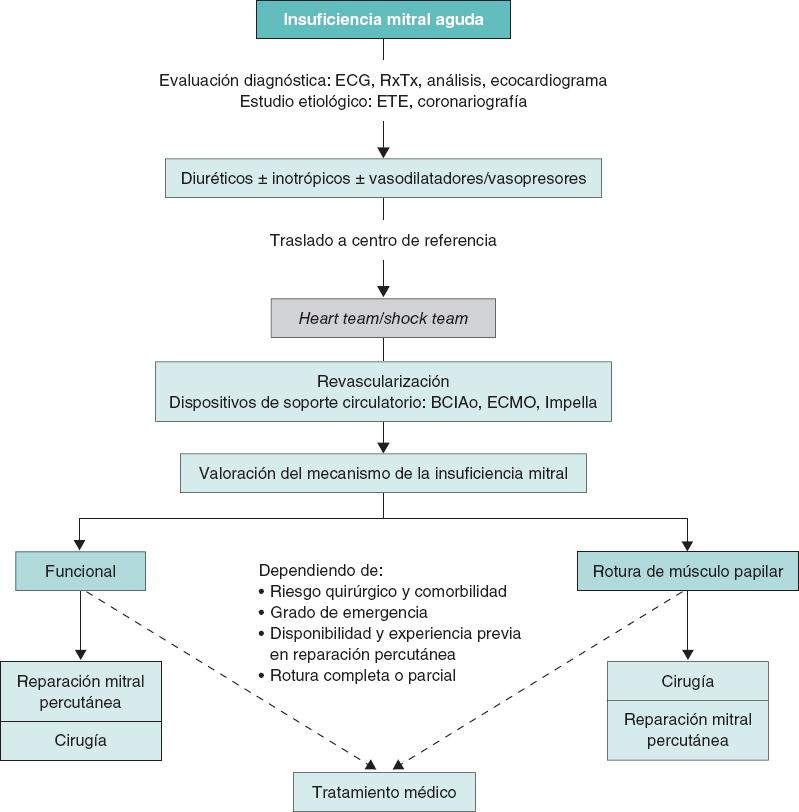
Figura 1. Algoritmo de tratamiento para la insuficiencia mitral aguda. BCIAo: balón de contrapulsación intraaórtico; ECG: electrocardiograma; ECMO: oxigenador extracorpóreo de membrana; ETE: ecocardiografía transesofágica; RxTx: radiografía del tórax.
La ventilación mecánica no invasiva puede ser de utilidad en pacientes con edema agudo de pulmón flash, que a menudo se asocia a hipertensión. La ventilación con presión positiva mejora la relación ventilación-perfusión, disminuye el edema alveolar, reduce el espacio muerto y mejora la redistribución de flujo pulmonar. Sin embargo, los pacientes en situación de shock cardiogénico asociado a IM aguda grave precisan intubación orotraqueal precoz y ventilación mecánica con el objetivo de lograr una adecuada estabilización, disminuir la descarga adrenérgica y asegurar una correcta oxigenación8.
La monitorización de los parámetros electrocardiográficos, hemodinámicos y gasométricos debe ser precisa y continua. Para ello se aconseja la canalización de una línea arterial para monitorización arterial invasiva, un acceso venoso central en pacientes en shock, la medición de la presión venosa central, la cuantificación continua de la diuresis y la realización de controles gasométricos con una periodicidad variable dependiendo de la situación clínica del paciente. En caso de escasa respuesta diurética se recomienda el tra- tamiento de sustitución renal continuo de forma precoz con el ob- jetivo de reducir lo antes posible la congestión pulmonar9,10.
En caso de refractariedad al tratamiento farmacológico inicial y de persistencia del deterioro clínico y hemodinámico durante las primeras 12-24 horas, se valorará el inicio de soporte mecánico circulatorio11. En tal situación es aconsejable la evaluación del caso por el shock team del centro y tomar una decisión conjunta sobre la secuencia más adecuada de tratamiento y la elección del dispositivo. Esta elección se basará en 4 aspectos fundamentales: a) aquellos relacionados con el paciente y su comorbilidad; b) la etiología y el mecanismo de la IM, y la función ventricular; c) la situación hemodinámica y el grado de profundidad del shock; y d) la experiencia del centro. El abordaje detallado del soporte circulatorio está fuera del objetivo del presente documento. Brevemente, el balón de contrapulsación intraaórtico puede resultar de utilidad en pacientes con IM secundaria a infarto de miocardio en situación de pre-shock (estadio B de la clasificación de la SCAI [Society for Cardiovascular Angiography and Interventions], cuando el paciente se encuentra hipotenso o taquicárdico, pero mantiene una adecuada perfusión tisular) o en estadios iniciales del shock (estadio C de la SCAI, cuando necesita fármacos inotrópicos, vasopresores o soporte mecánico para mantener la perfusión sistémica)12,13. En este mismo escenario, en fases más avanzadas del shock (estadio D de la SCAI, cuando no responde a las medidas instauradas en el estadio anterior), y más aún si existe RMP, el dispositivo de elección será el oxigenador extracorpóreo de membrana venoarterial periférico con o sin descarga asociada del VI mediante balón de contrapulsación intraaórtico o Impella (Abiomed, Estados Unidos), con especial precaución en caso de RMP13,14. En los pacientes con IM isquémica en el contexto de un infarto de miocardio por isquemia del músculo papilar o miocardiopatía dilatada isquémica, o disfunción ventricular izquierda con función conservada del ventrículo derecho, el dispositivo Impella puede resultar de gran utilidad, ya que permite la descarga directa del VI y con ello la reducción de las presiones telediastólicas del VI y la regurgitación mitral, al tiempo que mejora el gasto cardiaco11 (figuras 1 y 2 del material adicional). Un aspecto esencial a considerar es el inicio precoz del soporte mecánico circulatorio en los pacientes con indicación, con el objetivo de anticipar y prevenir la aparición de fallo multiorgánico establecido.
La revascularización coronaria es muy recomendable cuando la IM está relacionada con isquemia aguda15. En este sentido, y en relación con la revascularización percutánea en el contexto del infarto agudo de miocardio, la gravedad de la IM puede cambiar desde la fase más próxima a la angioplastia hasta la fase más crónica. En cualquier caso, la persistencia de IM significativa condiciona el pronóstico a corto y medio plazo de los pacientes16. El tratamiento definitivo pasa por una sustitución o una reparación mitral.
En la actualidad, el momento óptimo para realizar la intervención percutánea sobre la válvula mitral es motivo de controversia. Será variable en función de la etiología, la función ventricular, el estado clínico del paciente y la comorbilidad. Siempre que la situación clínica y hemodinámica lo permita, es preferible el implante diferido. Sin embargo, esta situación no siempre es posible y en algunas ocasiones es preciso el tratamiento agudo de la IM mediante una reparación de borde a borde para lograr la estabilización del paciente. Así, en pacientes con edema agudo de pulmón flash, con VI normal, en los que la IM suele asociarse a hipertensión, que responden adecuadamente al tratamiento médico con oxigenoterapia/ventilación mecánica no invasiva y diuréticos, así como en aquellos pacientes inestables, en los que la respuesta al tratamiento sea adecuada, la reparación se realizará de forma diferida, una vez resuelta la insuficiencia cardiaca aguda, en situación de euvolemia, con la dosis de diurético ajustada. En algunos pacientes con insuficiencia cardiaca por IM en los que no se logra la retirada del tratamiento diurético por vía intravenosa, deberá considerarse la reparación urgente, dentro de las primeras 72 horas. Por último, en el espectro más grave de pacientes, aquellos con IM en situación de shock cardiogénico, con respuesta insuficiente al tratamiento y persistencia de shock refractario, se debe evaluar la viabilidad de la reparación emergente (dentro de las siguientes 24 horas) de la válvula mitral o considerar alternativas como el trasplante cardiaco. (figura 2). En este grupo de pacientes más inestables, el tratamiento de reparación percutánea puede cambiar el espectro de gravedad, aun con reducciones parciales de la gravedad de la IM, facilitando la transición a un escenario más estable que permita plantear un tratamiento definitivo3.
PAPEL DE LAS TÉCNICAS DE IMAGEN EN LA VALORACIÓN DE LA INSUFICIENCIA MITRAL AGUDA
Se requiere un alto índice de sospecha para identificar a los pacientes con IM significativa de instauración aguda. La ecocardiografía transtorácica se puede realizar en la cabecera del paciente, incluso en la sala de emergencias, y debería ser la técnica de primera línea en la evaluación de la disnea aguda. La ecocardiografía es la prueba de imagen de primera elección para identificar el mecanismo causante de la IM y descartar otras etiologías para un nuevo soplo sistólico en este contexto clínico. A menudo se requiere la ecocardiografía transesofágica para establecer el diagnóstico, la gravedad de la IM y la estrategia de tratamiento, definiendo además a aquellos candidatos más o menos idóneos para el tratamiento de reparación percutánea de borde a borde (TEER) (figura 3).
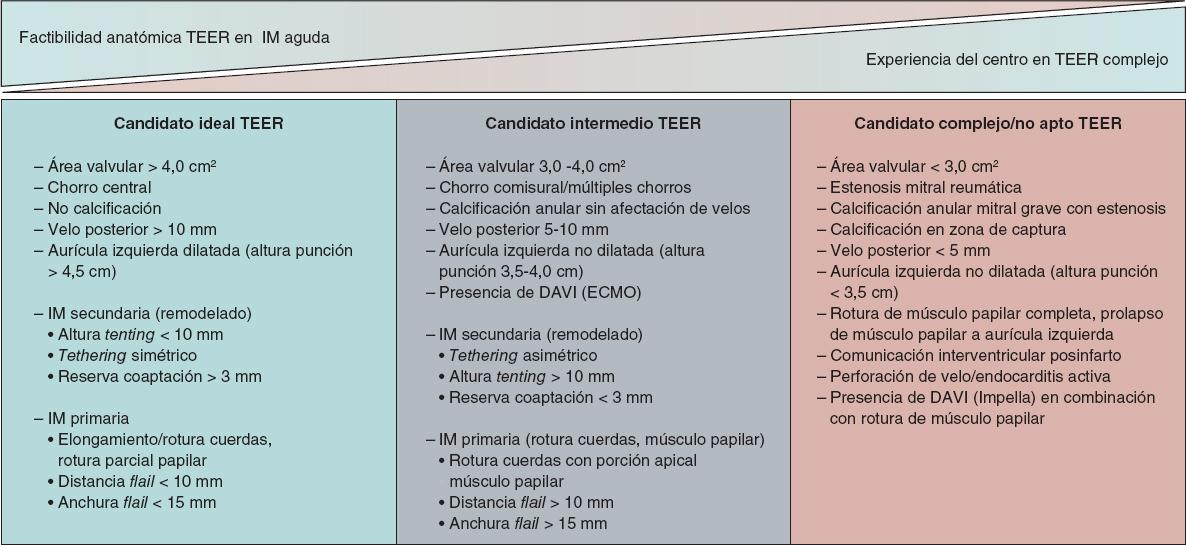
Figura 3. Evaluación de la idoneidad para el tratamiento de reparación mitral de borde a borde. DAVI: dispositivo de asistencia ventricular izquierda; ECMO: oxigenador extracorpóreo de membrana; IM: insuficiencia mitral; TEER: tratamiento de reparación percutánea de borde a borde.
La exploración ecocardiográfica debe incluir una cuidadosa evaluación del VI (fracción de eyección, dimensiones y alteraciones del movimiento de la pared), la anatomía de la válvula mitral (anillo, velos, cuerdas tendinosas y músculos papilares) y la identificación de la etiología, el mecanismo y el grado de la IM. Se debe realizar un enfoque integrador para la cuantificación de la IM, que incluya parámetros cualitativos, semicuantitativos y cuantitativos de acuerdo con las guías vigentes17,18. El flujo de Doppler color suele ser marcadamente excéntrico, lo que puede subestimar la gravedad de la IM. La medición del ancho de la vena contracta y la densidad de la señal Doppler de onda continua son las técnicas más simples para determinar rápidamente si hay una IM significativa. La curva de velocidad del volumen de regurgitación en el Doppler de onda continua a menudo muestra la forma triangular característica debido a una rápida disminución en la velocidad sistólica tardía, que refleja el aumento abrupto en la presión auricular izquierda, coherente con una «onda v». La IM isquémica es mayor en la sístole precoz y tardía cuando predominan las fuerzas opuestas de tracción (contracción sistólica del VI). Cuanto más grave sea la IM, más holosistólica será la duración de la IM. Sin embargo, es importante recordar que algunos parámetros de Doppler para evaluar la gravedad de la IM se ajustan mejor a la IM crónica que a la aguda. La combinación de hipotensión y alta presión en la aurícula izquierda resulta en un bajo gradiente de conducción y, por lo tanto, una velocidad del chorro de IM más baja a través de la válvula mitral. En consecuencia, la imagen Doppler color a menudo no mostrará una gran turbulencia en el flujo, y así la IM puede subestimarse o no apreciarse en absoluto. Algunas imágenes anatómicas relevantes (flail del velo, RMP, VI hiperdinámico en el contexto de edema pulmonar o shock cardiogénico) deberían ser suficientes para corroborar el diagnóstico, incluso si el Doppler color no muestra un gran chorro de IM.
La ecocardiografía también identifica con frecuencia la causa de la IM aguda. Una etiología habitual en los pacientes ancianos es la rotura de cuerdas asociada a degeneración fibroelástica. La IM isquémica debida a la tracción de la valva también será evidente con alteraciones en el movimiento de la pared en la región de la arteria coronaria culpable y la consecuente tracción de los velos. La IM isquémica aguda puede ocurrir con isquemia miocárdica activa o reversible, y puede desaparecer después de que se resuelva la isquemia, por lo que se recomienda una nueva evaluación después de la revascularización19.
La IM aguda por remodelado del VI es una consecuencia de la distorsión en la relación espacial normal del aparato valvular mitral y el VI. Con el remodelado adverso del VI (dilatación y cambio de forma), uno o ambos velos mitrales se desplazan en sentido apical y radial lejos del centro del ventrículo, debido al desplazamiento hacia fuera de los músculos papilares secundario al remodelado. Este patrón se observa mejor en las vistas apicales de 3 y 4 cámaras20. Las valvas son esencialmente normales en el escenario agudo, pero se ha descrito un proceso de remodelado de la valva con aumento de los grosores durante el seguimiento21. El anillo mitral puede estar dilatado, siendo más frecuente en la IM no aguda. Aunque tanto el remodelado regional como el global pueden llevar a IM, el sitio específico de remodelado es muy relevante. Los infartos miocárdicos inferolaterales tienen más probabilidades de estar asociados con una IM significativa que los infartos miocárdicos anteriores19. Las diferencias entre el remodelado regional y el global típicamente resultan en patrones de tracción diferentes. Los pacientes con tracción simétrica presentan chorros centrales, mientras que aquellos con tracción asimétrica se caracterizan por chorros excéntricos.
La forma más grave de la IM aguda es la RMP. Las características ecocardiográficas bidimensionales comunes incluyen una valva mitral suelta con cuerdas cortadas o una cabeza de músculo papilar que se mueve libremente dentro del corazón izquierdo. Debido a la diferencia en la anatomía vascular coronaria, la RMP posteromedial ocurre con más frecuencia que la anterolateral. El prolapso de la valva de reciente aparición durante la fase aguda del infarto de miocardio puede ser un signo de una RMP inminente que requiere atención cuidadosa. La función del VI a menudo es hiperdinámica debido a una disminución repentina de la poscarga, y las alteraciones regionales del movimiento de la pared pueden ser sutiles o no reconocidas. La evaluación del Doppler color suele mostrar una IM excéntrica, lo que puede llevar a una subestimación del grado de la IM.
INTERVENCIONISMO PERCUTÁNEO EN LA INSUFICIENCIA MITRAL AGUDA
Hasta la fecha, el abordaje quirúrgico de la IM aguda sigue siendo la primera línea de tratamiento, a pesar de que los pacientes incluidos en las series quirúrgicas están muy seleccionados y sus resultados no pueden generalizarse, además de que se trata de una evidencia observacional. En este sentido, en el SHOCK Trial Registry solo se ofreció cirugía valvular mitral al 38% de los pacientes con IM aguda posinfarto complicada con shock cardiogénico22, con una mortalidad en estos casos del 40%. Asimismo, en un estudio en el que se evaluaba la presencia de RMP en una gran cohorte de pacientes con IM, se halló que solo el 57,5% recibieron tratamiento quirúrgico23; decisión influida por la edad, la comorbilidad y la estabilidad clínica. Este grupo de pacientes tuvieron una mortalidad del 36%. Incluso en aquellos tratados con cirugía, los resultados fueron subóptimos teniendo en cuenta la mortalidad precoz, la tasa de transfusiones, la insuficiencia renal y la ventilación mecánica prolongada24.
Por lo tanto, el desarrollo de enfoques menos invasivos para abordar la IM en este contexto, en el que los pacientes suelen presentar un alto riesgo quirúrgico, es primordial para ampliar el potencial número de pacientes que se beneficiarían de una corrección de la IM.
Las técnicas percutáneas para el tratamiento de la IM han experimentado un gran desarrollo en los últimos años. De todos los dispositivos disponibles, el TEER con el sistema MitraClip (Abbott Vascular, Estados Unidos) es el más utilizado y acumula la mayor experiencia clínica. El TEER con MitraClip ha demostrado ser una técnica segura y eficaz para reducir la IM en pacientes con alto riesgo quirúrgico, y para mejorar los síntomas, la calidad de vida y el pronóstico en pacientes con IM funcional y degenerativa25-28. El dispositivo PASCAL (Edwards Lifesciences, Estados Unidos), en el ensayo aleatorizado CLASP IID29, también ha demostrado un rendimiento seguro y eficaz en comparación con MitraClip en pacien- tes con IM degenerativa. Del mismo modo, los datos procedentes de registros tampoco muestran diferencias significativas con el MitraClip en la regurgitación mitral secundaria30.
Sin embargo, mientras que la mayoría de los TEER se realizan en pacientes que se encuentran en una situación clínica estable con clase funcional avanzada e IM crónica, los pacientes con IM aguda están menos representados en la literatura. La IM aguda supone una gran necesidad no cubierta en la que el uso de intervenciones percutáneas ha crecido de manera significativa en los últimos años.
Cada vez hay más pruebas de la eficacia y la seguridad del TEER en pacientes que desarrollan una IM aguda grave sintomática de «tipo funcional». El grupo EREMMI (European Registry of MitraClip in Acute Mitral Regurgitation following an Acute Myocardial Infarction) ha publicado la mayor serie sobre el tema. El primer artículo apareció en 2020 y mostraba la experiencia europea con MitraClip en este contexto31. Se incluyeron 44 pacientes con una edad media de 70 años y alto riesgo quirúrgico (mediana de EuroSCORE II 15,1%,) entre 2016 y 2018. Es importante destacar que la media- na de tiempo entre el diagnóstico de infarto agudo de miocardio y el tratamiento intervencionista con el MitraClip fue de 18 días, y entre el desarrollo de IM y el tratamiento fue de 12,5 días, lo que refleja el fracaso en la estabilización con tratamiento médico aislado. Los pacientes estaban muy sintomáticos, con un 63,6% en clase IV de la New York Heart Association (NYHA) en el momento del procedimiento. En esta serie, el éxito técnico fue del 86,6%. Durante el seguimiento, la mortalidad a los 30 días fue del 9,1%, cifra más que aceptable teniendo en cuenta que la IM isquémica aguda es la enfermedad con mayor mortalidad en todas las cirugías de IM aguda32. A los 6 meses se observaron una IM ≤ 2+ en el 72,5% y una clase I-II de la NYHA en el 75,9% de los pacientes supervivientes.
Posteriormente, los investigadores evaluaron el papel del TEER en el escenario del shock cardiogénico en una cohorte de 93 pacientes33. El éxito técnico fue elevado y la mortalidad a los 30 días, aunque mayor en el grupo de shock cardiogénico, no mostró una diferencia estadísticamente significativa entre los grupos (10% en pacientes con shock y 2,3% en pacientes sin shock; p = 0,212). Por otro lado, la tasa de mortalidad en los pacientes que no estaban en situación de shock fue extremadamente baja, incluso para una población de tan alto riesgo, lo que refleja los efectos hemodinámicos positivos de una corrección percutánea de la IM. Por lo tanto, si la experiencia del equipo de TEER es amplia, el shock cardiogénico no debería excluir este enfoque terapéutico. Estos resultados, junto con la nueva información sobre el papel del TEER en pacientes en shock34-36, deberían situar a este tratamiento como una estrategia a considerar teniendo en cuenta su seguridad y eficacia.
Comparando los pacientes con fracción de eyección del VI mayor o menor del 35%, los autores no encontraron diferencias significativas en la mortalidad intrahospitalaria ni al año (11 frente a 7%, p = 0,51, y 19 frente a 12%, p = 0,49), ni tampoco en la tasa de rehospitalización a 3 meses. Por lo tanto, el efecto positivo del tratamiento percutáneo se mantiene en los pacientes con fracción de eyección más baja37.
Por último, el trabajo más completo del grupo comparó 3 estrategias de tratamiento de la IM precozmente tras un infarto: conservadora, quirúrgica y TEER38. Esta serie incluyó 471 pacientes, de los que 266 se trataron de forma conservadora y 205 se sometieron a intervenciones; de estas, 106 fueron quirúrgicas y 99 fueron TEER. En consonancia con la literatura previa, los pacientes tratados médicamente presentaron los peores resultados, con una mortalidad 2 veces mayor que los que recibieron una intervención. Sin embargo, más interesante es la comparación de ambas estrategias intervencionistas. Los resultados revelaron que los pacientes con corrección quirúrgica presentaban peores resultados que los que recibieron MitraClip, con una mortalidad más de 2 veces superior a 1 año. Esta diferencia se debió a la mortalidad durante la hospitalización (16 frente a 6%; p = 0,03). Dicho hallazgo fue independiente del perfil de puntuación de riesgo quirúrgico de los pacientes.
En cuanto al tratamiento percutáneo en el escenario de la RMP, se ha presentado la mayor serie tratada con TEER39. El estudio incluyó 23 pacientes, con una edad media de 68 años, el 56% varones, rechazados para cirugía debido a su alto riesgo quirúrgico. Casi el 90% se encontraban en situación de shock cardiogénico y 17 estaban con soporte mecánico circulatorio (11 con balón de contrapulsación intraaórtico, 2 con Impella y 4 con oxigenador extracorpóreo de membrana venoarterial). El éxito inmediato de la intervención se obtuvo en el 87% de los pacientes y se acompañó de una rápida mejoría hemodinámica. La mortalidad hospitalaria fue del 30%, todavía elevada, pero aceptable si se tiene en cuenta que los pacientes no eran candidatos a cirugía y que la única alternativa posible era el tratamiento médico, con un pronóstico infausto. Cabe señalar que 5 pacientes que pudieron ser dados de alta recibieron una sustitución quirúrgica de la válvula mitral con éxito durante el seguimiento, lo que pone de relieve el importante papel de la transición a una situación clínica más estable para poder realizar una intervención quirúrgica diferida.
En este escenario, las guías y las recomendaciones40-42 recogen el tratamiento percutáneo solo en pacientes seleccionados de alto riesgo no aptos para cirugía. Sin embargo, considerando la dificultad de la toma de decisiones, las limitaciones para ofrecer la cirugía a una población más amplia y la complejidad de tratar a los pacientes con shock cardiogénico, la mayoría de los casos deberían evaluarse por el shock team y considerar las diferentes opciones terapéuticas, entre ellas el tratamiento percutáneo (figura 1).
Existen varias posibles ventajas de un enfoque percutáneo en el tratamiento de la IM aguda. Estos pacientes suelen presentar un deterioro clínico significativo, principalmente atribuible al desarrollo de la regurgitación mitral dirigida a una aurícula izquierda pequeña y no distensible. Esto se traduce en presiones pulmonares muy elevadas y un volumen de eyección efectivo bajo, que son los factores fisiológicos principales que conducen a la enfermedad. El TEER induce una mejoría hemodinámica casi inmediata al aliviar la cantidad de regurgitación mitral, lo que a su vez disminuye las presiones en las cámaras izquierdas y en la arteria pulmonar, y aumenta el gasto cardiaco, llevando a una recuperación más rápida con la menor agresión tisular posible43. Además, el TEER no excluye una cirugía cardiaca programada en caso de que el dispositivo falle o recurra la IM. De hecho, el papel del TEER como puente hacia una cirugía de menor riesgo es atractivo. En los casos en que la evolución no sea buena, tampoco se cierra la puerta a un posible trasplante cardiaco.
En cuanto a las limitaciones, hay varias que deben señalarse. Los resultados con TEER en esta condición son prometedores, pero la evidencia se limita a análisis observacionales retrospectivos de una población pequeña. No se puede excluir la presencia de un sesgo de selección en los pacientes tratados con TEER, en el sentido de que solo aquellos que respondieron al tratamiento médico y al soporte cardiaco fueron los que recibieron TEER. Asimismo, el seguimiento clínico y ecocardiográfico a largo plazo es limitado. Y por otra parte, casi todos los estudios incluyen pacientes de antes de 2020, cuando aún no se disponía de las nuevas generaciones de dispositivos con posibilidad de captura independiente o más grandes y anchos, que pueden mejorar los resultados del TEER.
Idealmente, el desarrollo de registros prospectivos y un ensayo aleatorizado debidamente diseñado y ejecutado deberían proporcionar información más robusta sobre la indicación de este tratamiento en la IM aguda.
Actualmente existen 2 ensayos en fases muy iniciales que puede que arrojen claridad en este escenario. El ensayo internacional multicéntrico EMCAMI (Early Transcatheter Mitral Valve Repair After Myocardial Infarction; ClinicalTrials.gov: NCT06282042) se ha diseñado para evaluar de manera prospectiva el papel del tratamiento precoz con el tratamiento de aproximación de velos con MitraClip frente al tratamiento convencional conservador en la IM aguda próxima (menos de 90 días) a un infarto agudo de miocardio, en términos de mortalidad y reingresos por insuficiencia cardiaca. En el ensayo MINOS (Transcatheter Mitral Valve Repair for Inotrope Dependent Cardiogenic Shock; ClinicalTrials.gov: NCT05298124) se evaluarán las mismas estrategias de tratamiento en pacientes con shock cardiogénico e IM aguda.
Consideraciones técnicas y organizativas
La reparación valvular percutánea de borde a borde en la IM aguda supone un desafío desde el punto de vista técnico y organizativo, con varios aspectos destacables.
La aurícula izquierda suele ser pequeña y no distensible. Por lo tanto, la punción transeptal y la posición para lograr suficiente altura sobre la válvula pueden ser complejas y requieren experiencia. Asimismo, es posible que se necesite una punción fuera de la fosa oval. Podrían ser recomendables los sistemas que permiten la punción con radiofrecuencia para un punto de entrada preciso44.
La complejidad de la anatomía valvular, especialmente en casos de IM primaria, en los que se puede encontrar espacios, o gaps grandes y anchos, y los chorros comisurales, no son infrecuentes. En estas situaciones se recomienda aprovechar las nuevas características de MitraClip G4 o PASCAL Ace45,46, que permiten la captura independiente y la optimización de los velos para mejorar los resultados. Con estas nuevas generaciones, la gran mayoría de los casos son técnicamente realizables. Si se trata de regurgitación mitral primaria por RMP, por lo general, después de la colocación de múltiples dispositivos, se estabiliza el músculo papilar y se controla el movimiento adicional, evitando así desgarros adicionales de tejido. Sin embargo, se debe prestar especial atención para no interferir con el dispositivo en el músculo y evitar daños adicionales o incluso la rotura completa en aquellos con una rotura parcial.
El deterioro clínico de algunos pacientes puede ser muy rápido, lo que plantea la cuestión de si los equipos especializados en válvula mitral deben estar preparados para realizar el TEER en situaciones de emergencia, o incluso si deberían trasladarse a centros que no la ofrezcan y cuyos pacientes sean demasiado inestables para ser transferidos. En este sentido, se considera que los equipos deben poder implementar el tratamiento en las siguientes 24 horas de deterioro clínico para la IM primaria y los pacientes en shock, y lo antes posible para el resto de los casos. Este tipo de tratamientos deberían considerarse dentro del marco del «código shock», todavía por desarrollar en la mayoría de las comunidades autónomas, y organizarlas según los recursos disponibles.
CONCLUSIONES
Los pacientes con IM aguda requieren un abordaje multidisciplinario tanto en su evaluación diagnóstica como en la toma de decisiones sobre la estrategia de tratamiento. El TEER constituye una alternativa de tratamiento eficaz para la IM aguda, ya sea como tratamiento definitivo o como transición a un escenario más estable para otros tratamientos, con una alta tasa de éxito del procedimiento y una mejoría del pronóstico de los pacientes en centros con experiencia en la técnica. La adecuada selección de los pacientes, la cuidadosa evaluación anatómica y la elección del momento óptimo para el implante son esenciales para el éxito del TEER.
CONTRIBUCIÓN DE LOS AUTORES
Todos los autores han contribuido a la redacción del texto y a su revisión crítica, y han aprobado la versión final del artículo.
MATERIAL ADICIONAL
Se puede consultar material adicional a este artículo en su versión electrónica disponible en https://doi.org/10.24875/RECIC.M24000464.











 texto en
texto en