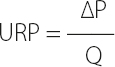INTRODUCCIÓN
Los dispositivos de protección embólica tipo red (DPEr) se han convertido en una herramienta de conocimiento obligado para los especialistas en esta patología, aunque su uso estandarizado en la práctica clínica ha sido objeto de debate a lo largo de su desarrollo (1-3). El DPEr consiste en una red o filtro, cuya base es un anillo de nitinol, que se coloca mediante una guía de 0,014” y un catéter portador de bajo perfil (3,2 Fr) distal a la lesión. Tras desplegarse en una zona adecuada, su diámetro debe estar ajustado al tamaño del vaso de manera que, una vez fijo, contendrá las partículas liberadas mientras se realiza el procedimiento. Posteriormente, se recupera la red o malla mediante un catéter de perfil mayor adecuado a cada uno (4).
Las ventajas de los DPEr son la protección activa manteniendo el flujo cerebral anterógrado ininterrumpido y la posibilidad de realizar arteriografía en todo momento durante el procedimiento. Entre las desventajas, se incluyen: dificultad o riesgo de atravesar la lesión, posibilidad de daño de endotelio por el anillo (disección o trombosis), fuga de partículas por error de dimensión o mala colocación, vasoespasmo e incluso atrapamiento del DPEr dentro del catéter de recuperación (4).
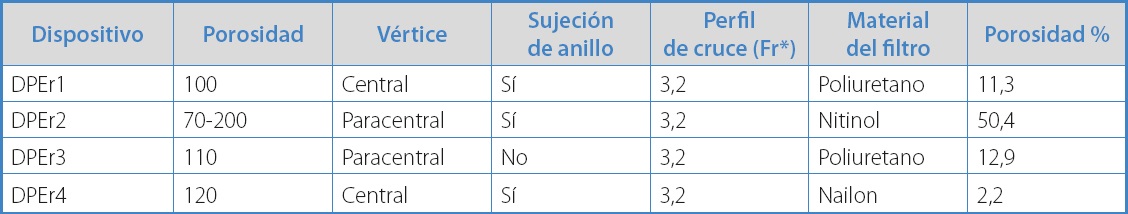
A partir de la generalización de su uso, se han aprobado varios modelos de DPEr. Entre los disponibles en nuestro país están Emboshield Nav6' (Abbott®), RX Accunet Embolic Protection System' (Abbott®), FilterWire EZ Embolic Protection System' (Boston Scientific Corporation®), Angioguard' (Cordis®), Spider Fx' (Medtronic®) y Robin' (Balton®). Todos guardan similitudes en su diseño, perfil de cruce, despliegue y recuperación. Se recomienda utilizar la vía femoral, aunque pueden introducirse por cualquier arteria que admita un introductor de 6 Fr para capturar el dispositivo al final del procedimiento, lo que puede requerir un perfil mayor si el DPEr está lleno. Sin embrago, existen diferencias importantes en su estructura y diseño, su forma cónica de distinta longitud, superficie y porosidad, así como en su posicionamiento central o paracentral (Fig. 1). Debido a que el flujo sanguíneo en condiciones normales es laminar (cada capa se mantiene a la misma distancia del vaso y en su porción central tiene mayor velocidad que en sus capas externas), la presencia del DPEr central o paracentral, añadida al tamaño y a la densidad de los poros, puede modificar este flujo central y generar turbulencias, como se ha demostrado en modelos de laboratorio (5). Estas diferencias nos hacen suponer que pueden alterar el flujo sanguíneo de forma distinta, con diferentes resultados, de lo que tenemos escasa información.

Figura 1. A. Esquema de filtro de cono con posicionamiento central y paracentral. B. Esquemas de los DPEr estudiados.
El objetivo del presente estudio consistió en determinar la repercusión hemodinámica provocada por los DPEr analizando su resistencia al flujo en un modelo hemodinámico de fluido continuo in vitro y comparar los resultados entre distintos dispositivos.
MATERIALES Y MÉTODOS
Modelo hemodinámico
Se construyó un modelo hemodinámico in vitro mediante un circuito con tubos de PVC y silicona inicialmente de 12 mm, que fueron reduciéndose mediante adaptadores (Intersept®, Medtronic, Estados Unidos) hasta obtener un diámetro de 5,5 mm para poder ceñirse a todos los DPEr, según las recomendaciones de la casa comercial. Se utilizó un sistema de bombeo pulsado combinando una bomba principal centrífuga de flujo continuo (Bio-Pump® Plus, Medtronic, Estados Unidos) controlado por su consola (Bio-console®, Medtronic, Estados Unidos) y añadiendo un circuito pulsado con bomba de rodillos (Stockert Shiley®, Stockert Instruments, Alemania). Este sistema de bombeo compuesto permite obtener una onda de pulso similar a la fisiológica humana. El circuito dispone de puertos para monitorización de presión y una sonda electromagnética para monitorización de flujos (BIO-PROBE®, Medtronic, Estados Unidos). Se utilizó, además, un monitor para controlar la onda del pulso, la presión media, sistólica y diastólica (Spacelabs-medical, Redmond-WA, Estados Unidos). Se incorporó, asimismo, un reservorio con filtro de 38 μm (Affinity®, Medtronic, Estados Unidos) al final del circuito y previo a la bomba para mantener el fluido libre de partículas por contaminación exterior sin afectar al flujo o a las resistencias del sistema.
En el proyecto inicial se utilizó como fluido una solución de glicerina al 36%, que tiene una viscosidad de 3,5 centiPoise (cP), similar a la sangre (4 cP con hematocrito de 40% a 37°C), pero durante los experimentos su sedimentación afectaba al funcionamiento de la bomba centrífuga, a los sensores del flujómetro y a la presión; además, se impregnaba en los filtros de estudio y reservorio, lo que afectaba seriamente el resultado. Para garantizar el correcto funcionamiento de los instrumentos, se sustituyó por suero salino fisiológico (SSF) (Grifols, Barcelona, España) como medio de fluido, que tiene una viscosidad de 1,09 cP a 20°C.
Previamente a cada toma de medidas hubo un primer periodo de estabilización de 5 minutos con los parámetros deseados, un segundo periodo similar con el catéter portador (todos de 3,2 Fr) colocado en el sitio de estudio y un tercer periodo de 5 minutos con el DPEr desplegado. Se registraron los resultados en cada periodo.
Dispositivos de estudio
Se utilizaron 4 DPEr disponibles comercialmente para la captura de restos embólicos tras la angioplastia-stent carotídea, todos compatibles con un diámetro de tubo de 5,5 mm (sus características principales de diseño y porosidad se describen en la tabla I). Los cuatro dispositivos seleccionados son los más utilizados en nuestro medio. Por respeto a los fabricantes y para evitar el uso comercial de nuestros resultados, se omitieron los nombres comerciales de los dispositivos.
Diseño del estudio
Es un estudio experimental de medidas pareadas en un modelo hemodinámico in vitro construido en nuestro laboratorio para este propósito (Fig. 2). Los parámetros hemodinámicos fijados fueron: presión media de 100 mmHg y flujo de 16,67 mL/s (1 L/min) con suero salino fisiológico (SSF), mantenidos sin variación en todas las pruebas. Se colocó a través del introductor el DPEr en el punto de ensayo (test) según las instrucciones de la casa comercial. Previamente al experimento inicial se realizaron 10 mediciones de control sin DPEr y 10 solo con el catéter portador. Se realizaron posteriormente 40 mediciones con DPEr: 10 por cada dispositivo, 5 de presión media proximal (PMA) y 5 de presión media distal (PMB). En total, 60 mediciones.
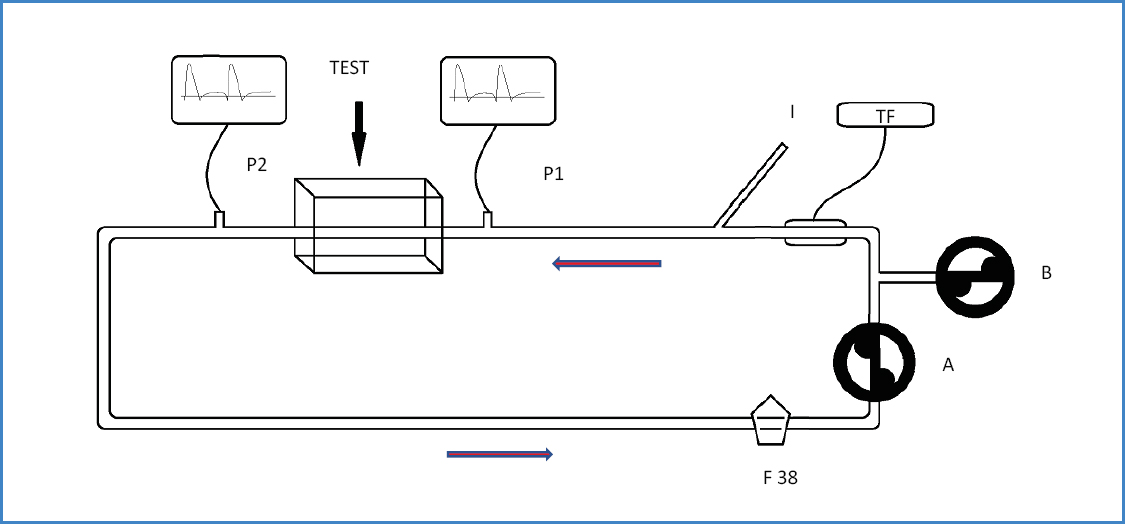
Figura 2. Esquema del modelo in vitro. A: Bomba principal centrífuga de flujo continuo. B: Bomba de rodillo para flujo pulsado. TF: Transductor de flujo. I: Introductor 6F para el DPEr colocado directamente (sin punción) sobre una extensión lateral del tubo con un conector en “Y”. P1: Monitorización de onda de pulso proximal. P2: monitorización de presión distal. TEST: zona donde se abre el DPEr. F 38: reservorio con filtro de 38 μm.
Análisis estadístico
Tras las pruebas iniciales, se observó una variabilidad en las diferencias entre PMA y PMB de 0 ± 0,00 tanto en la calculada sin DPEr como en la PM con catéter portador. Con estos parámetros controlados, el tamaño muestral de 5 mediciones por DPEr (total 40 mediciones) fue suficiente para demostrar el objetivo que nos habíamos planteado. Para la comparación antes y después se utilizó la prueba de los rangos con signo de Wilcoxon para datos pareados; para la comparación entre medias entre dispositivos se utilizó el análisis de dos vías de Friedman de varianza por rangos de muestras. Se consideró significativo un valor de p < 0,05. La unidad de resistencia utilizada fue la unidad de resistencia periférica, cuya fórmula de cálculo es la siguiente:
Donde URP es unidad de resistencia periférica, ΔΡ es la diferencia de presión en mmHg obtenida entre la medición proximal y distal al filtro abierto y Q es el flujo expresado en mL/sg (6).
RESULTADOS
Se realizaron en total 60 mediciones. En el primer control (10 repeticiones sin dispositivo), la diferencia entre PMA y PMB fue de 0 ± 0,00 mmHg, como ya se preveía, manteniéndose constante en todas las repeticiones (varianza = 0). En el segundo (10 repeticiones con catéter portador de 3,2 Fr), se obtuvo una reducción de 5 mmHg (95 ± 0,00 mmHg) en todas las pruebas, con una resistencia de 0,29 ± 0,00 URP); por tanto, podemos decir que en estas condiciones hemodinámicas con un diámetro de 5,5 mm todos los catéteres portadores generaron una caída de 5 mmHg y una resistencia de 0,29 ± 0,00 URP (p = 0,02).
Todos los DPEr desplegados generaron una caída de presiones (11,45 ± 2,35 mmHg) con aumento de las resistencias 0,69 ± 0,14 URP). En el estudio principal, tal como se describe en la tabla II, se midieron la PMB, el gradiente de presión y las resistencias, donde se observa un mayor gradiente y resistencias con el DPEr1 con respecto a los demás.
Tabla II. Resultados para las mediciones de resistencias en cada DPEr
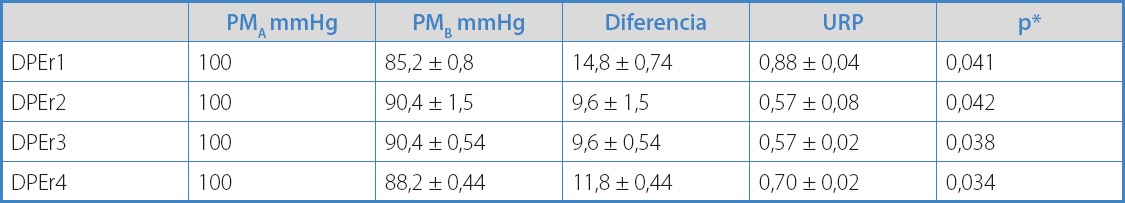
*Se utilizó la prueba de Wilcoxon de los rangos con signo de muestras pareadas (TW). El valor de p corresponde a los resultados de URP.
En el análisis multivariable se observó que el DPEr1 y DPEr4 presentaron mayor resistencia: la del DPEr1 (0,88 ± 0,04 URP) fue significativamente mayor al resto (p = 0,02). El DPEr 2 (0,57 ± 0,08 URP) presentó una resistencia similar al DPEr3 (p = 0,56) y tampoco se demostraron diferencias significativas con el DPEr4, a pesar de los valores menores obtenidos (0,57 ± 0,08 frente a 0,70 ± 0,02 URP, con valor p = 0,78). Por otro lado, el DPEr4 presenta una resistencia intermedia, significativamente mayor con respecto a los DPEr3 (p = 0,03) y menor al DPEr1 (p = 0,04) (Fig. 3). Además, se analizó la influencia del diseño, se agruparon los DPEr por material de filtro (poliuretano frente a no poliuretano) y por el tipo de cono (simétrico o vértice central frente a asimétrico o vértice para-central). No hubo diferencias significativas entre los DPEr de poliuretano perforado (DPEr1 y DPEr3) comparados con otros materiales (nitinol y nailon), con una resistencia de 0,53 ± 0,16 frente a 0,64 ± 0,09 URP, valor p = 1,00. En cuanto a los grupos de cono simétrico frente a asimétricos, se encontró una diferencia significativa con una resistencia de 0,79 ± 0,10 frente a 0,57 ± 0,06 URP, valor p = 0,002 (Tabla III).

Figura 3. Valor URP. Se observa una mayor resistencia para los DPEr1 y DPEr4. URP: unidad de resistencia periférica.
Tabla III. Resultados comparativos entre tipos de DPEr

*Para datos entre 2 grupos (comparaciones A-E) se utilizó el TW. Para el análisis entre grupos por tipo de diseño (F,G) se utilizó el análisis de dos vías de Friedman de varianza por rangos de muestras. Los DPEr de poliuretano son los 1 y 3. Los DPEr simétricos son los 1 y 4. La p corresponde al análisis de resistencia en URP.
DISCUSIÓN
La estabilidad de los parámetros presión y flujo en las mediciones basales sin y con catéter portador (varianza = 0) demuestra que nuestro modelo hemodinámico in vitro es una herramienta fiable para un control estable de parámetros de flujo y presión en el estudio del comportamiento hemodinámico de dispositivos endovasculares.
Existen diferencias importantes en estructura y diseño de los DPEr. Por citar unos cuantos ejemplos, el material del filtro puede ser una membrana perforada de poliuretano (DPER1, DPEr3) o nailon (DPEr4) o una red de nitinol (DPEr2), a su vez, con distinto tamaño y distribución del poro, así como el tipo de sujeción del anillo (tabla I). Al variar en diámetro y longitud, su capacidad de almacenamiento es distinta (5).
La caída de presión y aumento de resistencia con la presencia de catéteres portadores de 3,2F (5 ± 0,00 mmHg y 29 ± 0,01 URP) es independiente del dispositivo utilizado y confirma que provocan una alteración del flujo. El análisis de los DPEr estudiados se demuestra que, al desplegarse todos, condicionan una modificación en las presiones entre 8 y 16 mmHg y resistencias entre 0,48 y 0,96 URP, dependiendo del DPEr utilizado, mayor para los DPEr1 y DPEr4.
Las diferencias entre los dispositivos se explicarían por su distinto diseño. La porosidad del DPEr sería el principal factor condicionante de las resistencias: cuanto mayor es la superficie de porosidad, menor será su resistencia; sin embargo, esta es, a su vez, la principal característica protectora del paso de partículas durante el procedimiento. La porosidad entendida como la ratio de superficie porosa comparada con la superficie del DPEr a partir la zona de sellado del vaso es un dato desconocido, no está incluido en la ficha técnica ni lo aportaron los fabricantes cuando nos pusimos en contacto con ellos.
Solo hemos encontrado en la bibliografía dos referencias al respecto con información que debería actualizarse, puesto que son del 2008 y algunos DPEr han sido modificados (7,8). Por el ejemplo, el DPEr4 ha pasado de tener poros de 100 a 120 μm. Actualmente, el menor tamaño de poro es el DPEr1 que, a su vez, tiene menor superficie, lo que concuerda con la mayor resistencia obtenida. Por otro lado, el DPEr2 es el que tiene la mayor porosidad; de hecho, es el único que consiste en una red de nitinol y no poros perforados, lo que le otorga una menor resistencia que al resto.
Los hallazgos encontrados con respecto al DPEr1 se asemejan a los obtenidos en otros estudios, con un aumento de las resistencias del 37% con respecto al resto (8,9). El DPEr 4 es el siguiente en resistencias elevadas, probablemente también relacionado con su baja porosidad, aunque una mayor superficie que el DPEr1. El caso del DPEr2 es singular: al no tener un tamaño fijo de poro (70-200 μm) permite mantener el flujo con una menor resistencia, aunque no significativa con respecto al DPEr3. Esta menor resistencia del DPEr2 también ha sido mencionada con distintas condiciones de flujo, sometido a la captación de partículas de 300 μm, y apoya la idea de que este dispositivo favorece la continuidad del flujo (8,10,11). El DPEr3 parece tener un buen equilibrio en porosidad, resistencia y eficacia.
En cuanto a su forma, los de tipo cono simétrico (vértice central) tuvieron una resistencia superior con respecto a los asimétricos. Aunque sin duda el factor más importante es la porosidad, la interrupción del flujo laminar central podría generar una mayor turbulencia y pérdida de energía que el paracentral. Las diferencias entre estos grupos pueden estar sobrevaloradas porque la porosidad de los DPEr de vértice central es menor.
Existen varios ejemplos de estudios experimentales pequeños, con diferentes formas de circuitos y parámetros hemodinámicos, que demuestran con alguna variabilidad su diferente comportamiento. Siewiorek y cols. (9) usaron un modelo de circuito cerrado pulsátil con modelos de silicona de carótida bifurcada con estenosis del 70% con un flujo de 737 mL/min con un rango de presión media de entre 80 y 100 mmHg y, como fluido, una mezcla de glicerol al 36%. Müller-Hülsbeck y cols. (12) utilizaron un modelo de circuito abierto con SSF con flujo de 700 mL/min pulsátil y presión media de 78 mmHg en un tubo de silicona de 5 mm como carótida interna (ACI). Hendriks y cols. (10) usaron un circuito abierto con flujo continuo de 200 mL/min de un fluido que imita a la sangre con una presión fija de 70 mmHg y como ACI un tubo de silicona de 5 mm. Por último, Kurzhals y cols. (13) utilizaron un modelo cerrado con flujo pulsátil con SSF de 942 mL/min de agua purificada, con ACI un tubo de silicona de 5 mm. la presión se midió en bares, aunque no expresaron la presión media del circuito. Todos los estudios se realizaron con distintos grupos de DPEr y una variabilidad de resultados que no permite definir resultados de forma fiable.
La importancia de realizar estudios de este tipo radica en ampliar el conocimiento acerca de cómo funcionan realmente, sus puntos débiles y fuertes, de gran importancia a la hora de decidir la conveniencia de su uso o sugerir la inclusión de mejoras en su diseño (14,15).
Un punto débil del presente estudio es el tipo de fluido. Se escogió el SSF para asegurar el correcto funcionamiento de los instrumentos, ya que no fue posible utilizar otro fluido compatible. Se trata, por tanto, de un modelo con un fluido newtoniano y laminar muy distinto a la sangre, con una densidad casi 4 veces inferior, y demuestra que su presencia afecta a la resistencia y presión en estas condiciones. Probablemente este efecto se vería incrementado en sangre. La porosidad de los DPEr no ha sido analizada en este estudio, para lo que debería realizarse un estudio específico por imagen en alta resolución. Solo hemos encontrado una publicación al respecto en el año 2008 y su información debería ser contrastada y actualizada (8). Otras limitaciones son el hecho de haber utilizado volumen de flujo/minuto basado en estudios previos, que es superior a una carótida interna estenótica, y no utilizar una temperatura de 37°C, que podría haber influido en un mejor despliegue del anillo de nitinol.
CONCLUSIÓN
Todos los DPEr provocan un aumento de las resistencias y existen diferencias entre ellos que dependen del tamaño del poro y del tipo de filtro. El dispositivo con mayor resistencia es el DPEr1, seguido del DPEr4, DPEr3 y DPEr2, en ese orden. Estas diferencias se incrementarían probablemente tras la captación de partículas. El aumento de resistencias y turbulencia generadas podría influir sobre su eficacia. Existen diferencias entre los distintos dispositivos, aunque harían falta nuevos estudios para demostrar estos hechos.