INTRODUCCIÓN
La enfermedad tromboembólica venosa (ETV) es una entidad clínica relevante por su frecuencia, morbimortalidad y secuelas a largo plazo.
El Grupo de Estudio sobre la Enfermedad Tromboembólica Venosa en España 2006 (1) ha descrito una prevalencia del 3-5 % en la población general y una incidencia de 120/100 000 habitantes/año en nuestro país. Supone la tercera causa de muerte cardiovascular después del síndrome coronario agudo y el accidente cerebrovascular y entre el 3 y el 5 % de la mortalidad general.
En los últimos años los esfuerzos se han orientado en identificar factores de riesgo y diseñar modelos de predicción con el fin de cuantificar el riesgo de presentar un evento tromboembólico agudo, centrándose en la prevención y la tromboprofilaxis.
Aproximadamente un 25 % de todos los casos de ETV se relacionan con ingresos hospitalarios. Entre un 50-75 % de ellos ocurre en pacientes ingresados por causa médica (2). Un evento de ETV en estos pacientes aumenta la mortalidad a tres meses, independiente de la causa del ingreso (3).
En ausencia de tromboprofilaxis, la incidencia de ETV durante el ingreso hospitalario, confirmada por ecografía Doppler o venografía, alcanza entre un 10-40 % (4). Los grandes estudios que han demostrado el impacto de la tromboprofilaxis describen una reducción del riesgo relativo de un 63 % (5), 48 % (6) y 47 % (7), respectivamente.
No hay estudios disponibles que hayan evaluado conjuntamente la tromboprofilaxis con heparina de bajo peso molecular (HBPM) en términos de eficacia clínica (disminuir los episodios de ETV a tres meses) y eficacia bioquímica (niveles de actividad anti-Xa en rango sugerido como óptimo para tromboprofilaxis). De hecho, actualmente no hay recomendaciones para la monitorización de los niveles de actividad anti-Xa en relación con la tromboprofilaxis.
El objetivo del presente estudio es evaluar criterios de eficacia clínica (disminución de episodios de ETV a tres meses de seguimiento) y criterios de eficacia bioquímica (niveles de actividad anti-Xa en rango sugerido como óptimo para tromboprofilaxis) con el fin de identificar factores de optimización de la tromboprofilaxis en pacientes del servicio de urgencias (SU).
PACIENTES Y MÉTODO
Selección de pacientes
Estudio de tipo observacional y prospectivo unicéntrico desarrollado en el SU de un hospital terciario. Entre el 1 de enero de 2013 y el 31 de diciembre de 2013, se reclutaron prospectivamente todos los pacientes que acudieron a urgencias, hasta completar 100 pacientes. Los criterios de inclusión fueron los siguientes: edad > 18 años y una estancia en el SU de más de 48 horas y menos de 5 días. Además, debían cumplir criterios de indicación de tromboprofilaxis, sugerida (puntuación 3-4) o recomendada (mayor de 4 puntos), según práctica clínica habitual del SU, siguiendo las pautas de la Guía PRETEMED (8), que corresponden con los grupos de riesgo medio y alto de esta guía.
Como criterios de exclusión se siguieron: pacientes en tratamiento previo con anticoagulantes, trombocitopenia < 50 000 plaquetas/ uL en la analítica al ingreso en el SU, coagulopatías primarias o secundarias con alteración de los tiempos de coagulación (ratio tiempo tromboplastina parcial activada > 1,5, protrombina < 50 % o INR > 1,2), aclaramiento de creatinina < 30 ml / minuto calculada por Cockroft-Gault al ingreso en el SU, embarazo y lactancia y contraindicación para el uso de HBPM (por ejemplo, hipersensibilidad, hemorragia activa o riesgo elevado de hemorragia).
Siguiendo las directrices sobre estudios observacionales, el estudio fue evaluado y aprobado por el comité ético de investigación clínica del hospital. Todos los pacientes firmaron el consentimiento informado previo a la inclusión en el estudio.
Evaluación inicial
La decisión de iniciar la tromboprofilaxis, así como el tipo de HBPM indicada y la dosis administrada, fue del clínico a cargo según las recomendaciones de la Guía PRETEMED (8), siguiendo la práctica clínica habitual.Se recogieron variables demográficas (edad y sexo), variables antropométricas (peso, talla e IMC) y antecedentes médicos: hipertensión arterial, diabetes mellitus, insuficiencia cardíaca y situación funcional según los criterios de la New York Heart Association (NYHA), patología pulmonar crónica, asma o enfermedad pulmonar obstructiva crónica (EPOC) e infección por virus de la inmunodeficiencia humana (VIH).Al ingreso, se determinaron los factores de riesgo:
• Predisponentes o intrínsecos: edad, historia previa de ETV, cáncer, insuficiencia cardíaca o respiratoria, enfermedad inflamatoria intestinal, síndrome nefrótico, trastornos mieloproliferativos, hemoglobinuria paroxística nocturna, varices en miembros inferiores, sobrepeso u obesidad (definido según IMC > 25 o > 30 kg/m2), tabaquismo (si mantiene el hábito activo en el momento del ingreso en el SU), apnea obstructiva del sueño y situaciones de trombofilia congénita o adquirida.
• Factores de riesgo desencadenantes o extrínsecos: inmovilización, intervenciones quirúrgicas, enfermedad médica aguda, traumatismos, canalización de vías centrales, embarazo, puerperio, tratamiento hormonal sustitutivo o anticonceptivos orales con estrógenos, moduladores selectivos de los receptores estrogénicos y tratamiento antineoplásico (hormonal, quimioterapia o radioterapia).
Se clasificó a los pacientes según las escalas de valoración en el grupo de riesgo correspondiente según la Guía PRETEMED (8).
Medición de anti-Xa
Se extrajo una muestra a cada paciente durante su permanencia en el SU, empleando el equipo de extracción habitual: autoanalizador ACL TOP 700 (Instrumentation Laboratory®), utilizando los reactivos del laboratorio Izasa HemosIL® Liquid Anti-Xa - 0020302600. Se utilizó un tubo de citrato BD Vacutainer de 4,5 mL de sangre extraído a cada sujeto a las 4 horas después de la administración de la segunda dosis de heparina subcutánea (9). Se estableció como rango de actividad anti-Xa tromboprofiláctica entre 0,2 y 0,4 U/mL (10,11).
Objetivos y definiciones
La variable primaria de eficacia clínica se definió como la aparición de un evento de ETV (definida como TVP sintomática y/o EP sintomática) durante el ingreso hospitalario y en el seguimiento durante los tres meses posteriores al alta del SU. Se realizó seguimiento telefónico y a través de la historia clínica electrónica de nuevos episodios agudos.
Análisis estadístico
Las características generales fueron expresados como media (DE) para variables continuas y proporciones para categóricas. Para la estimación de diferencias entre variables se utilizó χ2 o la T de student si eran paramétricos, y en caso de no seguir una distribución normal, se utilizaron test no paramétricos (U de Mann-Whitney o Kruskal Wallis, según procedió). Se ajustó un modelo de regresión lineal múltiple para estimar la influencia de una o varias variables independientes en relación con eventos tromboembólicos y niveles terapéuticos de tromboprofilaxis de actividad anti-Xa, incluuidas aquellas variables en las que, en el análisis univariado, la p fue menor de 0,1. Como medida de asociación se calcularon las odds ratio (OR) ajustadas y sus IC al 95 %. La significación estadística se estableció en p < 0,05. Los datos fueron analizados usando el software de análisis estadístico SPSS 23.0 (IBM SPSS Statistics for Windows, versión 23.0. Armonk, NY).
RESULTADOS
Se incluyeron un total de 100 pacientes atendidos en el SU. Las características generales se encuentran recogidas en la tabla I. Las causas de ingreso más frecuentes fueron: infección aguda (47 %), EPOC reagudizado (23 %) y proceso relacionado con cáncer (21 %).
Tabla I. Características generales de los pacientes al ingreso
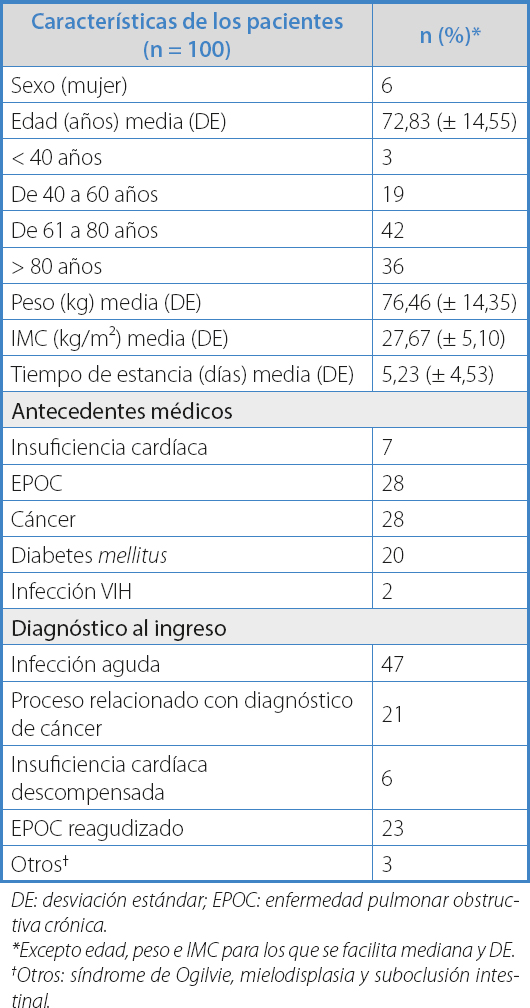
DE: desviación estándar; EPOC: enfermedad pulmonar obstructiva crónica.
*Excepto edad, peso e IMC para los que se facilita mediana y DE.
†Otros: síndrome de Ogilvie, mielodisplasia y suboclusión intestinal.
Factores de riesgo predisponentes y desencadenantes de ETV
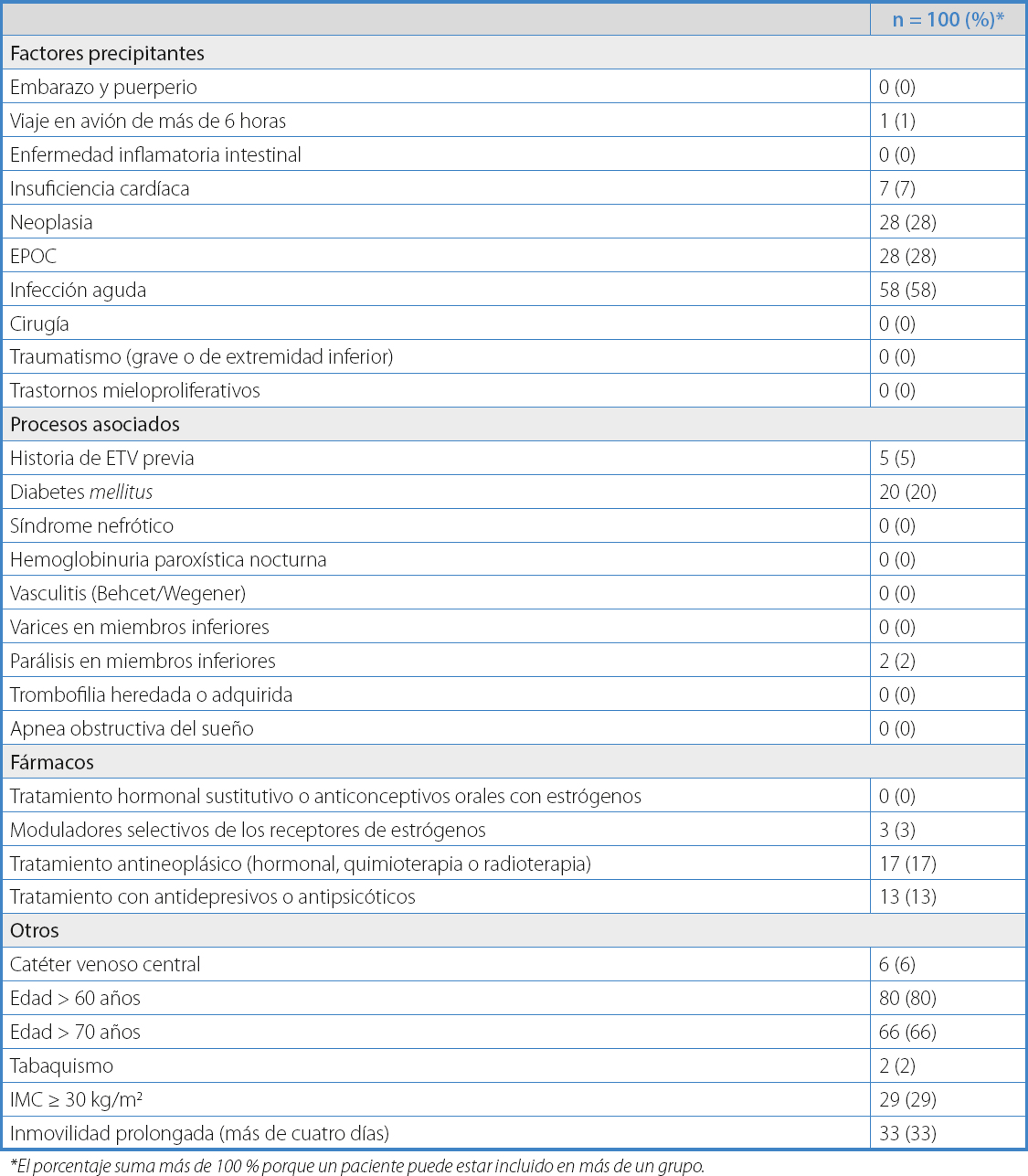
Los factores de riesgo predisponentes más frecuentes fueron la edad (80 % > 60 años y 66 % > 70 años), antecedentes de neoplasia (28 %), EPOC (28 %) y obesidad (30 % IMC > 30 kg/m²) (Tabla II). Los factores de riesgo desencadenantes observados en la población estudiada fueron la presencia de una infección aguda (58 %), inmovilidad por más de cuatro días (33 %) y tratamiento con quimioterapia (17 %) (Tabla II).
Estratificación del riesgo según guía PRETEMED
Según la Guía PRETEMED, el 20 % de los pacientes se clasificaron en riesgo medio (4 puntos) y el 80 %, en riesgo alto (> 4 puntos) El grupo de riesgo alto presentó mayor frecuencia de cáncer (34,2 % riesgo alto frente al 4,8 % riesgo medio, p = 0,008), mayor frecuencia de personas > 70 años (68,4 % frente a 57,1 % en grupo de riesgo medio, p = 0,335) y mayor porcentaje de inmovilidad > 4 días (41 % frente a 4,8 % en grupo de riesgo medio, p = 0,002).
Actividad anti-Xa y heparinas de bajo peso molecular
Las HBPM utilizadas fueron enoxaparina 20 mg en 12 pacientes y 40 mg en 43 pacientes; bemiparina 2500 U en 32 pacientes y 3500 U en 15 pacientes.
En cuanto a la distribución de los niveles de actividad anti-Xa, un 48 % de los pacientes estaba fuera del rango de actividad anti-Xa tromboprofiláctica (34 % niveles < 0,2 U/mL y 14 % niveles > 0,4 U/mL) (Tabla III).
Tabla III. Nivel de actividad anti-Xa según tipo y dosis de HBPM*
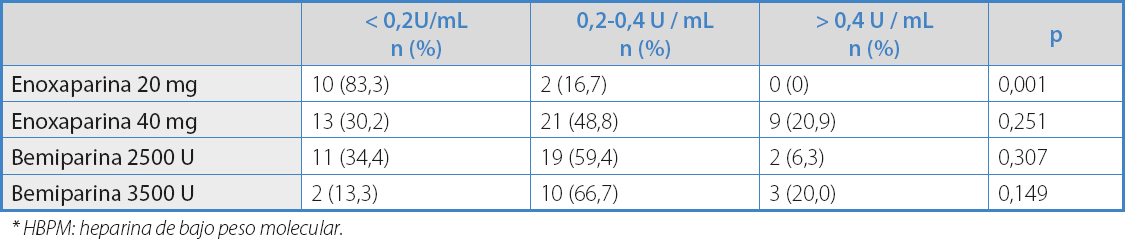
*HBPM: heparina de bajo peso molecular.
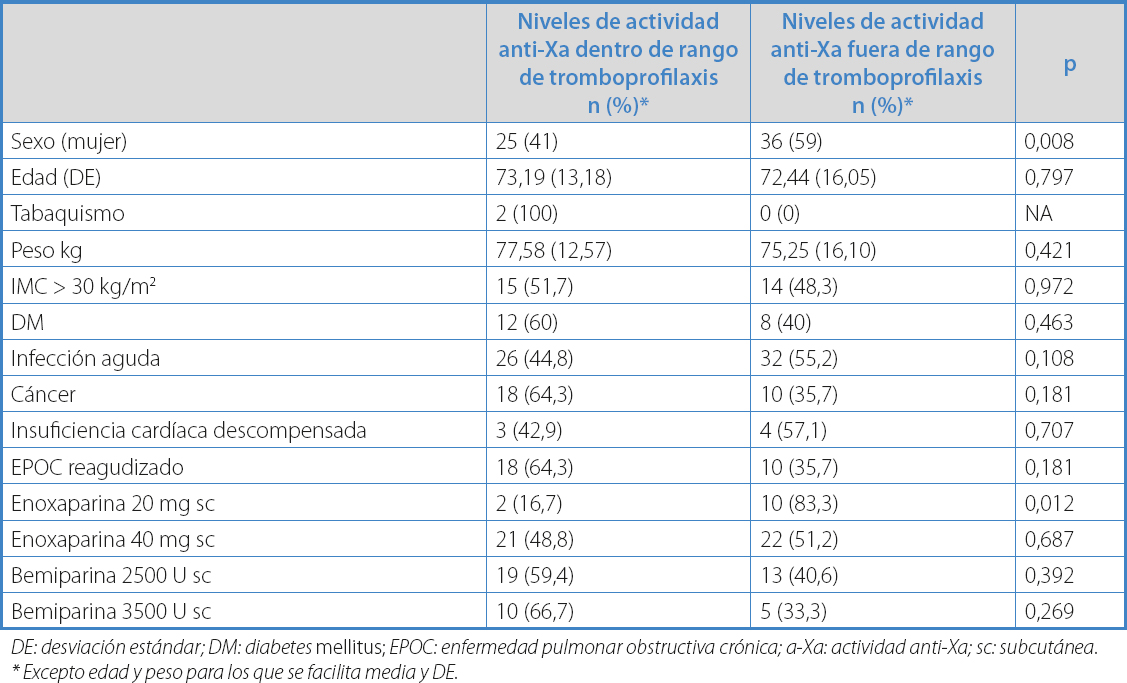
Los factores relacionados con niveles de actividad anti-Xa fuera de rango terapéutico fueron: ser mujer (59 % frente a 38 % de los hombres, p = 0,008) con un OR = 1,68 (IC 95 %; 1,17-2,43) y utilización de enoxaparina 20 mg sc (83,3 % frente a 16, 7 %, p = 0,012, con un OR = 1,93 (IC 95 %, 1,36- 2,73) (Tabla IV).
Criterios de evaluación clínica: eventos de ETV sintomática a 3 meses
Se observó un 3 % de episodios de ETV sintomáticos en los tres meses de seguimiento, Ninguno durante el ingreso en la unidad de corta estancia. Se trató de dos episodios de tromboembolismo pulmonar sintomático y de un episodio combinado de trombosis venosa profunda y tromboembolismo pulmonar sintomático.
No se observaron diferencias significativas en la aparición de eventos tromboembólicos durante tres meses en relación a los niveles de actividad anti-Xa. Los tres pacientes con episodios de ETV a tres meses presentaron niveles de actividad anti-Xa en rango de tromboprofilaxis.
No se observó ningún evento adverso como: hematoma en sitio de punción, lesiones cutáneas, necrosis cutánea, reacciones de hipersensibilidad o trombocitopenia inducida por heparina ni durante el tratamiento tromboprofiláctico ni durante el seguimiento. Un paciente presentó una complicación hemorrágica al final del seguimiento. Se trató de un hematoma posquirúrgico a los 86 días de seguimiento.
DISCUSIÓN
En nuestro estudio, pacientes ingresados en una unidad de corta estancia del SU (estancia < 4 días) con patología médica aguda e indicación de tromboprofilaxis según PRETEMED, presentaron una frecuencia de eventos ETV en el seguimiento a tres meses similar a lo descrito en la literatura para pacientes con enfermedad médica aguda ingresados en unidades convencionales con estancias de entre 6 y 14 días (5,6). En este sentido, es recomendable identificar y tratar aquellos pacientes con riesgo moderado/alto de presentar un evento tromboembólico.
Es significativo que, en nuestra población estudiada, la incidencia de eventos de ETV sintomáticos a tres meses sea similar a la descrita en estudios cuyo objetivo primario era la suma de eventos sintomáticos y eventos asintomáticos. Esto nos hace pensar que la incidencia real de ETV pueda estar infraestimada. La relación entre actividad anti-Xa y su impacto clínico se ha estudiado en varios ensayos clínicos (12-15). En el estudio de Koller y cols. (15), se compararon 2 dosis de dalteparina (2500 U y 7500 U) con HNF (5000 U dos veces al día) en 289 pacientes. Se observaron más complicaciones hemorrágicas con dalteparina 7500 U al día relacionadas con una actividad anti-Xa mayor a las 4 horas después de la administración en pacientes que presentaron complicaciones hemorrágicas respecto a los pacientes que no presentaron algún tipo de sangrado (0,48 U/mL frente a 0,11 U/mL de actividad anti-Xa; p < 0,01). Levine y cols. (12) compararon dos dosis de tromboprofilaxis con HBPM posoperatoria: enoxaparina 40 mg y 60 mg al día subcutánea en 163 pacientes sometidos a reemplazo total de cadera. Las complicaciones hemorrágicas fueron más frecuentes, con picos mayores de actividad anti-Xa obtenidos 12 horas después de la administración subcutánea (24,5 % hematoma de la herida con pico anti-Xa > 0,2U / mL frente a 5,3 % con pico de actividad anti-Xa ≤ 0,2U / mL, p = 0,002). La aparición de complicaciones trombóticas posoperatorias fue menor en los pacientes con mayor actividad anti-Xa (6,3 % con actividad anti-Xa > 0,1U/mL frente al 14,6 % con actividad anti-Xa ≤ 0,1 U/mL, p = 0,003).
Sin embargo, otros estudios clínicos (16-22) no corroboraron estos hallazgos y el riesgo de trombosis y/o hemorragia, aunque en estos estudios clínicos no se relacionó la aparición de eventos ETV o complicaciones hemorrágicas con los niveles de actividad anti-Xa (22). Es posible que la monitorización de la actividad anti-Xa pueda ser insuficiente para cuantificar el efecto clínico de la HBPM, sobre todo en relación con la tromboprofilaxis, en la que no hay acuerdo en el rango óptimo de actividad anti-Xa.
La monitorización de niveles de actividad anti-Xa y su posterior ajuste de dosis están recomendados en pacientes de alto riesgo, como politraumatizados y grandes quemados, en los que se han visto niveles subterapéuticos con las dosis actuales de tromboprofilaxis recomendadas (23-25).
En nuestro estudio, un 48 % de los pacientes estaba fuera de rango de actividad anti-Xa definido como tromboprofilaxis, 34 de ellos en niveles < 0,2 U/mL (70 % del total de pacientes fuera de rango). Llama la atención que los 3 pacientes que presentaron un evento de ETV a tres meses estaban dentro de rango terapéutico. Estos datos sugieren que las dosis propuestas de HBPM para tromboprofilaxis pueden no ser las óptimas para alcanzar los niveles de actividad anti-Xa definidos hasta ahora como tromboprofilaxis adecuada, al menos en los pacientes de urgencias con patología médica. La duda es si estos pacientes se beneficiarían de un cambio en las dosis recomendadas de HBPM.
Un mayor número de pacientes tratados con bemiparina alcanzaron niveles de actividad anti-Xa en rango terapéutico (61,7 % de los tratados con bemiparina, p = 0,06). La bemiparina es una HBPM de segunda generación, de menor peso molecular (3600 Daltons), con una relación de actividad anti-Xa / anti-IIa de 8:1, a diferencia de la enoxaparina, cuya actividad anti-Xa / anti-IIa es de 3,3 a 5,3:1 (26,27). Hay estudios que sugieren que una mayor actividad anti-Xa y un ratio anti-Xa / anti-IIa mayor determinan más efectividad y mayor seguridad (28). Antonijoan y cols. (29) describieron en un estudio en voluntarios sanos que la bemiparina presentaba una actividad anti-Xa mayor y una relación anti- Xa / anti-Ila mayor que enoxaparina. Si bien es cierto que, en nuestra serie, los pacientes tratados con bemiparina alcanzaron con mayor frecuencia niveles dentro de rango terapéutico de tromboprofilaxis, no observamos traducción clínica de este hallazgo.
Los factores relacionados con niveles de actividad anti-Xa fuera de rango de tromboprofilaxis que observamos fueron el sexo (mujer) y la administración de enoxaparina en dosis de 20 mg una vez al día. Esto último ya se había observado en el estudio MEDENOX (30). En este estudio, se comparó enoxaparina 20 mg al día con enoxaparina 40 mg al día con placebo. Se observó una incidencia de 17,5 % de ETV a tres meses de seguimiento en el grupo de enoxaparina 20 mg al día, similar al 17,1 % del grupo placebo (p = 0,91) comparado con el 7 % del grupo enoxaparina 40 mg al día a tres meses de seguimiento (p < 0,001). Sin embargo, en este estudio no se relacionaron estos parámetros clínicos con datos bioquímicos de actividad anti-Xa.
En cuanto al hallazgo de niveles de actividad anti-Xa y a su relación con el sexo femenino, no hay claridad en la explicación de estos hallazgos. Es más, estudios previos en pacientes críticos habían demostrado, al contrario de nuestros hallazgos, una relación entre el sexo mujer y niveles mayores de actividad anti-Xa (31). Los autores plantean que estos hallazgos sean de causa multifactorial, posiblemente influenciados por diferencias en el IMC, diferencias en el contenido de agua corporal total de las mujeres comparado con los hombres, situación que puede alterar la farmacocinética de las HBPM. En nuestro estudio no observamos diferencia en la media del peso, en el IMC ni en otros parámetros clínicos ni analíticos entre hombres y mujeres. Tampoco observamos mayor incidencia de eventos ETV en mujeres, lo que corrobora nuevamente que los niveles terapéuticos de tromboprofilaxis no se relacionan con eventos clínicos. En este sentido, hacen falta más estudios que clarifiquen estos hallazgos.
No hay estudios que definan cuándo es adecuado comenzar la tromboprofilaxis en pacientes que ingresan en una unidad de corta estancia dependiente de un servicio de urgencias. Las distintas escalas de valoración definen el riesgo como inmovilidad o encamamiento superior a 3 o 4 días. En nuestro estudio, hemos observado en pacientes con menos días de ingreso una frecuencia de eventos de ETV similar a la descrita para estancias e inmovilidad más prolongada. Esto nos hace confirmar que la enfermedad aguda es una situación que incrementa per se el riesgo de ETV al ser una situación proinflamatoria, procoagulante y al asociarse en muchos casos a diversos grados de inmovilidad.
La tromboprofilaxis sistemática en ETV ha demostrado ser eficaz y presentar una relación coste-beneficio favorable por su frecuencia, la dificultad del diagnóstico, presentación en forma silente en muchos casos y la morbimortalidad que determina, asociada a unos costes sanitarios elevados en enfermos de alto riesgo. Sin duda, es más segura que detectar y tratar los casos establecidos de ETV. En pacientes agudos, cuyo paradigma es un paciente con patología aguda que ingresa en un servicio de urgencias, especialmente en una unidad de corta estancia, es posible que el momento adecuado de iniciar la tromboprofilaxis, en ausencia de contraindicación, sea el momento mismo de su ingreso.
LIMITACIONES Y FORTALEZAS
Las limitaciones de nuestro estudio son, en primer lugar, su diseño, que es observacional, transversal y unicéntrico, con un seguimiento a corto plazo. Al mismo tiempo, no permite determinar prevalencias ni incidencias, sino solo tendencias. Una evaluación transversal limita la evaluación dinámica del riesgo trombótico. A pesar de estas limitaciones, este estudio debe considerarse como generador de hipótesis.
Se trata del primer estudio realizado en una unidad de corta estancia dependiente del servicio de urgencias en el que se evalúa un grupo de pacientes que hasta ahora se había dejado fuera de los requerimientos de tromboprofilaxis y, por tanto, de la valoración de riesgo de ETV (pacientes médicos de urgencias). Otra fortaleza a tener en cuenta es relaciona parámetros bioquímicos (actividad anti-Xa) con clínicos (ETV).
Otra limitación es que la incidencia real de ETV a tres meses de seguimiento en estos pacientes podría estar subestimada al evaluar solo los casos sintomáticos.
En el futuro serán necesarios más estudios prospectivos que determinen la escala de riesgo más útil en el paciente médico agudo de urgencias para desarrollar así protocolos clínicos de actuación basados en el riesgo y en la prevención de la ETV.
CONCLUSIONES
Nuestros resultados refuerzan la necesidad de estratificar el riesgo de ETV en todos los pacientes, también en aquellos ingresados en unidades de corta estancia, y abre la necesidad de evaluar las dosis recomendadas de tromboprofilaxis y la definición de niveles óptimos de actividad anti-Xa en tromboprofilaxis, así como la de definir el impacto de los distintos tipos de HBPM en relación a criterios de eficacia clínica y bioquímica. Todos estos hallazgos podrían determinar una vía de optimización de la tromboprofilaxis y disminuir los eventos tromboembólicos en esta población.