INTRODUCCIÓN
En pacientes jóvenes con patología oclusiva aortoilíaca, la realización de bypass aortoilíaco o aortofemoral unilateral o bilateral es la técnica estándar de revascularización de los miembros inferiores, a pesar de que la cirugía endovascular esté proliferando y superándola en el número de procedimientos (1). Lo mismo ocurre con la reparación abierta de los aneurismas aortoilíacos: la reparación endovascular (EVAR) se impone claramente a la reparación abierta (2,3), que ha sido la técnica habitual de reparación antes de que Parodi y cols. comunicasen la primera reparación endovascular de un aneurisma de aorta abdominal en 1991 (4).
En la actualidad, el número de estas derivaciones ortoanatómicas para tratar patologías aórticas o ilíacas, simples o combinadas, esté claramente en descenso y, de hecho, como se recoge en los registros de la Sociedad Española de Angiología y Cirugía Vascular de los últimos años, es raro los servicios o unidades de angiología y cirugía vascular que superan los veinte procedimientos al año (5,6). Sin embargo, sí que existe un número no despreciable de pacientes que son portadores de dichos dispositivos protésicos y, por tanto, están sujetos a posibles complicaciones, entre las que se encuentra la infección protésica (7), cuyo cuadro más temido es la aparición de una fístula aortoentérica como causa primaria o incluso de forma secundaria a dicha infección (8).
En el manejo de estos cuadros de infección protésica no pueden establecerse cuidados o criterios comunes, ya que van a depender de diferentes factores, tanto individuales del paciente (variabilidad clínica, comorbilidades, edad, etc.) como del medio y del equipo que lo trate (disponibilidad de técnicas, experiencia local…). Así se recoge en la reciente guía de la Sociedad Europea de Cirugía Vascular (ESVS), cuya publicación se ha producido coincidiendo con la redacción de este artículo (9). De esta forma, sabemos que su manejo va a ser difícil, complicado y, además, acompañado de muy mal pronóstico, no solo por su alta morbilidad, sino también por la alta mortalidad que conlleva (1,8,9,10). Si el cuadro clínico lo permite, lo primero a plantearse es la necesidad del explante de la prótesis infectada y, aunque la teoría indica que es obligado, casi siempre se intenta de inicio una opción conservadora que consiste en el tratamiento antibiótico prolongado con vigilancia estrecha del paciente (7). Este tiempo de tratamiento conservador, aunque en pocos casos consigue erradicar la infección, nos sirve, por un lado, para programar de forma cuidadosa la opción quirúrgica agresiva de la ablación de la prótesis y, por otro, mejorar el estado general del paciente. Si podemos planificar la intervención, es crucial el hecho de si la prótesis está permeable y, por tanto, si hay que plantear una técnica de revascularización, bien a través de un nuevo injerto ortoanatómico o bien de uno extraanatómico, y, en este caso, si es posible secuenciar en dos tiempos la intervención y decidir el momento de cada uno (9-11).
Sin embargo, la aparición de forma aguda de una fístula aortoentérica en un paciente portador de un bypass aórtico no deja otra opción que la intervención quirúrgica, de manera urgente o como urgencia diferida. Si el estado clínico del paciente lo permite, lo conveniente es realizar la cirugía definitiva de explante del material infectado y la reconstrucción de las asas intestinales con o sin revascularización de las extremidades. Si el estado general del paciente es malo, puede optarse por controlar la hemorragia digestiva mediante el implante endovascular de una endoprótesis aórtica y esperar a que el paciente supere el proceso para, con posterioridad, plantear la exéresis de todo el material implantado, endoprótesis y prótesis aórticas, con revascularización de los miembros inferiores si es necesario (9-11).
En el procedimiento de revascularización de estos pacientes, e independiente de la localización del injerto y del tiempo en que se realice, hay que considerar el riesgo de colonización de cualquier material extraño que se implante en él. De esta forma, tenemos que pensar en utilizar un material que, en teoría, sea lo más resistente posible a dicha sobreinfección (9,10).
INJERTOS Y MATERIALES UTILIZADOS EN SITUACIONES CON RIESGO DE INFECCIÓN
Se han utilizado diferentes tipos de injertos y de materiales como intento de reducir los riesgos de sobreinfección en los casos en los que esta tiene alta probabilidad de que ocurra. Entre ellos tenemos que incluir como ideal el uso de injertos autólogos, en especial las venas superficiales, aunque no siempre están disponibles ni presentan dimensiones adecuadas (9,12,13), a lo que se une una mayor complejidad y duración de la intervención. Otros materiales utilizados y con series publicadas han sido los aloinjertos criopreservados, difíciles de conseguir y con experiencias que señalan su degeneración y la aparición de pseudoaneurismas y estenosis o trombosis; los injertos de poliéster (Dacron) recubiertos de plata o impregnados en antibióticos como la rifampicina y los de politetrafluoretileno (PTFE), de los que algunos encuentran mayor resistencia a la infección, pero con resultados variables y con un porcentaje no despreciable de índices de sobreinfección u otras complicaciones (7,9-15), y los injertos biosintéticos, a los que nos referiremos de manera más extensa.
Aunque a todos estos tipos de injertos se les atribuyen ventajas e inconvenientes y ninguno es superior al material autólogo, en el caso de las prótesis biosintéticas se han publicado numerosas experiencias acerca de que muestran bajo índice de infección posoperatoria cuando se usan para bypass electivos, por lo que diferentes centros disponen de ellos para reemplazar injertos protésicos infectados en ausencia de material autólogo (16-27). Dentro de ellos se encuentra la prótesis vascular biosintética Omniflow II® (Fig. 1), que está compuesta de colágeno ovino entrecruzado con un endoesqueleto de malla de poliéster.
La malla de poliéster le confiere resistencia y durabilidad, lo que le hace resistir la degeneración aneurismática, mientras que el colágeno la hace estable, no es antigénico y permanece intacto años después de la implantación. Esta estructura de colágeno es biocompatible y aporta una rápida incorporación en el tejido del huésped y conduce a una neovascularización de la pared (27), lo que se piensa que es lo que contribuye a la resistencia a la infección.
La actual generación de esta prótesis fue consecuencia de mejoras en su diseño a partir de una primera generación, en la que se describieron algunos casos de degeneración aneurismática y torsiones o kinkings. De esta forma se diseñó un tejido de colágeno más grueso que añadió estabilidad y resistencia, se prolongó el proceso de entrecruzado, lo que igualmente prolongó su estabilidad en el tiempo, y se mejoró el proceso de selección para aumentar la calidad de los injertos que se ofrecen al mercado. Es importante señalar que, en el caso de decidir usar este tipo de prótesis Omniflow II®, es necesario conocer sus instrucciones de uso (28) y realizar una cuidadosa preparación, algo que, en nuestra experiencia, no ha resultado nada complicado y se convierte en una rutina más dentro del personal de quirófano.
En nuestro centro disponemos de la prótesis biosintética Omniflow II® desde hace aproximadamente seis años y, cuando nos fue ofertada, buscábamos sobre todo un material que nos resolviese el problema de pacientes que no tenían material autólogo, en especial las venas safenas, para aquellos casos con infección o alto riesgo de tenerla en la zona a tratar y para derivaciones vasculares por debajo de las rodillas, donde ningún material ha superado al autólogo. También lo usamos de forma puntual y específica en un caso en el que realizamos la reconstrucción in situ de un bypass aortobifemoral ortoanatómico con una prótesis biosintética Omniflow II® de 8 mm de diámetro y 60 mm de longitud, previa resección o explante de una prótesis de poliéster previa que causó una fístula aortoentérica contenida en un paciente joven y que permitió su programación junto al servicio de cirugía digestiva y donde, además, no se observaron intraoperatoriamente signos directos de infección. Este paciente sobrevivió seis meses después de la intervención y finalmente falleció por una isquemia intestinal evolucionada, con necrosis y resección extensa de asas intestinales, sin que se encontrArán signos de infección del bypass aortobifemoral con material biosintético, que se encontraba permeable (Fig. 2).
EXPERIENCIA PERSONAL EN NUESTRO CENTRO CON EL USO DE LA PRÓTESIS OMNIFLOW II® EN BYPASS AXILOFEMORAL POR INFECCIÓN DE PRÓTESIS AORTOBIFEMORAL
En el caso de los procedimientos de bypass o derivaciones axilofemorales con estas prótesis biosintéticas, lo hemos realizado en cuatro pacientes con infección de prótesis previas, si bien en el primer caso, más simple, se trataba de un varón portador de un bypass axilofemoral con Dacron e infección subcutánea y localizada en un trayecto del mismo, que se sustituyó con una interposición de una prótesis Omniflow II® de 8 mm de diámetro realizando un nuevo trayecto de tunelización a zonas en apariencia sanas y que cursó de forma favorable y sin nuevos signos de infección a los 48 meses.
Los otros tres casos, mucho más complejos, se trataron de pacientes con infección conocida de prótesis abdominales aortobifemorales. En orden cronológico, el primero de ellos, intervenido en abril de 2016, era un varón de 66 años que había sido intervenido en dos ocasiones: la primera, vía laparotomía media hacía unos veinte años por obliteración de aorta infrarrenal y la segunda, por vía retroperitoneal izquierda cuatro años después, por oclusión del primero, para implantar un bypass aortobifemoral por isquemia crónica de grado III de miembros inferiores.
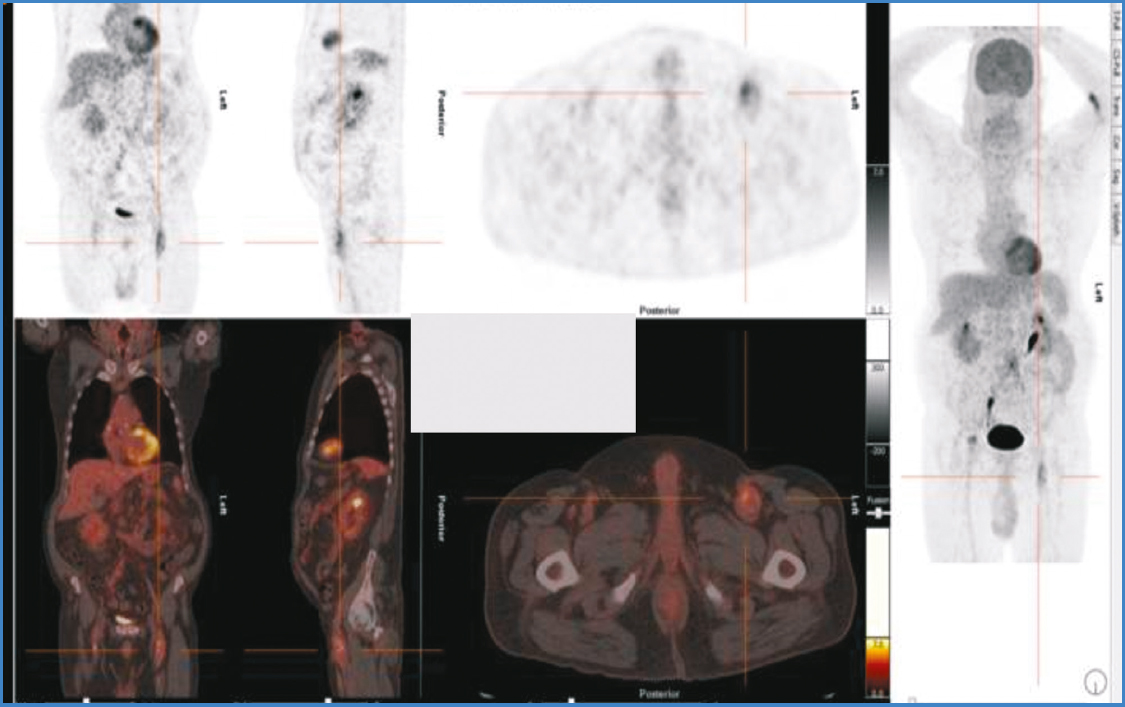
En su historia de más de quince años destacan episodios de infecciones tratados de forma conservadora con antibióticos y drenajes a nivel inguinal; incluso en 2012 se realizó una gammagrafía de leucocitos marcados que no reportó signos de captación. Finalmente, en marzo de 2016 ingresó en la unidad de infecciosos por fiebre de origen desconocido y evidencias en la TAC abdominal de aumento de los cambios inflamatorios periaórticos. En hemocultivo se aísla Actinomyces odontolitycus y en los pies aparecen petequias compatibles con émbolos sépticos. En SPET-TAC de tórax y abdomen se encuentra un aumento focal de la actividad metabólica a nivel de aorta abdominal y femoral bilateral (Fig. 3) que coincide con las anastomosis del bypass, por lo que la sospecha de infección del injerto vascular aórtico es muy probable. Ante estos hallazgos, se decide plantear tratamiento quirúrgico en dos tiempos: en el primero se realiza bypass axilofemoral bilateral con dos prótesis biosintéticas Omniflow II® de 8 mm de diámetro con explante de las prótesis de Dacron en femorales, con alta posoperatoria a los diez días, pues sufrió dehiscencia en la herida inguinal derecha del explante (distinta a la del bypass axilofemoral de ese lado, que fue a arteria femoral profunda), y, para un segundo tiempo, se programó la exéresis del bypass aortobifemoral mediante laparotomía media con ligadura de la aorta infrarrenal. Este segundo tiempo no llegó a realizarse por propia decisión del paciente y porque presentó un evento coronario que hacía arriesgada la cirugía. El paciente fue exitus por hemorragia digestiva masiva a los dos meses, pero sin sufrir isquemia de los miembros inferiores; es decir, con los bypass axilofemorales permeables.
El segundo caso, intervenido en octubre de 2018, se trataba de un paciente de 67 años también portador de un bypass aortobifemoral desde hacía unos 25 años por una claudicación intermitente motivada por una obliteración de aorta infrarrenal. Acude por primera vez a nuestra consulta en abril de 2017 refiriendo claudicación intermitente en miembro inferior izquierdo no invalidante y, en la exploración física, se constata ausencia de pulso femoral izquierdo y se establece la sospecha clínica de oclusión crónica de la rama izquierda del bypass aortobifemoral antiguo.
Se solicita angio-TAC abdominopélvico que confirma la sospecha clínica y descarta otros hallazgos patológicos. Sin embargo, a los seis meses de esta consulta, acude a urgencias del hospital con sintomatología de fiebre y mal estado general, sin que se encontrara foco séptico, hasta que un nuevo angio-TAC abdominopélvico informó de la presencia de enrarecimiento alrededor de la prótesis aórtica y burbujas de aire tanto a nivel del muñón aórtico, que se encuentra permeable, como de la rama izquierda del bypass que estaba trombosada (Fig. 4). Se confirma la sospecha radiológica de infección protésica mediante estudio de SPECT-TAC, en el que se aprecia hipercaptación en las mismas localizaciones anatómicas. En estos momentos, se instaura tratamiento antibiótico empírico (intravenoso durante 15 días y luego oral) y, ante la buena respuesta clínica y radiológica, se decide continuar en su domicilio durante seis meses y controles mediante angio-TAC y SPECT TAC a los tres y a los seis meses.

Figura 4. Angio-TAC abdominal con imágenes claras de infección, presencia de burbujas de aire y enrarecimiento de tejido periaórtico.
En este último control, si bien la evolución en TAC era buena, no fue así en la SPECT TAC, en la que se visualiza foco hipercaptador en pared anterior de aorta abdominal, sugestivo de persistencia de infección. A los quince días aproximadamente (julio de 2018), debuta con cuadro de dolor abdominal difuso y hemorragia digestiva en forma de rectorragias que hacen sospechar la temida aparición de fístula aortoentérica y obliga a su intervención. Se interviene como urgencia diferida y se implanta una endoprótesis aortouniilíaca a lado derecho, que resuelve la hemorragia intestinal y produce una clara mejoría clínica del paciente. Se decide alta hospitalaria y posponer la resolución quirúrgica definitiva, que se plantea tras nuevo angio-TAC de control dos meses después, donde no se observan complicaciones, con endoprótesis permeable y sin endofugas (Fig. 5).

Figura 5. Angio-TAC previo a tratamiento quirúrgico definitivo. Se observa endoprótesis aórtica sin endofugas y sin signos de fístula aortoentérica.
Finalmente, a principios de octubre de 2018, se procede al explante de la prótesis quirúrgica y de la endoprótesis aortounilíaca derecha y sutura del muñón aórtico con hasta tres planos de monofilamento 3.0. Una vez liberada la aorta de la brida y con las ramas viscerales y renales funcionando, se exploran las asas intestinales y se detectan dos zonas de perforación a nivel de tercera porción duodenal y en colon descendente próximo al ciego, por lo que se avisa al servicio de cirugía general y digestiva para su reparación, que fue muy laboriosa.
Tras unas ocho horas de intervención quirúrgica, se exploran los miembros inferiores del paciente y, ante la aceptable perfusión, se decide posponer la revascularización del MID, que se lleva a cabo al día siguiente mediante la realización de bypass axilofemoral derecho con prótesis biosintética Omniflow II®. El paciente pasa a reanimación posoperatoria, donde evoluciona favorablemente hasta que, al cabo de una semana, aproximadamente, comienza con complicaciones abdominales y abscesos en cavidad abdominal que obligan a drenaje percutáneo. Tras nueva mejoría clínica pasa a planta de hospitalización. Al mes de dicha intervención, por empeoramiento súbito del paciente, se realiza nuevo angio-TAC donde aparece aumento de las colecciones abdominales y se plantea intervención quirúrgica, que no llega a realizarse por fallecimiento del paciente. En este angio-TAC se aprecia buen estado de la reparación vascular realizada (Fig. 6).

Figura 6. Reconstrucción de angio-TAC posoperatorio al mes de la cirugía. Se aprecia el bypass axilofemoral derecho con prótesis Omniflow II® de 8 mm de diámetro en perfecto funcionamiento. Se observa la ligadura aórtica sin fugas y salida por arteria renal izquierda y varios drenajes abdominales. En esta reconstrucción no se aprecian las colecciones abdominales que finalmente causaron el fallecimiento del paciente.
Un último caso, intervenido en enero de 2019, fue un paciente de 64 años portador de un bypass aortobiilíaco y extensión posterior de rama izquierda a femoral común, implantado cinco meses antes para tratamiento de un gran aneurisma de aorta abdominal yuxtarrenal de 8,7 cm. Presentaba clínica anodina de febrícula junto a dolor en fosa lumbar izquierda irradiado a ingle ipsilateral y zona suprapúbica de unos meses de evolución, por lo que ingresa en otro hospital, donde se implanta catéter doble J y se realiza angio-TAC abdominal, donde se aprecia colección en flanco y en psoas izquierdo.
Con la sospecha de infección protésica abdominal, procedemos a estudio de gammagrafía de cuerpo entero con leucocitos marcados (Tc99m.HMPAO) y SPECT-CT, que confirma la sospecha de infección de prótesis vascular, a expensas del componente aórtico abdominal y femoral izquierdo.
Con el paciente en buenas condiciones generales, se realiza a finales de enero 2019 un bypass axilofemoral derecho con prótesis de Dacron plata de 8 mm anillado a la arteria femoral común derecha (que no había sido intervenida ni presentaba signos inflamatorios alguno) y bypass axilofemoral izquierdo a arteria femoral superficial con prótesis Omniflow II®, distal a la prótesis infectada a nivel de arteria femoral común izquierda, con resección de este segmento infectado y cierre de la referida arteria femoral común con parche de pericardio bovino. Dos días después, en un segundo tiempo y con el paciente recuperado de la primera intervención, se realiza resección de la prótesis abdominal infectada (bypass aortofemoral izquierdo y aortoilíaco derecho) y sutura del muñón aórtico mediante doble sutura de monofilamento.
El posoperatorio cursa de manera tórpida, con signos de shock séptico e insuficiencia renal aguda que precisan hemodiálisis por trombosis de ambas arterias renales. En cultivo de prótesis se obtiene Streptococcus anginosus, Prevotella y Candida albicans. Tras tratamiento antibiótico intensivo, se resuelve el cuadro séptico y el paciente es dado de alta hospitalaria al mes, con hemocultivos y cultivo de los catéteres centrales para hemodiálisis negativos. En las revisiones de consulta externa presenta una evolución clínica con claudicación no invalidante gemelar y en muslo izquierdo, con trombosis del bypass axilofemoral izquierdo y con colección periprotésica sin signos de infección, drenada y con cultivos negativos. Bypass axilofemoral derecho permeable. En angio-TAC de control a los seis meses se aprecian, además de los hallazgos mencionados, cambios posquirúrgicos abdominales en relación con la resección de la prótesis aórtica, sin signos de sospecha de infección.
DISCUSIÓN
El poseer una estadística propia suficiente de estos procedimientos axilofemorales en casos de infección de prótesis aórticas previas es difícil, debido a que afortunadamente son poco frecuentes, por lo que no se pueden hacer fuertes recomendaciones y su manejo, en la mayoría de las veces, queda supeditado a una actuación personal o de grupos concretos y, además, muy condicionado por las condiciones generales del paciente.
La revascularización mediante bypass extraanatómico ha demostrado a lo largo de los años muy buena permeabilidad a largo plazo (7), y aunque pensamos que la opción de una revascularización ortoanatómica in situ es la deseable, también pensamos que es más compleja y que tiene más riesgo de sobreinfección, por lo que solo debe asumirse si se dispone de material autólogo (12,15) o, en todo caso, con aloinjertos arteriales criopreservados (13,14), en los que, a pesar de las complicaciones comunicadas, existen series con buenos resultados. No se aconsejan otros materiales, aunque se describen casos de reconstrucción in situ con prótesis biosintéticas (18,24,25), de las que nosotros disponemos de una (Fig. 2). Por otro lado, hay coincidencia en que estas reconstrucciones in situ no deben intentarse en los casos en los que se ha producido una erosión o fístula aortoentérica, ya que empeora enormemente el pronóstico.
En nuestro centro, siempre que las condiciones clínicas del paciente lo permitan, sin constatarse afectación intestinal y con el bypass infectado permeable, adoptamos en general como primera opción la realización de una intervención quirúrgica en dos tiempos, y de preferencia y para minimizar los riesgos, realizamos en primer lugar el procedimiento de revascularización mediante un injerto extraanatómico con prótesis biosintética Omniflow II®; en general, un bypass axilo unifemoral o bifemoral, dependiendo de si están permeables una o las dos ramas de la prótesis aortoilíaca, procurando que no exista solución de continuidad con las áreas infectadas o, al menos, que esta sea mínima, pues siempre procuramos asegurar una región femoral lo más limpia posible. Si la zona está completamente limpia, pues no hay incisiones ni contacto alguno con la prótesis contaminada, también puede optarse por otro material (Dacron recubierto de plata o PTFE), como en uno de nuestros casos. En el segundo tiempo, y con los miembros ya perfundidos, procedemos a realizar el explante de la prótesis abdominal.
En la literatura no hemos encontrado casos de uso similar de este tipo de prótesis y, sin embargo, pensamos que, si se usan en otros territorios ante situaciones de riesgo de sobreinfección (16-26), en estos casos también tienen su indicación. Los pacientes descritos, a pesar del fatal desenlace de dos de ellos, no presentaron en el tiempo en el que pudieron seguirse ningún tipo de signos inflamatorios que hicieran sospechar sobreinfección en relación con esta prótesis, ni locales ni sistémicos.
En conclusión, pensamos que la realización de un bypass axilofemoral unilateral o bilateral para la revascularización de los miembros inferiores en pacientes con necesidad de realizar explante de una prótesis aortobifemoral por infección de la misma es una opción aceptada y que, a la hora de seleccionar el material, la prótesis biosintética Omniflow II® es una alternativa válida para anastomosis en áreas dudosas, sin problemas de disponibilidad y menos compleja que el uso de otros materiales, como los injertos autólogos (venas superficiales o profundas) o los aloinjertos criopreservados. Al igual que ocurre con el uso de esta prótesis en otras localizaciones o de cualquier otro material de nueva utilización, es necesario recoger datos de diferentes centros para aumentar la experiencia en dicha indicación, pues los registros de un solo centro siempre serán insuficientes para reunir un número significativo de casos.