INTRODUCCIÓN
En la era actual de la medicina basada en la evidencia, las directrices y, por lo tanto, las decisiones clínicas, se basan principalmente en datos proporcionados por ensayos clínicos aleatorizados a gran escala. Aunque estos ensayos proporcionan información relevante sobre la seguridad y la eficacia de los tratamientos, su extrapolación a la práctica clínica a menudo se ve obstaculizada por una limitada validez externa debido a sus estrictos criterios de inclusión y exclusión. Estos criterios solo capturan parcialmente la compleja realidad del paciente, ya que muchas de sus características no pueden tenerse en cuenta. Esto justifica la irrupción de la llamada medicina de precisión, que se define como la aplicación de “tratamientos dirigidos a las necesidades de un paciente individual sobre la base de biomarcadores, características genéticas, fenotípicas o psicosociales que distinguen a un paciente dado de otro con una presentación clínica similar” (1).
La medicina de precisión requiere un manejo clínico centrado en el paciente, orientado a las características únicas de cada individuo, siendo de particular importancia en el momento de la indicación de procedimientos invasivos. En el ámbito de la angiología y la cirugía vascular esto implica la selección del tratamiento adecuado para el paciente adecuado en el momento adecuado. Esto es posible gracias a la aparición de potentes sistemas informáticos que son capaces de almacenar y analizar grandes conjuntos de datos, además de la aplicación de algoritmos refinados que permiten la predicción de los resultados clínicamente (es decir, pronóstico), técnicamente o fisiopatológicamente. Por lo tanto, cabe esperar que la transformación digital de la atención sanitaria mejore la seguridad y la eficacia, pero también la eficiencia, reduciendo el tiempo de toma de decisiones y, a la vez, mejorando la calidad de las decisiones de tratamiento (utilidad frente a la inutilidad) y, por lo tanto, mejore la rentabilidad. El objetivo de este artículo es reflexionar sobre el uso de algoritmos informáticos para implementar la medicina de precisión en el campo de la angiología y cirugía vascular y reflejar cómo la inteligencia artificial (IA) y el modelado computacional avanzado están siendo aplicados en el diagnóstico, la planificación de tratamiento, la innovación y la investigación en angiología y cirugía vascular.
SALUD DIGITAL E INTELIGENCIA ARTIFICIAL: DEFINICIONES
La salud digital se ha definido como el uso de tecnologías digitales para la salud. La digitalización de registros médicos, la telemedicina, la monitorización de pacientes a través de dispositivos móviles (mobile health) o el reclutamiento on line de voluntarios para estudios de investigación son ejemplos de aplicaciones de salud digital en la práctica clínica (2-4). La inteligencia artificial (IA), sin embargo, podría considerarse el ejemplo paradigmático de aplicación de la tecnología digital a la atención de la salud.
La inteligencia artificial se define como la capacidad de una máquina para analizar e interpretar datos externos y aprender de ellos con el fin de lograr objetivos a través de la adaptación flexible (5-7). Se origina a partir de una iniciativa gestada en la Conferencia de Dartmouth, en 1953, durante la que se propuso el desarrollo de computadoras capaces de realizar tareas que requieren “inteligencia humana”. Poco después surgió el concepto de machine learning (ML, 1959) para desarrollar métodos matemáticos, que se aplicó por vez primera en la resolución de problemas lineales. Sin embargo, para los problemas no lineales se introdujeron las redes neuronales, que utilizaban una pequeña pila de capas densamente conectadas. Estas redes neuronales producen una red poco profunda, en la que la señal de entrada fluye a través de las capas hasta la salida. Mediante el uso de varias capas diferentes (por ejemplo, la capa convolucional), ampliando la pila de capas, se desarrollaron redes aún más profundas, introduciendo el concepto de deep learning (DL). El DL tomó gran impulso con la llegada de las unidades de procesamiento gráfico (GPU) utilizadas para la industria del juego (gaming), capaces de procesar grandes cantidades de cálculos aritméticos “de punto flotante” de forma paralela. Por su parte, la IA, y el DL en particular, vieron favorecidos su desarrollo con la aparición de plataformas en la nube como, por ejemplo, Microsoft Azure, que permite el almacenamiento de grandes cantidades de datos que pueden usarse para el desarrollo y la implementación de algoritmos de IA.
El machine learning es un algoritmo de IA avanzada mediante el que la máquina aprende de la experiencia a medida que el rendimiento de una tarea determinada mejora con la retroalimentación de más experiencia. Podemos distinguir entre aprendizaje supervisado, no supervisado o de refuerzo (8) (Fig. 1). El aprendizaje supervisado se basa en el análisis de datos etiquetados por humanos (anotados), en los que la máquina recibe ejemplos de relaciones de entrada y de salida hasta que aprende la función que mejor correlaciona la entrada con la salida etiquetada y, en última instancia, es capaz de predecir la salida de un conjunto de datos sin etiquetar. El aprendizaje no supervisado, por otro lado, se basa en el procesamiento de datos sin etiquetar, minimizando la necesidad de interacción humana mediante la búsqueda de patrones en los datos. Un ejemplo de aprendizaje no supervisado es el análisis de clusters, que se utiliza cada vez más en medicina.
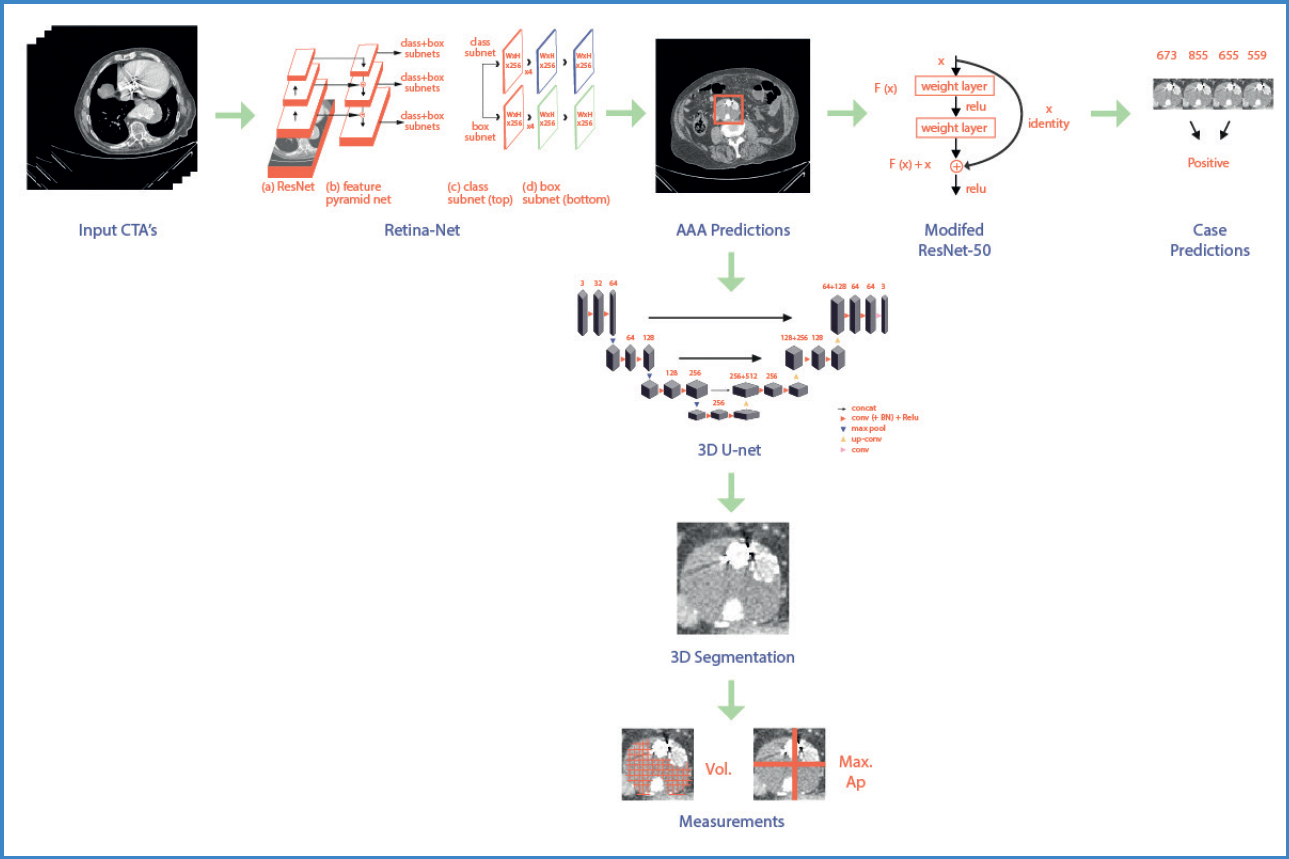
Figura 1. Descripción general del flujo de información que ilustra el uso de tres redes neuronales convolucionales modificadas (CNN). AAA: Aneurisma de la aorta abdominal; TAC: angiografía por tomografía computarizada; 3D: tridimensional. Modificado de Hahn S, et al. Machine deep learning accurately detects endoleak after endovascular abdominal aortic aneurysm repair. J Vasc Surg: Vascular Science 2020;5-12 (8).
El análisis de clusters es una técnica estadística orientada a clasificar a los individuos en grupos (clusters) con una cierta homogeneidad, buscando una posible agrupación natural entre los datos analizados y permitiendo el análisis de un volumen de datos mucho mayor. El aprendizaje de refuerzo combina características de aprendizaje supervisado y no supervisado. Esta área de ML se fundamenta en que los agentes artificiales realizan acciones en un entorno con el objetivo de maximizar algún tipo de recompensa acumulativa (8).
El deep learning es un tipo específico de ML que puede crear las propiedades necesarias para llevar a cabo por sí mismo una tarea dada. Mientras que el ML requiere de ingeniería de propiedades para representar los datos, el DL utiliza la profundidad de capas y la cadena de capas para crear estas propiedades por sí mismo. Las propiedades creadas podrían ser, por ejemplo, un detector de bordes o un detector de calcificación en un angio-CT, pero también pueden incluir propiedades que son ininteligibles para los seres humanos, razón por la que el DL puede considerarse un modelo de caja negra. Sin embargo, la combinación de todas estas propiedades creadas dentro de un modelo de DL puede llegar a generar marcos de decisión no lineales, de los que emanan modelos que se equiparan (o incluso superan) las capacidades de los seres humanos. Por ejemplo, Poplin y cols. (9) publicaron un método para predecir los factores de riesgo cardiovascular a partir de las fotografías de fondo de ojo de la retina utilizando un algoritmo de DL, información que parecía impensable que pudiera extraerse de esta prueba de imagen. La calidad de la salida (output) del DL (o ML) depende de la cantidad, de la calidad y de la diversidad de los datos de entrada (input). Se precisan grandes muestras de datos heterogéneos multivariables a partir de muestras vastísimas de pacientes o poblaciones con características, enfermedades y estados de enfermedad heterogéneos (big data) para alcanzar el objetivo de la medicina de precisión (1). Un problema particular del DL es el riesgo de sobreajuste, definido como la selección crítica de las variables relevantes para un problema dado. Además, la inclusión de una gran cantidad de datos aumenta la complejidad de los algoritmos y el tiempo de procesamiento, particularmente en el aprendizaje supervisado. Por ejemplo, Madani y cols. (10) etiquetaron solo el 4 % de los datos disponibles para algoritmos de deep learning supervisados y semisupervisados para el diagnóstico automatizado de enfermedades cardiacas.
No menos importante es que el DL requiere una potencia de procesamiento considerable que debe alcanzarse con bajos niveles de demanda de energía. Esto puede lograrse mediante computación estocástica o probabilística. A diferencia de la informática convencional, que opera a través de sistemas operados determinísticamente utilizando información en código binario (0 y 1), la computación probabilística utiliza bits probabilísticos (p-bits), que son entidades que interactúan entre sí sobre la base del principio de las redes neuronales humanas.
El modelado computacional avanzado (MCA) puede definirse como el uso de técnicas informáticas para simular y estudiar sistemas complejos, integrando conceptos matemáticos, físicos e informáticos. Así pues, el ensamblaje de técnicas de DL con el MCA actual puede convertirse en un futuro inmediato en la principal ayuda en la toma de decisiones de tratamiento en pacientes con patología vascular y en la planificación de las intervenciones, impulsando de esta forma la medicina de precisión.
INTELIGENCIA ARTIFICIAL Y MODELADO COMPUTACIONAL AVANZADO EN EL DIAGNÓSTICO Y PLANIFICACIÓN DEL TRATAMIENTO EN ANGIOLOGÍA Y CIRUGÍA VASCULAR
Las imágenes cardiovasculares van a cambiar sustancialmente en la próxima década, impulsadas por la revolución del DL. Para los angiólogos y los cirujanos vasculares será importante estar al corriente de estos desarrollos para garantizar que el DL tenga un impacto significativo en nuestra práctica clínica. Y es que un buen tratamiento quirúrgico precisa de un mejor diagnóstico y planificación preoperatorios. En este ámbito, los algoritmos de ML más comunes son las Convolutional Neural Networks (CNN) y, algunos más recientes, las Generative Adversarial Network (GAN) (11). Las CNN son el algoritmo utilizado en el diagnóstico por imagen para dar la capacidad de “ver” al ordenador. Así, Ni y cols. clasificaron hasta 14 tipos de filtros de vena cava inferior (VCI) en radiografías simples con un margen de error de identificación muy bajo y con posibilidad de refinamiento con la ayuda del procesamiento de un mayor número de imágenes (input) durante el supervised learning para mejorar las prestaciones de procesamiento de las capas profundas y su jerarquía (12).
Recientemente se han publicado varios estudios cardiológicos sobre la tomografía de coherencia óptica (TCO) intravascular para la detección de placa aterosclerótica mediante el uso de CNN (13,14). No tardaremos en ver este tipo de algoritmos aplicados a la TOC y el IVUS de vasos periféricos, como ya se esboza en el trabajo de Chamaria y cols. sobre la segmentación tridimensional de la luz utilizando CNN, que permite la evaluación automática de la estenosis arterial valiéndose de imagen multimodal (15).
Las actuales técnicas de procesamiento de imágenes capturan los grandes vasos de manera fiable, pero a menudo no logran preservar con suficiente precisión la conexión en las bifurcaciones y entre pequeños vasos. La adquisición de los árboles vasculares específicos de cada sujeto es un primer paso hacia las simulaciones hemodinámicas del paciente para planificar el tratamiento. La adecuada captura de la conexión del árbol vascular es ciertamente importante para su representación de calidad en mallas de superficie, tanto para su visualización con fines científica como para su impresión 3D.
El advanced computational modeling puede mejorar potencialmente el diagnóstico de las enfermedades vasculares mediante la aplicación de principios de biometría y anatomía vascular sirviéndose del análisis epidemiológico de grandes conjuntos de datos clínicos (big data). Las técnicas de segmentación de imagen se sirven de filtros validados, eliminando así la dependencia del operador y, por tanto, del error humano. Como ejemplo, Hsu y cols. nos presentan una red de angioarquitectura totalmente automatizada de angiografía rotacional 3D, angiografía por resonancia magnética (RM), venografía por RM y angiografía por TAC para su análisis topológico o estadístico (16).
Hirata y cols., por otra parte, han desarrollado un modelo de ML para predecir el crecimiento rápido de los AAA de pequeño tamaño basándose en la angiografía por TAC. Para medir el rendimiento del modelo utilizaron el área bajo la curva (en inglés, AUC) y concluyeron que el ML es un método efectivo para la predicción del riesgo de expansión del AAA (17).
Por último, estamos en camino de poder utilizar estimaciones de movimiento del corazón a partir de un vídeo intraoperatorio aplicadas a la cirugía asistida robótica, eliminando así la necesidad de estabilizadores mecánicos, como puede ser el uso de bomba (18). De forma análoga, no está lejos el día en el que dispondremos de estimaciones del movimiento del cayado aórtico para poder ser utilizadas para un correcto despliegue y ajuste preciso del posicionamiento de un TEVAR.
Podemos también utilizar datos más allá de las imágenes, como las características demográficas de los pacientes o su historial médico previo, para predecir los resultados (complicaciones, mortalidad, estancia hospitalaria media…) de un determinado procedimiento de cirugía endovascular valiéndonos de random forests aplicados a nuestro DL, como demuestra la investigación de Sinha y cols. publicada recientemente en el Journal of Vascular and Interventional Radiology. Estos modelos resultan efectivos cuando se entrenan con un gran conjunto nacional de datos. Resultan altamente eficientes si tenemos en cuenta que todos los inputs del modelo son características que se encuentran disponibles incluso antes del ingreso del paciente. Los datos generados pueden ser utilizados para el entrenamiento, la optimización y la ejecución del propio procedimiento. La precisión de estos modelos va a estar influenciada, sin duda, por el aporte de datos de alta calidad. Para medir el rendimiento de estos modelos se han utilizado el AUC y el score F1, que combina precisión y exhaustividad. Es inimaginable lo que la inteligencia artificial aplicada a diferentes campos de la medicina puede lograr siempre y cuando se alcance el compromiso de almacenar grandes conjuntos de datos y de desarrollar infraestructuras que admitan su intercambio. En esta línea, la implementación multiplataforma de modelos de IA y el desarrollo de algoritmos darán paso irremisiblemente a la nueva era de la medicina de precisión (19).
La realidad aumentada y la realidad mixta, esta última más reciente, surgen como tecnologías interactivas de visualización. La imagen es absolutamente esencial como guía en cualquiera de nuestros procedimientos. En una revisión realizada por Park y cols. se revelan las aplicaciones actuales y futuras de visualización tridimensional en procedimientos de radiología intervencionista. Estas tecnologías pueden fusionar objetos virtuales, en 2 o 3 dimensiones, con el mundo real. Aplicando la realidad aumentada o mixta, las imágenes médicas pueden ser más accesibles y mostrarse en un espacio tridimensional real durante los propios procedimientos o en la planificación para optimizar las indicaciones (20).
La era de la cirugía endovascular ha traído consigo consustancialmente un detrimento en nuestra experiencia en cirugía abierta. En esta nueva era que afrontamos –la era de la IA–, la realidad aumentada supondrá una útil herramienta, haciendo que las imágenes del angio TAC preoperatorio cobren vida, lo que permitirá al cirujano ver a través de la piel del paciente y apreciar la anatomía subyacente sin hacer ni una sola incisión, ayudando así a la identificación precisa de la lesión, a la disección y a la ejecución técnica, lo que disminuirá los tiempos y las eventuales complicaciones. Esto se consigue mediante la separación de volúmenes de estructuras óseas, cutáneas, tejidos blandos y vasculares usando paquetes de software de segmentación complementarios convertidos en modelos poligonales, renderizados por una aplicación dentro de la pantalla estéreo HoloLens™ montada en la cabeza del cirujano y asistiendo a través de comandos de voz (21).
Los procedimientos guiados por tomografía computarizada de haz cónico tienen mayor precisión y menor dosis de radiación que las TAC convencionales. Mediante una rotación alrededor de los pacientes se adquiere el conjunto de datos tridimensional necesario para planificar la trayectoria de la aguja y pinchar el ostium de una endofuga de tipo II a nivel lumbar o hipogástrico (donde el éxito del tratamiento endovascular se ha demostrado limitado), con gran fiabilidad y efectividad y sin peligro de perforar estructuras vitales de forma inadvertida. Una vez puncionado pueden introducirse microcatéteres para embolizar el origen de vasos ramificados o el saco aneurismático y ocuparlo con agentes trombogénicos o pegamento (22,23). Gracias a la IA, la combinación de la TAC de haz cónico con el arco en C en nuestros quirófanos inteligentes puede aportar avances muy importantes en el desempeño de nuestra especialidad.
La IA tiene también aplicación en nuestro laboratorio vascular. Lorintiu y cols. proponen un método que reconstruye la señal Doppler segmento a segmento, estimando el flujo sanguíneo en el territorio femoral y carotídeo, utilizando una reconstrucción de detección comprimida basada en algoritmos de aprendizaje bayesiano disperso en bloque. Este estudio presenta como limitación que no alcanza tasas de velocidad necesarias para obtener estas reconstrucciones a tiempo real debido a la gran cantidad de datos y a la complejidad del algoritmo (24).
¿Cómo conseguirlo?
La pandemia global por la COVID-19 ha incidido aún más en la necesidad de optimización, colaboración y conectividad entre núcleos generadores de información y probablemente acelerará la transición a la transformación de la salud digital para aportar valor y calidad a la atención del paciente con el desarrollo de una práctica clínica más eficiente. Comenzar con éxito este cambio puede resultar un completo desafío, difícil y costoso. La adopción de una plataforma basada en la nube puede proporcionar una administración efectiva de datos e imágenes (DICOM y no DICOM) a largo plazo, lo que permitirá a los proveedores de atención médica acceder a ellos para su revisión de forma rápida y remota y colaborar con otros proveedores de atención en diferentes ubicaciones. Además, podría proporcionarse a los pacientes un mayor acceso a su información clínica. Una limitación real a la implantación de estos avances es no conseguir implantar de forma generalizada esta plataforma y tener que lidiar con los sistemas de tecnología de información local de cada hospital. Es un movimiento en el que se encuentra todo el ecosistema de la atención médica y que pretende evitar las pérdidas de tiempo y de recursos de los sistemas de salud actuales, en los que no solo cada hospital, sino muchas veces cada departamento, tiene su propio sistema tecnológico de información. Con la integración de todos los sistemas de información ya no será necesario desarrollar motores de IA capaces de generar algoritmos para identificar imágenes e interpretar datos relacionados, motores de seguimiento de ajustes de IA que rastreen los cambios y preferencias del médico, motores de ML de diferentes tipos (supervised, unsupervised, reinforcement or semisupervised learning) o motores de comunicación que permiten ser interrogados, aceptados o modificados. Definitivamente, lo que pondrá en órbita todo nuestro potencial será un ensamblador de motores que orqueste al resto y que analice los datos resultantes para influir en intervenciones a tiempo real. Hay tanta información y en tantos puntos que, sencillamente, se pierde por no estar interconectada.
¿Por qué es importante utilizar la inteligencia artificial en la planificación preoperatoria?
Del mismo modo que todos deseamos que el piloto tenga experiencia y nos lleve a nuestro destino de manera segura sin reparar en los costes de un simulador de vuelo, los pacientes desean lo mismo con su cirujano. Los pilotos llevan décadas sirviéndose de la IA en forma de realidad aumentada y ahora de realidad virtual, haciendo que la experiencia sea más real y mejorando así su planificación y su capacitación en vuelo. Esta herramienta se utiliza por los pilotos en su aprendizaje, pero también por pilotos expertos para hacer frente a situaciones especialmente estresantes de forma eficaz. Esto solo se consigue cuando la situación deja de concebirse como una amenaza para pasar a considerarla un auténtico desafío (25). De la misma forma, en la angiología y cirugía vascular la aplicación de la IA a la planificación y al entrenamiento de los procedimientos supone un verdadero avance. El simulador permite aprender sin límite de repetición, mejorando la respuesta al estrés.
INTELIGENCIA ARTIFICIAL Y NUEVOS TRATAMIENTOS EN CIRUGÍA VASCULAR Y ENDOVASCULAR
Si bien la planificación preoperatoria no se concibe sin la ayuda de software de procesado tridimensional de imagen médica, el tratamiento quirúrgico en sí ha tardado más en contar con soluciones tecnológicas de alta complejidad, más allá de las que ofrecen los propios equipos radiológicos. En la actualidad, cada vez es más frecuente la integración de imagen tridimensional en los procedimientos endovasculares mediante tecnologías de fusión que permiten ahorrar contraste, tiempo quirúrgico y exposición a la radiación. A este respecto, aparte de las posibilidades que integran las salas híbridas más modernas (fundamentalmente, Philips Healthcare, General Electric Healthcare, Siemens Healthineers y Toshiba Medical), comienzan a aflorar soluciones comerciales basadas en segmentación automática de imagen 3D y reconocimiento automático de landmarks anatómicos para integrar tecnología de fusión de imagen en cualquier arco en C. El sistema Cydar RTRS EV (Cydar Medical, Cambridge, Inglaterra) genera de forma automática una máscara tridimensional del vaso a tratar a partir de la imagen DICOM preoperatoria y ajusta su posición con los cambios posturales del paciente, tomando como referencia el marco óseo. Haciendo uso de tecnologías de inteligencia artificial (IA) integradas en la nube (Cydar Cloud Vault), permite incluso corregir de forma dinámica la deformación que experimenta la anatomía vascular al introducir guías rígidas o dispositivos (34). En esta misma dirección, existen sistemas aún experimentales (CustusX, NCCUIGT, Noruega) para la navegación endovascular ayudada por posicionamiento electromagnético de catéteres (35,36) y también comienzan a implementarse algoritmos basados en redes neuronales para la identificación automática de estructuras (pared arterial, adventicia…) en ecografía intravascular (IVUS) (26,27).
Por otro lado, el uso de tecnología quirúrgica robótica aún no ha desarrollado todo su potencial en cirugía vascular. El guiado robotizado de catéteres ofrece grandes ventajas, minimizando el contacto con la pared arterial y el uso de contraste. Se consigue así una especie de “piloto automático”, capaz de posicionar el material endovascular en el punto deseado con predictibilidad completa de su trayectoria (28). Existen fundamentalmente dos sistemas en la actualidad, Magellan (Hansen Medical Inc., Mountain View, CA, Estados Unidos) y CorPath (Corindus Vascular Robotics, Waltham, MA, Estados Unidos), y algún modelo experimental basado en la movilización del catéter mediante electroimanes externos al paciente (29). En la actualidad, todos los sistemas se basan en la estructura maestro-esclavo, en la que es el cirujano quien indica al robot los pasos a seguir, beneficiándose de su mayor precisión de movimientos. La interacción cirujano-robot puede beneficiarse del reconocimiento automático de gestos mediado por IA (30). En un futuro inmediato podrán aplicarse redes neuronales convolucionales para que el robot aprenda de los movimientos del cirujano y pueda replicarlos de forma autónoma (31). Esta tecnología será también válida para las técnicas de laparoscopia asistida por robot (RAS), con un papel aún por determinar en los procedimientos vasculares complejos.
INTELIGENCIA ARTIFICIAL EN INVESTIGACIÓN VASCULAR
La medicina basada en la evidencia topa, en toda la práctica quirúrgica, con dificultades técnicas y éticas añadidas para aleatorizar pacientes y comparar entre opciones o procedimientos en condiciones de igualdad. Por ello, los estudios observacionales suponen el grueso de la producción científica en las especialidades quirúrgicas. Sin embargo, incluso los estudios observacionales de mayor calidad, basados en registros amplios y rigurosos, sufren problemas de calidad, sesgos, errores de medida o duplicidad. La inteligencia artificial permite un nivel de precisión, de profundidad y de automatización en el tratamiento de datos llamado a acercarse, en muchos casos, a la calidad de la evidencia aleatorizada en aquellos casos en los que esta no pueda obtenerse.
En los últimos años, diversos trabajos han puesto de manifiesto la utilidad de las técnicas de IA en la predicción de resultados en cirugía vascular, sobre todo en cirugía aórtica. En todos ellos, el uso de procedimientos de machine learning –fundamentalmente redes neuronales de una o varias capas– ha permitido superar la capacidad predictiva de los procesos de regresión tradicionales. Así se demuestra en algunos artículos encaminados a predecir la mortalidad intrahospitalaria tras la reparación programada de aneurismas de aorta abdominal, utilizando perceptrones multicapa y redes bayesianas y consiguiendo resultados con áreas bajo la curva de 0,869 (32) y precisiones de más del 95 % (33). Resultados similares se han obtenido para la mortalidad intrahospitalaria del aneurisma roto empleando redes neuronales con hasta 12 variables de entrada y superando en su desempeño a escalas clásicas como el Glasgow Aneurysm Score (34). La precisión en los últimos estudios llega al 98,5 % (35).
Por otro lado, el grupo de Alan Karthikesalingam, del St. George’s Vascular Institute de Londres, ha dedicado una línea de trabajo a la aplicación de redes neuronales bayesianas sobre el riesgo de reintervención a cinco años tras EVAR. Los resultados parecen prometedores, superando ampliamente a la capacidad predictiva de la regresión de Cox y permitiendo integrar con precisión hasta 19 variables, incluyendo datos anatómicos (36-38). También puede encontrarse en la literatura algún intento de modelizar el riesgo vascular a largo plazo en pacientes con enfermedad coronaria y enfermedad arterial periférica (EAP). El uso de machine learning superó de nuevo la capacidad predictiva de los modelos de regresión tradicionales, tanto para identificar pacientes con EAP (AUC 0,87 frente a 0,76, p = 0,03) como para predecir la mortalidad a largo plazo (AUC 0,76 frente a 0,65, p = 0,10) (39).
Las técnicas de AI son una herramienta coral, aplicable a casi cualquier campo de la investigación básica y clínica. En cirugía vascular se han aplicado con éxito en la integración de estudios genómicos y fenotipos clínicos del aneurisma de aorta (AAA). Mediante el sistema HEAL –un entorno de aprendizaje máquina–, el equipo de Li y cols. (2018) estudiaron la interacción de 60 genes y variables de estilo de vida para predecir el riesgo de desarrollar un AAA (40). También se han empleado técnicas de aprendizaje máquina en la identificación de genes claves para el desarrollo de la disección de aorta tipo A (41) y de enfermedad aterosclerótica general en un modelo murino (42). La IA supone también un avance significativo para simplificar procesos computacionales complejos de simulación sobre el comportamiento elástico de las arterias y la interacción entre flujo y pared. Así, se ha utilizado para mejorar y predecir la distribución del estrés de pared tanto en el AAA como en la bifurcación carotídea (43), para calcular de forma automática el grosor de la pared carotídea y aórtica, para calcular la velocidad de la onda de pulso en la aorta a partir de determinaciones de fotopletismografía periférica (44) o para simular el flujo en el AAA con herramientas de data mining (técnicas para extraer información de un conjunto de datos y transformarla en una estructura comprensible para su uso posterior) (45). Por otro lado, y en un campo de especial interés, están aplicándose herramientas de IA y machine learning para simular el comportamiento de las endoprótesis en anatomías tortuosas, donde su disposición final es menos predecible, mediante modelos completamente in silico (simulados en un modelo informático, sin soporte físico) (46,47) . De esta forma no solo se garantiza una mayor precisión, sino que se ahorran importantes costes experimentales.
Finalmente, la IA puede no solo ayudar a crear nuevos modelos predictivos, sino también generar herramientas que revolucionen la recogida de datos. Las historias clínicas digitales, los datos analíticos y los informes de pruebas radiológicas pueden analizarse con un software capaz de interpretar el lenguaje natural (natural language processing o NLP) y convertirlo en términos clasificables (48). Existen algunos sistemas en desarrollo (caTIES [49] y MedLEE [50]) y comienzan a aflorar iniciativas empresariales como SavanaMed (Madrid, España), que ponen esta tecnología a disposición del investigador.
SUMARIO Y CONCLUSIONES
La aplicación de técnicas de inteligencia artificial (AI) en angiología y cirugía vascular está empezando a jugar un papel importante en el análisis automatizado de imagen, en los modelos de predicción de crecimiento y en la asistencia a procedimientos endovasculares (eventualmente robóticos), tanto en su planificación como en su ejecución. Además, la simulación y los modelos predictivos ven incrementada su capacidad gracias a esta herramienta. Sin embargo, en nuestro medio la aplicación de estas nuevas tecnologías puede verse limitada por la ausencia de equipos multidisciplinares, con contacto y traslación entre informática/ingeniería y medicina clínica, y por la falta de incentivo innovador por parte de la Administración.














