INTRODUCCIÓN
Es muy frecuente que cuando leemos un artículo pasemos por alto el método y nos fijemos más en las conclusiones. Pero el fin no justifica los medios, sobre todo en el método científico, en el que llegar o no a un resultado depende de cómo evaluemos los datos obtenidos.
Además, cuando buscamos datos sobre un aspecto concreto nos llevamos la desagradable sorpresa de que según quien escriba los resultados son unos o los contrarios: ¿cirugía abierta del AAA o EVAR? ¿Cirugía de la estenosis carotídea o stent carotídeo? Tenemos de todo y para todos los gustos. Pida usted, que le será concedido.
Sin embargo, con el fin de minimizar la variabilidad en los resultados y para aunar conclusiones, tenemos a nuestra disposición una potente herramienta metodológica (que no infalible): las revisiones sistemáticas; mejor aún, los metaanálisis.
Un metaanálisis es, para nosotros los profanos, un diseño epidemiológico que permite analizar estadísticamente los diferentes estudios publicados aunando sus resultados, como si se tratara de uno solo que recogiera y sintetizara la información. Es probable que conozcas sobradamente estos conceptos. Este texto solo pretende ayudar a los que no tenemos mucho conocimiento sobre este tema, pero queremos analizar correctamente los gráficos y los resultados de un metaanálisis.
Para intentar comprender juntos esto, vamos a compartir la lectura desenfadada y práctica de un metaanálisis publicado en 2018 sobre el empleo de estatinas en pacientes portadores de un AAA (1,2).
OBJETIVO
“The aims of this systematic review and meta-analysis are to summarize and mathematically synthesize the available medical literature regarding the effects of statins on AAA growth, rupture, and elective perioperative mortality”.
El objetivo del estudio es evaluar el resultado de las estatinas sobre diferentes aspectos de los AAA. Fijémonos que la frase anterior recoge la esencia ya comentada del metaanálisis: sintetizar con cocina estadística los resultados de diferentes diseños para sacar una única conclusión.
MÉTODO
Search strategy and selection criteria
“We conducted a systematic review of the medical literature according to the 2009 Preferred Reporting Items for Systematic Reviews and Meta-Analyses statement guidelines”.
Todo metaanálisis se caracteriza por la búsqueda apropiada de los mejores diseños. Necesitamos quedarnos con los mejores y eliminar los peores estudios o los que no se ajustan a los criterios de nuestra búsqueda. Esta “selección natural” sigue unos criterios o pautas establecidos por las normas PRISMA, acrónimo de Preferred Reporting Items for Systematic Reviews and Meta-Analyses statement guidelines (Fig. 1).
En este punto debe informarse sobre las bases de datos en las que se ha realizado la búsqueda bibliográfica, así como sobre los términos que se han empleado para dicha búsqueda.
Data collection and analysis
Como hemos comentado previamente, la esencia de un metaanálisis es la combinación estadística de los datos incluidos a partir de diferentes estudios. Podemos afirmar que hay dos formas diferentes de hacer este análisis estadístico dependiendo de la homogeneidad o de la heterogeneidad de los estudios incluidos; es decir, de lo “parecidos” que sean entre sí los estudios incluidos. Si los estudios son homogéneos, entonces hacemos un “análisis de efectos fijos o fixed”. Si por el contrario los estudios son heterogéneos, el análisis que se realiza se denomina de “efectos aleatorios o random”. Cada uno de estos análisis sirve para dar un intervalo de confianza del 95 % al resultado final, que es más preciso (aparecerá en el gráfico más estrecho o pequeño) en el caso de los efectos fijos.
Probablemente te estarás preguntado cómo saber si los estudio son homogéneos o no para saber qué tipo de análisis, fixed o random, debe hacerse. Esto nos lo van a decir 2 parámetros diferentes en los que debemos fijarnos:
p de heterogeneidad: cuando es inferior a 0,1, indica diferencia entre estudios; es decir, heterogeneidad.
I2: se trata de un porcentaje que mide la heterogeneidad de los estudios incluidos. Suele considerarse que un valor superior al 35 % implica heterogeneidad.
Es decir, amigo lector, que siempre que veamos un valor p de heterogeneidad pequeño veremos un I2 grande, ya que ambos implican que existe heterogeneidad en los estudios incluidos.
A estas alturas estoy seguro de que necesitamos un buen cóctel para digerir esta lectura. Si a todos nosotros nos pidieran hacer uno con los mismos ingredientes, es muy probable que cada uno hiciera un cóctel diferente. ¿Por qué? Seguro que cada uno añadiría una cantidad diferente de los ingredientes, lo que condicionará el sabor final. Pues esto también le pasa al metaanálisis. Los estudios incluidos condicionan el resultado final, de forma que los estudios de mayor tamaño muestral tienen un mayor efecto en este (aunque también influyen otros aspectos que quizá excedan las pretensiones de esta lectura). Se denomina peso o weight al parámetro que analiza la importancia de cada estudio en el resultado del metaanálisis, de forma que cuanto mayor peso, mayor relevancia tiene dicho estudio en el resultado final.
Fijémonos ahora en el gráfico más importante de un metaanálisis, que se denomina diagrama de bosque o forest plot (Fig. 2).
El forest plot nos permite, de forma visual, tener una información completa y absoluta del metaanálisis. Vamos a analizarlo por partes:
Weight. Como hemos dicho antes, indica cuánto contribuye cada uno de los estudios en el resultado global.
En azul hemos marcado el parámetro que está midiéndose. En este caso, la diferencia media. Sobre el valor nulo o empate, en este caso el 0, se representa un eje vertical. Este eje es esencial, ya que, si cualquiera de los intervalos lo toca, el resultado será no significativo.
-
En naranja hemos representado el valor final del metaanálisis que debemos analizar a partir de la información de:
- El diamante: representa el intervalo de confianza al 95 %. Como vemos, en este caso no toca el eje vertical que se origina en el 0. Por ello, afirmamos que el IC (intervalo de confianza) sí es significativo.
- El intervalo de confianza numérico: aunque antes ya veíamos que el IC no toca el eje vertical, también tenemos disponibles los resultados de forma numérica: -0,82, IC 95 % (de -1,32 a -0,33). Nuevamente diremos que la reducción en la tasa de crecimiento de los AAA es significativa, ya que el IC no incluye el nulo, que como hemos dicho en este caso es el 0.
-
- Resultado del test estadístico (test for overall effect): en este caso, asumimos resultados estadísticamente significativos si la p es menor de 0,05. En este caso, el valor de p obtenido es 0,001.
Como vemos, las 3 formas de información son diferentes, pero convergen en el resultado, y este es que podemos afirmar que los pacientes tratados con estatinas tienen un menor ritmo de crecimiento de los AAA.
Heterogeneity. Antes hemos hablado de la importancia de saber si los estudios incluidos son homo- o heterogéneos. En rojo está marcado todo lo que nos informa de este aspecto: la p de heterogeneidad y el parámetro I2. En este caso, la p de heterogeneidad es < 0,00001 y el I2 es 86 %, lo que indica, según hemos comentado antes, que los estudios incluidos son muy diferentes los unos de los otros, lo que puede limitar la validez de los resultados. Como asumimos heterogeneidad, el análisis estadístico apropiado es el de efectos aleatorios o random, como figura encima del eje vertical.
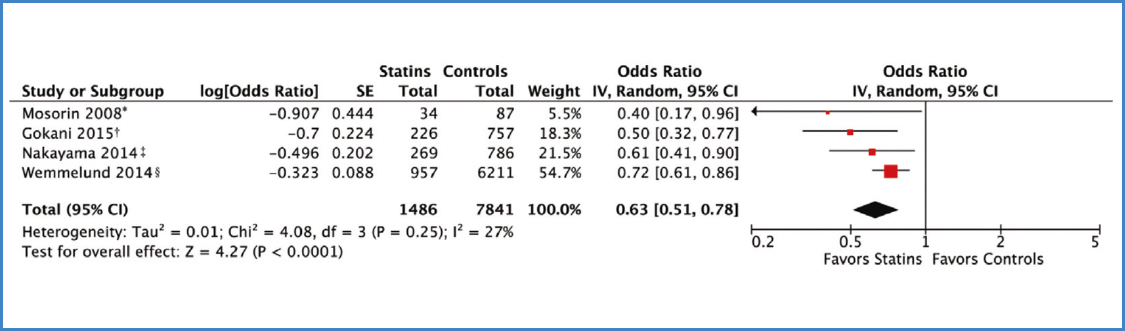
Llegados a este punto, creo que podemos interpretar adecuadamente la figura 3 sobre la relación de estatinas y riesgo de ruptura.
Existe una asociación estadísticamente significativa entre ambas variables, como indica el valor de p de overall effect: el IC total que no incluye el nulo (el 1 por tratarse de la OR) y el diamante que no toca el eje vertical. En este caso no hay heterogeneidad en los estudios incluidos, como indica el valor p de heterogeneity (mayor de 0,1) y el valor de I2 (menor del 35 %). Alguno podrá preguntarse entonces si ha sido adecuado emplear random, como indica la leyenda del gráfico encima del eje vertical. La respuesta es que no es erróneo, aunque quizá habría sido mejor y se habría obtenido un IC 95 % más estrecho si se hubiera hecho fixed.
Pero los metaanálisis no son infalibles, ya que podemos incurrir en un sesgo de publicación que, en síntesis, consiste en no incluir en el análisis los estudios no estadísticamente significativos, que suelen ser los de menor tamaño muestral.
La forma gráfica en la que vemos si existe este sesgo es mediante la interpretación de un diagrama de embudo o funnel plot (Fig. 4).
La imagen habitual de un funnel plot es la de un embudo que incluye dentro una serie de puntos que representan a cada uno de los estudios incluidos en el metaanálisis.
En el eje de abscisas se sitúa siempre el parámetro que está analizándose en los estudios. En el caso de la figura 4, la odds ratio. En el eje de ordenadas, el error estándar del logaritmo del parámetro que se mide. Todos tranquilos. El eje de ordenadas tiene, indirectamente, ordenados todos los estudios en función del tamaño muestral. En la parte de arriba, los de mayor tamaño muestral (menor error estándar) y en los de abajo, los de menor tamaño muestral (mayor error).
Sospechamos sesgo de publicación cuando faltan puntos en una de las bases de ese embudo porque, como dijimos, lo que suele no incluirse en el meta- análisis son los estudios de menor tamaño muestral. Es decir, que a partir del gráfico de la figura 4 parece que sí hay un sesgo por exclusión de estudios en los que las estatinas se asociarían a mayor riesgo de ruptura.
Si todavía sigues leyendo y no has abandonado es que el tema del metaanálisis verdaderamente te interesa. Sin duda, el metaanálisis es muchísimo más, pero con lo que hemos visto creo que podremos enfrentarnos a la lectura e interpretación de cualquiera de ellos y no nos temblará el pulso cuando afirmemos que hay poca heterogeneidad, que el resultado no es significativo o incluso que los autores han hecho un estudio con elevada probabilidad de sesgo de publicación.