INTRODUCCIÓN Y OBJETIVOS
La enfermedad de la COVID-19, causada por el virus SARS-CoV-2, fue declarada pandemia mundial por la Organización Mundial de la Salud en diciembre de 2019. Las manifestaciones clínicas más frecuentes son de tipo respiratorio y habitualmente consisten en fiebre, tos, disnea o hallazgos en la radiología torácica. No obstante, la infección por SARS-CoV-2 puede cursar con afectación sistémica y provocar un fallo multiorgánico al producir daño cardiaco, síntomas gastrointestinales o alteraciones de la coagulación, entre otros síntomas (1,2). Además, se estima que el 5 % de los pacientes con COVID-19 han necesitado ingreso en una Unidad de Cuidados Intensivos (UCI) (1), con un riesgo incrementado de sufrir fenómenos tromboembólicos o hemorrágicos que empeoran el pronóstico.
Se conoce la relación entre el SARS-CoV-2 y los fenómenos trombóticos. Del mismo modo, existe cierta asociación también con los fenómenos hemorrágicos. Recientemente se han publicados varios casos de hematomas retroperitoneales espontáneos (HRE) en pacientes con enfermedad COVID-19 severa probablemente relacionados con la coagulopatía que sucede a consecuencia del daño endotelial y con el síndrome de respuesta inflamatoria sistémica (SIRS) secundario a la infección (3-5).
El objetivo de este estudio fue profundizar en la asociación entre los HRE y la COVID-19, la etiopatogenia subyacente y las experiencias reflejadas en la literatura.
DESARROLLO
Método
Se realizó una revisión sistemática de la literatura fundamentada en la búsqueda de artículos que comunicasen la presencia de HRE en el contexto de infección severa por SARS-CoV-2. Para ello, se diseñó una estrategia de búsqueda combinando diferentes términos en las principales bases de datos bibliográficas: OVid, MEDLINE, PubMed, Cochrane Library y ScienceDirect. Como estrategia secundaria se realizó una búsqueda inversa en la bibliografía citada en los artículos previamente seleccionados. Durante el proceso de búsqueda se empleó el software Zotero para la gestión de las referencias bibliográficas.
El proceso de revisión se desarrolló acorde a las recomendaciones de la declaración PRISMA (6). Los descriptores para la búsqueda de artículos incluyeron los términos MeSH y términos libres: “retroperitoneal hemorrhage”, “retroperitoneal hematoma”, “SARS-CoV-2” y “COVID”. Se empleó como operador booleano [and], realizando las siguientes combinaciones de términos: “retroperitoneal hemorrhage [and] SARS-CoV-2”, “retroperitoneal hemorrhage [and] COVID”, “retroperitoneal hematoma [and] SARS-CoV-2” y “retroperitoneal hematoma [and] COVID”. No se estableció ninguna restricción respecto a los formatos de publicación. No se establecieron restricciones por idioma. La búsqueda bibliográfica se llevó a cabo entre junio de 2021 y febrero de 2022. Se incluyeron artículos publicados hasta el 31 de diciembre de 2021. El protocolo de selección de estudios incluyó, en primer lugar, el examen por título y resumen por parte de un revisor y el descarte de aquellos manuscritos irrelevantes con base en su valoración. En segundo lugar, se llevó a cabo por parte de dos revisores la lectura del texto completo de los potencialmente relevantes y se realizó un informe de cada uno de los estudios seleccionados. Por último, al menos tres revisores participaron en la toma definitiva de decisiones sobre la inclusión de cada uno de los estudios leídos por completo con base en sus características y en su contenido. Los desacuerdos sobre la inclusión de estudios se resolvieron mediante discusión y, en casos seleccionados, con la mediación de un cuarto revisor. Posteriormente, se trataron de sintetizar las características e ideas fundamentales de los estudios, para lo cual tres de los autores llevaron a cabo el proceso de gestión de la información y posterior redacción del manuscrito, que fue revisado en sus diferentes fases por todos los miembros del grupo de trabajo.
Análisis estadístico
Las variables cuantitativas se describieron usando la mediana y el rango o la media y su desviación estándar, mientras que las variables cualitativas se describieron como porcentajes. Las curvas de incidencia acumulada y de supervivencia se estimaron empleando el método de Kaplan-Meier. Se estimó la incidencia acumulada, como el intervalo temporal entre la fecha del diagnóstico de enfermedad por COVID-19 y la fecha del diagnóstico del HRE. La supervivencia se definió como el intervalo temporal entre el diagnóstico del HRE y el fallecimiento (en los casos en los que no constó la comunicación del exitus se asumió la supervivencia respecto al episodio referido en las publicaciones). Se realizó una representación gráfica de ambos parámetros. Para ello, todos los análisis se realizaron con el programa estadístico R (versión 4.0.1): A language and environment for statistical computing. R Foundation for Statistical Computing (Viena, Austria).
RESULTADOS
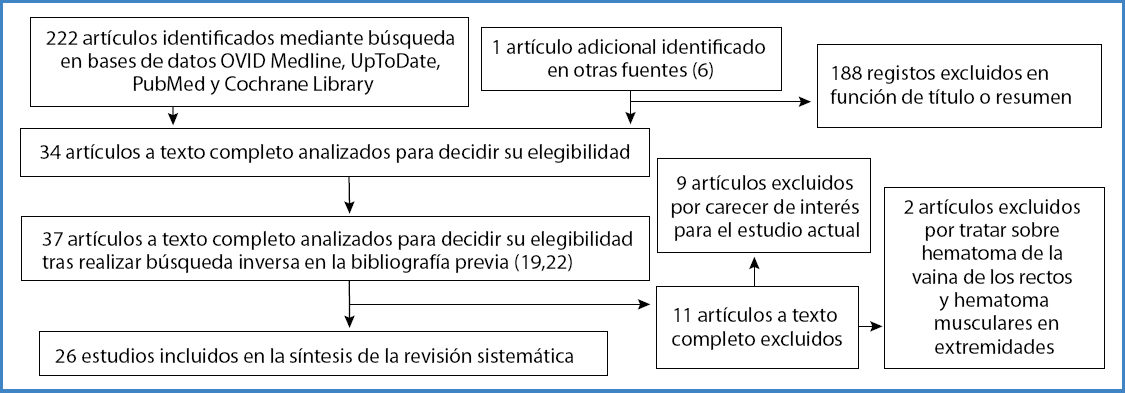
El proceso de revisión sistemática permitió identificar 222 artículos compatibles con los términos de búsqueda. Se realizó un cribado por título y resumen de todos ellos y se seleccionaron 34 textos completos para su lectura crítica. La búsqueda inversa en la bibliografía de estos artículos permitió identificar tres publicaciones más (19,22,24). Del total de manuscritos elegibles se descartaron 188 en la primera fase de revisión y 11 más tras la lectura completa del texto. 9 de ellos se descartaron por carecer de interés para el estudio que nos ocupa y otros 2 se excluyeron por tratarse exclusivamente de hematomas de la vaina de los rectos o hematomas musculares en las extremidades. Finalmente, se incluyeron 26 manuscritos que contenían casos de HRE en pacientes con la COVID-19 de acuerdo a los requisitos establecidos de búsqueda. En todas las publicaciones incluidas en esta revisión la recogida de datos se realizó de manera retrospectiva. De la totalidad de manuscritos incluidos, 15 son series retrospectivas de casos, 2 revisiones no sistemáticas de la literatura, 2 guías clínicas y 6 estudios retrospectivos observacionales, de los que 4 son multicéntricos. El diagrama de flujo correspondiente al proceso de revisión sistemática se muestra en la figura 1.
En total, se identificaron 32 casos publicados de pacientes con neumonía por SARS-CoV-2 que durante el ingreso presentaron el diagnóstico de HRE. La tabla I muestra los aspectos demográficos de los casos recogidos y las principales características respecto a los hematomas, así como datos sobre el diagnóstico, el tratamiento y la evolución de la COVID-19.
Tabla I.
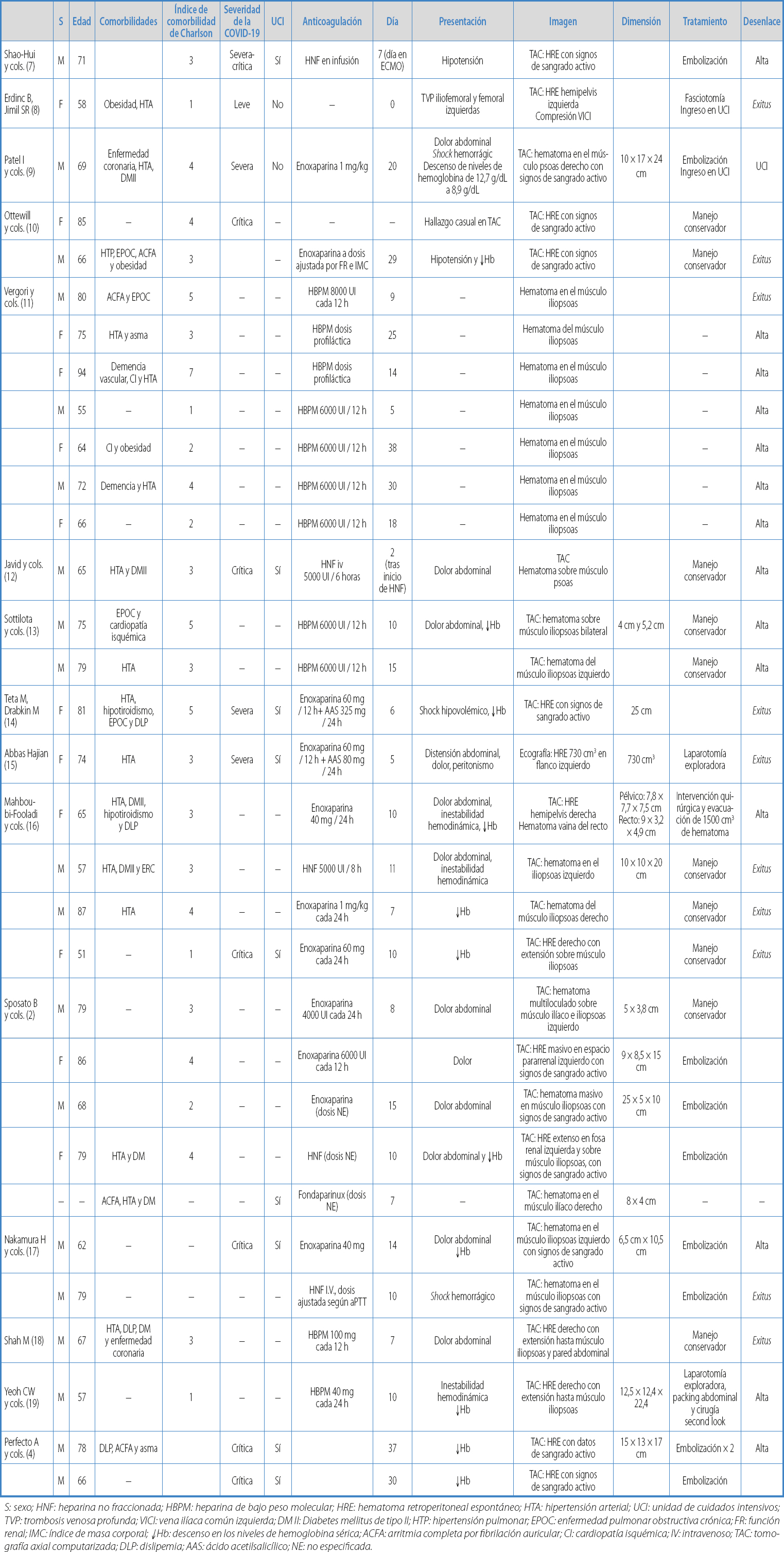
S: sexo; HNF: heparina no fraccionada; HBPM: heparina de bajo peso molecular; HRE: hematoma retroperitoneal espontáneo; HTA: hipertensión arterial; UCI: unidad de cuidados intensivos; TVP: trombosis venosa profunda; VICI: vena ilíaca común izquierda; DM II: Diabetes mellitus de tipo II; HTP: hipertensión pulmonar; EPOC: enfermedad pulmonar obstructiva crónica; FR: función renal; IMC: índice de masa corporal; ¯Hb: descenso en los niveles de hemoglobina sérica; ACFA: arritmia completa por fibrilación auricular; CI: cardiopatía isquémica; IV: intravenoso; TAC: tomografía axial computarizada; DLP: dislipemia; AAS: ácido acetilsalicílico; NE: no especificada.
La mediana de edad fue de 71 años (rango de 51-94 años) y 19 pacientes (59,3 %) fueron hombres. Las comorbilidades más frecuentes fueron la hipertensión arterial (HTA) (47 %) y la diabetes mellitus de tipo 2 (DM2) (25 %). La mediana del índice de comorbilidad de Charlson fue de 3 (rango 1-7). En cuanto a la severidad de la infección por SARS-CoV-2, 9 pacientes (28,1 %) presentaron enfermedad severa-crítica, de los que todos ellos requirieron ingreso en UCI. En un paciente (3,1 %), la enfermedad se categorizó como leve-moderada. Cabe mencionar que en 22 casos (68,8 %) no se especificó el grado de severidad de la enfermedad. Únicamente en un paciente (3,1 %) se señaló la necesidad de terapia con membrana de oxigenación extracorpórea (ECMO).
En relación con la pauta de anticoagulación, en 22 pacientes (68,8 %) consta la recepción de tratamiento con heparina de bajo peso molecular (HBPM): 8 a dosis profiláctica (25 %) y 11 a dosis terapéutica (34,4 %), mientras que 5 pacientes (15,6 %) se trataron con heparina no fraccionada (HNF). Además, se recoge que en 2 pacientes (6,2 %) se añadió antiagregación con ácido acetilsalicílico (AAS). Las dosis empleadas se especifican en la tabla I.
La mediana de días de ingreso hasta el diagnóstico del HRE fue de 10,5 (rango de 0-38 días). La curva de incidencia acumulada se muestra en la figura 2. El síntoma más frecuente fue el dolor o la presencia de una masa abdominal (37,5 %). Por otra parte, en 12 casos (37,5 %) también se objetivó un descenso de los niveles séricos de hemoglobina al diagnóstico y 6 pacientes (18,8 %) presentaron datos de inestabilidad hemodinámica o shock hipovolémico. La confirmación diagnóstica se realizó mediante tomografía computarizada (TC) en 24 casos (75 %) y ecografía en 1 caso (3,1 %). Únicamente en un paciente (3,1 %) el diagnóstico de HRE se debió a un hallazgo casual en la TC.
En cuanto a las principales características del HRE, se describen 14 hematomas en el propio espacio retroperitoneal (43,8 %) y 18 hematomas del músculo iliopsoas (56,2 %). En 11 de ellos (34,4 %) se objetivaron hallazgos de sangrado activo en la TC contrastada, de los que 10 requirieron angioembolización. En 10 casos (31,2 %) se realizó un manejo conservador del HRE mediante fluidoterapia, transfusión de hemoderivados, fármacos vasoactivos y control de la coagulación. Únicamente 4 pacientes (12,5 %) requirieron intervención quirúrgica. Por otra parte, 9 pacientes (28,1 %) se encontraban en la UCI en el momento del diagnóstico del HRE, mientras que 2 (6,3 %) requirieron ingreso en la UCI tras su diagnóstico.
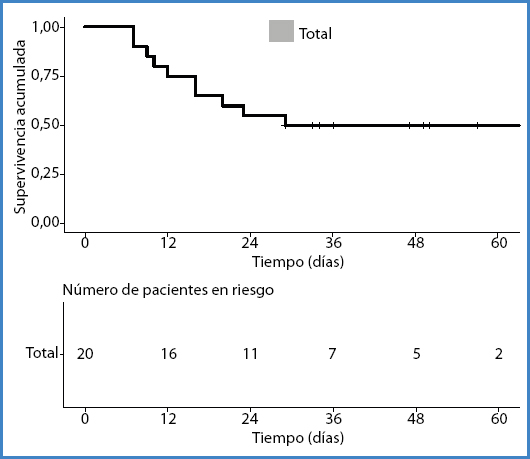
Respecto a la evolución clínica, en 14 casos (43,8 %) consta que fueron dados de alta hospitalaria de manera satisfactoria. Por otra parte, se comunicaron 10 exitus (31,2 %). En 6 casos (60 %, relativo) el fallecimiento se comunicó como consecuencia del HRE. La curva de supervivencia de Kaplan-Meier se muestra en la figura 3. Se advierte de una limitación respecto a los datos acerca de la evolución clínica, puesto que no se especifica claramente en 8 de ellos.
DISCUSIÓN
Existe un espectro muy amplio en cuanto a la severidad de la infección sintomática por SARS-CoV-2, desde la enfermedad leve-moderada hasta la crítica-severa. Según el Centro Chino para el Control y Prevención de Enfermedades (20), se consideran criterios de enfermedad severa la disnea, la hipoxia o la afectación radiológica pulmonar superior al 50 % transcurridas 24-48 horas desde el inicio de los síntomas. En el caso de pacientes con fallo respiratorio, shock o disfunción multiorgánica, se habla de enfermedad crítica. Se estima que el 14 % y el 5 % de los pacientes con enfermedad COVID-19 se presentaron con dichos cuadros, respectivamente (1,20,21). De los 32 pacientes incluidos en esta revisión el 100 % se encontraban hospitalizados y al menos 11 de ellos (34,4 %) precisaron ingreso en la UCI.
El HRE se define como un sangrado en el espacio retroperitoneal en ausencia de un traumatismo o una manipulación yatrogénica. Frecuentemente, el HRE ocurre en pacientes que se encuentran con tratamiento anticoagulante o con efectos antiplaquetarios (22). No obstante, se han descrito otros factores de riesgo asociados, como la edad avanzada, el sexo femenino y la presencia de comorbilidades, como enfermedades pulmonares crónicas, alteraciones de la coagulación, HTA, arterioesclerosis, cirrosis o enfermedad renal severa. Habitualmente el HRE se manifiesta con dolor en la región lumbar o dolor abdominal. Además, es frecuente la aparición concomitante de clínica por compresión nerviosa o vascular, como la disminución de pulsos periféricos o las disestesias. En algunas series se ha descrito el signo de Grey Turner (discromía cutánea por equimosis al nivel de los flancos abdominales o de la región lumbar) hasta en el 6,3 % de los pacientes (23). En la presente revisión de la literatura sobre los HRE en el contexto de enfermedad COVID-19, el dolor o la presencia de una masa abdominal se describieron en el 37,5 % de los casos, que fueron el síntoma y el signo de presentación más frecuentes.
Autores como Rosen H y cols. describen que hasta el 50 % de los pacientes con HRE pueden presentar inestabilidad hemodinámica y necesitarán monitorización en UCI (22). Sin embargo, únicamente el 18,8 % de los casos valorados en esta revisión presentaron datos de inestabilidad o shock hipovolémico y tan solo 2 (6,3 %) requirieron ingreso en la UCI a causa del HRE.
La sospecha de un HRE debería establecerse con base en la clínica y requiere confirmación diagnóstica de forma urgente mediante angio-TC con contraste intravenoso (Fig. 4A). En el caso de pacientes jóvenes o mujeres embarazadas, las pruebas de imagen podrían basarse en la ecografía o la resonancia magnética (22). Las determinaciones analíticas deberían incluir el control seriado de los niveles séricos de hemoglobina y hematocrito, aunque debe tenerse en cuenta que estos pueden ser normales al inicio del sangrado. De hecho, solo un 37,5 % de los pacientes valorados en este estudio presentaron alteración en los niveles séricos de hemoglobina al momento del diagnóstico.
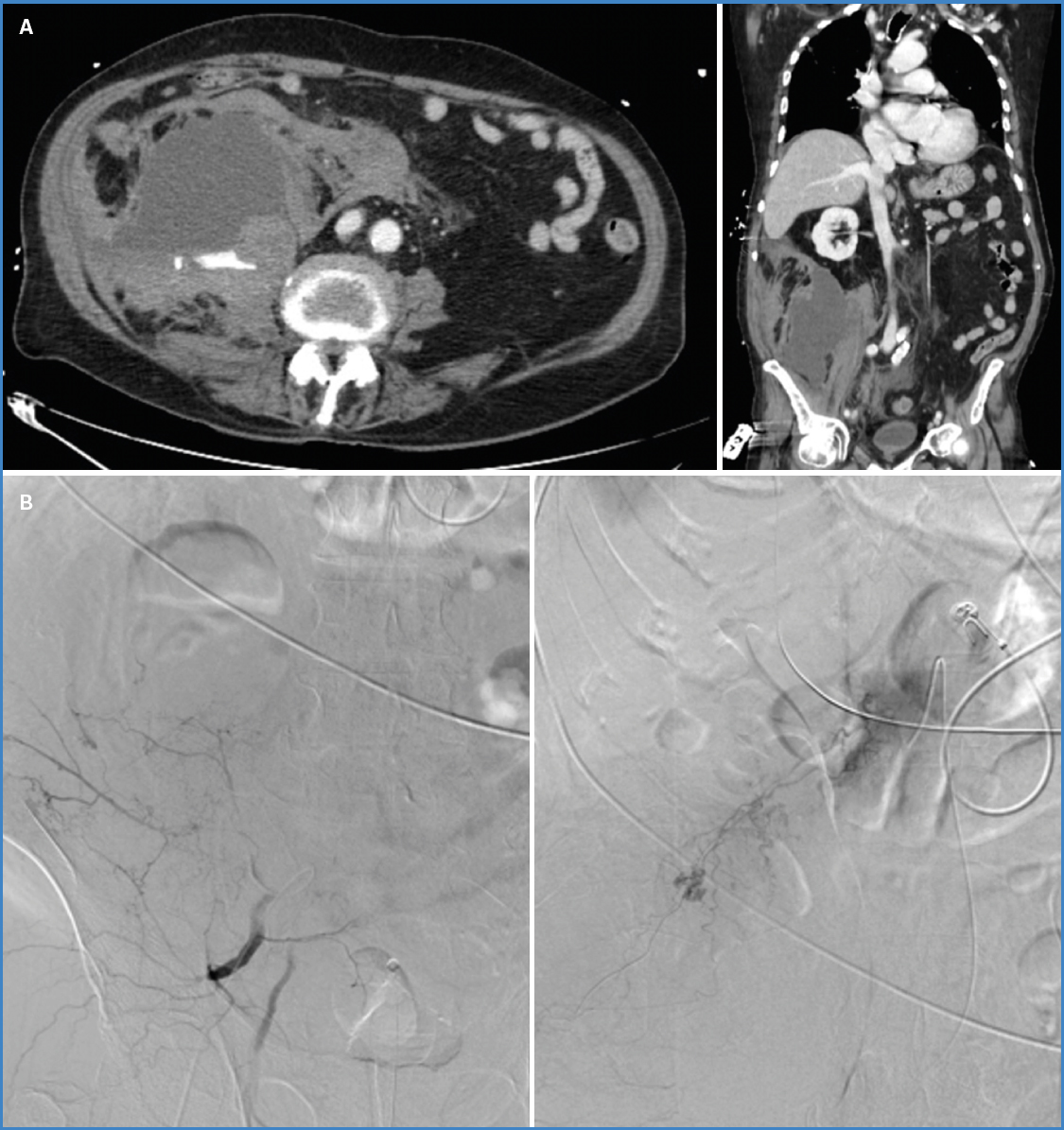
Figura 4 A. TAC abdomino-pélvico. Hematoma adyacente al músculo psoas ilíaco derecho a la altura de L3-L4 de aproximadamente 15 × 12,8 × 17 cm con focos de extravasación de contraste en fase arterial. Hallazgos compatibles con sangrado activo. B. Arteriografía y embolización de varios puntos de sangrado activo dependientes de arterias lumbares, 12.ª arteria intercostal y arteria iliolumbar derecha.
En cuanto al manejo terapéutico de esta entidad, en la revisión bibliográfica realizada consta que en la mayoría de los casos se estableció un tratamiento inicialmente conservador del HRE con reposición de volumen mediante fluidoterapia intravenosa, transfusión de hemoderivados y corrección de las alteraciones de la coagulación. Por otra parte, en los pacientes con shock hipovolémico refractario a las terapias de resucitación inicial, presencia de hematoma retroperitoneal expansivo o signos de sangrado activo en la TC, estaría indicada la angioembolización como tratamiento de primera línea (Fig. 4B). Únicamente ante su fracaso, la presencia de patología quirúrgica concomitante o el acontecimiento de un de síndrome compartimental abdominal refractario al tratamiento médico (definido por una presión intraabdominal superior a 20 mmHg objetivada en 3 determinaciones estandarizadas, con disfunción secundaria de uno o varios órganos, por ejemplo, renal o restricción respiratoria) estaría indicada la intervención quirúrgica (22).
Cabe destacar que los HRE pueden asociarse a una mortalidad del 6-22 % (22). Sin embargo, no suelen ser la causa directa del exitus. La mortalidad en estos pacientes normalmente es atribuible a sus comorbilidades, aunque se trata de una población heterogénea y es difícil identificar factores predictores de mortalidad independientes. De acuerdo con la revisión realizada, únicamente 10 pacientes fallecieron durante el seguimiento, de los que 6 probablemente estuviesen relacionados con el HRE.
La infección severa y crítica por SARS-CoV-2 se ha relacionado principalmente con complicaciones tromboembólicas, cuya incidencia en pacientes ingresados en UCI se encuentra entre el 21 y el 69 %. Estas complicaciones suponen un reto añadido a la complejidad del manejo del paciente crítico (24). Se han propuesto diferentes mecanismos fisiopatológicos para explicar esta relación, entre los que destaca la respuesta inmune excesiva con aumento de citoquinas proinflamatorias, como IL-6, IL-1 beta y TNF alfa (1,9,16,24). Por otra parte, también se ha descrito la afectación endotelial por acción directa del virus o secundaria a los propios cambios hemodinámicos que acontecen en el paciente grave (15). También se ha evidenciado mayor afectación por el virus SARS-CoV-2 en aquellos órganos que expresan el receptor de la enzima conversora de angiotensina 2 (ACE2) en el endotelio vascular, especialmente en los pulmones, el corazón, el tracto digestivo y el riñón (1,3). Esto se debe a que el SARS-CoV-2 se une al receptor ACE2 y provoca una sobreproducción de angiotensina II. De manera concomitante, se desencadena la producción de IL-6 (3,15), citoquina que inactiva la ACE2 y provoca la retención de la angiotensina II formada, lo que genera una reacción endotelial e inflamación (3). Por otra parte, las plaquetas juegan también un papel proinflamatorio que favorece el SIRS y la trombocitopenia inmune, presente de igual modo en otras infecciones virales (3). Mediante estos mecanismos el virus tiene la capacidad de activar la cascada de coagulación, producir la agregación plaquetaria y la formación de coágulos (3,9). De este modo, se desencadena la formación de microtrombosis que, sin el tratamiento adecuado, puede desencadenar un fallo multiorgánico (15).
Además, al igual que otros patógenos, como los adenovirus, los virus de la gripe o los virus herpes simple, el SARS-CoV-2 puede afectar de manera directa a las células endoteliales. La relación entre fenómenos trombóticos o hemorrágicos y las enfermedades virales se ha descrita también en virus como el del Ébola. Sin embargo, durante la epidemia por SARS-CoV-1 las alteraciones de la coagulación no fueron frecuentes (24), lo que sugiere la existencia de mecanismos fisiopatológicos diferentes entre las diversas cepas de coronavirus.
La respuesta sistémica a la infección, por lo tanto, puede resultar en la formación de microtrombosis y trombosis venosas superficiales o profundas, síndrome coronario agudo, tromboembolismo pulmonar, accidente cerebrovascular, coagulopatía inducida por sepsis o coagulación intravascular diseminada (CID) (9,15). A su vez, la CID puede cursar con trombosis microvasculares generalizadas y hemorragias severas secundarias al consumo de factores de coagulación. Por lo tanto, es importante tener en cuenta que en algunos casos de fallo multiorgánico pueden coexistir las microtrombosis y los fenómenos hemorrágicos (3).
El riesgo de hemorragia en los pacientes ingresados en UCI puede alcanzar tasas de hasta el 5,6 %, incluso bajo tratamiento con HBPM a dosis profiláticas (24). Lo más frecuente es la hemorragia de origen gastrointestinal. En el caso de los pacientes críticos por la enfermedad COVID-19, Al-Samkari y cols. comunicaron una incidencia de sangrado del 7,6 %, con una tasa de hemorragia superior al 5,6 % (25). De manera similar, el estudio multicéntrico de Shah y cols. mostró una tasa de sangrado del 8 % (24). En el estudio multicéntrico prospectivo publicado por Demelo-Rodríguez P y cols. se incluyeron 1975 pacientes hospitalizados por COVID-19 con diferentes grados de severidad y se observó una tasa de sangrado del 6,7 %, con una tasa del 5,7 % de hemorragia mayor (26). Por otra parte, Qiu C. y cols. realizaron un estudio retrospectivo comparativo entre pacientes críticos con COVID-19 y neumonía adquirida en la comunidad (NAC) en el que se objetivaron mayores tasas de complicaciones hemorrágicas en pacientes con infección por SARS-CoV-2 (35 % en el grupo SARS-CoV-2 frente al 10 % de pacientes en el grupo de NAC) (1). Este riesgo aumentado de fenómenos hemorrágicos se ha visto asociado a la propia enfermedad COVID-19, a la necesidad de terapia con ECMO (1,7) y al tratamiento con anticoagulación a dosis terapéuticas o profilácticas (24). No obstante, los datos actuales sugieren que el riesgo de hemorragia en el paciente crítico con COVID-19 es mayor que en el paciente ingresado en UCI por otras patologías. Esto podría deberse a un fenómeno multicausal asociado a los mecanismos de acción de la infección viral y, por lo tanto, que no se encontrase asociado únicamente a las terapias anticoagulantes.
Somos conscientes de las limitaciones del estudio, en especial debido a la naturaleza retrospectiva de las publicaciones, al limitado número de pacientes que contiene, a su heterogeneidad y a la imposibilidad de aleatorización. La literatura publicada hasta la actualidad referente a los HRE en el contexto de la infección por SARS-CoV-2 es muy escasa. En la mayoría de las ocasiones se trata de manuscritos que comunican casos aislados, con una recogida de datos retrospectiva y limitada y diversas experiencias de tratamiento. Por otra parte, como revisión sistemática no se encuentra exenta de posibles sesgos de publicación. Es probable que no se hayan publicado los casos de HRE asintomáticos, leves o sin necesidad de manejo terapéutico y, por lo tanto, con base en la literatura actual, la presente revisión sistemática sobreestime la gravedad del suceso y la necesidad de su manejo terapéutico.
No obstante, existe suficiente información para considerar que la infección por SARS-CoV-2 pueda ser causa directa de fenómenos hemorrágicos a través del desencadenamiento de daño endotelial, del desequilibrio entre la producción y la destrucción plaquetarias, de las alteraciones de la cascada de la coagulación, de la trombocitopenia o de la disminución de los niveles de fibrinógeno (2). Además, en relación con la aparición de HRE se ha descrito la posibilidad de que la existencia de alteraciones endoteliales en los vasos retroperitoneales pueda aumentar el riesgo de su ruptura y sangrado de manera secundaria a microtraumas, como el esfuerzo tusígeno, la ventilación mecánica invasiva, el vómito o los cambios posturales que precisan los pacientes ingresados en las UCI (11).
CONCLUSIONES
La relación entre el SARS-CoV-2 y los fenómenos hemorrágicos no está claramente establecida. Sin embargo, el acontecimiento de un hematoma retroperitoneal espontáneo puede comportar un exceso de gravedad en los pacientes críticos por COVID-19 que sufren esta infrecuente y atípica asociación. La sospecha clínica y el diagnóstico precoz mediante pruebas radiológicas son esenciales para instaurar una adecuada resucitación inicial e identificar precozmente a los pacientes que pueden ser subsidiarios de angioembolización. El tratamiento angiointervencionista se considera de primera línea en el caso del shock hipovolémico refractario a la terapéutica inicial, signos radiológicos de hematoma retroperitoneal expansivo o signos de sangrado activo. La intervención quirúrgica debería considerarse como una terapia de segunda línea o ante patología concomitante o síndrome compartimental abdominal que requiera cirugía.
La literatura publicada hasta la actualidad respecto a los hematomas retroperitoneales espontáneos en pacientes con infección por SARS-CoV-2 es muy escasa. Dada la complejidad del manejo de estos pacientes y la gravedad añadida que el hematoma retroperitoneal supone, se considera necesario profundizar en la investigación de esta infrecuente asociación. Para ello, podría ser de interés la creación de un registro internacional que aunara las diferentes experiencias a fin de obtener mayores niveles de evidencia.