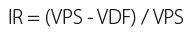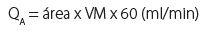INTRODUCCIÓN
El acceso vascular para hemodiálisis es fundamental para el paciente con insuficiencia renal crónica terminal debido a que la diálisis va a depender en gran medida del acceso en sí mismo y a que parte de la morbimortalidad del paciente va a depender de él y de sus complicaciones.
Sabemos que la fístula arteriovenosa nativa es superior a la protésica y esta al catéter venoso central (CVC) por su mayor permeabilidad y su menor tasa de complicaciones y reintervenciones (1) Por tanto, y aunque el envejecimiento de la población hace que suponga un reto, la creación y el mantenimiento del acceso vascular es fundamental para estos pacientes.
En dicho contexto, el eco Doppler nos va a ser de gran ayuda a la hora de planificar y de mantener el acceso vascular. Por tanto, va a ser fundamental en el mapeo prequirúrgico, en la planificación preoperatoria y será también de gran utilidad durante la operación. En el posoperatorio nos ayudará en el seguimiento del acceso, en el diagnóstico de la disfunción y en la valoración de la maduración (2).
PLANIFICACIÓN PREOPERATORIA
Como todos sabemos, para la realización de un acceso vascular bueno y duradero es imprescindible una buena planificación preoperatoria.
La anamnesis, junto con la exploración física complementada por el eco Doppler, nos va a dar toda la información para decidir dónde realizar el acceso vascular, que debe ser lo más distal posible y en el brazo no dominante, si puede ser.
Durante la anamnesis se tendrán en cuenta datos clínicos de sospecha de estenosis venosa central (antecedente de catéter venoso central, de trombosis venosa profunda o de fractura clavicular) y de presencia de catéter tunelizado o de marcapasos, porque condicionarán la elección del miembro para el acceso vascular. La presencia de una linfadenectomía, la actividad especializada con algún miembro superior, la paresia de un miembro o la presencia de insuficiencia cardiaca son también otros factores importantes a tener en cuenta.
La anamnesis vendrá acompañada de una exploración física, que se llevará a cabo en los miembros superiores, pero también en los inferiores en caso necesario. Se explorará el sistema venoso superficial valorando la visibilidad y la compresibilidad, la superficialidad de las venas, su trayecto rectilíneo y la ausencia de tortuosidad mayor. En la exploración arterial se palparán los pulsos, se realizará la maniobra de Allen y se medirá la presión sistólica en los miembros superiores para determinar que no existe una diferencia superior a 15 mmHg entre ellos dos (situación en la que debería llevarse a cabo un estudio para determinar la presencia de una estenosis al nivel de la arteria subclavia/axilar). También se llevará a cabo la exploración de los miembros inferiores. Hay que tener en cuenta la gran variabilidad anatómica que existe tanto en el sistema venoso superficial, con las diferencias a nivel de la famosa “M” del codo, como en la bifurcación arterial. La arteria humeral doble o accesoria, o bien el origen alto de la arteria radial, están presentes en un 15 % de la población. Por otro lado, se han clasificado al menos ocho tipos de distribuciones venosas al nivel de la flexura del codo. La confluencia entre las venas cefálica y basílica proximal y distal, las medianas cefálica y basílica y la perforante del codo, en forma de M, es la configuración más habitual.
De todas maneras, y pese a la gran información que la exploración física nos da, sabemos que sola no es suficientemente precisa: hay localizaciones difíciles de explorar (como la basílica proximal o la fosa antecubital), pacientes obesos, zonas reintervenidas, variabilidad anatómica y la presencia de arteriopatía. Por todo ello, el eco Doppler en el preoperatorio va a complementarnos y a mejorar la exploración física y va a ayudarnos a identificar la mejor localización para el acceso vascular (3).
El uso sistemático del eco Doppler en el preoperatorio mejora la tasa de fallos y tiende a una mejor maduración. Además, se demuestra más útil si se realiza de forma sistemática que selectiva (3,4).
Por tanto, la recomendación de las recientes guías, tanto Práctica clínica de la utilidad de los ultrasonidos en la creación y el mantenimiento de los accesos arteriovenosos, del Capítulo de Diagnóstico Vascular (CDV) de la Sociedad Española de Angiología y Cirugía Vascular (SEACV) (5), la Guía clínica española para el acceso vascular para hemodiálisis (6) como la guía europea (ESVS Vascular Access Guideline) (7), es el uso rutinario del eco Doppler en el preoperatorio.
TÉCNICA
Se recomienda que el paciente descanse en posición de decúbito supino, relajado y tranquilo, con el brazo estirado con la palma de la mano hacia arriba. La habitación debe tener una luz tenue y estar a temperatura agradable y cálida (Fig. 1).
Fundamentalmente se utilizará la sonda lineal multifrecuencia (7-12 MHz) y puntualmente necesitaremos la sonda convexa de 3-5 MHz, sobre todo para el sistema venoso profundo.
Aunque es cierto que no existe evidencia acerca de la secuencia del escaneado, se recomienda seguir un método sistemático para la exploración del sistema venoso y arterial de ambos miembros superiores, empezando preferiblemente por el brazo no dominante, seguido del dominante. Se aconseja iniciar el estudio venoso desde distal a proximal y el arterial, a continuación, de proximal a distal.
La exploración venosa la realizaremos con compresión venosa proximal y comenzaremos por el sistema venoso superficial en modo B transverso.
La secuencia de la exploración que nosotros utilizamos es la siguiente: se inicia el estudio por la vena cefálica desde la muñeca hasta la fosa antecubital y seguimos por el brazo. También exploraremos la presencia de la vena cefálica accesoria. Seguiremos por la vena basílica en el antebrazo hasta el brazo.
Valoraremos la permeabilidad venosa mediante la compresión con la sonda, su diámetro interior, detectando cambios en el diámetro o presencia de estenosis u oclusión, su continuidad hacia el sistema venoso profundo, su longitud sin tortuosidad (para la correcta canulación la vena debería de tener al menos 6 cm de trayecto rectilíneo), su profundidad (debería estar a menos de 6 mm de la superficie cutánea) y también su distensibilidad, midiendo su diámetro con la compresión venosa proximal y posteriormente al retirar el torniquete. La permeabilidad venosa puede explorarse también mediante el Doppler pulsado y Doppler color.
A continuación, seguiremos con la exploración del sistema venoso profundo, empezando desde la vena humeral, axilar y subclavia; la yugular interna es la última en explorar. Hay que tener en cuenta que el sistema venoso profundo no es compresible ni visible en su totalidad, de manera que tendremos en cuenta signos indirectos de su permeabilidad, como la pulsatilidad transmitida y la fasicidad respiratoria. En caso de ausencia de fasicidad, presencia de flujo monofásico y velocidades muy disminuidas, se recomienda completar el estudio mediante otras pruebas complementarias, como el angio TC, el angio RMN o flebografía (8).
El estudio arterial de los miembros superiores empezará en modo B en plano transverso y posteriormente en longitudinal, desde la parte distal de la arteria subclavia hasta las arterias radial y cubital (2). Habrá que tener en cuenta la variabilidad anatómica a la que hacíamos referencia en la descripción de la exploración física. Recordemos que hasta el 20 % de los pacientes pueden presentar una bifurcación alta de la arteria humeral (9).
Se valorarán, en primer lugar, las características anatómicas arteriales:
– Diámetro interior.
– Presencia de calcificación.
– Engrosamiento parietal.
– Lisura de la íntima.
– Engrosamiento íntima-media, que puede estudiarse por ultrasonidos de alta resolución.
Posteriormente, se seguirá mediante el modo Doppler color y Doppler pulsado, midiendo las curvas arteriales y calculando la velocidad pico sistólica (VPS), la velocidad diastólica final (VDF) y el flujo (Q), teniendo en cuenta hacerlo con el ángulo de insonación de 60°.
Los criterios de estenosis arterial significativa vienen definidos por la velocidad pico sistólica y el ratio de la VPS entre los segmentos estenosados y el segmento preestenosis:
– VPS > 200 cm/s.
– Ratio de VPS preestenosis / estenosis de > 2-3 (50 % / 70 %) (10).
De todas maneras, hay que tener en cuenta que estenosis inferiores pueden resultar significativas tras la realización de la fístula arteriovenosa por el aumento del flujo (2).
La distensibilidad de la pared arterial puede evaluarse de manera preoperatoria por el estudio de la onda Doppler en la arteria radial durante la prueba de hiperemia reactiva: una arteria sana responde a la isquemia con hiperemia reactiva, es decir, incrementando el flujo de sangre y la dilatación arteriolar distal. Tras la inducción de la isquemia realizando una compresión mediante torniquete a nivel proximal o cerrando el puño, la hiperemia reactiva se observa de manera inmediata tras soltar la mano y la compresión proximal. La onda espectral Doppler en la arteria radial distal muestra una curva trifásica de alta resistencia durante la isquemia, que posteriormente cambia a una onda monofásica de baja resistencia con aumento de la velocidad global durante la hiperemia reactiva (Fig. 2). El cambio en la onda espectral puede cuantificarse mediante el índice de resistencia (IR):
Cuanto mayor es la respuesta hiperémica de la arteria, más bajo es el índice de resistencia o mayor la diferencia de velocidad pico sistólica. Un índice de resistencia bajo (< 0,7) en el periodo inicial de la hiperemia en la arteria radial se ha descrito como un factor positivo en relación con la permeabilidad de la fístula en comparación con aquellas cuyas arterias presentaban un IR > 0,7 (10,11).
CRITERIOS ECOGRÁFICOS INDIVIDUALES PREOPERATORIOS Y SU RELACIÓN CON LA PERMEABILIDAD DEL ACCESO VASCULAR
Existen muchos estudios publicados en relación con los parámetros ecográficos preoperatorios que influyen en la permeabilidad de la fístula arteriovenosa. De todos ellos, los diámetros venoso y arterial son los más estudiados y los recomendados en las guías como factores claramente relacionados con la futura permeabilidad de la fístula arteriovenosa (7,12-16).
Por tanto, respecto a los diámetros, los criterios para elegir una arteria o una vena para el acceso vascular siguiendo las recomendaciones de las guías, tanto las de Práctica clínica de la utilidad de los ultrasonidos en la creación y el mantenimiento de los accesos arteriovenosos del CDV de la SEACV (5) como las de la guía europea (ESVS Vascular Access Guidelines) (7), son los siguientes:
Por otro lado, el estudio mediante eco Doppler preoperatorio debería darnos información acerca de la permeabilidad arterial y venosa, descartando estenosis, y también acerca de la profundidad de las venas, que debería ser inferior a 6 mm, puesto que, de no ser así, podría requerir en un segundo tiempo una superficialización, transposición u otra técnica adyuvante. La longitud venosa mínima también debería ser entre 6 y 10 cm para su posterior canulación.
Respecto a otros factores, como la velocidad pico sistólica (VPS) arterial, la prueba de hiperemia reactiva descrita previamente o bien el estudio arterial detallado, no se recomienda su uso de manera sistemática en las guías, pese a que puede resultar de gran utilidad.
VALORACIÓN INTRAOPERATORIA
Justo después de la realización del acceso vascular se produce un aumento del flujo tanto a nivel arterial como venoso debido al descenso de las resistencias periféricas.
La curva espectral Doppler de la arteria humeral, curva de alta resistencia con índice de resistencia (IR) > 1 en condiciones normales, se transforma en una curva de baja resistencia, con un IR < 1 (Fig. 3).
Existe un gran aumento del flujo inicial seguido por un posterior incremento gradual en las siguientes semanas.
Durante la operación, la palpación de frémito y la auscultación de soplo tras la realización de la fístula arteriovenosa son los mejores predictores de maduración del acceso vascular. La ausencia de soplo es el de mayor sensibilidad y especificidad para predecir la trombosis del acceso vascular (1,5).
Se han descrito diferentes parámetros ecográficos que pueden estar relacionados con la permeabilidad de la fístula arteriovenosa:
– El cálculo intraoperatorio del flujo venoso (Qv) en las fístulas proximales (> 300 ml/min) o distal (140 ml/min) (17).
– La velocidad pico sistólica arterial (VPS) > 53 cm/s (18).
– La velocidad diastólica final (VDF) (19). Esta es la que podría predecir con mayor exactitud la trombosis del acceso cuando es < 25 cm/s, pero sin añadir sensibilidad ni especificidad respecto a la auscultación del soplo (5).
Por tanto, no se recomienda el uso del eco Doppler durante la operación de manera sistemática, aunque puede ayudarnos a diagnosticar estenosis arteriales o venosas o defectos y sernos de gran utilidad en caso de dudosa permeabilidad.
Por otro lado, el eco Doppler puede servirnos de guía para técnicas endovasculares, como la angioplastia primaria con balón o maduración asistida por balón (20,21) o para la técnica de Miller.
VALORACIÓN POSOPERATORIA: MADURACIÓN Y SEGUIMIENTO
Como hemos comentado previamente, tras la realización de la fístula arteriovenosa se produce un incremento en el flujo tanto de la vena como de la arteria dadora debido al descenso de la resistencia venosa, lo que conduce a un aumento del flujo de la vena. De manera inmediata se produce un aumento significativo del flujo, que posteriormente es más gradual en las siguientes semanas. Tras las 4-6 semanas posteriores a la realización de la fístula puede examinarse para evaluar su idoneidad para la hemodiálisis. Las fístulas arteriovenosas protésicas suelen poder canularse antes de las 4 semanas de su realización, a excepción de aquellas que son de punción rápida, que pueden canularse a las 24-48 horas.
Maduración
Un acceso maduro es aquel que presenta idoneidad teórica para la hemodiálisis, que suele valorarse en 4-6 semanas en caso de acceso nativo o a las 2-4 semanas si es protésico.
Un acceso funcional es aquel que ya se ha canulado con éxito con dos agujas al menos en seis sesiones de hemodiálisis durante un periodo de 30 días, lo que permite un flujo durante la hemodiálisis de al menos 350 ml/min (7).
Los criterios ideales ecográficos de maduración se han descrito tradicionalmente en la regla del 6 (1):
– > 6 mm de diámetro venoso.
– < 6 mm de profundidad venosa.
– > 600 ml/min flujo (medido en la arteria braquial).
– > 6 cm longitud de segmento (idealmente > 10 cm).
– > 6 semanas posoperatorias.
Estos criterios son excesivamente estrictos u optimistas (y no tienen en cuenta, por ejemplo, diferencias raciales, en las que los diámetros arteriales y venosos pueden ser inferiores, como en el caso de la raza asiática), de manera que, en realidad, una fístula que tenga un flujo de al menos 500 ml/min y un diámetro de 4 mm cumple los criterios de maduración (5-7).
Las causas más habituales de falta de maduración son: estenosis venosa, arterial o anastomótica, venas pequeñas, venas muy profundas, tortuosidad y bajo flujo del acceso (5).
Seguimiento
La monitorización del acceso (exploración física) y el control durante la hemodiálisis (instrumentación) están indicados de manera regular en las fístulas arteriovenosas nativas y protésicas (7).
El eco Doppler permite una medida directa del flujo del acceso y es equivalente a otros métodos dilucionales para evaluar la función de la fístula. Todos ellos son equivalentes para calcular el flujo (QA) (7).
Aunque no hay suficiente evidencia científica como para declarar al eco Doppler como método de rutina para el seguimiento del acceso vascular de manera regular, su uso está claramente aceptado para el diagnóstico del acceso vascular disfuncionante (5,7,22).
Por otro lado, las guías europeas añaden como recomendación el seguimiento con ultrasonidos en intervalos periódicos y el tratamiento profiláctico de estenosis para reducir el riesgo de trombosis, que debe considerarse en FAV nativas. No se recomienda en FAV protésicas (nivel de evidencia IIa/A) (7).
En las guías del CDV de la SEACV recientemente publicadas (5), y a las que hacemos alusión en este artículo, también añaden como recomendaciones:
– Si bien no está clara la utilidad del eco Doppler sistemático de cribado para evaluar la maduración, sí se aconseja realizarlo en toda FAV con defecto de maduración clínica tras 6 semanas de su creación (nivel de evidencia IIa/C).
– El examen mediante ultrasonidos debe ser el primero en realizarse en cualquier acceso arteriovenoso con sospecha de disfunción (nivel de evidencia I/B) (5).
Por tanto y, a modo de resumen, el eco Doppler será el método de elección para el estudio de todo acceso vascular disfuncionante. Su uso para el seguimiento regular de todos los accesos vasculares es selectivo.
TÉCNICA DE EXPLORACIÓN Y PROTOCOLO DE UNA FÍSTULA
Igual que comentábamos en la exploración del marcaje preoperatorio, tampoco existe evidencia acerca de cuál debe ser la secuencia y el orden de la exploración de la fístula arteriovenosa, pero la recomendación es seguir un mismo método sistemático. La mayoría de los grupos utiliza el orden que se describe a continuación (5).
El paciente debe estar cómodamente estirado/semirreclinado en posición de supino, con el brazo que va a insonarse con la palma de la mano hacia arriba, en rotación externa, en una habitación cálida.
El examen empieza en un plano transverso para el estudio morfológico y posteriormente seguiremos de manera longitudinal para el cálculo de velocidades y de flujos. Iniciaremos en el modo B, que nos dará información acerca del diámetro, de la anatomía de la pared, de la profundidad y de la presencia de complicaciones (hematomas, pseudoaneurismas o aneurismas, trombosis, etc.), para posteriormente seguir en el modo Doppler color y pulsado, en el que podremos valorar la hemodinámica, valorando la morfología de la onda espectral, el cálculo de VPS, de VDF, de QA y la presencia de turbulencias.
La secuencia de exploración más utilizada es la siguiente (23):
Arteria dadora (inflow) → anastomosis → vena de salida (outflow)
La arteria nativa dadora (A en la figura 4) empieza a explorarse al menos a 5 cm proximales respecto de la anastomosis para evitar la turbulencia que se genera en la anastomosis. Aquí mediremos la VPS, la VDF y QA. La arteria distal a la anastomosis también puede ser explorada en este momento.
Seguiremos con la anastomosis (B en figura 4), documentando la morfología de la onda Doppler y la VPS, en las que la gran turbulencia es normal. Como el acceso vascular provee un outflow de baja resistencia hacia el lecho arterial, esperaremos encontrar un ensanchamiento espectral y un flujo diastólico en esta zona en vez de la onda trifásica que se observa en el lecho arterial periférico (D en figura 4).
Posteriormente continuaremos con el estudio del resto del acceso al nivel de la vena de salida (C en figura 4), analizando el área yuxtanastomótica, las zonas de punción (morfología, cambios en diámetros venosos y VPS) y cualquier anomalía (trombo, aneurismas, pseudoaneurismas y colecciones) hasta las venas axilar y subclavia. El diámetro y la profundidad de la vena también deben medirse. Como hemos comentado previamente, la exploración del sistema venoso profundo está limitada por la imposibilidad de la valoración de los vasos intratorácicos, de manera que debería realizarse una prueba complementaria en el caso de encontrarse alguna alteración en los signos indirectos de permeabilidad, como son la fasicidad respiratoria y pulsatilidad cardiaca transmitida.
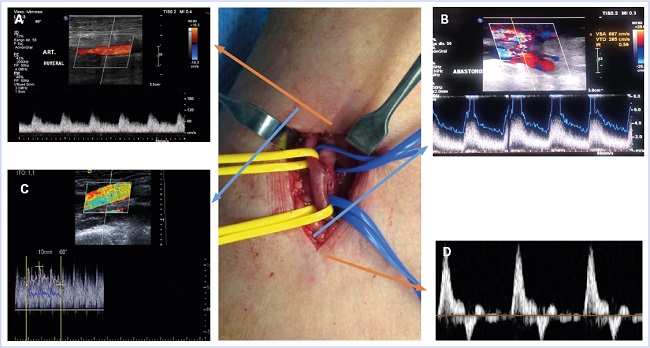
Figura 4. Segmentos de la fístula. A. Arteria dadora. B. Anastomosis arteriovenosa. C. Salida distal venosa. D. Arteria distal.
Medición del flujo (QA)
La medición del flujo (QA) del acceso vascular se realizará al nivel de la arteria humeral, a un mínimo de 5 cm proximal a la anastomosis arteriovenosa, para evitar la turbulencia que se genera a este nivel. Debe evitarse la medición al nivel de la vena de salida por los siguientes motivos: su diámetro es irregular, lo que dificulta el cálculo del área, es más fácilmente compresible con la sonda, lo que hace que sea más difícil técnicamente, y presenta un flujo turbulento no axial. Por todo ello, el cálculo del flujo a nivel de la vena es propenso a presentar más errores.
El cálculo al nivel de la arteria, en cambio, es más fácil, ya que esta tiene un diámetro y una morfología rectilíneos y homogéneos. El cálculo del área y de la velocidad es más fiable.
En las fístulas arteriovenosas protésicas el cálculo del flujo sí que puede medirse directamente en la prótesis.
¿CÓMO MEDIR EL FLUJO DE LA FÍSTULA ARTERIOVENOSA?
Debe realizarse en el eje longitudinal, como cualquier medida hemodinámica, con 60° o menos de angulación. El volumen de la muestra deberá ser lo suficientemente ancho como para incluir al menos dos tercios del diámetro arterial.
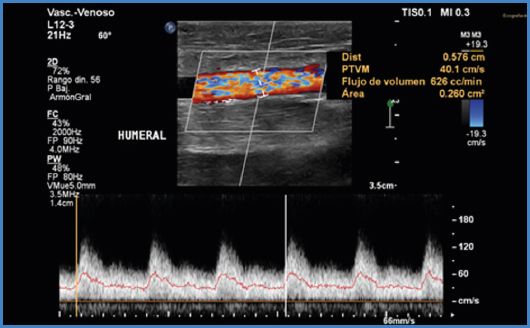
Habitualmente, el cálculo del flujo lo realiza de manera automática el software del ecógrafo (Fig. 5), pero la fórmula es la siguiente (5,7):
Donde VM es la velocidad media.
En fístulas radio-cefálicas de muñeca, el flujo lo recibe la fístula tanto por la arteria radial como por la cubital, a través del arco palmar, de manera que la medida del flujo al nivel de la arteria humeral sería la manera más fiable de medir el flujo total de la fístula.
Algunos autores recomiendan restar al flujo calculado en la arteria braquial del acceso vascular el flujo arterial calculado en la humeral contralateral, de manera que así el cálculo sea únicamente el flujo al nivel del acceso vascular (24).
DISFUNCIÓN DEL ACCESO VASCULAR
Como comentábamos previamente, el ultrasonido es el método prínceps para estudiar la disfunción del acceso vascular.
Estenosis
Para el diagnóstico de la estenosis significativa del acceso vascular existen unos criterios ecográficos morfológicos y anatómicos de alta sensibilidad y especificidad (5):
Por otro lado, la Guía clínica española para el acceso vascular para hemodiálisis (6) describe unos criterios de estenosis significativa con riesgo de trombosis, que son los siguientes:
La presencia de al menos dos de estos parámetros podría ayudarnos a decidir qué fístulas disfuncionantes intervenir.
Por otro lado, aunque existe cierta controversia acerca de si el diagnóstico ecográfico de la disfunción de la fístula debería confirmarse mediante fistulografía (por no haber suficiente evidencia científica) las guías recientemente publicadas del CDV sobre el acceso vascular (5) recomiendan que, dado que el estudio mediante eco Doppler de un acceso disfuncionante en manos de un explorador experimentado es suficiente para la indicación de tratamiento de una fístula disfuncionante, no es necesaria la comprobación mediante la fistulografía.
Existe un patrón de localización de la estenosis en función del tipo de fístula (25).
En la fístula radiocefálica la estenosis suele estar o bien en la arteria radial, al nivel venoso yuxtanastomótico, o bien en el trayecto de punción de la vena. En la húmero-cefálica la estenosis característica es al nivel del arco de la cefálica. Las fístulas húmero-basílicas, por otro lado, suelen desarrollar estenosis en relación con la aparición de hematomas en las zonas de punción. Aquellas húmero-basílicas superficializadas o con transposición pueden presentar estenosis en la parte final de la vena. Por último, las fístulas protésicas suelen presentar estenosis al nivel de la anastomosis venosa, por hiperplasia.
Trombosis
La trombosis del acceso vascular suele ser de fácil diagnóstico clínicamente. A nivel ecográfico, simplemente valorando la curva espectral al nivel de la arteria humeral podremos saberlo: encontraremos una curva trifásica, con alta resistencia y con curva espectral estrecha.
El estudio mediante eco Doppler también va a poder darnos información acerca de la localización y de la extensión de la trombosis y de la presencia de colaterales. Por otro lado, la hiperecogenicidad del trombo va a darnos información acerca de la antigüedad del trombo.
Isquemia inducida por el acceso vascular
La isquemia inducida por el acceso vascular es una complicación poco frecuente pero grave cuyo diagnóstico suele realizarse clínicamente. El índice de presión digital nos confirmará el diagnóstico y el estudio con eco Doppler va a resultarnos de gran ayuda para evaluar tanto la anatomía como la hemodinámica del acceso.
En primer lugar, evaluaremos la anatomía del acceso vascular, el diámetro de la anastomosis y la permeabilidad de los vasos. Valoraremos el flujo del acceso y así podremos clasificarlo en alto flujo o normal-bajo flujo, cuyos tratamientos posteriores serán diferentes (6). Podremos detectar si el problema está en una estenosis arterial de la arteria dadora, en las arterias más distales o, por el contrario, se trata de una isquemia debida a la inversión del flujo en la arteria distal a la anastomosis, no compensada correctamente. Podremos evaluar el flujo en la arteria distal a la anastomosis, su dirección del flujo basal y tras la compresión de la fístula. Por tanto, tendremos un estudio exhaustivo del acceso vascular que nos permitirá plantear un tratamiento específico de revascularización, en el caso que esté indicado.
Otras disfunciones: aneurismas, pseudoaneurismas y hematomas, seromas
El eco Doppler también puede ser de gran utilidad para diferenciar, en alguna ocasión, grandes hematomas de pseudoaneurismas o aneurismas y determinar las características anatómicas y hemodinámicas.
Punción ecoguiada del acceso vascular
El control ecoguiado de la punción del acceso vascular puede ser de gran utilidad en manos experimentadas, especialmente en accesos de difícil punción, por ser profundos, por tener un frémito débil, en las primeras punciones o tras complicaciones de la punción.
Si bien es cierto que no existe suficiente evidencia científica como para recomendar su uso sistemático en todas las punciones de los accesos (5), se ha demostrado que reduce el tiempo para el inicio de la hemodiálisis, mejora la canulación y disminuye el número de complicaciones locales.
Para concluir, el eco Doppler es una herramienta muy útil en los pacientes con enfermedad renal crónica terminal. Mejora la maduración, la utilidad y la supervivencia de las fístulas arteriovenosas nativas y protésicas, aumentando así la calidad y la expectativa de vida del paciente.