Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Archivos de Zootecnia
versión On-line ISSN 1885-4494versión impresa ISSN 0004-0592
Arch. zootec. vol.58 no.223 Córdoba sep. 2009
Rendimiento de terneros alimentados con silo de maíz o láctico con un promotor de la fermentación ruminal
Productive response in steers fed corn silage, or lactic silage enriched with a ruminal fermentation improver
Galina, M.A.1A, M.A. Ortiz-Rubio1, F. Mondragón1, M. Delgado-Pertíñez2 y A. Elías3
1Facultad de Estudios Superiores Cuautitlán. Universidad Nacional Autónoma de México. Carretera Cuautitlán-Teoloyucan km 3,5. C.P. 54720. Cuautitlán. México. Amiguelgalina@correo.unam.mx
2Departamento de Ciencias Agroforestales. Universidad de Sevilla. Sevilla. España.
3Instituto de Ciencia Animal. Las Lajas. La Habana. Cuba.
Investigación apoyada por DGAPA IN211701 UNAM, Cátedra SP FES-C.
RESUMEN
Se efectuó el engorde de 120 bovinos (296 ± 6,9 kg) machos cruzados de Cebú durante 120 días divididos en tres tratamientos. Tratamiento 1: 40 animales alimentados con ensilaje normal de maíz (EN). Tratamiento 2: n= 40 animales alimentados con ensilaje inoculado con probiótico láctico enriquecido en N no proteico (NNP) (EP). Tratamiento 3 (EPS): 40 bovinos alimentados con EP más un suplemento nitrogenado de lento consumo (SNLC). Se emplearon tres toros canulados para estudiar la cinética ruminal y la digestibilidad in vivo. La concentración de NH3 en el fluido ruminal fue significativamente menor en EN (15 mg/100 ml) que en EP y EPS (18 y 22 mg/100 ml, respectivamente). La degradabilidad in situ de la FND fue 28% en EN, 38% para EP y 48% en EPS (p<0,05). El coeficiente de digestibilidad aparente de la MS fue significativamente menor en EN (57%) comparado con 68% en EP y 70% en EPS. El consumo voluntario fue menor (p<0,05) en EN (90 g/kg0,75/d) comparado con 120 y 140 g/kg0,75/d para EP y EPS respectivamente. Se observó un aumento en la ingestión de N de 72 g/d (EN) a 218 g/d (EP) y 277 g/d en EPS, aunque no se observan diferencias en la eficiencia de utilización entre los tratamientos EP y EPS. La digestibilidad aparente del N aumentó de un 73% para EN a un 76% para EP y EPS. Las cuentas de lactobacilos fueron de 1,6 millones/ml en EN, 10,5 en EP, a 12,5 millones/ml en el EPS. La excreción de derivados púricos aumentó en las dos dietas con el probiótico (p<0,05). Las ganancias diarias de peso fueron diferentes (p<0,05) para las 3 dietas (0,874 kg/d para EN, 1,172 para EP y 1,250 para EPS). La oferta de ensilaje de maíz enriquecido con probióticos con o sin suplemento nitrogenado de lento consumo incrementó la ganancia de peso en bovinos en engorde mejorando el proceso de fermentación ruminal e incrementando la producción de proteína microbiana.
Palabras clave: Nitrógeno no proteico. Digestibilidad in vivo. Fisiología ruminal.
SUMMARY
A feeding trial was carried out with 120 steers (296 ± 6.9 kg) crosses of Zebu during 120 days divided in three treatments. Treatment 1: 40 animals fed corn silage (EN). Treatment 2: n= 40 fed silage enriched a lactic probiotic enriched with a NPN source (EP). Treatment 3 (EPS): 40 steers fed EP plus a slow intake nitrogen supplement (SNLC). Three steers fixed with rumen cannula were used to study ruminal kinetics and in vivo digestibility. Ruminal NH3 was significant lower in EN (15 mg/ 100 ml) than EP and EPS (18 and 22 mg/100 ml respectively). The degradability of NDF, measured in situ, was 28% in EN, 38% in EP and 48% in EPS (p<0.05). Dry matter apparent digestibility was significantly lower in EN (57%) compared with 68% in EP and 70 % in EPS. The voluntary intake was lower (p<0.05) in EN (90 g/kg0.75/d) compared with 120 and 140 g/kg0.75/d in EP and EPS respectively. An increase was observed in N intake from 72 g/d (EN) to 218 g/d (EP) and 277 g/ d in EPS. N digestibility increased from 73% in EN to 76% in EP and EPS. Lactobacilli counts were 1.6 millions/ml in EN, 10.5 in EP and 12.5 million/ml in EPS. Purines derivatives excretion increased in both diets with probiotic (p<0.05). Daily body weight gain differed (p<0,05) in the three diets (0.874 kg/d in EN, 1.172 in EP and 1.250 in EPS). The offer of silage with probiotic with or without the slow intake nitrogen supplement increased the body weight gain in feedlot steers, improving ruminal fermentation and increasing microbial protein.
Key words: Non-protein N. In vivo digestibility. Rumen physiology.
Introducción
En los últimos años se ha obtenido un conocimiento significativamente más preciso de la degradación de la fibra en el rumen, que ha permitido el desarrollo de sistemas de manejo alternativos con o sin suplementación para mejorar la calidad del producto (Galina et al., 2007a). Por otra parte, el conocimiento de la importancia de la degradación del nitrógeno por los microorganismos ruminales ha permitido una inclusión racional de la urea en las dietas, además de tratamientos mecánicos o químicos de los forrajes que mejoran su digestibilidad (Ortiz-Rubio et al., 2007). Se ha documentado que la adición al alimento de ciertos microorganismos ha dado como resultado una disminución de bacterias patógenas en el intestino en las ovejas, mejorando el crecimiento, engorde y el índice de conversión, además de incrementar la digestibilidad de la fibra (Lema et al., 2001).
Una de las tecnologías disponibles para mejorar el valor nutritivo de los forrajes fibrosos la constituye el uso de cultivos de microorganismos como agentes que faciliten la degradación de la fibra formando proteína bacteriana (Galina et al., 2007b; 2007c). Algunas de las especies utilizadas son los hongos Pleurotus oestreatus y Streptomyces spp, entre otros; las bacterias Acetobacter o Lactobacillus y entre las levaduras destaca el uso de Saccharomyces cerevisiae (Newbold et al., 1995). El uso de ensilajes de fermentación láctica con Streptococcus lactis, S. cremoris, Saccharomyces lactis o Lactobacillus spp es una alternativa importante para la alimentación de los bovinos, sobre todo si se pueden elaborar en forma artesanal a base de cultivos lácticos. El ensilaje de planta completa de maíz ha sido una alternativa relativamente poco utilizada, y mucho menos cuando se ha adicionado de bacterias lácticas (Elías, 1983).
El presente trabajo tuvo como objetivo comparar en bovinos de engorde los efectos que sobre la ganancia de peso y la cinética ruminal tienen la incorporación de un probiótico láctico enriquecido en NNP a un ensilaje de maíz simple y la adición a esta mezcla de un suplemento nitrogenado de consumo lento.
Material y métodos
La investigación fue realizada en el Rancho Suchitlán ubicado en Colima (México), a 19o12' de latitud norte y 103o49' de longitud oeste y una altitud de 390 msnm. El clima es Awo con lluvias de mayo a septiembre, con precipitación pluvial de 800 a 900 mm al año y con una temperatura media anual de 25oC (García, 1973). Se prepararon dos ensilajes de maíz de 60 toneladas, uno sin inóculo de probiótico láctico como control y un segundo adicionado del inóculo. El inóculo se preparó con 5 kg de excreta de ave, 1 kg de urea, 20 kg de melaza y dos litros de cultivo láctico (Lactobacillus plantarum, L. helvaticus, L. delbrueckii, Lactococcus lactis L. cremoris, Leuconostoc mesenteroides, Bifidus essensis y Sacharomyces cerevisiae) diluidos en 180 litros de agua. El probiótico (inóculo) se adicionó al ensilaje con ayuda de una regadera de mano de jardinería, a razón de 50 litros del inóculo por 1000 kg de ensilaje, después de esparcir capas de maíz picado de 10 cm de espesor. Al ensilaje se le adicionó simultáneamente al voleo 1,0 % de urea (10 kg /1000 kg) y 0,5% de sulfato de amonio (5 kg/ 1000 kg).
Una vez preparados los ensilados, se realizó un engorde de 120 bovinos machos cruzados de cebú durante 120 días con tres tratamientos. En el tratamiento uno (EN), 40 animales (298 ± 7,4 kg) se alimentaron con ensilaje normal de maíz (EN). En el segundo tratamiento (EP), a 40 animales (297 ± 7,6 kg) se les ofertó el silo de maíz inoculado con el probiótico láctico enriquecido en NNP (EP). El tercer tratamiento (EPS), se formó con 40 animales (295 ± 5,6 kg) alimentados con EP más 1,5 kg materia fresca/d/animal de un suplemento nitrogenado de lento consumo (SNLC), formado por una mezcla de melaza (18%), harina de algodón (16%), cascarilla de arroz (10%), maíz (14%), excretas de ave (10%), harina de pescado (8%), cebo de res (10%), sal común (4%), carbonato cálcico (3%); cemento (1%), sales minerales (2%), ortofosfato cálcico (2%) y sulfato de amonio (2%). En todos los tratamientos, la oferta del ensilaje se llevó a cabo 3 veces al día, asegurando siempre un 10% de rechazo. Todos los animales tuvieron libre acceso al agua.
La tabla I recoge la composición química de los ensilados y del SNLC. Los análisis de la composición química se realizaron de acuerdo a la metodología de la AOAC (1995). La determinación de la fibra fue realizada según la metodología de Van Soest y Wine (1967). El extracto libre de nitrógeno se determinó con la ecuación: ELN, % = 100 - (humedad + PC + EE + FC + cenizas).
Se utilizaron tres toros canulados en el rumen (325 ± 27 kg) alojados en compartimentos individuales para analizar la cinética ruminal, degradabilidad y la digestibilidad in vivo del ensilado de maíz, bajo un diseño de cuadrado latino 3x3 con periodos experimentales de 21 días, 14 días de adaptación y 7 días para muestreo. La dietas utilizadas fueron las mismas que las ofertadas a los animales de engorda.
La digestibilidad in vivo de la materia seca, materia orgánica y FND fue determinada a partir de la colección total de heces y el consumo de alimento, durante los días 15, 16 y 17 de cada periodo. La degradabilidad de las fracciones de fibra fue calculada mediante los modelos sugeridos por Waldo et al. (1972) y Allen and Mertens (1988) modificados por Singh et al. (1992):

Donde:
A es la cantidad del material potencialmente degradable in el rumen, B es la cantidad de nutrientes no degradables en rumen, kd es la constante de digestión, kP la taza de pasaje, y t es el tiempo en horas, tomando 72 h como punto de fermentación para definir la fracción no degradable (Smith et al., 1972).
El tiempo medio de desaparición fue determinado con la ecuación de Kempton (1980):

Donde:
t1/2 es el tiempo medio, 0,693 es el logaritmo natural de 2, k es la tasa de desaparición.
La degradabilidad in situ fue realizada los días 18-21 de cada periodo experimental, con la técnica de bolsa de nylon (Ørskov et al., 1980), utilizando bolsas de nylon de 7 x 15 cm, con un tamaño de poro de 53 (± 10) micras (Ankom, USA). Dentro de las bolsas, se colocaron 3 gramos de muestra de ensilaje de maíz con un tamaño de partícula de 3 mm; las bolsas se incubaron en el rumen durante 8, 16, 24, 48, 72 y 96 horas. Al final del tiempo de incubación, el material fue retirado del rumen para ser lavado durante períodos de 10 minutos en un agitador mecánico, hasta que el fluido de lavado fue transparente. Posteriormente se secó a 65oC durante 48 horas. Al material residual se le determinó el contenido de materia seca (AOAC, 1995). Las bolsas correspondientes a la hora cero sólo se sometieron a lavado para determinar la cantidad de material soluble en la muestra. La degradabilidad in situ de la MS se determinó con la ecuación propuesta por Ørskov y McDonald (1979) donde se describe la curva de degradación de la materia seca; ajustándose a la ecuación:
![]()
Donde:
Pt es la pérdida por degradación después del tiempo t (horas); a es el intercepto por extrapolación de la curva de degradación a t=0; b es la asíntota de la exponencial b (1-e-ct), la cual está regida por el tiempo t; c es la tasa constante de degradación de la exponencial.
De esta manera, b y c definen la tasa de la degradación del forraje.
El balance de nitrógeno se obtuvo mediante la colección total de heces y orina (días 15-17 de cada periodo experimental). Se determinó la cinética de pH y NH3 ruminal, para lo cual se obtuvo liquido ruminal a las 0, 2, 4, 6, 8 y 12 horas, separándose en dos porciones. La muestra para amoníaco (NH3) se adicionó de 0,1 ml de HCl (0,1N) para evitar su volatilización, cuantificándose posteriormente en laboratorio con un electrodo de ión selectivo (Orion Research, USA). El pH se cuantificó inmediatamente después de tomada la muestra por potenciometría, utilizando un electrodo portátil (Orion Research, USA). La producción diaria de orina fue recogida los tres primeros días de muestreo en contenedores con solución de H2SO4 al 10% para asegurar un pH menor a 3. La cantidad de H2SO4 varió de acuerdo con el volumen de orina producido. La determinación de los derivados de purinas se llevó a cabo siguiendo las instrucciones de Chen y Gomes (1992).
Las muestras para la identificación de los microorganismos ruminales procedían del primer día de muestreo. El lapso entre la toma de muestra y el inicio del análisis en anaerobiosis no fue mayor de 10 minutos. La población de lactobacilos fue determinada por la técnica descrita por Elías (1971).
El pesaje de los animales se realizó mensualmente. Los resultados de ganancia de peso se analizaron por medio de un análisis de varianza, con un diseño completamente al azar y un nivel de significación de p<0,05. En el modelo estadístico de cuadro latino 3 x 3 para el análisis de parámetros ruminales y digestibilidad, las diferencias entre medias fueron evaluadas mediante la prueba de Tukey (p<0,05) con el programa estadístico SAS (1996).
Resultados
En la tabla II se muestran la ganancia de peso, el consumo de materia seca y el índice de conversión para los diferentes tratamientos. La administración del EPS produjo una mayor (p<0,05) ganancia diaria de peso e ingestión de materia seca que los tratamientos EN y EP, si bien ambos parámetros fueron mayores (p<0,05) en los animales del grupo EP que en el control. El índice de conversión del alimento fue superior en el EPS con respecto a los tratamientos EP y EN, sin diferencia entre EN y EP.
En la tabla III se muestra el balance de N y la digestibilidad aparente in vivo de las diferentes dietas. Para las dietas EP y EPS se observaron mayores (p<0,05) valores de nitrógeno consumido, N fecal, N urinario, retención de N, eficiencia de utilización del N y digestibilidad aparente (%) que para la dieta control. No existieron diferencias (p>0,05) en la eficiencia de utilización del N, digestibilidad de la materia seca y la materia orgánica entre los tratamientos EP y EPS, pero los valores fueron superiores a los del EN (p<0,05).
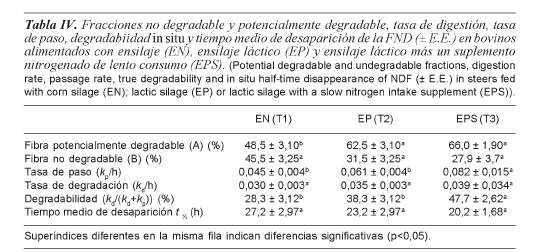
Los valores de los parámetros de la cinética de degradación ruminal de la FND se muestran en la tabla IV. La degradabilidad ruminal aumentó significativamente con la adición del probiótico en los tratamientos EP y EPS. El tiempo medio de desaparición disminuyó en los tratamientos EP y EPS al aumentar la degradabilidad de las paredes celulares.
La figura 1 muestra las variaciones de pH ruminal en los animales fistulados con las tres dietas. En los animales que recibían el ensilaje de maíz solo (EN) bajó el pH en las primeras horas, pero los animales del tratamiento EP tuvieron una disminución menor que los anteriores, mientras que en el tratamiento EPS se observó una estabilización del pH ruminal.
La figura 2 muestra la degradabilidad in situ del ensilaje de maíz en bolsa de nylon. Como se puede observar, el porcentaje de degradación fue menor para la dieta control
La figura 3 muestra la evolución de la concentración en amoníaco en el fluido ruminal en los tres tratamientos. Las concentraciones a las 6 y 8 horas tras la ingestión fueron superiores (p<0,05) para los animales que recibían las dietas EP y EPS que para los que recibían la dieta control.
En la tabla V se resumen los efectos de los tratamientos experimentales sobre la excreción urinaria de los derivados púricos. La excreción diaria de los derivados púricos (mmol/kg0,75) fue mayor (p<0,05) para las dietas EP y EPS que para la dieta control.
Las concentraciones de los lactobacilos fueron de 1,6 millones/ml para el primer día manteniéndose en ese rango en el tratamiento EN, y aumentando progresivamente hasta 10,5 millones/ml con la adición del probiótico en el tratamiento EP y 12,5 millones/ml para el EPS (p<0,05). En los tratamientos EP y EPS la suma de colonias fue siempre superior a los 10 millones.
Discusión
Con anterioridad han sido identificados una serie de factores que favorecen un buen ambiente ruminal (pH, nitrógeno, aminoácidos esenciales, nivel de carbohidratos fermentables, ácidos grasos de cadena ramificada, microminerales específicos, azufre, fósforo etc.) como elementos claves para la utilización de los forrajes fibrosos (Galina et al., 2007b). El aumento de la ingestión de materia seca observado para las dietas EP y EPS en el presente trabajo se puede explicar en función de una mayor degradación de las paredes celulares por las bacterias fibrolíticas, que se traduce en un incremento en la tasa de desaparición en el rumen, con un aumento del consumo, como fue demostrado recientemente al agregar un suplemento de lento consumo (Galina et al., 2007b).
Los resultados del presente trabajo indican crecimientos razonables con el ensilaje de maíz (874g/d), que fueron incrementados significativamente con el ensilaje sembrado con el probiótico (EP) o adicionando el SNLC (EPS) (tabla II). Sin embargo, no se observaron diferencias significativas entre los tratamientos EP y EPS, debido probablemente a que ambas dietas proporcionaron un nivel óptimo de amoníaco en el liquido ruminal para un buen desarrollo de las bacterias del rumen (Ortíz-Rubio et al., 2007; Puga et al., 2001). El aumento de consumo del ensilaje hasta alcanzar más de 100 g/kg0,75 y día (EP) cuando se compara con otros trabajos que señalan como máximo 100 g/kg0,75 (Ortíz-Rubio et al., 2002) fue probablemente producto de su mayor degradación por las bacterias celulolíticas, principalmente Fibrobacter succinogenes, Ruminococcus albus, R. flavefaciens (Ørskov,1994), que puede traducirse en una mayor tasa de paso. Con respecto a otros elementos claves para una buena fermentación ruminal, el azufre y fósforo necesarios se adicionaron por tres vías, en la melaza, como fósforo soluble y en la mezcla mineral (Puga et al., 2001). El índice de conversión sólo fue significativo en el último tratamiento, probablemente por el uso de suplemento.
En este ensayo se alcanzaron niveles medios de amoníaco de 18 y 22 mg/100 ml para las dietas EP y EPS respectivamente (tabla III), mientras que únicamente se alcanzaron 15 mg/100 ml para EN. Una mayor concentración de NH3 permitirá un incremento en el crecimiento bacteriano en el rumen (Ortíz-Rubio et al., 2007). Sudana y Leng (1986) demostraron la importancia de mantener niveles continuos de amoníaco ruminal. En el presente ensayo las mezclas de melazaurea y salurea permitieron un consumo durante 8 horas del SLNC con el ensilaje láctico tras la oferta del alimento. Con la excreta de pollo el SNLC provee aminoácidos claves con una mezcla adecuada de sales minerales (Ørskov, 1994). La proteína de baja degradabilidad ruminal de la harina de algodón, harina de pescado y la cascarilla de arroz permiten explicar los resultados observados por su efecto en la digestibilidad post-ruminal (Leng, 1990). El uso de la melaza como una fuente barata de carbohidratos aunada a los efectos buffer del cemento contribuyen a explicar los resultados debido a la conjugación de elementos que mantienen un pH adecuado para la reproducción de las bacterias con un microambiente propio para la acción cinética de sus enzimas fibrolíticas y los carbohidratos imprescindibles para la formación del ATP (Puga et al., 2001).
Los resultados de excreción de los derivados púricos (tabla V) fueron similares a los observados por Dawson et al. (1990), que señalaron un aumento significativo del número de bacterias ruminales en becerros con una dieta de forrajes suplementada con probióticos. Trabajos posteriores han demostrado que el tratamiento con probióticos (Lactobacillus y levaduras) incrementa el número de bacterias celulolíticas en el rumen y en algunos casos aumentan la degradación ruminal (Dawson et al., 1990; Newbold et al., 1995). El aumento de la tasa de degradación observado para los tratamientos EP y EPS (tabla IV) demuestra el efecto de degradación de paredes celulares probablemente por el aumento del número de bacterias celulolíticas (Galina et al., 2007c). Se observó también un aumento de la digestibilidad in vivo de la MS, y un menor tiempo medio de desaparición de la FND del rumen (in situ) lo cual indica una mayor tasa de desalojo del rumen, que contribuiría a explicar el aumento del consumo (tabla II) junto al aumento de la fermentación ruminal (Ortíz-Rubio et al., 2007). Newbold et al. (1995) sugieren que Aspergillus oryzae y Saccaromices cervisiae pueden estimular la tasa de degradabilidad de la fibra por los microorganismos ruminales. El aumento en la excreción de derivados púricos indicaría también un incremento de proteína bacteriana, que permitiría explicar los resultados. Por el contrario, Jouany et al. (1998) no observaron diferencias significativas en el crecimiento microbiano ruminal en ovejas que recibieron raciones suplementadas con Saccharomyces cerevisiae o Aspergillus oryzae.
Conclusiones
La utilización de ensilajes inoculados con probióticos y con un suplemento nitrogenado de lento consumo produjo una mejora de la respuesta productiva de bovinos de engorde. La utilización de los probióticos incrementó significativamente la degradación ruminal del forraje, formando una cantidad significativamente mayor de proteína bacteriana.
Bibliografía
Allen, M.S and D.R. Mertens. 1988. Evaluating constraints on fibre digestion by rumen microbes. J. Nutr., 188: 261-270. [ Links ]
AOAC. 1995. Official methods of analysis. 16th Ed. Association of Official Agricultural Chemists. Washington. D.C. USA. 600 p. [ Links ]
Chen, X.B. and M.J. Gomes. 1992. Estimation of microbial protein supply to sheep and cattle based on urinary excretion of purine derivatives an overview of the technical details. IFRU-Rowett Research Institute. Occasional Publication. 21 p. [ Links ]
Dawson, K.A., K.E. Newman and J.A. Boling. 1990. Effects of microbial supplements containing yeast and lactobacilli on roughage fed ruminal microbial activities. J. Anim. Sci., 68: 3392. [ Links ]
Elías, A. 1971. The rumen bacteria of animals fed on a high molassesurea diet. PhD Thesis. University of Aberdeen Sctoland. UK. 310 p. [ Links ]
Elías, A. 1983. Los pastos en Cuba. Tomo 2. ICA. La Habana. Cuba. [ Links ]
Galina, M.A., F. Osnaya, H.M. Cuchillo and G.F.W. Haenlein. 2007a Cheese quality from milk of grazing or indoor fed Zebu cows and Alpine crossbred goats. Small Rum. Res., 71: 264-272. [ Links ]
Galina, M.A., M. Guerrerro and D.C. Puga. 2007b. Fattening Pelibuey lambs with sugar cane tops and corn complemented with or without slow intake urea supplement. Small Rum. Res., 70: 101-109. [ Links ]
Galina, M.A., M.A. Ortíz-Rubio, M. Delgado-Pertíñez and L.J. Pineda. 2007c. Effect of a lactic probiotic supplementation on goat kids growth. 12th Seminar of the Sub-network FAO-CIHEAM on Sheep and Goat Nutrition. October 11-13, 2007. Thessaloniki (Greece). [ Links ]
García, E. 1973. Modificaciones al sistema de clasificación climática de Köppen (Modifications of Köppen climatic classification system). Instituto de Geografía, UNAM. México, D.F. 33 p. [ Links ]
Jouany, J.P., F. Mathieu, J. Senaud, J. Bohatier, G. Bertin and M. Mercier. 1998. Effect of Saccharomyces cerevisiae and Aspergillus oryzae on the digestion of nitrogen in the rumen of defaunated and refaunated sheep. Anim. Feed Sci. Technol., 75: 1-13. [ Links ]
Kempton, T.J. 1980. El uso de bolsa de nylon para caracterizar el potencial de degradabilidad de alimentos para rumiantes. Prod. Anim. Trop., 5: 115-1126. [ Links ]
Lema, M., L. Williams and D.R. Rao. 2001. Reduction of fecal shedding of enterohemorrhagic Escherichia coli O 1 57:H7 in lambs by feeding microbial feed supplement. Small Rumin. Res., 39: 31-39. [ Links ]
Leng, R.A. 1990. Factors affecting the utilization of "poor quality" forages by ruminant animals particularly under tropical conditions. Nutr. Res. Rev., 3: 277-303. [ Links ]
Newbold, C.J., R.J. Wallace, X.B. Chen and F.M. McIntosh. 1995. Different strains of Saccharomyces cerevisae differ in their effects on ruminal bacterial numbers in vitro and in sheep. J. Anim. Sci., 73: 1811-1818. [ Links ]
Ørskov, E.R. 1994. Recent advances in understanding of microbial transformation in ruminants. Livest. Prod. Sci., 39: 53-60. [ Links ]
Ørskov, E.R., F.D. Hovell y F. Mould. 1980. Uso de la técnica de la bolsa de nylon para la evaluación de los alimentos. Prod. Anim. Trop., 5: 213-233. [ Links ]
Ørskov, E.R. and I. McDonald. 1979. The estimation of protein degradability in the rumen from incubation measurements weighted according to rate of passage. J. Agr. Sci., 92: 499-503. [ Links ]
Ortiz-Rubio, M.A., E.R. Ørskov, J. Milne and H.M.A. Galina. 2007. Effect of different sources of nitrogen on in situ degradability and feed intake of Zebu cattle fed sugarcane tops (Saccharum officinarum). Anim. Feed Sci. Technol., 139: 143-158. [ Links ]
Ortíz-Rubio, R.M.A., M.A. Galina and M.M.A. Carmona. 2002. Effect of a slow non-protein nitrogen ruminal supplementation on improvement of Cynodon nlemfuensis or Brachiaria brizanta utilization by Zebu steers. Livest. Prod. Sci., 78: 125-131. [ Links ]
Puga, D.C., M.A. Galina, F. Pérez-Gil, G.L. Sanguinez, B.A. Aguilera and G. Haenlein. 2001. Effect of a controlled-released urea supplement on rumen fermentation in sheep fed a diet of sugar cane tops (Saccharum officinarum), corn (Zea mays) and king grass (Penisetum purpureum). Ruminal fermentation. Small Rum. Res., 39: 269-276. [ Links ]
SAS. 1996. Statistical Analysis System. User's Guide: Statistics, Version 6th Edition. SAS Institute Inc. Cary, North Carolina. USA. [ Links ]
Singh, B., H.P.S. Makkar and S.S. Negi. 1992. The kinetics of digestion in ruminants. A review. Indian. J. Dairy Sci., 43: 90-99. [ Links ]
Smith, L.W., H.R. Goering and C.H. Gordon. 1972. Relationships of forage compositions with rates of cell wall digestion and indigestibility of cell wall. J. Dairy Sci., 55: 1140-1147. [ Links ]
Sudana, I.B. and R.A. Leng. 1986. Effects of supplementing a wheat straw diet with urea or urea-molasses block and/ or cottonsead meal on intake and liveweight changes in lambs. Anim. Feed Sci. Technol., 16: 25-35. [ Links ]
Van Soest, P.J. and R.H. Wine. 1967. Use of detergents in the analysis of fibrous feeds. IV. Determination of plant cell-wall constituents. J. Assoc. Offic. Anal. Chem., 50: 50-55. [ Links ]
Waldo, D.R., L.W. Smith and E.L. Cox. 1972. Model of cellulose disappearance from the rumen. J. Dairy Sci., 55: 125-129. [ Links ]
Recibido: 12-7-07.
Aceptado: 14-5-08.