Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Archivos de Zootecnia
versión On-line ISSN 1885-4494versión impresa ISSN 0004-0592
Arch. zootec. vol.63 no.241 Córdoba mar. 2014
https://dx.doi.org/10.4321/S0004-05922014000100014
Estudio de microsatélites en las abejas sin aguijón Melipona colimana y M. beecheii de Mesoamérica
Study of microsatellite markers in stingless bees Melipona colimana and M. beecheii from Mesoamerica
Hurtado-Burillo, M.1*; Martínez, J.1A; May-Itzá, W. de J.2A; Quezada-Euán, J.J.G.2B y De la Rúa, P.1B
1Departamento de Zoología y Antropología Física. Facultad de Veterinaria. Universidad de Murcia. Murcia. España. *miguel.hurtado@um.es; Atinto1984@yahoo.es; Bpdelarua@um.es
2Departamento de Apicultura. Facultad de Medicina Veterinaria y Zootecnia. Universidad Autónoma de Yucatán. Itzimná. Mérida, Yucatán. México. Amayitza@uady.mx; Bqeuan@uady.mx
Este trabajo ha sido financiado por la Fundación BBVA, el Fondo de Cooperación Internacional en Ciencia y Tecnología Unión Europea - México (FONCICYT) (proyecto MUTUAL 94.293) y SEP-CONACYT (proyecto 103341).
RESUMEN
En este estudio, se ha analizado por primera vez la variabilidad de los loci de microsatélites en la especie silvestre de abejas sin aguijón Melipona colimana. Los datos obtenidos se han comparado con los de una población insular de la especie domesticada M. beecheii. Los resultados del genotipado de los individuos de M. colimana, indican que la secuencia de los loci de microsa-télites está conservada dentro del género Melipona. Los parámetros poblacionales estudiados (número de alelos y valores de heterocigosidad) no mostraron diferencias significativas entre las dos especies estudiadas, estando ambos dentro del rango observado en otras especies del género. Estos valores fueron inferiores en la población insular de M. beecheii con respecto a otras poblaciones continentales de la misma especie analizadas previamente, lo cual coincide con lo observado en estudios previos de otros organismos insulares. La especie silvestre M. colimana es susceptible a los efectos de la deforestación, por ello se han comparado parámetros poblacionales de colmenas situadas en una zona deforestada y en otra conservada. La diversidad poblacional no ha mostrado diferencias significativas, probablemente debido a que las perturbaciones del medio estudiado son recientes y aún no se han reflejado en la diversidad genética de estos insectos.
Palabras clave: Diversidad genética. Deforestación. Meliponicultura. México. Cuba.
SUMMARY
In this study, variability of microsatellite loci has been for the first time analyzed in the wild stingless bee Melipona colimana. Data have been compared with those obtained from an insular population of the managed species M. beecheii. Genotyping results in M. colimana demonstrate that microsatellite loci sequences are conserved within the genus Melipona. Population parameters such as number of alleles and heterocigosity values, were not significantly different between the two studied species, both being within the observed range in other Melipona species. Values of the insular M. beecheii population were lower than in previously studied continental populations of the same species, in agreement with the results obtained in other island organisms. Wild M. colimana colonies are susceptible to deforestation effects, so that, we have compared the genetic parameters of colonies from a deforested area with those of a conserved area. Population diversity was not significantly different, may be due to recent environmental perturbations that are not yet reflected in the genetic diversity of these insects.
Key words: Genetic diversity. Deforestation. Meliponiculture. Mexico. Cuba.
Introducción
Las abejas sin aguijón son insectos eusociales (Apidae: Meliponini) que se distribuyen por las zonas tropicales del planeta, conociéndose alrededor de 500 especies de 42 géneros diferentes (Michener, 2007; Camargo y Pedro, 2008). El género Melipona abarca unas 40 especies presentes en la zona tropical americana (Michener, 2007), entre las que se encuentran Melipona colimana Ayala, 1999 y M. beecheii Bennett, 1831. M. colimana es endémica de la provincia mexicana de Jalisco, aparece en bosques de pino-encino a más de 1000 metros de altitud, en donde habita en los troncos de los árboles y no es manejada para la producción de miel (Quezada-Euán, 2005). Sin embargo, M. beecheii es el meliponino más común en México con una amplia distribución a lo largo de las dos costas y la península de Yucatán, así como en Belice, Cuba y Jamaica, aunque su distribución por el Caribe podría estar influida por su uso en la meliponicultura. A diferencia de M. colimana, esta especie es explotada desde épocas precolombinas para la producción de miel, cera y polen, siendo manejadas en jobones o cajas especialmente diseñadas para ello.
Las abejas sin aguijón juegan un papel esencial en la producción primaria de los ecosistemas al ser polinizadoras de multitud de especies vegetales (Roubik, 1989). Su importancia ecológica radica también en la especificidad que presentan determinadas plantas para ser polinizadas por ellas: aproximadamente un 33% de las plantas de selvas tropicales son exclusivamente visitadas por estas abejas (Wilms et al., 1996). Además son efectivas polinizadoras en invernaderos (Kakutani et al., 1993). A causa de su necesidad de árboles maduros, vivos y huecos, para hacer sus nidos (González-Acereto, 2008), de su reducida capacidad de dispersión, debida a la corta distancia de vuelo de las obreras y el escaso movimiento de sus enjambres (Imperatriz-Fonseca y Engels, 1990; Roubik, 2006), las especies silvestres son especialmente susceptibles de extinción en zonas sometidas a amenazas de origen antrópico como la fragmentación, destrucción y degradación de los hábitats, el uso de herbicidas y pesticidas que reducen la disponibilidad de plantas silvestres y con ello su fuente de alimento (Kerr et al., 2001). Por ello, es fundamental evaluar la diversidad genética de las poblaciones ya que su disminución conlleva una reducción del potencial adaptativo de las especies. Entre las herramientas moleculares, los microsatélites han sido usados en estudios de genética de poblaciones de abejas sin aguijón (Borges et al., 2010; Quezada-Euán et al., 2007, 2012). Lopes et al. (2010) demostraron que el uso de microsatélites específicos dio una mayor frecuencia de polimorfismo y de alelos por locus en dos especies del género Melipona que al usar marcadores diseñados para otras especies del mismo género. Igualmente Viana et al. (2011) pusieron en marca el análisis de microsatélites en cuatro especies de Melipona usando cebadores diseñados para otras especies del mismo género.
El objetivo del presente estudio es poner en marcha el análisis de marcadores microsatélites en la especie silvestre M. colimana. Para probar su eficacia se compararon los resultados con los obtenidos en la especie manejada M. beecheii. De esta especie ya se tienen datos sobre la variabilidad de los mismos loci de microsatélites en poblacionales continentales (Quezada-Euán et al., 2007) por lo que se ha usado como referencia. Una vez que se constató la efectividad de estos marcadores en la especie, se compararon parámetros poblacionales obtenidos en colonias de M. colimana situadas en una zona recientemente deforestada con los de colonias de una zona conservada, para evaluar el efecto de dicha actuación en la diversidad genética de esta especie.
Material y métodos
Se han estudiado un total de 60 colonias silvestres de M. colimana de dos áreas del estado de Jalisco, una conservada (Tecalitlán) y la otra deforestada (San Isidro), más otras 30 colonias manejadas de M. beecheii de Cuba (tabla I, figura 1). M. colimana presenta una distribución restringida a áreas específicas de la provincia biogeográfica del Eje Volcánico Transversal (Yañez-Ordoñez, 2008) por lo que es difícil encontrar colonias de esta especie. Sin embargo, M. beecheii es la especie más común de su género en Mesoamérica y tiene una amplia distribución (Ayala, 1999). En ambos casos, se muestrearon abejas obreras adultas del interior del nido de cada colmena y se conservaron en etanol absoluto a -20 oC.
La extracción de ADN se realizó a partir de dos patas traseras de un ejemplar por colonia. Para la amplificacion de los loci de microsatelites se realizaron dos reacciones multiples de PCR. En la primera reaccion (R1) se amplificaron conjuntamente los loci T4-171 y T7-5 (Paxton et al., 1999), y en la segunda (R2) Mbi254, Mbi259, Mbi278, Mbi28 y Mbi201 (Peters et al., 1998). Las reacciones de amplificacion se prepararon con un volumen total de 12,5 μL con el reactivo PCR beads Pure Taq™ Ready-To-Go™ (GE Healthcare, Buckinghamshire, Reino Unido). El programa de amplificacion fue de 95oC durante 5 minutos de desnaturalizacion inicial, 30 ciclos de 30 segundos a 96oC, 30 segundos a 55oC (R1) o 57oC (R2), y 30 segundos a 72oC, y una elongacion final de 10 minutos a 72oC.
Los productos de PCR se visualizaron por electroforesis capilar en un secuenciador ABI® 3730 DNA (Applied Biosystems, Foster City, CA, EEUU) y con un estándar de tamaño interno (Servei Central de Suport a la Investigació Experimental de la Universidad de Valencia, España). El tamaño de los fragmentos de amplificación se determinó con el programa GeneMapper® v4.0 (Applied Biosystems, Foster City, CA, EEUU). El nivel de polimorfismo fue evaluado mediante parámetros poblacionales (R: rango del tamaño de los alelos de los loci de microsatélites, A: número de alelos, Ho: heterocigosidad observada, He: heterocigosidad esperada) obtenidos con el programa GenAlex v6.41 (Peakall y Smouse, 2006). Para comprobar la presencia de alelos nulos en cada uno de los loci se usó el programa Micro-checker (Van Oosterhout et al., 2004).
Dado el diferente número de ejemplares analizados en cada una de las dos áreas de muestreo de M. colimana, se llevó a cabo un análisis de rarefacción, para estimaciones objetivas de la riqueza alélica (Leberg, 2002), con el programa HP-RARE 1.0 (Kalinowski, 2005). Una vez obtenidos los datos se comprobó si existían diferencias estadísticamente significativas con la prueba t de Student (http://www.physics.csbsju.edu/stats/t-test_bulk_form.html).
Resultados y discusión
Los parámetros de diversidad por locus obtenidos en las dos especies del género Melipona estudiadas se muestran en la tabla II. Todos los loci fueron polimórficos excepto Mbi259, que mostró una sola alternativa alélica de 177 pares de bases (pb) en M. beecheii y 180 pb en M. colimana. En esta última especie, el locus T7-5 también mostró un único alelo de 66 pb. Los valores más altos de riqueza alélica por locus se observaron en M. colimana en los loci T4-171 (6), Mbi201, Mbi254 y Mbi28 (4), mientras que en M. beecheii el mayor valor (4) correspondió a los loci Mbi254, Mbi278 y Mbi28. En cuanto a la media de riqueza alélica para todos los loci se obtuvieron valores similares en ambas especies (3,143 en M. colimana y 3,000 en M. beecheii, diferencia no significativa, p= 0,87). Estos valores están incluidos dentro del rango de variación observado en otras especies de Melipona: desde 1,67 en M. rufiventris (Lopes et al., 2010) hasta 3,78 obtenido en M. bicolor (Peters et al., 1998), especie para la que fueron diseñados parte de los cebadores utilizados.
Los valores de heterocigosidad esperada por locus fueron mayores en M. beecheii (0,276-0,713) que en M. colimana (0,038-0,723) aunque no significativamente diferentes (p= 0,80). La heterocigosidad media esperada (He) de la población insular de M. beecheii (0,411) es algo menor que la obtenida en las poblaciones continentales de M. beecheii estudiadas por Quezada-Euán et al. (2007) de México (0,535) y Costa Rica (0,711). Esto es debido, probablemente, al hecho de que las poblaciones estudiadas en este trabajo son insulares y éstas suelen presentar valores más bajos de heterocigosidad tal y como se ha observado en poblaciones insulares de la abeja de la miel A. mellifera (De la Rúa et al., 2001).
Los bajos valores observados en M. colimana pueden deberse a que los cebadores usados no son específicos de esta especie; ya que los cebadores Mbi fueron diseñados en M. bicolor y T4-17 y T7-5 en Scaptotrigona postica. Estos resultados coinciden con los de Lopes et al. (2010) en los que se obtuvieron valores de riqueza alélica y heterocigosidad más altos en poblaciones de M. rufiventris y M. mondury analizadas con cebadores específicos que cuando se usaron cebadores diseñados en M. bicolor. Otra consecuencia del uso de cebadores no específicos puede ser la presencia de alelos nulos, tal y como se ha observado en el locus Mbi28 en la especie M. colimana. Estos alelos aparecen cuando se produce una mutación en la secuencia de nucleótidos contigua al microsatélite, lo que impide la unión de los cebadores a su secuencia complementaria (Chapuis y Estoup, 2006) y, en consecuencia, la amplificación del fragmento (Callen et al., 1993). Alternativamente, la detección de alelos nulos en este locus en concreto podría deberse a un error analítico dado el reducido número de muestras analizadas. En cualquier caso, la eficacia obtenida en la amplificación indica que las secuencias de estos loci de microsatélites están conservadas en las especies del género Melipona, ya que junto con M. colimana, son seis las especies (M. bicolor en Peters et al., 1998; M. beecheii en Quezada-Euán et al., 2007; M. yucatanica en May-Itzá et al., 2010; M. rufiventris y M. mondury en Lopes et al., 2010) en las que la amplificación de estos mismos loci y el genotipado de los individuos es posible. Se puede concluir por tanto que, si bien se pueden usar cebadores no específicos en estudios de especies filogenéticamente próximas, los resultados deben ser cuidadosamente analizados, para evitar la inclusión de aquellos loci que puedan mostrar alelos nulos en los paneles usados para determinar la diversidad genética.
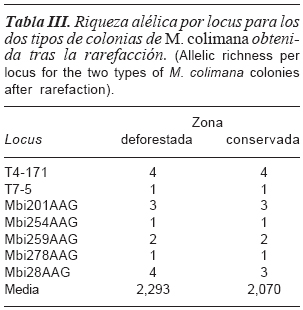
La pérdida de diversidad genética en meliponinos como consecuencia de la degradación de sus hábitats ha sido demostrada en estudios anteriores. Lopes et al. (2010) observaron un descenso de la heterocigosidad en M. rufiventris y M. mondury a causa del reducido número de colonias encontradas como consecuencia de la destrucción y fragmentación de sus ecosistemas naturales. Otros estudios revelaron que la fragmentación de los hábitats afecta en mayor medida a los individuos especialistas que a los generalistas (Kitahara y Fujii, 1994), como es el caso de las abejas sin aguijón (Zayed et al., 2005). En el caso de M. colimana, al no ser una especie explotada para la producción, sus poblaciones están sujetas a los efectos de la deforestación y de la destrucción de su hábitat. Aún así, en este estudio no se observaron diferencias significativas en la riqueza alélica por locus tras el análisis de rarefacción (tabla III) entre las colmenas situadas en la zona deforestada y la conservada, ya que en el momento del muestreo, la zona deforestada apenas llevaba dos años siendo talada (Macías, 2008). El hecho de que la degradación de los hábitats de M. colimana sea tan reciente podría explicar los valores similares en ambas zonas, ya que el tiempo transcurrido no es suficiente para que se aprecie el efecto sobre la pérdida de diversidad genética.
Agradecimiento
Agradecemos la ayuda de O. Sánchez en el laboratorio y de I. Muñoz en el análisis de los datos.
Bibliografía
1. Ayala, R. 1999. Revisión de las abejas sin aguijón de México (Hymenóptera: Apidae: Meliponini). Folia Entomol Mex, 106: 1-123. [ Links ]
2. Borges, A.A.; Campos, L.A.O.; Salomão, T.M.F. and Tavares, M.G. 2010. Genetic variability in five populations of Partamona helleri (Hyme-noptera, Apidae) from Minas Gerais state, Brazil. Genet Mol Biol, 33, 4: 781-784. [ Links ]
3. Callen, D.F.; Thompson, A.D.; Shen, Y.; Phillips, H.A.; Richards, R.I.; Mulley, J.C. and Sutherland, G.R. 1993. Incidence and origins of null alleles in (AC)n microsatellite markers. Am J Hum Genet, 52: 922-927. [ Links ]
4. Camargo, J.M.F. and Pedro, S.R.M. 2008. Meliponini Lepeletier, 1836. Moure, J. S.; Urban, D. and Melo, G.A.R. (Orgs). Catalogue of bees (Hymenoptera, Apoidea) in the Neotropical Region. http://www.moure.cria.org.br/catalogue (10/07/2011). [ Links ]
5. Chapuis, M.P. and Estoup, A. 2006. Microsatellite null alleles and estimation of population differentiation. Mol Biol Evol, 24: 1-11. [ Links ]
6. De la Rúa, P.; Galián, J.; Serrano, J. and Moritz, R.F.A. 2001. Molecular characterization and population structure of the honeybees from the Balearic Islands. Apidologie, 32: 417-427. [ Links ]
7. González-Acereto, J.A. 2008. Cría y manejo de abejas nativas sin aguijón en México. Impresiones Planeta. México. 177 pp. [ Links ]
8. Imperatriz-Fonseca, V.L. and Engels, W. 1990. Caste development, reproductive strategies and control of fertility in honeybees and stingless bees. In: Engels, W. (Ed.). Social insects: an evolutionary approach to castes and reproduction. Springer Verlag. Berlin. pp. 166-230. [ Links ]
9. Kakutani, T.; Inoue, T.; Tezuka, T. and Maeta, Y. 1993. Pollination of strawberry by the stingless bee, Trigona minangkabau, and the honey bee, Apis mellifera: an experimental study of fertilization efficiency. Res Popul Ecol, 35: 95-111. [ Links ]
10. Kalinowski, S.T. 2005. HP-Rare: A computer program for performing rarefaction on measures of allelic diversity. Mol Ecol Notes, 5: 187-189. [ Links ]
11. Kerr, W.E.; Carvalho, G.A.; Silva, A.C. and Assis, M.G.P. 2001. Aspectos pouco mencionados da biodiversidade amazónica. Parcerias Estratégicas, 12: 20-41. [ Links ]
12. Kitahara, M. and Fujii, K. 1994. Biodiversity and community structure of temperate butterfly species within a gradient of human disturbance - an analysis based on the concept of generalist vs specialist strategies. Res Popul Ecol, 36: 187-199. [ Links ]
13. Leberg, P.L. 2002. Estimating allelic richness: effects of sample size and bottlenecks. Mol Ecol, 11: 2445-2449. [ Links ]
14. Lopes, D.M.; Campos, L.A.; Salomáo, T.M. and Tavares, M.G. 2010. Comparative study on the use of specific and heterologous microsatellite primers in the stingless bees Melipona rufiventris and M. mondury (Hymenoptera, Apidae). Genet Mol Biol, 33: 390-393. [ Links ]
15. Macías, J.O.M. 2008. Costos ambientales en zonas de coyuntura agrícola. La horticultura en Sayula (México). Agroalimentaria, 26: 103-118. [ Links ]
16. May-Itzá, W.de J.; Quezada-Euán, J.J.G.; Medina Medina, L.A.; Enríquez, E. and De la Rúa, P. 2010. Morphometric and genetic differentiation in isolated populations of the endangered Mesoamerican stingless bee Melipona yucatanica (Hymenoptera: Apoidea) suggest the existence of a two species complex. Conserv Genet, 11: 2079-2084. [ Links ]
17. Michener, C.D. 2007. The bees of the world. 2nd ed. The Johns Hopkins University Press. Baltimore. USA. 953 pp. [ Links ]
18. Paxton, R.J.; Weisâchuh, N. and Quezada-Euán, J.J.G. 1999. Characterisation of dinucleotide microsatellite loci for stingless bees. Mol Ecol, 8: 685-702. [ Links ]
19. Peakall, R. and Smouse, P.E. 2006. GENALEX 6: Genetic analysis in Excel. Population genetic software for teaching and research. Mol Ecol Notes, 6: 288-295. [ Links ]
20. Peters, J.M.; Queller, D.C.; Imperatriz-Fonseca, V.L. and Strassmann, J.E. 1998. Microsatellite loci for stingless bees. Mol Ecol, 7: 784-787. [ Links ]
21. Quezada Euán, J.J.G. 2005. Biología y uso de las abejas sin aguijón de la península de Yucatán, México (Hymenoptera, Meliponini). Ediciones de la Universidad Autónoma de Yucatán. México. 112 pp. [ Links ]
22. Quezada-Euán, J.J.G.; Paxton, R.J.; Palmer, K.A.; May-Itzá ,W. de J.; Tay, W.T. and Oldroyd, B.P. 2007. Morphological and molecular characters reveal differentiation in a Neotropical social bee, Melipona beecheii (Apidae, Meliponini). Apidologie, 38: 247-258. [ Links ]
23. Quezada-Euán, J.J.G.; May-Itzá, W. de J.; Rincón, M.; De la Rúa, P. and Paxton, R.J. 2012. Genetic and phenotypic differentiation in endemic Scaptotrigona hellwegeri (Apidae: Meliponini): implications for the conservation of stingless bee populations in contrasting environments. Insect Cons Div, 5: 433-443. [ Links ]
24. Roubik, D.W. 1989. Ecology and natural history of tropical bees. Cambridge University Press. Cambridge. 528 pp. [ Links ]
25. Roubik, D.W. 2006. Stingless bee nesting biology. Apidologie, 37: 124-143. [ Links ]
26. Van Oosterhout, C.; Hutchinson, W.F.; Wills D.P.M. and Shipley, P. 2004. MICRO-CHECKER: software for identifying and correcting genotyping errors in microsatellite data. Mol Ecol Notes, 4: 535-538. [ Links ]
27. Viana, M.V.C.; Miranda, E.A.; de Francisco, A.K.; Carvalho, C.A.L. and Waldschmidt, A.M. 2011. Transferability of microsatellite primers developed for stingless bees to four other species of the genus Melipona. Genet Mol Res, 10: 3942-3947. [ Links ]
28. Wilms, W.; Imperatriz-Fonseca, V.L. and Engels, W. 1996. Resource partitioning between highly eusocial bees and possible impact of the introduced Africanized honey bee on native stingless bees in the Brazilian Atlantic Rainforest. Stud Neotrop Fauna E, 31: 137-151. [ Links ]
29. Yáñez-Ordóñez, O.; Trujano Ortega, A. y Llorente Bousquets, J. 2008. Patrones de distribución de las especies de la tribu Meliponini (Hymenoptera: Apoidea: Apidae) en México. INCI, 33: 41-45. [ Links ]
30. Zayed, A.; Packer, L.; Grixti, J.C.; Ruz, L.; Owen, R.E. and Toro, H. 2005. Increased genetic differentiation in a specialist versus a generalist bee: implications for conservation. Conserv Genet, 6: 1017-1026. [ Links ]
Recibido: 12-3-13
Aceptado: 25-9-13