Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Archivos Españoles de Urología (Ed. impresa)
versión impresa ISSN 0004-0614
Arch. Esp. Urol. vol.58 no.6 jul./ago. 2005
Monográfico: Trasplante Renal. Experiencia del Hospital Clínico de Barcelona
MANEJO CLÍNICO DEL PACIENTE TRASPLANTADO RENAL DE DONANTE VIVO
Federico Cofan y Jose-Vicente Torregrosa
Servicio de Nefrología. Unidad Trasplante Renal. Hospital Clínico de Barcelona. España
Resumen.- Analizar el manejo clínico del paciente trasplantado renal con un riñón procedente de donante vivo. El TR de donante vivo sin complicaciones quirúrgicas tiene una frecuencia muy baja de necrosis tubular aguda (NTA) que facilita enormemente el control clínico. El esquema de seguimiento post-TR debe incluir: (1) Monitorización hemodinámica; (2) Control clínico; (3) Monitorización del injerto renal: función renal, diuresis, renograma isotópico y ecografía-Doppler; (4) Tratamiento farmacológico: analgesia, protección gástrica, profilaxis antibiótica; (5) Monitorización del tratamiento inmunosupresor: niveles de inmunosupresores; (6) Monitorización digestiva; (7) Control del riesgo cardiovascular; (8) Profilaxis infecciosa; (9) Osteodistrofia. En el TR de donante vivo suele observarse una rápida normalización de la función renal y un tiempo de hospitalización reducido. La presencia de una NTA prolongada o una disfunción renal del injerto deben obligar a realizar una biopsia precoz del injerto.
Palabras clave: Trasplante renal. Donante vivo. Clínica. Monitorización. Necrosis tubular aguda.
Summary.- To analyze the clinical management of the renal transplant recipient from a kidney living donor. The renal transplantation (RT) from a living donor without surgical complications has a very low frequency of acute tubular necrosis (ATN) that facilitates enormously the clinical control. The scheme of follow-up after-RT must include: (1) Hemodynamic monitoring; (2) Clinical management; (3) Renal allograft monitoring: renal function, diuresis, radionuclide imaging and ultrasound -Doppler; (4) Pharmacological treatment: analgesia, gastric protection, antibiotic prevention; (5) Monitoring of the immunosuppressive therapy; (6) Digestive monitoring; (7) Control of the cardiovascular risk; (8) Preventions infectious; (9) Osteodistrophia control. In living donor RT a rapid normalization of the renal function and a time of hospitalization reduced are observed. The presence of a long ATN or a renal dysfunction of the graft must force to realize an early renal allograft biopsy.
Keywords: Living donor. Renal transplantation. Clinical medecine. Acute tubular necrosis.
Correspondencia
Federico Cofan
Unidad Trasplante Renal
Hospital Clínico de Barcelona
C/ Villarroel, 170
08036-Barcelona (España)
fcofan@clinic.ub.es
INTRODUCCIÓN
El manejo clínico del paciente receptor de un trasplante renal (TR) de donante vivo no difiere excesivamente del paciente que ha recibido un injerto renal de donante cadáver. En el TR de donante vivo el manejo clínico suele ser más sencillo, fundamentalmente porque se trata de una intervención programada, con los beneficios que ello conlleva, entre los que cabe destacar la escasa frecuencia de necrosis tubular aguda (NTA) post-trasplante. En este tipo de trasplante renal, habitualmente el paciente puede ser dado de alta en la primera semana post-trasplante.
En este capítulo comentaremos en primer lugar la evaluación clínica inicial, la posterior monitorización de los diferentes parámetros que hay que vigilar en el periodo post-trasplante y finalmente analizaremos la evolución del trasplante con las circunstancias que pueden presentarse en este período.
EVALUACIÓN CLÍNICA INICIAL
Después de la intervención quirúrgica, es aconsejable que el paciente permanezca en el área de reanimación entre 6-8 h. La finalidad es realizar un mejor control hemodinámico y respiratorio del paciente, vigilar los drenajes y detectar complicaciones quirúrgicas precoces. Después de este período, si el estado del paciente es adecuado, se podría trasladar a la sala de hospitalización convencional.
Hay que revisar la hoja anestésica con el fin de obtener información del balance de líquidos, confirmar la administración intraoperatoria de los inmunosupresores y detectar hipotensiones o pérdidas hemáticas anómalas. También hay que revisar el informe quirúrgico para obtener datos técnicos de la intervención (cirugía de banco, anastomosis vascular, tiempo de isquemia caliente, anastomosis de la vía urinaria). En la práctica clínica el mejor parámetro es la información directa y oral del cirujano obtenida tras el trasplante en relación a incidencias técnicas remarca- bles, al aspecto del riñón tras el desclamapaje (color, turgencia) y la presencia de diuresis intraoperatoria. Esta información tiene gran valor en el manejo clínico inicial post-trasplante.
MONITORIZACIÓN
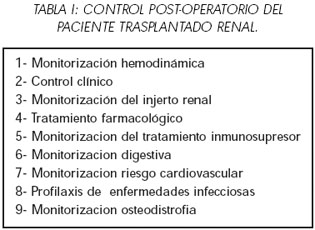
El seguimiento clínico del paciente trasplantado renal de donante vivo exige el control de diferentes parámetros (Tabla I).
1-MONITORIZACIÓN HEMODINÁMICA
• Constantes (TA, FC, tº, FR) desde el post-TR hasta el momento del alta. La periodicidad en el número de tomas se va espaciando con los días de evolución. En las primeras horas se toman cada 1-3 horas y posteriormente cada 4h, 6h y 8 h.
• Determinación PVC cada 8 horas durante el primer día. Es útil para manejar la sueroterapia.
• Vigilancia de los drenajes (redon y sylastic) y aspecto de los apósitos. Se realiza de forma estricta durante las primeras 24 horas para descartar un sangrdo post-quirúrgico. Posteriormente cada 8-24 h hasta su retirada.
• Control de la sonda urinaria. Aspecto básico en el control post-TR. Se trata de evaluar la existencia de hematuria (intensidad, presencia de coágulos, obstrucción de la sonda) o espasmos vesicales. Se realizará de forma simultánea con la determinación de constantes y ante la demanda del paciente (dolor hipogástrico, polaquiuria intensa).
• En caso de duda de la permeabilidad de la sonda se realizarán lavados vesicales (instilación por sonda de 50 cc de suero fisiológico con aspiración posterior).
• Eventualmente, con la presencia de hematuria macroscópica con coágulos y obstrucción de la sonda urinaria se necesitará el tratamiento oportuno (lavados vesicales con extracción de coágulos, cambio de sonda o incluso la colocación de una sonda de tres vías con la instilación de lavados vesicales.
• Se controlará el funcionamiento de la FAVI (fístula arteriovenosa de díalisis). Eventualmente puede trombosarse durante la cirugía o el post-TR inicial.
• Se administrará la sueroterapia en función del ritmo de diuresis. Inicialmente (primeras 8 horas) la reposición es horaria y con un volumen equivalente a la diuresis. Después de este período inicial, y si el paciente mantiene diuresis se suelen administrar unos 4.000 cc en las primeras 24 h (S.fisiológico y S.glucosado). No obstante se van ajustando según las necesidades del paciente. Si no hay complicaciones en los días siguientes y coincidiendo con la ingesta oral se van reduciendo los sueros hasta su supresión a los 3- 4 días.
• Tras la retirada de la sueroterapia, el paciente deberá mantener una ingesta hídrica oral adecuada a sus necesidades (1.5-2 l /día)
2- CONTROL CLÍNICO
• Evaluación clínica: Durante el ingreso se realiza una evaluación clínica diaria (anamnesis y exploración). La existencia de datos patológicos obligará a proseguir en su diagnóstico con los métodos apropiados.
• Movilización: En general se mantiene reposo en cama las primeras 24 h. La movilización se inicia de forma precoz (a partir de las 24 h) y de modo progresivo
• Fisioterapia respiratoria: A partir del primer día post-TR se incentivarán las maniobras respiratorias.
• Se practicará una ecografía abdominal completa coincidiendo con la primera ecografía renal para descartar patología asociada.
3-MONITORIZACIÓN DEL INJERTO RENAL
• Analítica completa de sangre y orina inicialmente cada 24 h y posteriormente cada 48 h.
• Control del volumen de diuresis. Inicialmente cada 8 horas los primeros 2-3 días y después cada 24 h.
• Control del drenaje perirrenal. El débito desproporcionado de un líquido seroso obligará a descartar una fístula urinaria o un linfocele. El débito hemático obligará a descartar una hemorragia.
• En el 1º día post-TR inicial es aconsejable realizar un renograma isotópico MAG3. Si el paciente presenta diuresis inmediata con progresiva mejoría de la función renal, no será necesario repetir la exploración. En caso de oliguria post-TR, se repetirá la exploración cada 3-5 días ya que permite cuantificar la mejoría o empeoramiento de la perfusión renal.
• Durante el 2º día post-TR también es aconsejable realizar una ecografía renal y estudio Doppler de los vasos intrarrenales y la arteria renal principal. Proporciona información de la ecoestructura renal, vascularización, vía urinaria y colecciones perirrenales. Representa una exploración básica y primordial en la monitorización del TR. Si no existen hallazgos patológicos y la evolución clínico-funcional es correcta, tampoco es es imprescindible repetir la exploración.
• La biopsia renal del injerto permite el estudio histológico del injerto renal. En situación de una NTA prolongada debe realizarse de forma sistemática a los 10-14 días para descartar un rechazo agudo subclínico. Se realiza bajo control ecográfico. Está indicada para confirmar un rechazo agudo, en situaciones de deterioro no explicado de la función renal o ante una proteinuria progresiva.
4-TRATAMIENTO FARMACOLÓGICO
• La analgesia se pueden realizar mediante catéter peridural (Metadona 4-6 mg/8 h peridural) durante las primeras 24h alternando con Paracetamol ev (1 gr/8h iv). Esta pauta es suficiente en la mayor parte de los casos. Eventualmente pueden utilizarse la Bupremorfina (1/2-1 cada 8 h sbc). Es aconsejable evitar los AINES por el riesgo de nefrotoxicidad).
• Protección gástrica: Ranitidina 50 mg/12 iv (2-3 d) y posteriormente vía oral (150 mg/12h). En caso de antecedentes de ulcus duodenal o en pacientes sintomáticos se aconseja pantoprazol (40 mg/24 h vo/iv).
• El tratamiento diurético se utilizará para forzar la diuresis en las siguientes circunstanacias: Presencia de necrosis tubular aguda (NTA) oligúrica y especialmente en situaciones de sobrepeso (fenómeno habitual en los primeros días post-TR). Se emplea furosemida a dosis variables (20-80 mg /4-6-8-12h iv o en perfusión continua en casos severos 250-500 mg/24h iv).
• La hipocalcemia (Calcio iónico < 1) se tratará con Gluconato Cálcico (1-2 viales/8h iv) aunque suele resolverse durante las primeras 24-48 h.
• Profilaxis de trombosis venosa profunda. Se suele reservar para pacientes obesos o que precisan encamamiento prolongado o en pacientes con riesgo de enfermedad tromoboembólica. Se realiza con heparina de bajo peso molecular.
• El tratamiento hipotensor se individualizará en función de las necesidades del paciente. No es infrecuente tener que prescribir hipotensores a lo largo del ingreso hospitalario (especialmente si el paciente ya tenia antecedentes de hipertensión). Se emplean habitualmente: antagonistas del calcio (amlodipino, lercanidipino, nifedipina retardada), diuréticos (furosemida), Beta-bloqueantes (bisoprolol, atenolol) o alfabloqueantes (doxazosina). En el post-operatorio inicial se intentará evitar los IECA o ARAII por el riesgo de disfunción renal o el diltiazem o verapamil por la interacción con la ciclosporina/tacrolimus.
• En caso de anemia asintomática y a la espera que el injerto renal inicie la producción endógena de eritropoyetina, se puede administrar de forma exógena eritropoyetina recombinante y ferroterapia.
• La medicación habitual del paciente en diálisis se suspende en el post-TR a excepción de aquellos tratamientos imprescindibles (antiepilépticos, antianginosos, hormonas tiroideas, etc).
5-MONITORIZACIÓN DEL TRATAMIENTO INMUNOSUPRESOR
• Se realizará la prescripción de los fármacos inmunosupresores de forma individualizada y siguiendo los protocolos individualizados. En nuestro centro el protocolo habitual es: Basiliximab-tacrolimus-micofenoleato mofetil-esteroides. En pacientes de alto riesgo inmunológico (hiperinmunizados o retrasplantes con pérdida del injerto previo en el primer año) se emplea cuádruple terapia (Timoglobulina-tacrolimus-micofenolato- esteroides). Si el donante vivo tiene edad avanzada (> 60años) se utiliza basiliximb-sirolimus-micofenolato mofetil-esteroides.
• La monitorización de los inmunosupresores constituye una herramienta primordial en el tratamiento del trasplante. Existe un estrecho margen terapeútico entre la toxicidad y el riesgo de presentar un rechazo. Por otra parte existe una elevada variabilidad interindividual para las mismas dosis que obliga a monitorizar el tratamiento.
• El tratamiento inmunosupresor se monitorizará de forma habitual cada 24-72h. para ajustar la dosis más adecuada para el paciente. La situación funcional del injerto también influye en los niveles deseados.
• Se pueden monitorizar los siguientes fármacos: ciclosporina, tacrolimus, ácido micofenólico y rapamicina.
• El protocolo básico consiste en la determinación valle pre-dosis del fármaco (Cmin) en Ciclosporina, Rapamicina, Tacrolimus, Ac. Micofenólico y determinación a las 2 horas (C2) de la administración para mejor ajuste de los valores de Ciclosporina.
• Actualmente se puede realizar un perfil farmacocinético del tratamiento inmunosupresor. La utilidad reside en que el área bajo la curva y la Cmax se han relacionado con la eficacia inmunosupresora con una sensibilidad mayor que la Cmin (niveles valle predosis) no obstante, no se suele realizar de rutina.
6-MONITORIZACIÓN DIGESTIVA
• Se realizará un control del peristaltismo intestinal con el objeto de iniciar precozmente el tratamiento inmunosupresor.
• A las 12 h se inicia la tolerancia a líquidos. Posteriormente se instaura de forma progresiva una dieta líquida-gástrica-normal.
• En general en la mayor parte de los pacientes la dieta es hiponatremica. En situación de insuficiencia renal se controlará la ingesta de potasio y la cantidad de proteínas.
• Se controlara el ritmo deposicional. Al inicio suele presentarse un estreñimiento fisiológico.
7-MONITORIZACIÓN RIESGO CARDIOVASCULAR
• En el momento actual está perfectamente demostrado que el paciente trasplantado renal presenta un elevado riesgo cardiovascular (CV) que conviene detectar precozmente. El conocimiento del riesgo cardiovascular del paciente en el periodo post-TR inicial va a permitir instaurar de forma precoz un tratamiento enérgico de los factores de riesgo CV.
• Se determinará un perfil lipídico completo (colesterol, triglicéridos, cHDL, cLDL) antes del alta.
• La determinación de un perfil lipídico complejo (Apo-AI, Apo-B, Lp(a). Homocisteina) se realizará en pacientes con un trastorno lipídico conocido o para evaluar mejor el perfil lipídico en pacientes de alto riesgo cardiovascular.
8- PROFILAXIS DE ENFERMEDADES INFECCIOSAS
• A pesar de conocer el status serológico antes del trasplante (lista de espera), se realiza una nueva determinación el mismo día del trasplante para conocer eventuales modificaciones. En el momento del ingreso se analiza: HBsAg, VHC, RNA-VHC, VIH, IgG e IgM CMV, IgG-VEB, IgG-Toxoplasma, IgG-VHS y lúes).
• Se realiza la determinación sistemática del antígeno del citomegalovirus (CMV pp65) de forma semanal durante el ingreso.
• La profilaxis del CMV se realizará a todos los pacientes de alto riesgo D+/R- (6 meses) y a los pacientes que han recibido anticuerpos antilinfocitarios mono o policlonales (3 meses).
• Tras la retirada de la sonda vesical se realizará un urocultivo y se iniciará tratamiento con co-trimoxazol (1/24-48h) durante 6 m. Este fármaco actúa como profilaxis de las infecciones urinarias y de la infección por Pneumocistis carinii.
• Se realizará profilaxis candidiásica con nistatina y/o fluconazol únicamente en pacientes diabéticos o de edad avanzada que hayan requerido dosis elevadas de esteroides.
• La profilaxis de la tuberculosis (isoniazida) se realizará en pacientes con antecedentes previos de tuberculosis (aunque haya sido correctamente tratada) o con PPD positivo
9-MONITORIZACIÓN OSTEODISTROFIA
• La pérdida de masa ósea se produce especialmente en los primeros 6 meses post-TR que puede condicionar un riesgo de fractura y aplastamientos vertebrales. El conocimiento del grado de osteopenia o osteoporosis pos-TR permitirá instaurar medidas profilácticas selectivas.
• Se debería de realizar una densitometría ósea previa al trasplante. El diagnóstico de osteopenia u osteoporosis obligará a realizar medidas profilácticas (calcio, vitamina D y bifosfonatos). Del mismo modo deberá conocerse los valores séricos de PTHi y Ca/P antes del alta.
EVOLUCIÓN DEL TRASPLANTE RENAL
La evolución habitual se caracteriza por una progresiva mejoría en la condición clínica del paciente con una rápida evolución hacia la normalización de la función renal. En líneas generales, nos podemos encontrar fundamentalmente con tres situaciones:
a) pacientes con excelente función renal.
Es la situación ideal, y de hecho la más frecuente (más del 90% ) en el trasplante de donante vivo. La diuresis es excelente, no existen requerimientos de diálisis y la función renal se normaliza rápidamente alcanzando valores normales en los primeros días pos trasplante. En estas circunstancias, no se requieren excesivos controles excepto constantes vitales, volumen de diuresis, bioquímica sanguínea y valores séricos de anticalcineurínicos (en el caso de que estos estén incluidos en el protocolo inmunosupresor)
b) pacientes con moderada disfunción renal.
En estos pacientes, la evolución suele ser con mantenimiento de diuresis y una lenta mejoría de la función renal. Si la función renal mejora progresivamente, aunque de manera lenta, no se suelen requerir otros controles diferentes a los del apartado anterior. Probablemente necesitaremos estudios complementarios (Ecografía y/o Renograma) en el caso de que la función renal se estabilice en valores superiores a la normalidad o muestre algún moderado deterioro. En estos casos habrá que descartar alguna moderada obstrucción o también toxicidad por anticalcineurínicos.
c) pacientes con retraso de la función del injerto (necrosis tubular aguda).
La necrosis tubular aguda (NTA) post-trasplante se define como la necesidad de diálisis en la primera semana post-trasplante debido a un estado de oliguria o anuria con persistencia de la insuficiencia renal. Si bien es una complicación relativamente frecuente en el trasplante renal de donante cadáver, es muy excepcional en TR de donante vivo.
Existen una serie de factores de riesgo que pueden predecir la aparición de NTA (Tabla II). Los más importantes son el tiempo de isquemia prolongado, la edad avanzada del donante o receptor y la hipotensión. Estos factores son aditivos y se potencian entre sí. Se manifiesta por oliguria o anuria que aparece generalmente en las primeras 24 horas post-trasplante. La existencia de NTA dificulta el manejo clínico del paciente ya que requiere realizar hemodiálisis, requiere más exploraciones complementarias para la monitorización de la NTA, dificulta el diagnóstico del rechazo agudo sobreañadido, alarga el tiempo de hospitalización e incrementa el coste del TR. La NTA se resuelve espontáneamente en menos de 15 días en la mayoría de los casos, aunque excepcionalmente puede prolongarse durante varios meses. La recuperación se caracteriza por un incremento progresivo de la diuresis que permite suspender la diálisis seguido de una recuperación de la función renal hasta valores normales.
La presencia de anuria o oliguria en un paciente con factores de riesgo y con una adecuada hidratación permite el diagnóstico clínico de NTA. Sin embargo es necesario realizar, en las primeras 24 horas post-TR, una ecografía renal (que descarta la obstrucción urológica) y un estudio isotópico para demostrar la presencia de vascularización intrarrenal. El estudio isotópico mediante renograma con MAG3 es una técnica muy útil en la monitorización de la NTA ya que permite observar la recuperación de la NTA y facilita el diagnóstico de sospecha del rechazo. Cuando la oliguria se prolonga más de 10-14 días, es necesario realizar una biopsia renal percutánea para descartar el rechazo agudo sobreañadido. La NTA se ha implicado como un factor favorecedor del rechazo agudo y del desarrollo a largo plazo de la nefropatía crónica del injerto.
La medida más eficaz es su prevención, siendo el más importante la reducción del tiempo de isquemia fría. Una vez instaurada es necesario evitar la administración precoz de anticalcineurinicos ya que se ha demostrado que retrasan la recuperación de la función renal. Para ello es útil la administración de una terapia secuencial con globulina antilinfocitaria.
CONCLUSIÓN
Podemos decir que, el trasplante renal de donante vivo presenta una manejo clínico similar al de cualquier trasplante renal con la ventaja de que el número de posibles complicaciones es menor, siendo excepcional la necrosis tubular aguda.
BIBLIOGRAFIA y LECTURAS RECOMENDADAS (*lectura de interés y **lectura fundamental)
**1. WHO, Y.M.; JARDINE, A.G.; CLARK, A.F. y cols.: "Early graft function and patient survival following cadaveric renal transplantation". Kidney Int., 55: 692, 1999. [ Links ]
**2. SHOSKES, D.A.; HALLORAN, P.: "Delayed graft function in renal transplantation: etiology, management and long-term significance". J. Urology, 155: 1831, 1996. [ Links ]
*3. QURESKI, F.; RABB, H.; KASISKE, B.: "Silent acute rejection during prolonged delayed graft function reduces kidney allograft survival". Transplantation, 74: 1400, 2002. [ Links ]
4. MENGER, M.D.: "Microcirculatory disturbances secondary to ischemia/reperfusion." Transplant Proc., 27: 2863, 1995. [ Links ]
5. LAN, W.; MESSMER, K.: " The impact of ischemia/ reperfusion injury on specific and non-specific early late chronic events alter organ transplantation". Transplant Rev., 10: 108, 1996. [ Links ]
6. CECKA, J.M.: "The UNOS Scientific Renal Transplant Registry". In: Cecka, J.M.; Terasaki, P.I. (eds). Clinical Transplants . Los Angeles CA: UCLA Tissue Typing Laboratory,( pp 1-16), 1999. [ Links ]
7. BLEYER, A.J.; BURKART, J.M.; RUSSEL, G.B.: "Dialisys modality and delayed graft function after cadaveric renal transplantation". J. Am. Soc. Nephrol., 10: 154, 1999. [ Links ]
*8. TAKADA, M.; NADEAU, C.K.; SHAW, D.G.: "Prevention of late renal changes alter inicial ischemia/ reperfusion injury by blocking early selectin binding". Transplantation, 64: 1520, 1997. [ Links ]
9. VAN DER HOEVON, J.A.B.; POSTEMA ,F.; VAN SUYLICHEM, P.T.R. y cols.: "Effects of brain death on donor organ quality: endothelial cell activation and predisposition for ischemia/reperfusion damage in transplantation". Transplantation, 65: 95, 1998. [ Links ]
10. NOVITZKY, D.: "Detrimental effects of brain death on the potential organ donor". Transplant Proc., 29: 3770, 1997. [ Links ]