Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Archivos Españoles de Urología (Ed. impresa)
versión impresa ISSN 0004-0614
Arch. Esp. Urol. vol.58 no.8 oct. 2005
TÁCTICAS Y TRUCOS DE ENDOUROLOGÍA
TÁCTICAS EN LAPAROSCOPIA, RETROPERITONOSCOPIA EN RIÑÓN Y SUPRARRENAL
Antonio Rosales Bordes1, José H. Amon Sesmero2, Carlos Hernández Fernández3 y Carlos Rioja Sanz4.
1Servicio de Urología. Fundación Puigvert. Barcelona.
2Servicio de Urología. Hospital del Río Hortega. Valladolid.
3Servicio de Urología. Hospital Gregorio Marañon. Madrid.
4Servicio de Urología. Hospital Universitario Miguel Servet. Zaragoza. España.
ÍNDICE/RESUMEN
1. Nefrectomía radical derecha laparoscópica transperitoneal.
A. Rosales Bordes.
2. Nefrectomía radical izquierda laparoscópica transperitoneal
A. Rosales Bordes.
3. Nefrectomía parcial laparoscópica transperitoneal
A. Rosales Bordes.
4. Nefroureterectomía laparoscópica transperitoneal
A. Rosales Bordes.
5. Desinserción ureteral endoscópica
J. H. Amón Sesmero.
6. Nefrectomía retroperitoneal
C. Hernández Fernández.
7. Nefrectomía mano-asistida
C. Hernández Fernández.
8. Cirugía laparoscópica suprarrenal
C. Rioja Sanz.
Palabras clave:Táctica laparoscopica. Nefrectomia laparoscópica. Nefroureteroctomía laparoscópica. Desinserción ureteral endoscópica. Cirugía laparoscopica suprarrenal.
Correspondencia
Antonio Rosales Bordes
Servicio de Urología
Fundación Puigvert
Cartagena, 340-350
08025-Barcelona. (España)
1. TÁCTICA EN LA NEFRECTOMÍA RADICAL DERECHA LAPAROSCÓPICA TRANSPERITONEAL
A. Rosales Bordes.
La nefrectomía radical laparoscópica fue descrita por Clayman en 1990, y desde entonces numerosos grupos la han utilizado para el tratamiento estándar del tumor renal localizado. Esta técnica presenta claras ventajas con respecto a las incisiones empleadas en cirugía abierta, como la menor pérdida sanguínea, la disminución del dolor postoperatorio, la disminución de la morbilidad relacionada con la incisión, menor estancia hospitalaria y el retorno más precoz a la actividad diaria.
Tal como se ha comentado, el abordaje puede ser transperitoneal o retroperitoneal teniendo cada una ventajas e inconvenientes mostradas en la Tabla I.
Asimismo, el acceso puede realizarse de diferentes formas mediante aguja de Veress, mediante acceso directo, a través de minilaparotomía o utilizando diferentes trocares transparentes que permiten un control óptico de las distintas estructuras de la pared abdominal durante el acceso, tal como se muestra en la Tabla II.
Las indicaciones dependen de la experiencia del cirujano en el abordaje laparoscópico. Inicialmente se indicó para tumores menores o iguales a 7 cm (T1), pero con el aumento de la experiencia en esta técnica, muchos grupos han abordado masas renales de mayor tamaño e incluso lesiones con afectación de trombo venoso en vena renal y vena cava. La mejora en el utillaje, y en las fuentes de energía utilizadas en la cirugía laparoscópica permiten un mejor abordaje de masas renales de gran tamaño siendo éste último realmente el que establece el límite de la técnica a utilizar pues masas por encima de 15 cm pueden dificultar la movilización del riñón durante la disección del mismo.
Al igual que en cirugía abierta, la nefrectomía radical incluye el riñón con su grasa de Gerota y la práctica de la adrenalectomía en casos de tumores de polo superior mayores a 4 cm.
Preparación preoperatoria
Tras la correcta selección del paciente, insistiendo en los antecedentes de cirugía abdominal previa y de su patología respiratoria, no creemos necesaria la práctica de preparación intestinal. Todos los pacientes reciben una dosis de antibiótico de amplio espectro antes de la intervención. En casos de riesgo de insuficiencia renal postoperatoria los pacientes serán evaluados por el servicio de nefrología para su control postoperatorio o para la realización previa de una fístula arterio-venosa para la práctica de diálisis posterior sobretodo en casos de nefrectomía en monorrenos.
Tras una anestesia general, los pacientes son sometidos a un vendaje compresivo de las extremidades inferiores que puede realizarse mediante algodón y vendas elásticas o con dispositivos al uso que permiten una compresión dinámica y secuencial de las piernas que favorece el retorno venoso en estos pacientes colocados en posición de lumbotomía y con una insuflación abdominal de 13mm de Hg. Los pacientes son sometidos a sondaje vesical y a la colocación de una sonda nasogástrica que se retirará al final de la intervención.
Colocación del paciente y de los cirujanos
El paciente es colocado en decúbito lateral izquierdo y en flexión al igual que la posición que se utiliza para una lumbotomía clásica, con unos 20 grados de rotación dorsal. El cirujano se colocará en el lado contralateral mirando al monitor de TV y la torre laparoscópica, el primer ayudante a su lado izquierdo sosteniendo la cámara y un segundo ayudante detrás del paciente para sostener el separador hepático. En caso de contar con un asistente robotizado tipo Aesop este se colocará en el lado derecho del paciente, pudiendo sustituir al primer ayudante. La instrumentista se colocará en los pies del paciente en el lado del cirujano.
Acceso, vía de abordaje y colocación de puertas de entrada
La realización del neumoperitoneo para un abordaje transperitoneal puro como hemos comentado, la preferimos realizar mediante una minilaparotomía a través de una incisión de 2 cm por el que introduciremos un trocar de 10-12 mm por el que colocaremos una óptica de 0º. La colocación de un trocar transparente puede facilitar la óptima posición del mismo, pudiendo retirarlo hasta dejar su extremo distal a 2 cm del peritoneo parietal. Para escoger el lugar de esta incisión inicial nos basaremos en la morfología del abdomen del paciente, alejándonos de la línea media cuanto más abdomen tenga el enfermo, como se muestra en la figura 3.
Tras una insuflación inicial a 5 litros/minuto para una distensión abdominal lenta, se consigue una presión intrabdominal de trabajo a 13 mm de Hg. Se coloca la óptica con la cámara de 3 ccd que consigue una visión excelente en un monitor RGB de alta resolución y se decide la estrategia del abordaje de los distintos trocares para la intervención que dependerá del volumen y de la situación del tumor. Generalmente, se colocan 2 puertas de entrada más: una de 5 mm en fosa iliaca derecha por donde se introducirá la pinza bipolar y un trocar de 10 mm en la región epigástrica para la colocación de la tijera monopolar y posteriormente del Ligasure y de la Endogia para el clipado de la vena renal. Un cuarto trocar se colocará en la línea axilar anterior y subcostal para la separación hepática. En ocasiones, es útil para la luxación del lóbulo derecho hepático la colocación de un trocar de 5 mm en la región epigástrica cranealmente al trocar por el que colocamos las tijeras, por donde podremos introducir unas pinzas de agarre que podrán pinzar el peritoneo parietal separando de forma sencilla el hígado evitando la colocación de un trocar de mayor diámetro.
En masas superiores a 7 cm es conveniente la colocación de un trocar adicional de 5 mm para la tracción y luxación craneal del polo renal inferior que nos facilitará la exposición del pedículo renal. Es conveniente que durante la colocación de los trocares la dirección de los mismos en su trayecto a través de la pared abdominal no siga una dirección perpendicular sino tangencial para que las incisiones de la piel, pared muscular y peritoneo no coincidan, disminuyendo así la posibilidad de la aparición de eventraciones posteriores (figura 1).
Técnica quirúrgica
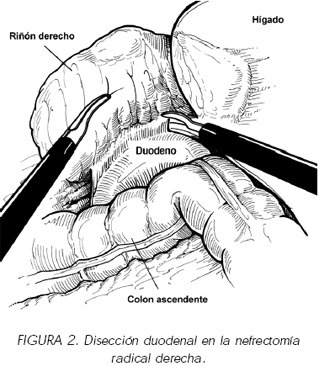
Se inicia la intervención con la apertura del espacio parietocólico derecho a través de la línea de Told, facilitando la decolación que nos permitirá disecar la cara anterior de la fascia de Gerota en toda su longitud hasta la región diafragmática. Es importante no abrir dicha fascia hasta tener bien separado el colon ascendente pues la liberación de la grasa perirrenal nos dificultaría la orientación y la identificación del psoas y del cartucho que rodea al uréter y a la vena gonádica. Tras la elevación del lóbulo hepático derecho, la decolación nos facilitará la identificación duodenal que se halla en íntimo contacto con la cara interna del riñón. Se realizará una maniobra de Kocher para separar el intestino y así poder descubrir la vena cava que se halla por debajo (figura 2). Hemos de ser generosos en la disección del duodeno pues una deficiente luxación del mismo puede llevar las lesiones inadvertidas durante la intervención que pueden provocar graves complicaciones que se manifiestan entre el 2 y 7 día del postoperatorio.
Tras la apertura de la fascia de Gerota vamos a buscar el uréter lumbar que se halla siempre más medial que la vena gonadal. Se identifica y diseca , y se puede ligar mediante un clip metálico o mediante la utilización de Ligasure®. En casos de uréteres engrosados el sellado con ligasure debe de ser realizado mediante dos aplicaciones contiguas para evitar aperturas o sangrados. Una vez seccionado el uréter, disecamos medialmente la vena gonadal, aunque en ocasiones es lesionada y tenemos que cliparla y seccionarla.
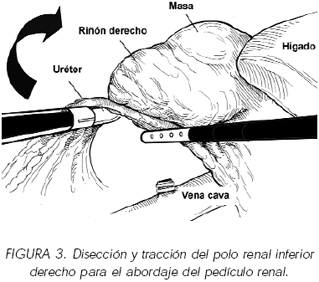
La liberación del polo inferior del riñón nos facilitará la disección del pedículo al poder luxarlo cranealmente tras la disección de su cara posterior y su borde externo (figura 3).
Para esta maniobra podemos utilizar una pinza que se introduce por el trocar de 12 mm que hemos colocado para separar el hígado o en muchas ocasiones se requiere la colocación de un trocar en la porción más inferior de la línea axilar anterior. Seguiremos la cava expuesta en la disección previa, seccionando las adherencias grasas que la unen a la cara interna del polo renal inferior y disecaremos la vena renal que aparecerá generalmente por delante y ligeramente caudal a la arteria renal. La disección venosa debe de ser cuidadosa pues es corta y ancha y se halla rodeada de una abundante atmósfera grasa. Comúnmente podemos hallar la arteria a través de la disección de sus bordes superior o inferior y liberando cuidadosamente su cara posterior. El clipado de la arteria se realiza mediante colocación de clips metálicos o hem-o-looks que proporcionan un sellado más seguro. Al igual que en el caso de nefrectomía para trasplante renal de donante vivo es conveniente dejar un pequeño segmento de arteria renal próximalmente al lugar del clipado, de lo contrario se podría producir una liberación de los clips y producirse un sangrado de difícil solución endoscópica.
El sellado venoso lo realizamos habitualmente mediante la colocación de una endogia vascular de 45 mm que produce una sección y sutura seguras de la vena. Seguidamente abordamos el polo renal superior que incluirá la glándula suprarrenal en casos de tumores de polo superior > a 4 cms o a lesiones renales de otra localización > 7 cms. La utilización del ligasure o el bisturí armónico en este paso es importante pues facilita la disección y el sellado de los pequeños vasos así como el control vascular de la vena suprarrenal que frecuentemente es muy corta y retrocava.
Tras la liberación de la pieza quirúrgica se realiza una revisión del lecho quirúrgico prestando atención a la región hiliar, zona suprarrenal y gonádica. Se coloca un drenaje aspirativo por uno de los trocares posteriores y se extrae la pieza mediante una bolsa endoscópica de 15 mm que se coloca mediante la introducción de un trocar de 18 mm a través del orificio de un trocar de 12 mm extraído previamente. Puede utilizarse un lapsac que se introduce por un trocar de 12 mm o se realiza una extracción manual a través de una incisión de 7 cms por contrabertura. La utilización de bolsas extractoras facilita una incisión ligeramente menor y disminuye el riesgo de implantaciones celulares neoplásicas en la pared abdominal. Se cierra la incisión de pared y las producidas por los trocares de 10-12 mm, sobretodo de aquellos cuya incisión de piel se halla perpendicular a la incisión peritoneal.
2. TÁCTICA EN LA NEFRECTOMÍA RADICAL IZQUIERDA LAPAROSCÓPICA TRANSPERITONEAL
A. Rosales Bordes.
La preparación del paciente es la misma que la empleada en el lado derecho y la posición del personal de quirófano y la colocación de los trocares se invierte con respecto a la descrita en el lado contralateral. En este caso se introducirá sólo un cuarto trocar de 5 mm en la línea axilar anterior, para elevar el polo renal inferior.
Técnica quirúrgica
Tras la decolación izquierda hasta el ángulo esplénico, se descubre el psoas ilíaco y frontalmente, la cara anterior de la fascia de Gerota que se abre en la porción más medial para disecar y seccionar el uréter y la vena gonádica izquierda. Al igual que en el otro lado, la disección colónica debe de ser extensa para que el intestino no entorpezca la disección del pedículo vascular renal. En ocasiones, se debe realizar la sección del epiplon mayor con la apertura de la transcavidad de los epiplones para luxar el eje espleno- pancreático hacia la línea media, técnica muy utilizada en la nefrectomía de donante vivo. La elevación del polo inferior renal colocará los vasos renales en una posición más vertical al eje aórtico lo que nos facilitará su disección y la identificación, clipado y sección de los vasos lumbares que de forma casi constante encontramos en la nefrectomía izquierda. El seguimiento de la trayectoria de la vena gonádica nos llevará hacia la vena renal izquierda y posteriormente hacia la o las arterias renales. Al igual que el lado contrario, utilizaremos una disección cuidadosa de la cara interna de la aorta y de la vena renal para la disección, clipado y sección del pedículo renal izquierdo utilizando endogias y clips. Tras la disección del polo renal superior de las adherencias que lo unen al peritoneo parietal se abordará el borde supero interno y la región suprarrenal. La extracción de la pieza se aconseja que sea a través de una bolsa y bajo visión endoscópica, generalmente aprovechando una incisión de uno o dos trocares en la región ilíaca.
3. TÁCTICA EN LA NEFRECTOMÍA PARCIAL LAPAROSCÓPICA TRANSPERITONEAL
A. Rosales Bordes.
Indicación
Se halla indicada en todos aquellos tumores renales < a 4 cms y preferiblemente en los que se hallan en polo inferior, aunque un cirujano experto puede abordar tumores en cualquier localización y de mayor tamaño sobretodo en casos de cirugía imperativa por monorrenia, tumor bilateral sincrónico o insuficiencia renal.
Preparación preoperatoria, acceso, colocación del paciente y del cirujano y colocación de trocares
La preparación preoperatoria, colocación del paciente, de los cirujanos, la vía de abordaje, el acceso y la colocación de los trocares acostumbra a ser similar que en las descritas en la nefrectomía radical laparoscópica.
En casos en que presumiblemente se pueda realizar una apertura de la vía urinaria es aconsejable la colocación de un catéter ureteral previo que nos servirá para la instilación de un colorante para comprobar la estanqueidad de una posible sutura urotelial y disminuir el riesgo de fístula urinaria en el postoperatorio inmediato. Algunos autores aconsejan la instilación de suero salino a 4 grados para enfriar el riñón a través de la vía urinaria, aunque en ningún caso llega a alcanzar la temperatura que ofrece una isquemia fría clásica. Janeschek ha publicado una técnica de isquemia fría del riñón colocando en el preoperatorio un catéter de Fogarty en el ostium de la arteria renal del riñón problema, para poder ocluir y perfundir el riñón durante la fase previa de la exéresis parcial del riñón. Gill a su vez ha diseñado una estrategia para enfriar el riñón mediante la colocación de hielo pilé en una bolsa extractora donde coloca al riñón previo al inicio de la incisión de la nefrectomía parcial.
Técnica quirúrgica
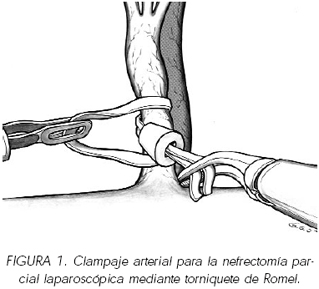
En cuanto a la estrategia quirúrgica es importante disecar completamente el riñón de su grasa para poder exponer la glándula perfectamente y presentar la porción del riñón donde se encuentra el tumor hacia la dirección de la óptica, para tener una correcta visión de los límites del mismo y gozar de una correcta orientación en el momento de realizar la sutura hemostática. A su vez nos permitirá descubrir todo el pedículo vascular en busca de vasos polares que podrían facilitar la exeresis de la lesión tumoral sin un clampaje total de la vascularización. Tras la perfusión con manitol se realiza un clampaje del pedículo renal que generalmente se realiza en régimen de isquemia caliente (figura 1). Comúnmente muchos autores realizan un clampado de la arteria y de la vena renal mediante un clamp vascular de Satinsky diseñado para un abordaje laparoscópico que ofrece un campo exsangüe del lecho quirúrgico renal, hecho que facilita la práctica de la intervención. Pero tiene el inconveniente que debe introducirse a través de un trocar flexible de 12 mm y que ocupará dicha puerta de entrada durante todo el proceso de clampado. Otros autores solo indican la interrupción vascular arterial, mediante bulldocks que se introducen mediante aplicadores diseñados para la cirugía laparoscópica, sobretodo en lesiones renales de pequeño tamaño y periféricas pues la pequeña hemorragia venosa producida en la sección del parénquima renal no dificulta la delimitación del lecho de sección.
Creemos como muchos autores que la sección del lecho de la nefrectomía parcial debe ser realizado mediante corte frió, detalle que disminuirá la probabilidad de márgenes en el lecho de sección. Actualmente hay quien defiende la practica de nefrectomía parcial en lesiones periféricas sin clampado vascular y utilizando el bisturí armónico, la hidrodisección o el ligasure.
Tras la retirada de la pieza quirúrgica se realiza el cierre de la vía urinaria mediante sutura continua de ácido poliglicólico de 3/0 se coloca un cojín de Surgicel® en el lecho de la sección y se cubre este con solución de fibrina (Floseal o Tyssucol) que reforzará la hemostasia. Generalmente se asocian unos puntos de colchonero con dexon del 0 y tras una isquemia caliente a ser posible inferior a 35 minutos se retira el clampado vascular, comprobando la hemostasia. La intervención finaliza con la extracción de la pieza mediante bolsa endoscópica y la colocación de un drenaje aspirativo en la fosa lumbar.
4. TÁCTICA EN LA NEFROURETERECTOMÍA LAPAROSCÓPICA TRANSPERITONEAL
A. Rosales Bordes.
Indicaciones
Al igual que en cirugía abierta se hallan indicadas en el tratamiento de las neoplasias del tramo urinario superior en los casos en que no se halle indicado un tratamiento conservador. La intervención exige desde el punto de vista oncológico la exéresis del riñón ,de la totalidad del uréter y de un rodete vesical ipsilateral. Las lesiones deberán ser diagnosticadas mediante técnicas de imagen (TAC, UIV) y tener una citología positiva o la confirmación biopsia de la neoplasia a través de ureterorrenoscopia. Los pacientes no requieren preparación intestinal y todos serán sometidos a tratamiento antibiótico de amplio espectro como profilaxis antibiótica.
El punto más importante en cuanto a esta técnica es el abordaje del uréter distal. Esto vendrá condicionado por la localización del tumor urotelial y por la presencia o no de tumor vesical concomitante. Una de las preguntas a realizarse es si el abordaje del uréter intramural se realiza antes o después de la nefrectomía.
Hay autores que defienden su abordaje precoz para disminuir el riesgo de implantación celular neoplásica pues se produce un sellado precoz del uréter. En nuestro centro se aplica el protocolo expuesto en la Tabla III para el abordaje del uréter distal en estos casos.
Colocación del paciente, del cirujano, acceso y posicionamiento de los trócares
La configuración del posicionamiento de los distintos protagonistas de la intervención en el quirófano y de las puertas de entrada, es similar que en la que se ha descrito para la nefrectomía radical. Solo si el paciente presenta un tumor en uréter distal por debajo del cruce ilíaco y se quiere realizar su exéresis mediante técnica laparoscópica pura obligaría, tras la realización en una primera fase de la nefrectomía sin la sección ureteral, a la modificación de la mesa quirúrgica, de la posición de la torre de laparoscopia y a la colocación adicional de trócares en la región pelviana para poder abordar laparoscópicamente el uréter intramural y realizar un rodete vesical con cistorrafia posterior mediante sutura laparoscópica. En nuestro medio esta opción la dejamos a decisión del cirujano, quedando excluidos los grandes tumores uroteliales localmente avanzados (T4) con fijaciones a estructuras vecinas donde indicamos una cirugía abierta con una extensa linfadenectomía ilíaca.
Técnica quirúrgica
Los pasos quirúrgicos de la nefrouretectomía son similares a los descritos en la técnica de la nefrectomía radical obviando generalmente la exéresis de la glándula suprarrenal. Lo que varía es la disección del uréter en toda su longitud obviando su sección y la práctica de un rodete vesical del lado ipsilateral. Durante la disección del uréter es muy importante el clipado precoz del mismo por debajo de la lesión tumoral, para disminuir la posible migración e implantación de células neoplásicas durante la manipulación ureteral en el acto quirúrgico, hecho muy relevante en casos de desinserción endoscópica previa.
En caso de que sea necesario un abordaje abierto del uréter distal este se realizará mediante una incisión de Gibson en la fosa ilíaca ipsilateral de 7 cms, generalmente coincidiendo ampliando la incisión de un trocar a este nivel. Se coloca un separador ortostático y se diseca el uréter distal de forma idéntica que en el abordaje clásico a cielo abierto, extrayéndose toda la pieza por esa incisión. Esto ha hecho que muchos autores defiendan un abordaje mano asistida para este tipo de intervenciones.
En el caso de que el paciente presente un tumor que facilite la "desinserción" del uréter distal esta se puede realizarse mediante distintas técnicas. La más común es la resección simple del meato ureteral y la desinserción del mismo mediante asa de resector o de Collins coagulando el extremo distal para asegurarnos en el tiempo abdominal de la extracción completa del mismo. Si bien es la que más se utiliza en nuestro centro, ha sido una técnica poco popular en USA por haberse publicado casos de implantación celular perivesical secundario a la manipulación ureteral tras la desinserción con muy mala evolución de los pacientes. Para evitar dicho riesgo se han utilizado otras variantes que plantean la oclusión del uréter, ya sea mediante un catéter balón o mediante una ligadura o clip ureteral mediante un abordaje transvesical con instrumentos de 5 mm. Otros autores preconizan la intususcepción del uréter tras seccionar el uréter distal, previo un cuidadoso clipado proximal, y realizar una ligadura del uréter sobre un catéter de Chevassú y realizar la extracción del segmento ureteral a través de la uretra del paciente.
En nuestro medio si ha tumor en uréter distal tras un clipado ureteral precoz seguido de la disección delicada del mismo continuamos distalmente la disección ureteral y practicamos un rodete vesical laparoscópico modificando el campo quirúrgico, colocando al paciente en una posición de Trendelemburg forzada para favorecer el desplazamiento craneal del intestino y colocamos dos trocares accesorios en región hipogástrica para poder realizar una cistorrafia en buenas condiciones, comprobando la estanqueidad de la sutura tras el llenado vesical con suero fisiológico. Otros autores defienden el clipado extravesical mediante endogia tras la disección del uréter intramural y la tracción posterior del mismo "herniando" dicha porción que quedaría englobada en la sutura mecánica. El riesgo de migración de las grapas y de la formación calculosa hace de esta opción una alternativa poco usada.
No está claro el efecto beneficioso de una linfadenectomía ilíaca pero coincidiendo con distintos autores la indicamos en grandes masas tumorales (T3- T4) por debajo del cruce iliaco y en presencia de adenopatías significativas en el TAC.
En caso de desinserción endoscópica o laparoscópica pura aconsejamos la extracción en bolsa endoscópica de 15 mm para disminuir al máximo la contaminación neoplásica de la incisión.
5. DESINSERCIÓN URETERAL ENDOSCÓPICA.
J. H. Amon Sesmero.
La nefroureterectomía total laparoscópica se ha convertido en el nuevo patrón de tratamiento del carcinoma de células transicionales del tracto urinario superior. Para llevar a cabo la intervención con rigor oncológico es preceptivo evitar el contacto de la orina de la vía urinaria a tratar con el lecho quirúrgico.
La desinserción ureteral endoscópica con resección del meato ureteral hasta la grasa y posterior "tirón" (1) es un método rápido para tratar el uréter distal, pero tiene el grave inconveniente, hasta que se sella el uréter, de la posibilidad de paso de orina de la vía al lecho quirúrgico con el posible riesgo de siembra de células tumorales como ya se ha descrito (2,3).
Este inconveniente desaparece con el método de desinserción laparoscópica transvesical desarrollado en la Cleveland Clinic (4). Con él ocluyen el uréter distal con un "endoloop", previa disección instrumental transvesical del tramo distal ureteral. Ahora bien, esta disección es compleja, dada la dificultad de trabajar en una cavidad pequeña y excesivamente laboriosa (los autores emplean una media de 90 min.en realizarla).
Una táctica que utilizamos para evitar la salida de orina en el lecho quirúrgico durante la nefroureterectomía laparoscópica con desinserción ureteral endoscópica, es sellar el meato ureteral con un clip metálico por abordaje transvesical. Es un procedimiento rápido que garantiza la estanqueidad de la vía urinaria. Procedemos del siguiente modo:
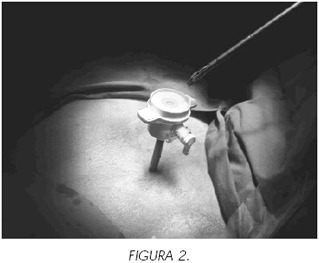
Iniciamos la desinserción marcando un pequeño rodete alrededor del meato con el cuchillete de Collins. Profundizamos la incisión liberando el uréter en el túnel submucoso, interrumpiendo el destechamiento cuando comprobemos que existe un cm de uréter libre (figura 1). Sustituimos el resector por un cistoscopio con el que controlamos el acceso de un trócar de 5 mm con puerto de entrada en hipogastrio, 2 o 3 traveses de dedo por encima de la sínfisis pubiana (figura 2), para pasar un hemoclip que conducimos al área de desinserción. Con una pinza de" cuerpo extraño " abrazamos el meato y tiramos de él hacia el cuello vesical (figura 3), tensando de este modo el tramo de uréter destechado para facilitar su clipaje (figura 4). Una vez realizado éste, volvemos a introducir el resector para continuar la desinserción del uréter intramural hasta la grasa perivesical.
BIBLIOGRAFÍA RECOMENDADAS
1. STEPHENSON, R.N.; SHARMA, N.K.; TOLLEY, D.A.: "Laparoscopic nephroureterectomy: A comparison with open surgery". J Endourol.; 9:(supp 1) 99. 1995.
2. ARANGO, O.; BIELSA, O.; CARLES, J. y cols.: "Massive tumor implantation in the endoscopic resected area in modified nephoureterectomy". J Urol.; 157: 1839. 1997.
3. HETHERINGTON, J.W.; EWING, R.; PHILIP, N. H.: "Modified nephroureterectomy: A risk of tumor implantation". Br J Urol.; 58: 368. 1999.
4. GILL, I. S.; SOBEL, J.J.; MILLER, S. D. y cols.: "A novel technique for the management of the en- bloc bladder cuff and distal and distal ureter during laparoscopic nephoureterectomy". J Urol.; 161: 430. 1999.
6. NEFRECTOMÍA RETROPERITONEAL
C. Hernández Fernández.
Una vez abordado el retroperitoneo el primer gesto quirúrgico es identificar y disecar el uréter, del cual vamos a traccionar en sentido craneal. Al mismo tiempo el riñón es empujado en sentido contrario.
La disección prosigue por el uréter en dirección al riñón, de esta forma se alcanza la pelvis y el hilio renal.
Por la vía transperitoneal encontramos primero la vena, que ha de ser rechazada, y detrás la arteria renal, que una vez liberada habitualmente puede cliparse con endoclips de titanio y seccionarse posteriormente. La vena, una vez disecada, es preferible seccionarla con un un Endo-Gia, instrumento que permite en un solo tiempo , aplicar dos lineas de sutura mecánica y seccionar por la parte intermedia.
Una vez que el riñón está ya isquémico proseguimos la disección por el polo superior, evitando lesionar la glándula suprarrenal, que se encuentra a dicho nivel. Finalmente se continúa la disección de todo el órgano separándolo de su grasa adyacente, hasta que la única sujeción que queda es la del propio uréter que ha de ser clipado y seccionado.
La extracción se realiza introduciendo, por uno de los trócares, una bolsa estéril y plegada, que se desdobla en el interior del abdomen. En ella podemos introducir el riñón y el extremo abierto de la bolsa exteriorizarlo a través de uno de los orificios de los trócares.
Al tratase de un órgano sólido suele ser necesario el fragmentearlo, lo que conseguimos con métodos mecánicos, habitualmente introduciendo en la bolsa unas pinzas fuertes.
En aquellos casos de nefrectomía radical por cáncer evitamos trocear la pieza para que que la información posterior del patólogo sea lo más exacta posible. Para ello y sin extraer el C02 de la cavidad retroperitoneal practicamos una incisión de McBurney de 4-5 cms. sacando por ella la pieza íntegra dentro de la bolsa extractora.
Una vez extraído el riñón se revisa la hemostasia del lecho quirúrgico y colocando un tubo de drenaje se procede a cerrar los orificios de la piel.
BIBLIOGRAFÍA RECOMENDADA
1. HERNÁNDEZ, C.; ESCRIBANO, G.; DÍEZ, J.M. y col.: "Nefrectomía laparoscópica por vía retroperitoneal: caso report". Actas Urol. Esp., 18: 619, 1994.
2. VALDIVIA, J.G.; ABRIL, G.; MONZÓN, F. y cols.: "Cirugía renal laparoscópica". Arch. Esp. Urol., 46, 7: 603, 1993.
3. RIOJA, C.; VLÍNGUEZ, P.; BLAS, M. y cols.: "Nefrectomía laparoscópica: caso report". Actas Urol. Esp., 16: 544, 1992.
4. GAUR, D.D.: "Laparoscopic operative retroperitoneoscopy: use of a new device". J. Urol., 148: 1137, 1992.
5. Mc DOUGALL, E.M.; CLAYMAN, R.V.; ELASHRY, O.M.: "Laparoscopicradical nephrectomy for renal tumor: the Washington University experience". J. Urol., 155: 1180, 1996.
6. CADEDDU, J.A.; ONO, Y.; CLAYMAN, R. y cols.: "Laparoscopic nephrectomy for renal cell cancer: Evaluation of efcacy and safety: A multicenter experience". Urology, 52: 773, 1998.
7. KAVOSSI, L.R.; KERBL, K.; CAPELONTO, C.C. y cols.: "Laparoscopic nephrectomy for renal neoplas". Urology, 42: 603, 1993.
8. ABBOU, C.C.; CICCO, A.; GASMAN, D. y cols.: "Retroperitoneal laparoscopic versus open radical nephrectomy". J. Urol., 161: 1776, 1999.
9. GILL, I.S.; SCHWEIZER, D.A.; HOBART, M.G. y cols.: "Retroperitoneal laparoscopic radical nephrectomy: the cleveland clinic experience". J. Urol., 163: 1665, 2000.
10. NAKADA, S.; MOON, T.; GIST, M. y cols.: "Use of the pneumosleeve as an adjunct laparoscopic nephrectomy". Urology, 49: 612, 1997.
11. KEELEY, F.X.; SHARMA, N.K.; TOLLEY, D.A.: "Hand-assisted laparoscopic nephroureterectomy". BJ. Int., 83: 504, 1999.
12. LANDMAN, J.; LEV, R.Y.; BHAYANI, S. y cols.: "Comparison of hand assisted and standard laparoscopic radical nephroureterectomy for the management of localized transitional cell carcinoma". J. Urol., 167: 2387, 2002.
7. NEFRECTOMÍA MANO-ASISTIDA
C. Hernández Fernández.
Una vez anestesiado el paciente dibujamos en su abdomen donde realizaremos la incisión para la mano y la posición de los dos o tres trócares complementarios.
En la mayor parte de las cirugías solemos utilizar una incisión en la línea media por encima y debajo del ombligo, haciendo coincidir su longitud en cms con el número de guante que usa el cirujano. Este tipo de incisión es válida para la nefrectomía de ambos lados. En ocasiones en la cirugía renal del lado derecho podemos realizar la incisión en la fosa inguinal del mismo lado, aunque al hacerlo así la distancia al polo superior renal es mayor y más incómoda la posición del cirujano.
Se distiende la cavidad abdominal, insuflando C02 según técnica habitual a través de una aguja de Veress introducida en el hipocondrio ipsilateral a la altura de la línea clavicular media.
Con la cavidad distendida a 12 mms de presión realizamos la pequeña laparotomía para la mano y habitualmente nos servimos de alguno de los sistemas comercializados que evitan la pérdida de gas. Aunque si la incisión se ajusta mucho al diámetro de la muñeca del cirujano puede introducirse la mano sin este tipo de aparatos aunque conociendo que perderemos más gas durante la cirugía.
Sustituimos entonces la aguja de Veress por un trocar de 10 mm. A su través pasamos la óptica de 0°, conectada a una cámara de televisión.
Las trocarizaciones accesorias se colocan en la linea axilar anterior, 12 y 5 mm. respectivamente. El trócar de mayor diámetro estará en poción más craneal en la nefrectomía derecha y será inferior en las del lado izquierdo. Todos estos puertos de entrada se colocan bajo visión directa.
En esta posición de decúbito supino se explora la cavidad abdominal y, una vez acabada ésta, es necesario colocar al paciente en decúbito lateral, con el fin de que las asas intestinales no interfieran ni la visión ni el procedimiento quirúrgico.
Se inicia entonces la sección del peritoneo en la gotiera parietocólica, para exponer la fascia de Gerota. La mano introducida es la no dominante, mientras que en la contraria tendremos una pinza de corte y coagulación. Nosotros nos sentimos muy cómodos con la pinza "ligasure".
La mano tensa y expone los tejidos mientras que el ayudante maneja la cámara y un aspirador introducido por el trócar de 5 mms.
Una vez abordado el retroperitoneo el primer gesto quirúrgico es identificar y disecar el uréter, del cual vamos a traccionar en sentido craneal. Al mismo tiempo el riñón es empujado en sentido contrario. La disección prosigue por el uréter en dirección al riñón, de esta forma se alcanza la pelvis y el hilio renal.
Por la vía transperitoneal encontramos primero la vena, que ha de ser rechazada, y detrás la arteria renal, que una vez liberada habitualmente puede cliparse con endoclips de titanio y seccionarse posteriormente. La vena, una vez disecada, es preferible seccionarla con un un Endo-GIA, instrumento que permite en un solo tiempo , aplicar dos lineas de sutura mecánica y seccionar por la parte intermedia. Todos estos instrumentos se introducen por el puerto de 12 mms, ya que la mano no dominante está siempre utilizandose para separar, palpar o aislar estructuras. Incluso nos vale para comprimir en el caso de sangrado.
Una vez que el riñón está ya isquémico proseguimos la disección por el polo superior, evitando lesionar la glándula suprarrenal.
Dependiendo del caso clipamos y seccionamos el uréter al final de la intervención o si nos interesa levantar el polo inferior renal procedemos a su sección antes de abordar el hilio.
La extracción de la pieza se realiza por la incisión de la mano pero, a ser posible, embolsada para que sea más fácil la exteriorización y para disminuir el riesgo de contaminación tumoral.
Una vez extraído el riñón se revisa la hemostasia del lecho quirúrgico y colocando un tubo de drenaje se procede a cerrar los orificios de la piel.
BIBLIOGRAFÍA RECOMENDADA
1. HERNÁNDEZ, C.; ESCRIBANO, G.; DÍEZ, J.M. y col.: "Nefrectomía laparoscópica por vía retroperitoneal: caso report". Actas Urol. Esp., 18: 619, 1994.
2. VALDIVIA, J.G.; ABRIL, G.; MONZÓN, F. y cols.: "Cirugía renal laparoscópica". Arch. Esp. Urol., 46, 7: 603, 1993.
3. RIOJA, C.; VLÍNGUEZ, P.; BLAS, M. y cols.: "Nefrectomía laparoscópica: caso report". Actas Urol. Esp., 16: 544, 1992.
4. GAUR, D.D.: "Laparoscopic operative retroperitoneoscopy: use of a new device". J. Urol., 148: 1137, 1992.
5. Mc DOUGALL, E.M.; CLAYMAN, R.V.; ELASHRY, O.M.: "Laparoscopicradical nephrectomy for renal tumor: the Washington University experience". J. Urol., 155: 1180, 1996.
6. CADEDDU, J.A.; ONO, Y.; CLAYMAN, R. y cols.: "Laparoscopic nephrectomy for renal cell cancer: Evaluation of efcacy and safety: A multicenter experience". Urology, 52: 773, 1998.
7. KAVOSSI, L.R.; KERBL, K.; CAPELONTO, C.C. y cols.: "Laparoscopic nephrectomy for renal neoplas". Urology, 42: 603, 1993.
8. ABBOU, C.C.; CICCO, A.; GASMAN, D. y cols.: "Retroperitoneal laparoscopic versus open radical nephrectomy". J. Urol., 161: 1776, 1999.
9. GILL, I.S.; SCHWEIZER, D.A.; HOBART, M.G. y cols.: "Retroperitoneal laparoscopic radical nephrectomy: the cleveland clinic experience". J. Urol., 163: 1665, 2000.
10. NAKADA, S.; MOON, T.; GIST, M. y cols.: "Use of the pneumosleeve as an adjunct laparoscopic nephrectomy". Urology, 49: 612, 1997.
11. KEELEY, F.X.; SHARMA, N.K.; TOLLEY, D.A.: "Hand-assisted laparoscopic nephroureterectomy". BJ. Int., 83: 504, 1999.
12. LANDMAN, J.; LEV, R.Y.; BHAYANI, S. y cols.: "Comparison of hand assisted and standard laparoscopic radical nephroureterectomy for the management of localized transitional cell carcinoma". J. Urol., 167: 2387, 2002.
8. CIRUGÍA SUPRARRENAL (ABORDAJE DEL FEOCROMOCITOMA)
C. Rioja Sanz.
La cirugía laparoscópica es hoy en día el estándar de oro del abordaje de la patología suprarrenal a excepción de la patología neoplásica (carcinoma de suprarrenal) cuya indicación sigue siendo controvertida por la posibilidad de diseminación local tumoral. Aunque en los inicios de la cirugía laparoscópica se cuestionó la oportunidad del abordaje del feocromocitoma, en estos momentos se ha comprobado que no existe mayor morbilidad ni efectos adversos intraoperatorios, comparados con la cirugía abierta convencional. Sin embargo es importante tener en cuenta los siguientes puntos:
• Importancia del diagnóstico biológico y por imagen (TAC, RNM, gammagrafía) para una correcta localización anatómica del tumor responsable del cuadro clínico. Actualmente no es necesario la exploración sistemática de lugares cromafines desde hiato diafragmático a vejiga como antaño.
• Es esencial una preparación preoperatoria adecuada (8-10 días previos) con objeto de bloquear la producción de catecolaminas: alfabloqueantes (prazosina), betabloqueantes (labetalol) y en ocasiones antagonistas del calcio (nifedipino).
• Desde el punto de vista quirúrgico el acceso laparoscópico por vía transperitoneal es hoy en día el más aconsejable.
• Los objetivos tácticos son la ligadura precoz de la vena capsular principal -para evitar el riesgo hemodinámico derivado de la liberación de catecolaminas- y la posterior ligadura arterial y exéresis del tumor con la mínima movilización.
• En cirugía laparoscópica suprarrenal el objetivo no es el tumor, son los sistemas vasculares. En el lado derecho la vena cava en su porción interna y la vena renal en la porción inferior. En el lado izquierdo la vena suprarrenal principal, rama de la renal. Una vez ligadas las venas, el siguiente objetivo son las arterias y el último la exéresis del tumor.
• En el lado derecho los pasos quirúrgicos son: apertura (amplia) del peritoneo parietal posterior subhepático que permite separar el hígado hacia arriba para exponer la glándula. Disección de la cara externa de la vena cava y superior de la renal cuyo ángulo conforma el límite inferior de la zona operatoria. Disección ascendente de la cava, hasta encontrar y ligar la vena suprarrenal principal (siempre está mas alta de lo supuesto) y seguir ascendentemente hasta ligar una posible accesoria, rama de una subhepática. Una vez superado el "tiempo venoso" podemos desplazar lateroexternamente la glándula, ligar el pedículo arterial y continuar mas tranquilamente la exéresis de la glándula.
• En el lado izquierdo, mucho mas difícil que en el derecho, los puntos técnicos clave son la disección de la vena renal y bascular ampliamente el bazo mediante sección del ligamento esplenoparietal. La glándula se encontrará entre la vena esplénica y la renal, cercana a la cola del páncreas, visible tras la movilización del bazo. La disección de la vena renal nos conducirá a la vena suprarrenal principal, procediendo a su clipaje. Siguiendo la disección ascendente se clipa la vena accesoria, rama diafragmática y finalmente las arterias suprarrenales.