My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Archivos Españoles de Urología (Ed. impresa)
Print version ISSN 0004-0614
Arch. Esp. Urol. vol.58 n.9 Nov. 2005
Urología Oncológica
CRIOCIRUGÍA (TERCERA PARTE). REVISIÓN DE LA LITERATURA Y NUESTRA EXPERIENCIA. (I).
Ángel Escudero Barrilero, Fernando Arias Fúnez, Rafael Rodríguez-Patrón Rodríguez y Ricardo García González1.
Servicio de Urología y Servicio de Anatomía Patológica1. Hospital Ramón y Cajal. Madrid. España.
*Debido a la extensión del trabajo, lo publicaremos en dos partes y en números consecutivos.
Resumen.- OBJETIVOS: La criocirugía es una técnica verdaderamente mini-invasiva, eficaz para tratar el adenocarcinoma de próstata con riesgo quirúrgico escaso, nula mortalidad per y postoperatoria y sin apenas morbilidad. Ya se ha constatado que se puede aplicar a enfermos de alto riesgo quirúrgico. No precisa sangre ni UVI y es factible en pacientes con desórdenes de la coagulación y en quienes no consienten en recibir transfusiones. Los resultados valorando niveles sanguíneos de PSA y biopsia negativa se consolidan con el paso del tiempo. No causa interferencia sobre la eficacia de otras técnicas utilizables cuando no es efectiva. Sus fracasos se pueden recuperar además de con una segunda criocirugía, con prostatectomía radical; muy poco investigado con radioterapia externa y por supuesto mediante supresión androgénica. La crioterapia se puede aplicar con posibilidades de éxito en enfermos con cáncer extracapsular (T3) y la citotoxicidad del frío se ejerce eficazmente sobre: células pobremente diferenciadas y Gleason de 7 a 10; células resistentes o cáncer recidivado tras la radioterapia y el tratamiento previo con hormonoterapia no interfiere su efecto.
Hay datos suficientes que apoyan las indicaciones que exponemos a continuación. 1.- Sería el tratamiento idóneo para realizar de 1ª intención. a) En pacientes con riesgo alto y medio de infiltración extracapsular. Son pocos los urólogos que indican la Prostatectomía radical en este grupo. Hay argumentos suficientes para anteponer la congelación controlada a la asociación braqui-radioterapia externa. Si consideramos persistencia de cáncer en la biopsia, elevación del PSA, complicaciones y peligrosidad de las mismas, se refieren muy buenos resultados. ¿Por qué ensayar la radiación y rescatar sus fracasos con crioterapia? Cuando la congelación se aplica como primera opción la tasa de éxitos mejora con respecto a la referida en cánceres resistentes o recidivados tras la radiación. Es evidente que las complicaciones serias son más graves y más frecuentes en pacientes previamente radiados y que no tienen fácil solución. b) En enfermos con cáncer limitado a la glándula con riesgo bajo de extensión extracapsular patologías múltiples y/o cuya edad biológica aparente ser superior a 70 años. c) En pacientes de bajísimo riesgo PSA < 10, cáncer estadio T1c-T2a y Gleason 2-4 e incluso 5 incluidos los de expectativa de vida superior a 10 años que no se conforman con la pauta "vigilancia". 2.- Se debe considerar como alternativa a cirugía en casos con cáncer intraprostático, bajo riesgo de extensión extracapsular, edad no superior a 70 años y sin patología asociada; claros candidatos a la prostatectomía radical. Este grupo sería bueno para hacer un estudio comparativo y valorar: eficacia, complicaciones, calidad de vida y relación costo-beneficio. Los efectos secundarios más temibles prácticamente han desaparecido: la fístula uretro-rectal, utilizando la maniobra de Onik y las uretro-cutáneas ni se mencionan. Con el empleo del sistema protector de uretra aprobado por la FDA y control de la temperatura en el esfínter estriado, desciende el riesgo de obstrucción y la necesidad de RTUs o manipulaciones endoscopias para extraer esfacelos. No se refiere incontinencia en más del 2% de los casos. También ahorra días de ingreso: 1,5 de media. No precisa UVI ni transfusión. 3.- Pacientes con cáncer resistente o recidivante tras Braquiterapia y/o Radioterapia externa. La Braquiterapia es inapropiada en esta situación: el Gleason es más alto que el primitivo en 2 de cada 3 casos y muchos tienen extensión extracapsular. De suma importancia el efecto "recuerdo de radiación": el tejido normal sólo tolera una dosis determinada incluso transcurridos varios años. Son mejores opciones la prostatectomía radical y la congelación controlada. Para prevenir la progresión local y su morbilidad asociada, para tratar de controlar el cáncer resistente a la radiación y evitar la diseminación a distancia a partir de la recidiva, se recurre a la prostatectomía radical; cirugía la mayoría de las veces bastante compleja. Para conseguir dichos objetivos preferimos la crioterapia. Con menos riesgo quirúrgico sin transfusión ni UVI, menor gravedad y número de complicaciones se describen resultados similares en cuanto al control del cáncer se refiere. 4.- En pacientes con cáncer unilateral, unifocal y bajísimo o bajo riesgo de extensión extracapsular, es posible evitar la impotencia aplicando la técnica de congelación focal.
HORMONOTERAPIA PREVIA: Debe indicarse sólo con la finalidad de reducir el volumen prostático al límite más idóneo (menor de 40 – 50 cc). Ventajas que proporciona: la glándula admite una congelación más rápida, precisa menos cantidad de gas, se mitiga la dificultad que entraña la interferencia del pubis y facilita la distribución espacial del menor número de sondas requerido. Todo ello, mejora la dosificación del frío y elimina gradientes de temperaturas acusados en los tejidos interpuestos entre cada dos elementos contiguos.
NUESTRA EXPERIENCIA: Emplear dilatadores, es ya historia. Nosotros hemos usado el sistema Fast-Trac de Endocare (Medipro): sondas de 2,4 mm de diámetro implantadas con una sola maniobra sin la ayuda de rejilla ni dispositivo de soporte para el transductor transrectal. Dos ciclos congelación – deshielo con retroceso apical en caso necesario. Duración de la congelación por ciclo entre 7 y 10 minutos e incluso más sin poner en riesgo la pared del recto. Permitiendo que el límite ecográfico de la congelación sobrepase la cápsula prostática incluso por su cara posterior: la maniobra de Onik inyección de suero salino en el espacio de Denonvilliers´ permite congelar con garantías más allá del límite posterior de la glándula sin incrementar el riesgo de fístula.
RESULTADOS: Hemos tratado 20 enfermos y seguido entre 30 y 36 meses. A partir del porcentaje de cilindros afectados y de su localización se han etiquetado de unilaterales el 58% y de bilaterales el 42% y atendiendo a la definición clásica son de riesgo bajo 9 enfermos, medio 6 y alto 5 y añadiendo la proporción de cilindros afectados 5, 6 y 9 respectivamente. Se ha practicado biopsia a 18 pacientes realizada por sistema en los meses 6, 12 y 24. Dos enfermos han sido recuperados con una segunda sesión por persistir cáncer en la biopsia obtenida a los 6 meses (11%). Con 21 criocirugías administradas a 19 enfermos, alcanzaron a los 3 meses nadir inferior a 0,2 ng/cc; a 0,5 ng/cc e igual o inferior a 1,0 ng/cc, 15 (78,9%); 17 (89,4%) y 18 (94,7%) respectivamente y sólo en el 5,26% fue superior a 1,0 ng/cc. La proporción de PSA a los 30 meses para esos mismos cortes y por el mismo orden es del 27,8%; 50%; 66,6% y 33,3%. De los 18 biopsiados se objetivó cáncer a los 12 meses en el 5,5%. Y no fue positiva ninguna de las biopsias realizadas en 17 pacientes a los 24 meses. Complicaciones, hemos observado edema de escroto, hematoma, dolor perineal y estreñimiento que remitieron en el transcurso de 2 – 3 semanas. Lesión del urotelio prostático, sin llegar a ser fístula uretro-rectal, en 1, curada con sonda permanente durante 3 meses. Cuatro enfermos con disfunción eréctil antes de la congelación continúan sin erecciones. De los otros 15, todos impotentes después de la criocirugía, 3 (20%) han recuperado turgencia suficiente para realizar el coito a lo largo de los 30 meses. Todos los enfermos contienen la orina y en ningún caso hemos observado eliminación de esfacelos ni retención urinaria.
Palabras clave: Adenocarcinoma de próstata. Tratamiento. Criocirugía. Indicaciones. Fracasos de la radioterapia. Hormonoterapia previa. Complicaciones.
Summary.- OBJECTIVES: To perform a bibliographic review of the main features of cryotherapy as a therapeutic option in the managemente of prostate cancer and to report our initial experience.
METHODS: We employed the Endocare Fast-Trac system (Medipro) with 2,4 mm needles implanted in a single maneouvre without rack or transrectal US transducer support. Two cycles of freezing -hawing were employed, with apex backward movement when necessary. Freezing cycle duration was between 7-10 minutes or more. The Onik maneouvre – injection of saline into the Denonvilliers spacediminishes the risk of rectal injury and fistula allowing reaching posterior limits of the icaball beyond the prostatic capsule.
RESULTS: We treated 20 patients. Follow-up was between 30-36 months. 58% of the patients had unilateral prostate cancer, 42% bilateral. In accordance to the classicdefinition 9 patients were classified as low risk of extraprostatic disease, 6 medium risk and 5 high risk; using number of positive cores as the criterion for risk 5, 6 and 9 were low, medium and high risk respectively. Perprotocol prostate biopsies were performed in18 patients 6, 12 and 24 months after treatment. Two patientsunderwent a second treatment due to persistence ofcancer cells in the 6-month biopsy (11%).3-month PSA nadirs after a total of 21 cryo treatments administered were < 0,2 ng/cc in 15 cases (78,9%), < 0,5 ng/cc in 17 (89,4%) and £ 1.0ng/cc in 18 (94,7%); it was over 1 ng/cc in only 5,6%. 30 month PSA for the same cutoff values was 27.8%, 50.0%, 66.6% and 33.3%, respectively.Prostate cancer cells were detected in the 12-month biopsies of 5.5% cases. All 24-month biopsies were negative.
COMPLICATIONS: we observed scrotal edema,hematoma, perineal pain and constipation which lasted 2-3 weeks. 1 patient suffered injury of the mucosa at the prostatic urethra, which did not result in rectal fistula and was treated with bladder catheter for 3 months. 4 patients had erectile dysfunction before treatment. All others presented erectile dysfunction after treatment; 3 of them (20%) recovered rigidity enough to have intercourse over the 30 month period.No urethral sloughing or acute urinary retention appeared and all patients are continent.
CONCLUSIONS: Prostatic cryosurgery is an effective, minimally invasive procedure for the treatment of prostate cancer with very low surgical risk, low morbidity and almost null mortality.
Keywords: Prostate adenocarcinoma. Treatment. Cryosurgery. Indications. Complications.
Correspondencia
Ángel Escudero Barrilero
Servicio de Urología
Hospital Ramón y Cajal
Carretera de Colmenar Viejo 9, 100 km.
28034 Madrid. (España)
Trabajo recibido: 15 de octubre 2005
INTRODUCCIÓN
Según estadísticas americanas el cáncer de próstata es la neoplasia más frecuente y la sitúan en segundo lugar como causa de muerte por cáncer en el varón.
A pesar de los numerosos trabajos realizados, todavía está por definir una pauta terapéutica que sobresalga sobre las demás, en cuanto a mejoría de resultados se refiere. Si bien en décadas pasadas las opciones para el cáncer localizado quedaban reducidas a prostatectomía radical o radioterapia externa, hoy día la oferta se ha multiplicado.
- Prostatectomía radical abierta o laparoscópica con o sin linfadenectomía previa.
- Radioterapia Externa convencional con o sin linfadenectomía laparoscópica previa.
- Radioterapia Externa 3D conformada.
- Radioterapia Externa de intensidad modulada.
- Braquiterapia.
- Braquiterapia más radioterapia externa.
- Ultrasonidos de alta intensidad.
- Hormonoterapia sólo.
- Todas las combinaciones posibles de las terapias anteriores con Hormonoterapia.
- Sin olvidar control periódico sin tratamiento alguno.
A todo lo anterior debemos añadir la criocirugía.
La resección transuretral aducida por algunos no se puede aplicar con fines curativos. Con ella es prácticamente imposible eliminar la totalidad del cáncer, dado que surge en la parte más externa de la próstata y su carácter multifocal. Además, condiciona muchísimo la calidad de vida en el supuesto de que el enfermo precise (que será con seguridad) de otra técnica con intención curativa: prostatectomía radical, radioterapia externa o crioterapia.
La congelación controlada es una técnica en auge. En urología ha aumentado considerablemente su empleo refiriéndose muy buenos resultados en el tratamiento del cáncer de próstata y la estamos investigando como posible alternativa a la nefrectomía parcial en el tratamiento del adenocarcinoma renal con diámetro inferior a 4 cm.
A su implantación ha contribuido el desarrollo de la tecnología que permite inspeccionar con bastante exactitud el proceso de congelación en tiempo real mediante ecografía transrectal y control de la temperatura en las zonas que deben ser destruidas totalmente para erradicar incluso el tejido canceroso existente por fuera de la cápsula prostática, por otro lado, difícil de extirpar con la cirugía (bordes positivos) y menos aún con la braquiterapia y/o radioterapia externa incluidas las modalidades tridimensionales.
Los controles se imparten en las zonas que debemos preservar del efecto letal del frío: esfínter externo, cuello vesical y cara anterior del recto, con el fin de hacer disminuir las complicaciones más temidas: incontinencia reducida a alrededor del 5% y las fístula uretro-rectales que prácticamente han desaparecido, refiriéndose en los últimos trabajos entre el 0 y el 1%.
Cuando se comparan los datos referidos-supervivencia libre de elevación de PSA a 5 años o más y proporción de biopsias negativas-con los publicados con prostatectomía radical o radioterapia externa, especialmente si se eligen grupos de enfermos con riesgo medio y elevado de invasión extraglandular, la crioterapia, se muestra como una técnica altamente competitiva con las otras dos; por lo cual, debe ser considerada como primera elección para el tratamiento de este grupo de pacientes.
La tecnología ha evolucionado considerablemente:
En las décadas de los 60 y 70 los aparatos utilizaban nitrógeno líquido para congelar y se operaba sin control alguno de la evolución del proceso.
Los sistemas de segunda generación incorporan examen ecográfico para guiar la distribución y emplazamiento de las sondas y visualizar en tiempo real la progresión de la bola helada perfectamente diferenciable de la imagen que proporciona el tejido prostático sin congelar y la pared del recto; y sistema de calentamiento uretral que preserva de la necrosis a la mucosa de la uretra.
Los de tercera generación sustituyen el nitrógeno líquido por gases: argón para congelar y helio para calentar e incorporan un dispositivo que permite transformar la congelación en calentamiento casi de forma instantánea. Tienen capacidad para alimentar entre 6 y 8 criosondas e incorporan termosensores que leen la temperatura en tiempo real, situados en lugares estratégicos: bandas neurovasculares derecha e izquierda, espacio de Denonvilliers´, ápex y esfínter externo.
Otro sistema incorpora agujas ultrafinas (1,4 mm de diámetro) y utiliza de 12-16 unidades por tratamiento situadas en posición con ayuda del "templete" utilizado en braquiterapia.
Se deben administrar 2 ciclos congelación-deshielo, alcanzar temperaturas inferiores a –40ºC incluso en el límite posterior de la próstata y separar las dos hojas de la aponeurosis de Denonvilliers´ inyectando suero salino en el espacio virtual existente entre ellas.
Todo ello ha contribuido a sacar mayor provecho de los efectos letales del frío y a que desciendan los porcentajes de complicaciones de forma drástica.
En 1999 el Medicare y el Medicaid aprueban la criocirugía como tratamiento primario del adenocarcinoma prostático por considerar que ha pasado la fase de experimentación para convertirse en una técnica que debe formar parte del arsenal utilizable como primera opción.
PRIMEROS ENSAYOS PUBLICADOS
Wieder y cols. (1) refieren una serie de 83 enfermos, con edades comprendidas entre 45 y 79 años (media 67), recogida entre el 11 de Marzo y el 28 de Diciembre de 1993.
Habían sido tratados previamente con: hormonoterapia el 33%, orquiectomía 3%, braquiterapia 3%, radioterapia externa 9% y con braquiterapia más radioterapia externa 1%. Realizado RTU al 7% y linfadenectomía al 11%. El cáncer fue objetivado en todos mediante biopsia variando el Gleason entre 2 y 10 (mediana 6). (Tabla I).
El PSA a los 3 meses de los 47 enfermos con estadio inferior a D y biopsia negativa es £ 0.5 en 27 (57.4%); entre 0.6 y 0.9 en 6 (12.8%); de 1 a 3.5 en 10 (21.3%) y superior a 3,5 en 4 (8.5%), de éstos últimos en 3 descendió en controles sucesivos por debajo de 0,7 ng/cc y del cuarto no tienen seguimiento.
Coogan y cols. (2) tratan a 87 enfermos, de edad comprendida entre 50 y 80 años con 95 criocirugías. Estadiados con linfadenectomía 49 (57%) y el 68% habían rechazado otras modalidades terapéuticas para tratar su adenocarcinoma de próstata.
Por estadios: T1 18 enfermos, T2 43 y T3 1; N+ 6. En 9 había fracasado la radioterapia y en otros 9 asocian hormonoterapia en el postoperatorio.
Refieren que en 86 de los 87 casos (99%) descendió el PSA con relación al preoperatorio en el transcurso de las 6 semanas siguientes a la crioterapia.
Un año después el PSA de 48 pacientes es £ 0,2 en el 33%; £ 0,5 en el 50%; £ 4 en 87,5% y en los 36 enfermos que no han recibido ningún tratamiento previo, ni tienen ganglios positivos, los porcentajes son: 28%, 42% y 86.1% respectivamente.
En los 33 pacientes con PSA preoperatorio inferior 10 ng/cc, la media de PSA a los 12 meses es de 0,95 ng/cc, con un 6% de biopsias positivas; mientras que en el grupo con niveles ³ 10 (27 enfermos) la media de PSA es de 5,5 ng/cc y en el 4% persiste cáncer. (Tabla II).
En el grupo sin tratamiento previo, llama la atención el bajo número de biopsias positivas (5%) y la alta media de PSA (0,8 ng/cc). En enfermos con biopsia negativa el PSA permanece estable en tanto que aumenta progresivamente en los casos que se objetiva cáncer.
La proporción de biopsias positivas es mucho más elevada en el grupo con radiación previa (37%) que en el radiado (5%) y también es patente la de PSA indetectable después de la crioablación: 11% y 33% respectivamente.
Como complicaciones refieren edema escrotal en la mayoría de los enfermos que se resuelve en casi todos en el transcurso de 7 a 10 días.
Necrosis uretral causa de retención en 9 enfermos (9%) tratada mediante extracción endoscópica de los fragmentos. Cuando se hace imprescindible la RTU, el riesgo de incontinencia es muy alto (25% de los casos), a pesar de tener la precaución de no resecar el cuello vesical. Una fístula uretro-rectal que curó con sonda permanente en 4 semanas.
Utilizando el calentador uretral de serie, observan obstrucción sólo en los casos con cáncer persistente o recidivado después de la radioterapia.
Bahn y cols. (3) entre el 10 de febrero de 1993 y 31 de octubre de 1994 han realizado 214 congelaciones controladas de próstata en 210 enfermos con edades comprendidas entre 51 y 80 años (media 67).
Analizan 130 enfermos con seguimiento superior a 3 meses, de los cuales 27 (21%) son cánceres recidivados tras la radioterapia. Excluyen los N+ objetivados con linfadenectomía.
Evalúan a los 3 meses 130 casos y 91 a los 6 meses. La diferencia se debe a persistencia de cáncer en 10 enfermos, 3 con fístula, gammagrafía ósea positiva y biopsia negativa en tres, uno murió por causa ajena y 22 perdidos. (Tabla III).
Las posibilidades de biopsia positiva en los enfermos con extensión extraprostática (20.8% vs 4.9%), Gleason ³ 7 -7 de 58 (12%) con Gleason 7 y 4 de 15 (28.6%) en los 8 - 9 vs 3 de 57 (5,2%) con Gleason 4 - 6- y en quienes han recibido radioterapia previa, -3 de 27 (11%) a los tres meses y uno más a los 6 meses vs 7 de 103 (6.8%) de los no tratados-.
El cáncer persistente en la biopsia de 14 enfermos se localiza en el pico prostático en 9, zona media en 5, base en 4 y en vesículas seminales en 5. Afectando a varias zonas en algunos. A 4 de ellos indican una segunda intervención siendo en 3 la biopsia posterior negativa.
Administran hormonoterapia entre 2 y 8 meses antes de la intervención en 114 enfermos (88%). La recomiendan en próstata de volumen superior a 40 cc, volumen tumoral que exceda los 3 cc y evidencia de tumor extracapsular. La media de volumen glandular desciende de 30 cc previa a 20,4 cc tras la supresión androgénica.
Shinohara y cols. (4) aplican criocirugía a 102 enfermos entre Julio de 1993 y Febrero del 95 (Tabla IV).
Estadian con linfadenectomía a 42 por PSA ³ a 15 ng/cc y Gleason ³ 7 y sólo encuentran ganglios positivos en 3 (7%). Descartan metástasis en hueso con gammagrafía en dichos enfermos y en aquellos con invasión de vesículas seminales y/o extensión extracapsular inequívoca.
Habían sido tratados previamente con: radioterapia 10%; orquiectomía bilateral 3%; crioterapia 8% y RTU o adenomectomía 5%.
Recomiendan hormonoterapia previa en pacientes con invasión de la grasa pericapsular y/o volumen prostático superior a 50 cc. La administran al menos 3 meses en el 58% y observan que se reduce el tamaño de la próstata entre un 9% y un 66%.
Los mejores resultados (Tabla V) los refieren en el estadio T1c (11 enfermos), de los cuales en 7 el PSA es inferior a 0,1 ng/cc; en 3 permanece estable durante 24 meses con cifras de 1,3; 0,3; 0,1 y aumenta en uno de 1,4 a 3 ng/cc en 6 meses. En todos ellos la biopsia fue negativa.
Nueve de 55 (16%) enfermos cuyo PSA pretratamiento era inferior a 10 ng/cc tienen biopsia positiva. Dos de ellos recidivaron en las vesículas seminales exclusivamente.
De los 53 enfermos con PSA < 0,1 ng/cc a los 3 meses, revisan a 40 tres meses más tarde. En 32 (80%) el PSA sigue por debajo de 0,1 ng/cc, en 5 (12,5%) es de 0,1 ng/cc y en los 3 restantes 0,2; 0,3 y 1,2 ng/cc respectivamente.
Los peores resultados del grupo que incluye los primeros pacientes tratados, los relacionan con el aprendizaje de la técnica (Tabla VI); al mejoramiento contribuye también innovaciones tales como el empleo de 5 criosondas, la congelación adecuada del ápex recolocando las sondas para adaptar la forma de la bola helada a la configuración de la próstata y, sobre todo, administrar 2 e incluso 3 ciclos en vez de uno. Todo ello permite tratar con más garantías la totalidad de la glándula.
En 1997 (5) añaden a los casos referidos los que tratan entre febrero de 1995 y abril de 1996, seguidos entre 3 y 36 meses (media 17,6).
El alto porcentaje de enfermos de mal pronóstico es muy similar al descrito en el trabajo anterior: estadio T3-T4 (61,3%), PSA entre 10 y 29,9 ng/cc en el 30% y Gleason 7 (35%) y entre 8-10 (19%).
Definen fracaso bioquímico como nadir ³ 0,5 ng/cc ó 2 incrementos de PSA ³ a 0,2 tras el nadir ó biopsia +.
Las Tablas VII y VIII resumen sus resultados. De los 28 con PSA ³ 0.5, 13 tenían biopsia positiva a los 3 meses, subió posteriormente el PSA 0,2 ng/cc en 12 y trataron con hormonoterapia a 3 (11%) con nadir superior a 30ng/cc.
Relacionan progresión con el número de ciclos aplicados. De los 12 enfermos primeros a quienes administran un solo ciclo, 9 (75%) tienen biopsia positiva y 11 (92%) fracaso bioquímico, cifras que contrastan con las de 98 enfermos del grupo tratado con dos o más ciclos: 17% y 42% respectivamente.
Al contrario de lo que ocurre con la radioterapia, tras la congelación controlada la muerte celular es casi inmediata y aunque el PSA puede aumentar durante el primer mes, el nadir se alcanza entre 6 y 8 semanas después del proceder. Puesto que el efecto de la hormonoterapia previa puede prolongarse durante 2-3 meses, cuando se administra, niveles de PSA determinados antes de 6 meses no tienen valor.
Concluyen: nadir de PSA £ 0,4 ng/cc predice altas posibilidades de buena evolución, tanto bioquímica como anatomopatológica.
Ambos fracasos tienden a diagnosticarse antes de los 18 meses.
La hormonoterapia previa (Tabla IX) parece reducir las posibilidades de fracaso en los T1 – T2.
En 1999 (6) amplían el número de casos descritos en sus dos artículos previos (4,5). Incluyen los tratados entre el 4 del 1996 y el 1 del 1998. Analizan 176 enfermos de edades comprendidas entre 50 y 80 años en quienes han practicado 207 procederes.
La proporción por estadios es muy similar en los 3 trabajos. Digno de resaltar: siguen incluyendo un alto porcentaje de cánceres estadio T3.
En la mayoría de los enfermos utilizan nitrógeno líquido, 5 criosondas y en algunos una sexta situada en áreas visibles de extensión extracapsular y dos ciclos, con recolocación para congelar el ápex en los casos que lo precisan. Extienden la bola helada entre 2 y 4 mm por fuera de los límites laterales de la próstata, 6 mm por delante del ápex y por su borde posterior hasta alcanzar la capa muscular del recto.
Media de seguimiento 30,8 meses. Controlan a 122 (60%) durante más de 24 meses y a 75 (36%) 36 meses o más.
La supervivencia actuarial libre de enfermedad bioquímica de los enfermos tratados con una crioterapia exclusivamente es del 62% y 49% al año y a los 3 años respectivamente. (Tabla X).
Consideran factores influyentes sobre el pronóstico:
Insisten sobre el efecto aprendizaje. De los enfermos seguidos más de 24 meses, en el grupo tratado el primer año permanecen con PSA "favorable" el 39% vs el 59% de los manejados durante el segundo año.
Son más eficaces dos ciclos que uno. Resaltan que 12 de sus primeros enfermos fueron tratados con un solo ciclo.
PSA preoperatorio. Cuanto más elevado mayores posibilidades de fracaso.
El nadir es útil para predecir incrementos de PSA y posibilidades de que la biopsia sea positiva. Ambos tienden a objetivarse dentro de los 12 primeros meses tras el tratamiento.
Los cánceres con riesgo bajo de extensión extracapsular evolucionan mejor que los de riesgo alto.
El Gleason previo no influye significativamente.
En esta serie la proporción de enfermos con cáncer de mal pronóstico es muy alta: estadio T3-T4 el 61,3%, media de PSA sérico 18,4 ng/cc y Gleason entre 8 – 10 en el 20%. Sólo el 22 % han sido etiquetados de bajo riesgo.
Además los criterios de fracaso son muy estrictos: Nadir de PSA ³ 0,5 ng/cc, incrementos del 0,2 ng/cc tras el nadir en dos ocasiones.
Criterios más rigurosos que los utilizados en la inmensa mayoría de los trabajos publicados sobre radioterapia -en cualquiera de sus formas- y en muchos de los que valoran la prostatectomía radical. Homologados, se refieren resultados similares en grupos de pacientes con cánceres de agresividad parecida; agresividad que condiciona el pronóstico cualquiera que sea la terapia aplicada: prostatectomía radical, radioterapia y, como no, la congelación controlada.
Connolly y cols. (7) analizan su experiencia con 147 enfermos. Los resultados más relevantes se resumen en la Tabla XI.
La evolución del PSA de los 65 enfermos con niveles sanguíneos inferiores a 0,1 ng/cc a los 3 meses, muestra a los 6 que en 28 de 33 (85%) con estadio T1 - T2a - T2b - T2c continúa por debajo de 0,1 ng/cc, oscilando en los 5 restantes entre 0,1 y 0,3 ng/cc. Siguen menores de 0,1 ng/cc en 19 (70%) de los 27 controlados al año y varía entre 0,1 y 0,5 ng/cc en los otros 7.
En el grupo con estadio T3a, T3b ó T3c se mantienen inferiores a 0,1 ng/cc en 25 (78%) de 33 enfermos a los 6 meses y en 13 de 24 (54%) al año.
Destacar que la proporción de biopsias negativas es exactamente igual en los estadios T2 y T3 (79%) y que no objetivan cáncer en ninguno de los dos T4 a quienes la practican.
Concluyen:
- En 68/145 (47%) el PSA es inferior 0.1 ng/cc a los 3 meses. Permanece por debajo de 0.1 ng/cc: a los 6 meses en 53 de 65 (82%) y al año en 32 de 51 (63%).
- Relacionan biopsia negativa y PSA inferior 0.1 ng/ cc con el volumen canceroso (estadio).
- El cáncer recidivado invade con más frecuencia las vesículas y/o el ápex.
- Se produce impotencia siempre que la próstata sea congelada completamente y el riesgo de retención pueda minimizarse con el empleo del calentador uretral aprobado por la FDA y dejando sonda permanente durante 2 - 3 semanas.
- La morbilidad no se incrementa en los T3.
Cohen y cols. (8) han tratado 383 enfermos entre Junio de 1990 y Mayo del 94. Emplean nitrógeno líquido, 5 sondas, un solo ciclo, control ecográfico y calentador uretral por el que circula líquido a 40ºC. En resumen, la biopsia realizada 21 meses después fue negativa con una sola sesión en el 69% de los casos y con dos ó más sesiones en el 82%. Llama la atención que ninguno de los 6 enfermos con diseminación a ganglios (D1) tenga biopsia positiva. Todos tratados con hormonoterapia. Mientras que en los D0 fue positiva en el 50% y 0% de los manejados sin y con hormonoterapia respectivamente.
De su experiencia se deduce: (Tabla XII y Tabla XIII).
- La hormonoterapia previa puede ser útil en enfermos con PSA superior a 30 ng/ml.
- La criocirugía es eficaz en pacientes con Gleason alto ³ 7 y PSA < 30 ng/ml.
- El estadio tumoral influye poco sobre los resultados.
Long y cols. (9) publican su experiencia de 145 enfermos tratados entre enero de 1993 y julio de 1994. Media de edad 65,6 años (entre 46 y 82 años). Recomiendan hormonoterapia en 45 pacientes con próstata de volumen superior a 50 cc que administran durante 3-4 meses.
Técnica: utilizan entre 5 y 7 sondas y control ecográfico en tiempo real dejando que el límite hiperecoico de la bola helada se aproxime a la pared del recto. En casi todos los casos administran un ciclo y otro retirando las sondas entre centímetro y centímetro y medio para congelar el ápex. El calentador aprobado por la FDA lo emplean en los primeros 94 enfermos y otro alternativo en los 51 últimos.
Sólo consideran de bajo riesgo al 29% y 18 (12%) son cánceres recidivados tras radioterapia. (Tabla XIV).
Realizan 160 biopsias: entre 3 y 6 meses a 105 enfermos y entre 1 y 2 años a 55. Evidencian cáncer en 27 (16%). Relacionadas con el aprendizaje refieren 7(28%) biopsias positivas en las realizadas a los primeros 25 pacientes frente a 6/67 (9%) en el grupo más reciente.
ESTADIO C (EXTRAPROSTÁTICOS)
Alrededor de 15.000 enfermos anuales entran en la categoría del Estadio C. En ellos se refieren resultados mediocres tanto si son tratados con radioterapia como con prostatectomía radical.
Miller y cols. (10) definen el estadio C como tumor palpable por fuera de la cápsula o extensión extracapsular demostrada por ecografía transrectal, resonancia magnética, TAC o biopsia positiva en áreas de las bandas neurovasculares o vesículas seminales. Practican linfadenectomía para evaluar los ganglios y excluyen los fracasos de la radioterapia. Media de seguimiento 12 m (3 – 36 m).
En la biopsia de control obtienen 10 muestras: ápex, porción media y base de la próstata, vesículas seminales, bandas neurovasculares, y en muchos enfermos una más de la zona de los conductos eyaculadores. Refieren ausencia tras el 1er proceder en 49/62 (79%) y con un 2º recuperan 6/9 (67%). En total, a los 3 meses no observan células malignas en las muestras de 55 de 58 enfermos (95%). Practicada un año después de la criocirugía fue positiva en 3 de 14 enfermos en quienes había aumentado el PSA. En ninguno de la serie objetivan metástasis por gammagrafía ósea ni otras localizaciones a distancia. Tabla XV.
Hallazgos por tacto rectal:
- No se palpa la próstata o fosa prostática plana en 32/45 (71%).
- Se reduce el tamaño de la glándula más del 50%, pero se palpa tejido prostático, cicatricial o indurado en 11(27%)
- Se reduce el tamaño menos del 50% con relación al previo en 1.
RESULTADOS DECISIVOS PARA DEFINIR LAS INDICACIONES E INTRODUCIR NOVEDADES EN LA TÉCNICA DIRIGIDAS A MEJORAR EL CONTROL DEL CÁNCER Y DESCENDER EL PORCENTAJE DE COMPLICACIONES.
A medida que se perfecciona el utillaje, se depura la técnica y se conoce mejor la distribución y efecto citotóxico del frío se percibe un mejoramiento en los resultados.
Resumimos comparados los aspectos clínico-patológicos (Tabla XVI), resultados más relevantes (Tabla XVII) y complicaciones (Tabla XVIII) expuestos en los trabajos de Wong y cols. (11), Saliken y cols. (12), Donnelly y cols. (13) y Aus y cols. (14).
De estas publicaciones se deduce:
1. La criocirugía puede ser eficaz en pacientes con cáncer que invade el espacio pericapsular (T3) y Gleason igual o superior a 7 ng/ml.
De la experiencia de Wong y cols. (11) se desprende que los resultados pueden ser tan buenos en enfermos con tumor estadio T2 como en los T3. Así, refieren biopsia negativa a los dos años en el 82% del grupo de los T2 (que incluye 54 enfermos con el 77% de la subdivisión T2b) frente al 75% en el grupo de los T3. En la misma medida, la Crioterapia es eficaz en cánceres con Gleason alto. Practican biopsia a los 2 años a 6 de los 7 enfermos con Gleason 8 – 10 y fue negativa en 5 de los 6 (83%).
Algo similar se infiere de la serie de Donnelly y cols. (13) que sólo incluye un 17% de enfermos con bajo riesgo de extensión extracapsular, siendo la proporción con Gleason ³ 7 del 58%.
2. Controlar sólo con ecografía como evoluciona la congelación no es suficiente.
Wong y cols. (11) ponen de manifiesto la necesidad de monitorizar la temperatura en tiempo real. Es muy llamativa la diferencia de proporciones con biopsia positiva en el grupo de enfermos en quienes vigilan la temperatura durante el proceder (6 de 66 enfermos: 2,9%) y en el que no lo hicieron (10 de 12: 83%).
Quizás un motivo que justifica los peores resultados descritos por Aus y cols. (14) podría ser la no utilización de termosensores. Está claro que el examen ecográfico, por sí solo, no es suficiente y estos autores describen la bola helada "ecográfica por fuera de los bordes laterales de la próstata". Es imprescindible que sobrepase también su límite posterior, especialmente en pacientes con riesgo alto de invasión pericapsular presumible en un porcentaje elevado de los enfermos que han tratado y evidente en los T3. También puede influir el empleo de 5 sondas para próstatas mayores de 50 gr. Hoy día se sabe que requieren 8 sondas y, dependiendo de su diámetro antero-posterior, recolocar para congelar el ápex.
3. Posibilidades de rescate con criocirugía en pacientes en quienes ha fracaso previamente.
Wong y cols. (11) realizan una segunda crioablación a 12 enfermos con biopsia positiva, se negativiza en 11 y persiste negativa durante 2 años contados a partir del segundo tratamiento. Así, tras 2-3 procederes en el 94% de los enfermos la biopsia es negativa. De igual modo, en la serie de Donnelly y cols. (13) la proporción de enfermos en que no objetivan cáncer en la biopsia tras un tratamiento es del 86% y aumenta al 98,6% después de administrar a los 10 enfermos en que persistió el cáncer 2 ó 3 criocirugías.
4. Digno de resaltar el descenso de los porcentajes de complicaciones respecto a los anteriormente publicados (Tabla XVIII).
Wong y cols. (11) también evidencian diferencias, en cuanto a complicaciones se refiere, entre el grupo en el que utilizan el sistema de protección uretral aprobado por la FDA comparado con el que usan un sucedáneo. De suma importancia es el control de la temperatura que alcanza el líquido que circula por el sistema protector de la uretra. Debe oscilar entre 40 y 43ºC.
El mayor porcentaje de complicaciones referidos por Aus y cols. (14) lo justifican porque la temperatura del líquido del sistema en su serie oscila entre 35º y 37ºC. Es posible que también contribuya a ello el tamaño de la próstata: sólo aplican hormonoterapia para reducir volumen en próstata mayores de 60 cc.
Las complicaciones: necrosis de la mucosa uretral, esclerosis del cuello vesical e incontinencia a las que Aus y cols. (14) añaden formación de cálculos en uretra prostática se producen cuando el sistema de protección de la uretra no hace buen contacto con el urotelio de la uretra prostática, cuello vesical y/o esfínter estriado respectivamente. Esta situación se da con mayor frecuencia en paciente con próstata de gran tamaño y en quienes han sido tratados previamente con RTU, Adenomectomía retropúbica o Radioterapia en cualquiera de sus modalidades.
Saliken y cols. (12) recomiendan no indicar la Criocirugía cuando se sospecha invasión del cuello vesical y/o uretra prostática. En estos casos el sistema calorífico preserva de la destrucción también al cáncer que pueda existir en su área de acción.
SEIS SONDAS EN VEZ DE CINCO
Lee y cols. (15) estudian la posibilidad de mejorar los resultados empleando 6 – 8 criosondas en vez de 5.
Para evitar el efecto aprendizaje comparan los 82 últimos de 500 tratados con 5 criosondas con los 81 siguientes en quienes emplean 6 – 8 criosondas. Tabla XIX y XX.
Los manejados con 6 sondas tienen 3,5 veces más posibilidades de alcanzar los niveles 0 y 1 que se relacionan con mayor destrucción de la glándula observada en la biopsia.
TRABAJOS CON SISTEMÁTICA HOMOGÉNEA Y SEGUIMIENTO PROLONGADO
Agrupan a los pacientes atendiendo al riesgo de extensión extracapsular. Cuando el caso reúne estas 3 condiciones: PSA < 10 ng/cc; Gleason < 7 (no existe ninguna zona en los cilindros con Gleason 4) y estadio < T2b se define de bajo riesgo; de riesgo medio si el valor de uno de los 3, cualquiera que sea, está incrementado y de alto riesgo cuando 2 ó los 3 parámetros indicados sobrepasan dichos límites.
La técnica que describen tiene muchos aspectos en común e incorpora la mayor parte de los requisitos necesarios destinados a compaginar la mayor destrucción de los tejidos con el mínimo de complicaciones:
• Aunque todavía emplean nitrógeno líquido, la mayoría se hicieron con el sistema de gases -bastante más eficaz-: argón para congelar y helio para calentar.
• Control ecográfico en tiempo real
• Sistema de protección uretral de serie aprobado por la FDA, por el que circula agua a temperatura entre 40º y 42ºC, suficiente para proteger los tejidos circundantes, cuello vesical, mucosa uretral y zona del esfínter externo.
• Utilizan no menos de 5 criosondas, en la mayoría de los enfermos 6 y cuando el caso lo requiere hasta 8 homogéneamente distribuidas en el volumen prostático.
• Cinco termosensores, situados en las bandas neurovasculares derecha e izquierda, pico prostático, espacio de Denonvilliers´ y esfínter estriado.
• Entre 1 y 3, en la mayoría 2 ciclos congelación – deshielo con retroceso apical en caso necesario.
• Temperaturas inferiores a –40ºC medidas con termosensores.
• La maniobra de Onik.
• Hormonoterapia durante el tiempo suficiente para que el volumen de la glándula descienda por debajo de 45 cc.
Los criterios de fracaso también son uniformes. Dan resultados tomando como límite niveles de PSA £ 0,5; £ 1,0 ng/cc y aplicando la definición ASTRO. Han realizado biopsia de control en la mayoría de los enfermos, obteniendo entre 6 y 12 muestras por caso.
El trabajo de Donnelly y cols. (13) se ha analizado con detalle en páginas anteriores.
Long y cols. (16) partiendo de la base de datos de cinco Hospitales, recogen 975 enfermos tratados con criocirugía como primera opción entre Enero de 1993 y Enero de 1999. Hacen 3 grupos atendiendo a la definición de riesgo de extensión extracapsular Bajo/Medio/Alto.
Con un seguimiento de 24 ± 16.5 meses refieren resultados considerando fracaso cuando los niveles sanguíneos de PSA son ³ 0.5ng/cc y/o biopsia positiva.
Identifican y categorizan por separado el grupo tratado con hormonoterapia previa que administran al 30% entre 3 y 8 meses. (Tabla XXI).
Considerando que el grupo tratado con hormonoterapia incluye mayor proporción de enfermos con más alto riesgo (49% vs 37% p= 0,0001), piensan que la supresión androgénica no afecta al resultado histológico.
La proporción de complicaciones en el grupo manejado con calentador uretral de serie es menor que en el que emplean un sistema alternativo: 10% RTUs o intervenciones génito-urinarias mayores y 0,4% con fístula próstato-rectal en el primer grupo, frente a 44% y 1,4% respectivamente en el segundo.
Bahn y cols. (17) publican su experiencia con 590 enfermos tratados entre Marzo de 1994 y Septiembre de 2001. La media de edad es 71,13 años y de seguimiento 5,72 años.
En los 350 primeros casos utilizan nitrógeno líquido que consideran menos eficaz que el argón/helio empleado en el resto.
Una vez alcanzada la temperatura objetivo, mantienen estable el volumen de la bola helada durante 10 minutos, cuidando de no poner en peligro la pared del recto.
El primer ciclo es más lento que el segundo ya que la capacidad térmica y resistencia a la congelación decrece en tejidos congelados previamente. Administran hormonoterapia al 91,5% de la muestra durante periodos que oscilan entre 3 y 12 meses para disminuir el tamaño de la glándula.
Chinn y cols. (18) exponen la evolución de 95 enfermos tratados entre Julio de 1993 y Enero de 1999 y refieren periodo libre de elevación de PSA actuarial a 6 años y proporción de biopsias negativas.
Los resultados de los 3 trabajos y el de Donnelly y cols. (13) se resumen en las Tablas XXII, XXIII y XXIV.
EXPERIENCIAS QUE REFIEREN RESULTADOS A 8 AÑOS O MÁS
Chinn y cols. (19) de 49 pacientes tratados con 50 procederes, excluyen a 3 fallecidos por causa ajena antes de los 8 años e incluyen 3 enfermos muertos con PSA aumentado. Así, analizan 47 enfermos seguidos durante 8 años, en quienes determinan PSA cada 6 meses y biopsian cada 12 meses. (Tabla XXV).
La supervivencia total es del 93.6% (44/47), la supervivencia libre de enfermedad del 95.9% (45/47) y en el 93.6% (44/47) la biopsia fue negativa.
Lugnani, F. y Zanconati, F. (20) exponen su experiencia con 54 casos seguidos como máximo 135 meses (media 92,5 meses). De edad comprendida entre 58 y 82 años y estadio tumoral T2-T4.
Técnica: emplean nitrógeno líquido, 4 ó 5 sondas de 3 mm, dos ciclos congelando en cada uno más de 7 minutos, con temperaturas inferiores a -40ºC en la mayoría de los casos. Emplean calentador uretral y termosensores que sitúan en base, pico y esfínter externo. Al ser los primeros de su serie (considerar efecto aprendizaje), no realizaron la maniobra de Onik.
Propugnan:
1.- No utilizar soporte para el transductor transrectal ni rejillas para situar las sondas. Así, facilitan las maniobras y distribuyen mejor las sondas en el tejido diana.
2.- La maniobra de Onik permite congelar con mayor agresividad la zona periférica de la próstata alcanzando en ella temperaturas útiles (inferiores a -40ºC) sin ocasionar fístulas uretro-rectales.
3.- Dejar sonda uretral en vez de talla, disminuye en número de complicaciones.
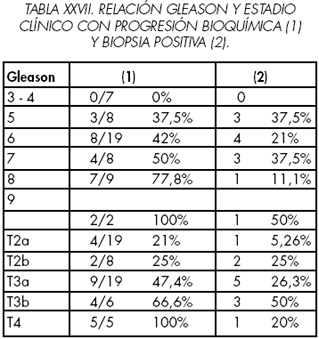
Refieren progresión bioquímica en 24 de los 57 y 12 de estos 24 tienen biopsia positiva. Fallecieron durante el periodo de observación 21 pacientes: 5 por cáncer (los 5 de alto riesgo y dos de ellos con biopsia positiva), uno en progresión por causa ajena y 15 por causa ajena. (Tabla XXVI y XXVII).
Derrick y cols. (21) refieren su experiencia con 215 enfermos estadio T1 - T2 y Gleason entre 5 y 9 de los cuales el 10% son fracasos de radioterapia y/o braquiterapia previa.
No refieren mortalidad operatoria, 8 enfermos fallecieron de cáncer y 3 por causa ajena.
De la Tabla XXVIII se deduce que los resultados se mantienen con el paso del tiempo.
En otro trabajo (22) analizan 249 casos de características muy similares a los anteriores -estadio T1 - T2, en ningún caso el Gleason fue igual o inferior a 4 variando entre 5 y 9-. Riesgo: bajo 34,76%, medio 38,09% y alto 27,17% y fracasos de la Radioterapia el 11,76%. Retiran el calentador uretral 1 hora después de finalizar el proceso. De ellos consideran a 19 perdidos y fallecieron 4 por cáncer y 14 por otras causas. Siguen vivos 211. (Tabla XXIX).
CRIOCIRUGÍA INDICADA EN PACIENTES QUE HA FRACASO O RECIDIVA SU CÁNCER DEPUÉS DE RADIOTERAPIA.
Para Hanks (Int. J. Rad. Oncol. Biol. Phys. 16.1431. 1989) "la recidiva local tras radioterapia tiene una historia natural agresiva, el riesgo de metástasis se acentúa y es, a menudo, causa de muerte".
La radioterapia externa y braquiterapia se utilizan como tratamiento del cáncer localizado de próstata. Son muchos los pacientes manejados con estas técnicas. Se dice que en EEUU se tratan anualmente unos 22.000 enfermos con "fines curativos". Se describe persistencia o recidiva local entre el 35 y 93% según diversas estadísticas. Amplio margen justificado por la diferente selección de los enfermos incluidos en los diversos trabajos, el tiempo tras la terapia a que se practica la biopsia y el empleo de hormonoterapia en algunos protocolos durante 3 años a partir del momento de la radiación.
La recidiva local -por ella misma- precisa de diversas actuaciones quirúrgicas y endourológicas. También se refiere correlación entre fracaso bioquímico/ biopsia positiva y fracaso clínico loco-regional y/o a distancia (metástasis), que puede influir en la supervivencia. La elevación del PSA se justifica por: micrometástasis ocultas y/o persistencia o recidiva del tumor local.
La radioterapia induce esclerosis en el ambiente tisular que rodea el cuello vesical, próstata y uretra membranosa y alteraciones en dichos órganos que solapándose potencian a las propias de otras técnicas como por ejemplo prostatectomía radical y criocirugía; resultado: un alarmante incremento del número y gravedad de las complicaciones, comparados con las que se producen tras dichas técnicas aplicadas de entrada, sin radioterapia previa.
El PSA se hace indetectable después de la prostatectomía radical entre un tercio y la mitad de los enfermos en quienes se emplea de rescate tras el fracaso de la radioterapia, es decir, dicha proporción de enfermos se ha recuperado con cirugía. En esta situación se está utilizando la congelación controlada -técnica mini-invasiva- de mucho menos riesgo que la prostatectomía radical, con menor número de complicaciones y prácticamente similares resultados desde el punto de vista canceroso.
Miller y cols. (23) manejan 33 enfermos de los cuales 27 habían sido tratados previamente con radioterapia externa, 4 con braquiterapia y 2 con ambas. Con media de seguimiento de 16,8 meses; comparan un grupo integrado por 11 pacientes que habían recibido con anterioridad Hormonoterapia entre 3 y 60 meses (media de 14 meses), suprimiéndola antes de practicar la congelación controlada, con otro manejado sin ella y refieren biopsia positiva tras una sesión en el 18,2% y 31,8% respectivamente. El intervalo entre radioterapia y criocirugía que varió entre 6,6 y 133 meses (48,3 meses), influye en la proporción de biopsias positivas: 3 de 17 (17,6%) cuando era igual o inferior a 40,5 meses y 6 de 16 (37,5%) cuando el espacio de tiempo es superior a 40,5 meses.
De los pacientes con biopsia positiva tratan de recuperar a 2 con una 2ª congelación y a otro con dos sesiones más. De estos 3 enfermos en 2 repiten la biopsia, siendo negativa en ambos. Como resultado final 27 de 32 enfermos (84,4%) tienen biopsia negativa. De los 10 seguidos al menos durante 1 año, 3 mantienen el PSA £ 0,4 ng/cc y 8 por debajo de 4 ng/cc. Recomiendan hormonoterapia después la criocirugía en 15 de 33 enfermos: por metástasis en 3; biopsia positiva en 6 y aumento de PSA con biopsia negativa en otros 6.
Pisters y cols. (24) indican crioterapia en 150 enfermos con adenocarcinoma de próstata recurrente tras haber administrado varias modalidades de radioterapia (grupo 1) y en pacientes en los que se suma evidencia clínica de hormono-quimio-resistencia: elevación del PSA tras asociar a la radiación hormonoterapia, supresión de andrógenos más quimioterapia y quimioterapia sólo.
Tratan enfermos con evidencia clínica de invasión de vesículas seminales y extensión extracapsular (el 60 % T3 antes de la radioterapia), PSA elevado y Gleason alto, siempre que haya posibilidades razonables de incluir en el campo de congelación todo el volumen tumoral. Consideran fracaso elevaciones del PSA ³ 0,2 ng/cc tras el nadir. (Tabla XXX).
Las posibilidades de PSA inferior a 4 ng/cc y PSA indetectables no alcanza significación estadística comparando un ciclo vs dos, ahora bien, la recaída bioquímica posterior es significativamente mayor en los primeros que en los segundos (p < 0,03).
En el grupo 1, la elevación tardía del PSA en enfermos que alcanzaron niveles indetectables, es significativamente mayor (p < 0,01) en los tratados con un ciclo que cuando aplican dos, tendencia que también observan en el grupo 2 (p= 0,05).
El porcentaje de biopsias negativas también se beneficia con la aplicación de 2 ciclos en los grupos 1 y 2: 93% y 75% vs 71% y 56% con 1 ciclo respectivamente.
Concluyen: con independencia del sistema de calentamiento uretral utilizado, aplicar 2 ciclos puede mejorar los resultados en cuanto se refiere a biopsias negativas y consolidación del PSA indetectable conseguido tras la criocirugía.
Taille y cols. (25) refieren 43 enfermos tratados con criocirugía de recuperación tras recidiva del cáncer después de haber sido radiados con fines curativos. Todos reciben hormonoterapia antes de la congelación durante 3 meses. Tiempo de hospitalización entre 1-2 días.
Cuando el PSA está aumentado y por tacto se palpan "de novo" nódulos, induración, asimetría o firmeza, confirman la presencia de cáncer con biopsia transrectal obteniendo muestras de próstata y vesículas seminales.
Basan la recomendación en: Gleason, niveles de PSA, edad y estado general del enfermo.
Es frecuente que tras la Radioterapia el Gleason sea más alto. Cuando esto ocurre recomiendan practicar gammagrafía ósea y linfadenectomía para evitar tratamientos locales superfluos a enfermos con cáncer extendido más allá de la glándula.
Advierten del peligro de congelar la base vesical y/o el trígono cuando el cáncer se extiende a las vesículas seminales. Es muy probable que en esta situación el enfermo no se beneficie con terapias de efecto local. Para estos casos se debe considerar el tratamiento hormonal. (Tabla XXXI).
Refieren supervivencia actuarial libre de elevación de PSA a los 6 meses del 79% y a los 12 del 66%. Permanecen libres de elevación del PSA el 73% de los pacientes que alcanzaron nadir £ 0,1 ng/cc v.s. el 30% de los que presentan niveles superiores a 0,1 ng/cc, nivel que predice recidiva bioquímica en el análisis multivariantes. En 8 pacientes con elevación del PSA practican biopsia y encuentran cáncer en 3 (37%).
Chin y cols. (26) refieren 118 enfermos seguidos entre 3 y 54 meses (media 18,6), 71 de los cuales habían recibido hormonoterapia en el período comprendido entre el fracaso de la radioterapia y la congelación controlada.
Observan PSA inferior a 0,5 ng/cc a los 3 meses en 114 (96,6%). Durante el seguimiento 10 desarrollaron metástasis .9 con PSA superior a 5 ng/cc y uno con PSA inferior a 5 ng/cc. localizadas en hígado, hueso y ganglios pélvicos.
Tomando como fracaso PSA mayor de 4, mayor de 2 y mayor de 0,5 ng/cc, la supervivencia libre de elevación de PSA es del 68%, 55% y 34% respectivamente. Encuentran cáncer en 23 de los 745 cilindros que estudian, correspondientes a 7 casos que rescatan con una segunda sesión.
Definen como signos de mal pronóstico: incremento del PSA en enfermos tratados con Hormonoterapia, PSA superior a 10 ng/cc, Gleason superior a 7 y gran volumen tumoral (T3-T4). A estos últimos, los consideran malos candidatos por riesgo acentuado de fístula uretro-rectal, lesión de la base vesical, orificios ureterales y esfínter externo. Asumen que el 100% de quienes fueron resecados antes de la radioterapia quedan incontinentes.
Izawa y cols.(27) analizan los 150 enfermos referidos anteriormente por Pisters y cols. (24) con media de seguimiento de 4,8 años (entre 1,5 y 6,3). Desestiman 14 tratados previamente con quimioterapia sólo. Así, refieren resultados de 131 pacientes de los cuales a 110 han realizado biopsia sextante, tras la congelación.
Consideran indetectable niveles de PSA £ 0,1 ng/cc y fracaso niveles ³ 2 ng/cc después del nadir.
Refieren recidiva bioquímica en el 63 % de los enfermos. Cáncer en la biopsia en 23 de 110 (20,9 %). Ganglios en el TAC en 16 (12,2%). Gammagrafía ósea positiva en 18 (13,7 %). Han muerto de cáncer 28 (21,4 %) y por causa ajena 7 (5,4 %). (Tablas XXXII).
Consideran de mal pronóstico PSA superior a 10 ng/cc e infiltración extracapsular (estadio >T2) previos a la RTX y anteriores a la crioablación: PSA superior a 10 ng/cc, Gleason 9-10 y andrógeno-independencia. (Tabla XXXIII).
Para Katz y cols. (28), el tratamiento del cáncer localizado a la próstata tras haber fracasado la radioterapia constituye un reto por las complicaciones propias de la radiación y la mayor agresividad de la célula cancerosa radiorresistente o recidivada.
Refieren su experiencia con 157 enfermos rescatados con Crioterapia durante 10 años. La mediana de edad, intervalo entre radiación y criocirugía, Gleason, niveles de PSA y seguimiento es de 70 años, 5.5 años, 8, 5 ng/cc y 37 meses (entre 3-119) respectivamente. Reciben hormonoterapia neoadyuvante 73 (46.5%).
Alcanzan nadir inferior a 1.0 ng/cc 131 (83.4%). Media y mediana de nadir de PSA 0.8 ng/cc y 0.1 ng/cc respectivamente. Mueren por cáncer 1.9%. Utilizando la definición de fracaso ASTRO la supervivencia libre > PSA es del 73,3% que aumenta al 83,3% considerando sólo los 50 casos tratados más recientemente.
• Continuará en el próximo número (Vol. 58, 10 diciembre 2005).
BIBLIOGRAFÍA y LECTURASRECOMENDADAS (*lectura de interés y ** lectura fundamental)
1. WIEDER, J.; SCHMIDT, J.D.; CASOLA, G. y cols.: "Transrectal utrasound-guided transperineal cryoablation in the treatment of prostate carcinoma: preliminary results". J. Urol., 154: 435, 1995. [ Links ]
2. COOGAN, L.; McKIEL, F.: "Percutaneous cryoablation of the prostate: preliminary results after 95 procedures". J. Urol., 154: 1813, 1995. [ Links ]
*3. BAHN, D.K.; LEE, F.; SOLOMON, M.H. y cols.: "Prostate cancer: US-guided percutaneous cryoablation". Radiology, 194: 551, 1995. [ Links ]
4. SHINOHARA, K.; CONNOLLY, J.A.; PRESTI, J.C. y cols.: "Cryosurgical treatment of localized prostate cancer (stages T1 T0 T4): preliminary results". J. Urol., 156: 115, 1996. [ Links ]
5. SHINOHARA, K.; RHEE, B.; PRESTI, J.C. Jr. y cols.: "Cryosurgical ablation of prostate cancer: patterns of cancer recurrence". J. Urol., 158: 2206, 1997. [ Links ]
*6. KOPPIE, T.M.; SHINOHARA, K.; GROSSFELD, G.D. y cols.: "The efficacy of cryosurgical ablation of prostate cancer: the university of California, San Francisco experience". J. Urol., 162: 427, 1999. [ Links ]
7. CONNOLLY, J.A.; SHINOHARA, K.; CARROLL, P.R.: "Cryosurgery for locally advanced (T3) prostate cancer". Seminars in Uroloic Oncology, 15: 244, 1997. [ Links ]
8. COHEN, J.K.; MILLER, R.J.; ROOKER, G.M. y cols.: "Cryosurgical ablation of the prostate: two-year prostate-specific antigen and biopsy results". Urology, 47: 395, 1996. [ Links ]
*9. LONG, J.P.; FALLICK, M.L.; LAROCK, D.R. y cols.: "Preliminary outcomes following cryosurgical ablation of the prostate in patients with clinically localized prostate carcinoma". J. Urol., 159: 477, 1998. [ Links ]
*10. MILLER, R.J.; COHEN, J.K.; MERLOTTI, L.A.: "Percutaneous transperineal cryosurgical ablation of the prostate for the primary treatment of clinical stage C adenocarcinoma of the prostate". Urology, 44: 170, 1994. [ Links ]
*11. WONG, W.S.; CHINN, D.O.; CHINN, M. y cols.: "Cryosurgery as a treatment for prostate carcinoma". Cancer, 79: 963, 1997. [ Links ]
*12. SALIKEN, J.C.; DONNELLY, B.J.; REWCASTLE, J.C.: "The evolution and state of modern technology for prostate cryosurgery". Urology, 60: 26, 2002. [ Links ]
*13. DONNELLY, B.L.; SALIKEN, J.C.; ERNST, D.S. y cols.: "Prospective trial of cryosurgical ablation of the prostate: five-year results". Urology, 60: 645, 2002. [ Links ]
*14. AUS, G.; PILEBLAD, E.; HUGOSSON, J.: "Cryosurgical ablation of the prostate: 5 year follow-up of a prospective study". Eur. Urol., 42: 133, 2002. [ Links ]
**15. LEE, F.; BAHN, D.K.; BADALAMENT, R.A. y cols.: "Cryosurgery for prostate cancer. Improved glandular ablation by use of 6 to 8 cryoprobes". Urology, 54: 135, 1999. [ Links ]
**16. LONG, J.P.; BAHN, D.; LEE, F. y cols.: "Five-year retrospective, multi-institutional pooled analysis of cancer-related outcomes after cryosurgical ablation of the prostate". Urology, 57: 518, 2001. [ Links ]
**17. BAHN, D.K.; LEE, F.; BADALAMENT, R. y cols.: "Targeted cryoablation of the prostate: 7 year outcome in the primary treatmente of prostate cancer". Urology, 60: 3, 2002. [ Links ]
*18. CHINN, D.O.; WONG, W.; CHINN, M.: "Targeted cryoablation for treatment of localized prostate cancer: six-year actuarial outcomes". J. Urol., 165: 1342, 2001. [ Links ]
**19. CHINN, D.O.; WONG, W.; CHINN, M.: "Temperature monitored prostate cryosurgery: 8 year accrued clinical experience". J. Urol., 171: 219, 2004. [ Links ]
20. LUGNANI, F.; ZANCONATI, F.: "Targeted Cryoablation of de prostate: 11 years outcomes in Primary Tratment of Prostate Cancer. What happened top my first 57 patients?". International SocietY of Cryosurgery. Corfu, Grecia. Séptima Conferencia Internacional de Investigación Anticáncer. Octubre 2004. [ Links ]
*21. DERRICK, F.C.; BRITTON, J.J.; CARTER, W.C. y cols.: "Cryoablation of the prostate for localized prostate cancer. 8 Year experience with 215 cases". J. Urol., 169: 1722, 2003. [ Links ]
**22. DERRICK, F.C.; BRITTON, J.J.; FOGLE, A.W. y cols.: "Cryoablation of prostate: 10 year experience with 249 cases". J. Urol., 173: 1030, 2005. [ Links ]
23. MILLER, R.J.; COHEN, J.K.; SHUMAN, B. y cols.: "Percutaneous, Transperineal Cryosurgery of the Prostate as Salvage Therapy for Post Radiation Recurrence of Adenocarcinoma". Cancer, 77: 1510, 1996. [ Links ]
24. PISTERS, L.L.; VON ESCHENBACH, A.C.; SCOTT, S.M. y cols.: "The efficacy and complications of salvage cryotherapy of the prostate". J. Urol., 157: 921, 1997. [ Links ]
25. TAILLE, A.; HAYERK, O.; BENSON, M.C. y cols.: "Salvage cryotherapy for recurrent prostate cancer after radiation therapy: the Columbia experiencie". Urology, 55: 79, 2000. [ Links ]
26. CHIN, J.L.; PAUTLER, S.E.; MOURAVIEV, V. y cols.: "Results of salvage cryoablation of the prostate after radiation: identifying predictors of treatment failure and complications". J. Urol., 165: 1937, 2001. [ Links ]
**27. IZAWA, J.I.; MADSEN, L.T.; SCOTT, S.M. y cols.: "Salvage cryotherapy for recurrent prostate cancer after radiotherapy: variables affecting patient outcome". J. Clin. Oncol., 20: 2664, 2002. [ Links ]
28. KATZ, A.E.; PREPELICA, K.; MASSON, P. y cols.: "Salvage cryosurgical ablation of the prostate (TCAP) for patients failing radiation: 10 years experience". J. Urol., 173: 1662, 2005. [ Links ]