My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Archivos Españoles de Urología (Ed. impresa)
Print version ISSN 0004-0614
Arch. Esp. Urol. vol.59 n.5 Jun. 2006
Evaluación de la reacción acrosomal inducida por el ionóforo de calcio: una aproximación mas real de la capacidad fecundante del espermatozoide
Evaluation of the calcium ionophore induced acrosome reaction: a more realistic approach to the fecundant capacity of th spermatozoid
Wálter Darío Cardona Maya, Martha Olivera Ángel y Ángela Patricia Cadavid
Grupo Reproducción-Biogénesis, Universidad de Antioquia, Medellín, Colombia
Dirección para correspondencia
RESUMEN
Objetivo: Evaluar la reacción acrosomal inducida por el ionóforo de calcio en espermatozoides de un grupo de individuos con fertilidad desconocida.
Método: Cada individuo donó una muestra de semen la cual fue evaluada para determinar la cantidad de espermatozoides que presentaban reacción acrosomal al estimularlos con el ionóforo de calcio después de la capacitación espermática. Se utilizó la lectina Pisum sativum aglutinina (microscopía de fluorescencia) y el anticuerpo anti-CD46 (citometría de flujo).
Resultados: Cinco de los seis individuos presentaron un aumento en el número de espermatozoides reaccionados al estimularlos con ionóforo de calcio comparado con el porcentaje de espermatozoides que presentaron reacción acrosomal espontánea tanto por microscopía de fluorescencia (7.4 +/- 2.4 vs 22.5 +/- 10.1), como por citometría de flujo (8.5 +/- 2.8 vs 25.4 +/- 6.0); en el otro individuo los valores de la reacción acrosomal con el ionóforo de calcio fueron similares a los de la reacción espontánea.
Conclusiones: Ambas técnicas son útiles para evaluar in vitro la capacidad de los espermatozoides para sufrir la reacción acrosomal posterior a la capacitación, sin necesidad de que exista fusión entre el espermatozoide y el oocito, pero la citometría de flujo es mas objetiva y permite visualizar un mayor número de células. De otro lado, aunque el individuo que no respondió al estímulo con el ionóforo de calcio tiene fertilidad desconocida, los resultados obtenidos permiten proponer que la evaluación de la reacción acrosomal podría ser una herramienta útil en el estudio de los hombres que consultan por infertilidad.
Palabras clave: Espermatozoide. Reacción acrosomal. Fertilidad. Ionóforo de calcio.
SUMMARY
Objectives: The aim of this investigation was to evaluate the acrosome reaction by fluorescence microscopy and the .ow citometry in a group of men with unknown fertility.
Methods: Each individual gave a semen sample for the analysis of the calcium ionophore-induced acrosome reaction after the capacitation process, using lectin Pisum sativum aglutinina (fluorescence microscopy) and antibody anti-CD46 (flow citometry).
Results: Five of out six individuals increased the number of the sperm with calcium ionophore-induced acrosome reaction versus the percentage of spontaneous acrosome reaction, using fluorescence microscopy (7.4 +/- 2.4 vs 22.5 +/- 10.1) and .ow citometry (8.5 +/- 2.8 vs 25.4 +/- 6.0); On the other hand, the other individual the values of the acrosomal reaction with calcium ionophore A23187 were similar to those of the spontaneous reaction.
Conclusions: Both techniques are useful to evaluate the in vitro capacity of the spermatozoa to undergo acrosomal reaction, after the capacitation, without fusion between the sperm and the egg, but the .ow citometry is more objective and allow the detection of a higher cell numbers of cells. On the other hand, although the individual that did not respond to the stimulus with calcium ionophore has unknown fertility, the obtained results allow to propose that the evaluation of the acrosomal reaction could be a useful tool in the study of the men who consult for infertility.
Keywords: Spermatozoa. Acrosome reaction. Fertility. Calcium ionophore.
Introducción
La fecundación es un proceso en el cual se requiere la interacción entre gametos masculinos y femeninos, maduros y competentes, para que éstos se fusionen y formen un nuevo individuo (1, 2). El diálogo celular entre ambos gametos ha sido motivo de estudio desde 1919 (3) y aún en la actualidad los detalles de este proceso son poco entendidos.
Cuando el espermatozoide viaja hacia el oocito sufre cambios iniciales que modulan su esta-do funcional: en organismos de fecundación externa como la estrella de mar y los peces teleósteos los espermatozoides desarrollan su potencial de movilidad sólo después de ser eyaculados; en los organismos de fecundación externa como los reptiles, los pájaros y los mamíferos, los espermatozoides desarrollan el potencial móvil cuando pasan a través del epidídimo (4, 5), y es durante este paso, que sufre modificaciones morfológicas y bioquímicas necesarias para convertirse en célula fecundante. Aunque la maquinaria celular involucrada en el desarrollo de estos cambios es heterogénea y requiere de diversos elementos, estudios recientes indican que el flujo de iones de Ca2++ y K+ es clave en el diálogo molecular que se estable-ce entre el espermatozoide, su medio ambiente y el óvulo; es decir, tanto en los procesos de maduración como de capacitación espermática (6-8).
A principios de 1950 J.C. Dan estudiando la penetración de los espermatozoides de estrella de mar en los oocitos, mediante microscopía de contraste de fase y microscopía electrónica, descubrió el proceso de reacción acrosomal (9, 10) y ahora está plenamente establecido que dicho proceso es un paso indispensable durante la fertilización en muchas especies, incluyendo el humano. Después de este hallazgo los científicos le dieron importancia al espermatozoide como elemento fundamental en el proceso de fecundación y gracias a ésto, nuevamente J.C. Dan (11) descubrió que la reacción acrosomal es dependiente de calcio.
La reacción acrosomal es un proceso especializado de fusión de la membrana citoplasmática con la membrana acrosomal externa en la zona apical de la cabeza espermática originando la liberación de las enzimas almacenadas en esta vesícula y la exposición de la membrana acrosomal interna. La importancia de la reacción acrosomal podría ser la liberación de las enzimas hidrolíticas que son requeridas para que el espermatozoide pueda penetrar la zona pelúcida, además de la expresión de moléculas que actúan como receptores para que pueda ingresar al oocito y ocurra la fusión entre gametos (12, 13). La reacción acrosomal puede ser determinada por varias técnicas: azul de coomasie (14), lectina Pisum sativum aglutinina marcada con isotiocianato de fluoresceína (PSA-FITC) (14), microscopía electrónica (15), citometría de flujo con los anticuerpos anti-CD46 (16) ó anti-GB24 (17), entre otras.
La lectina PSA-FITC tiene afinidad por los residuos de manosa y galactosa de las glicoproteínas presentes en la membrana plasmática del dominio acrosomal de la cabeza del espermatozoide, es una tinción negativa que permite determinar la desaparición de la membrana plasmática debido a que durante la reacción acrosomal se desaparece el dominio acrosomal del espermatozoide; De otro lado, el anti-CD-46 unido a un fluorocromo, es una coloración positiva, debido a que la proteína CD46 está localizada únicamente en la membrana interna acrosomal y sólo los espermatozoides que sufren reacción acrosomal completa pueden ser marcados (16).
Es conocido que el número de espermatozoides humanos que presentan reacción acrosomal espontánea in vitro en condiciones capacitantes es bajo y variable, menos del 15% (18), pero este número puede ser incrementado por el contacto con oocitos (19, 20) o con factores inductores de la reacción acrosomal como el fluido folicular (5), el suero sanguíneo (21), la progesterona (22), el ionóforo de calcio A23187 (23, 24) y el forbol miristato acetato (24).
Los espermatozoides de algunos hombres con infertilidad inexplicada muestran una disminución en la capacidad de sufrir reacción acrosomal (25), lo que podría indicar alteraciones en algún aspecto funcional del proceso de fecundación.
Históricamente, se han realizado muchos intentos para identificar una o varias características del semen que permitan predecir la capacidad de los espermatozoides para fecundar. Los laboratorios de reproducción asistida han usado pruebas como el ensayo de penetración de oocitos de hamster dorado libres de zona pelúcida (26), el cariotipo de espermatozoides (27), la desnaturalización del DNA (28), la evaluación de la membrana espermática (28) y la reacción acrosomal (13), entre otras.
De las anteriores pruebas, la integridad de la membrana y la desnaturalización del DNA, que evalúan la funcionalidad espermática, no presentaron una distribución homogénea en un grupo de individuos fértiles, lo cual deja en entre dicho la capacidad de discriminación de estas pruebas para el diagnóstico de infertilidad (29). El ensayo de penetración de oocitos de hámster dorado libres de zona pelúcida (27), por su parte, es demorado, costoso y sólo permite analizar la capacidad fecundante de un pequeño grupo de espermatozoides del eyaculado y no la capacidad de atravesar la zona pelúcida de éstos.
La determinación de la reacción acrosomal por citometría de flujo es un método alternativo para evaluar la capacidad de los espermatozoides de sufrir la reacción acrosomal in vitro, posterior a la capacitación, sin necesidad de que exista fusión entre el espermatozoides y el oocito; además puede dar información de aproximadamente 10.000 espermatozoides, haciendo esta evaluación más representativa del eyaculado.
El objetivo de este trabajo fue comparar la evaluación de la reacción acrosomal por las técnicas de microscopía de fluorescencia y citometría de flujo en un grupo de individuos.
Metodología
Población de estudio
Seis individuos aparentemente sanos con los parámetros seminales normales con respecto a la OMS (29). A cada muestra de semen se le determino el porcentaje de reacción acrosomal espontánea, sin inducción y el porcentaje de reacción acrosomal inducida inducida por el ionóforo de calcio.
Muestras de semen
Cada individuo donó una muestra de semen que fue tomada en un recipiente estéril mediante mas-turbación, después a una abstinencia sexual de 2 a 5 días. Uno de los individuos, que se describirá mas adelante, donó tres muestras de semen.
Separación y capacitación espermática
Simultáneamente se realizó la separación y la capacitación espermática variando el protocolo descrito por Jondet (30) con incubación de 5 horas en medio HAM F-12 suplementado con 35 mg/ml de BSA (Sigma Chemical Company, St Louis, MO, USA), lo que permitía obtener espermatozoides móviles y capacitados.
Inducción de la reacción acrosomal
La inducción de la reacción acrosomal se realizó con 10 uM de ionóforo de calcio A23187 (Sigma Chemical Company, St Louis, MO, USA) durante 3 horas a 37ºC/5%CO2.
Evaluación de la reacción acrosomal por microscopía de fluorescencia
Aproximadamente 1 x 106 espermatozoides fueron lavados dos veces en buffer fosfato salino (PBS), depositados sobre portaobjetos, fijados por exposición a metanol frío/30 segundos e incubadas con la lectina Pisum Sativum (Sigma Chemical Company, St Loui, MO, USA) a una concentración de 50 μg/ml en PBS durante 30 minutos/ cámara húmeda. Luego de dos lavados con PBS, los extendidos secos fueron montados en glicerol al 90% en PBS y se evaluaron 100 espermatozoides en el microscopio de fluorescencia con un aumento de 100X, para determinar el porcentaje de espermatozoides reaccionado.
Se consideraron como espermatozoides reaccionados aquellos que presentaban fluorescencia solo en la región ecuatorial y espermatozoides intactos, aquellos que presentaron todo el acrosoma fluorescente, los espermatozoides morfológicamente alterados no fueron incluidos en el recuento para minimizar el numero de espermatozoides falsos positivos. (Figura 1).
Evaluación de la reacción acrosomal por citometría de flujo
Aproximadamente 1 x 106 espermatozoides fueron incubados durante 30 minutos a temperatura ambiente con Ig G humana (Miltenyu Bistec GMBH, Bergisch Gladbach, Germany) para bloquear de la unión a los receptores Fc. Después de 2 lavados con PBS a 250 g/8 minutos se agregaron 10 μl de anticuerpo IgG de ratón contra CD46 humano conjugado con FITC (BD PharMingen San Diego, USA); en otra alicuota se agrego un control de isotipo utilizando un anticuerpo IgG de ratón contra trinitrofenol (BD PharMingen San Diego, USA). Las muestras se incubaron a Tº ambiente protegidas de la luz, se lavaron con PBS y luego se les adiciono 2.5 μg/ml de ioduro de propidio (Sigma Chemical Company, St Louis, MO, USA) para evaluar la viabilidad espermática (31).
Análisis estadístico
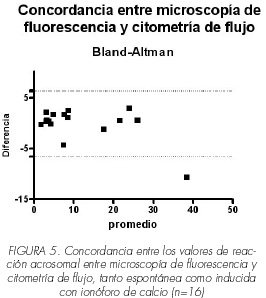
La comparación estadística entre los grupos de reacción acrosomal espontánea e inducida, fue realizada mediante la prueba de Mann-Whitney; el análisis de concordancia entre los valores de espermatozoides reaccionados, obtenidos mediante microscopia de fluorescencia y citometría de flujo se realizo por la prueba de Blant Altman. El paquete estadístico utilizado fue Prism® versión 4.0.
Resultados
En la Figura 2 se ilustran resultados representativos obtenidos mediante citometría de flujo, en FL1 las células marcadas con el anticuerpo anti-CD46 FITC y en FL2 las células que adquirieron o no el yoduro de propidio. La Figura 2a representa la reacción acrosomal espontánea y la Figura 2b la reacción acrosomal inducida por el ionoforo de calcio que fue mayor que la reacción espontánea, 8.5 +/- 2.8 vs 25.4 +/- 6, respectivamente. Uno de los individuos (el #1) no respondió al estimulo con el ionóforo de calcio (Figura 2c); se repitió la muestra tres veces con resultados similares.
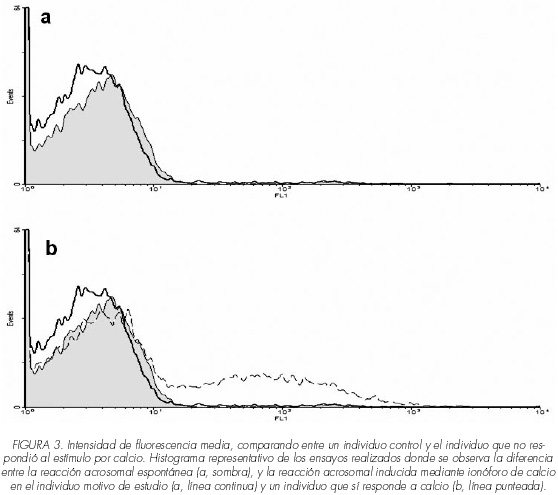
Para confirmar los resultados obtenidos, se determinó la intensidad de fluorescencia media y se observó que el individuo que no respondía al estímulo con ionóforo de calcio (línea continua Figura 3a y 3b) presentaba una intensidad similar a la obtenida en la reacción acrosomal espontánea (sombra Figura 3) y menor que la intensidad de un individuo control (línea punteada Figura 3b).
En la evaluación de la reacción acrosomal con la lectina PSA-FITC mediante microscopía de fluorescencia se observaron resultados similares a los anteriores, es decir se encontró la misma respuesta del individuo #1 que no respondió al estímulo con ionóforo de calcio (Figura 4).
El individuo que no respondió al estímulo con ionóforo de calcio, es aparentemente sano, con una edad de 32 años, con fertilidad desconocida y el cual, como se observa en la Tabla I, presenta en las tres muestras de semen todos sus parámetros seminales normales según los estándares de la Organización Mundial de la Salud (40).
Después de analizar los datos obtenidos en las muestras de los 5 individuos y en tres ensayos del individuo #1 que no respondió al estimulo con ionóforo de calcio, los resultados muestran que a diferencia de los 5 individuos donde se observó un aumento estadísticamente significativo en el porcentaje de espermatozoides reaccionados al estimular con ionóforo de calcio (p<0.01) el individuo #1 no presentó este aumento (p>0.05), ni con la lectina PSA-FITC ni con el anticuerpo anti-CD46-FITC, (Figura 4a y 4b) respectivamente. El análisis de concordancia entre ambos métodos, microscopía de fluorescencia y citometría de flujo, teniendo en cuenta los valores obtenidos en las 8 muestras analizadas, mostró una alta concordancia, (Figura 5).
Discusión
La evaluación de la reacción acrosomal podría ser una herramienta útil en el estudio de la infertilidad. Liu DY y cols (32) muestran que la reacción acrosomal inducida por el ionóforo de calcio A23187 tiene una correlación positiva (p<0.05) con los valores de fertilización en pacientes con semen teratozoospérmico (morfología normal <15%), lo cual evidencia que la reacción acrosomal inducida por el ionóforo puede generar información adicional de predicción de las tasas de fertilización, como lo sugieren también otros autores (33, 34), aunque el mecanismo sigue siendo desconocido. Cummins J.M. y cols. en 1991 (33) clasificaron a los individuos con menos de 5% de reacción acrosomal inducida por el ionóforo de calcio como pacientes con problemas en los procedimientos de fertilización in vitro y sugieren que a éstos se les realicen otros procedimientos como aumento en la concentración espermática para la inseminación o el análisis de dos muestras tomadas con un intervalo de 1 hora con el fin de aumentar el número de espermatozoides que se utilizarán.
Otros estudios del grupo de Liu D.Y. y cols. (35, 36), muestran que individuos infértiles con desórdenes en la inducción de la reacción acrosomal y con bajos índices de fertilización in vitro tenían un promedio de 6% (con un rango de 0 a 16), de inducción de la reacción acrosomal estimulada con oocitos. En forma similar, hombres normozoospérmicos con menos del 16% de reacción acrosomal tenían menos del 20% de penetración a zona pelúcida y de éstos los que tenían menos del 10% de reacción no penetraron la zona pelúcida (36). Los anteriores resultados son también confirmados por los hallazgos de Esterhuzen AD y cols (2) quienes encuentran que pacientes con espermogramas normales pero con menos del 15% de inducción de la reacción acrosomal por zona pelúcida solubilizada tenían malos resultados en los procedimientos de fecundación in vitro. Estos hallazgos indican que existen desórdenes espermáticos que no se pueden evaluar con las metodologías empleadas de rutina en los laboratorios de espermiología.
Algunos investigadores, reportan que la progesterona (16) y los oligosacáridos como la manosa y la N-acetilglucosamina (37) inducen reacción acrosomal parcial pero no reacción acrosomal completa; ésto lo pueden concluir gracias a que los trabajos son realizados con microscopía de fluorescencia usando la PSA-FITC y con citometría de flujo con el anticuerpo anti-CD46 y ambos trabajos concluyen que el ionóforo de calcio A23187 es un inductor de reacción acrosomal completa, por lo cual se puede evaluar por cualquiera de las dos técnicas (16, 37). El término reacción acrosomal parcial y completa hace referencia más al estado acrosomal de los espermatozoides de un individuo que al número de células reaccionadas; la reacción acrosomal parcial se refiere a la liberación del contenido acrosomal o pérdida de la membrana acrosomal externa y la reacción acrosomal completa se refiere a la exposición de la membrana acrosomal interna y a la pérdida completa del contenido acrosomal (15, 38). Como se mencionó anteriormente, la PSA evalúa el contenido acrosomal o la membrana acrosomal externa por desaparición de ésta, a diferencia del anti-CD46 el cual permite detectar el paso final de la reacción acrosomal por la exposición de la membrana acrosomal interna.
El ionóforo de calcio es un buen inductor de la reacción acrosomal debido a que provoca un aumento de flujo de calcio hacia el espacio intracelular el cual se asocia con la salida de iones H+ y por lo tanto un aumento del pH. Además el aumento de la concentración interna de calcio genera la liberación de los almacenamientos de calcio interno provocando un incremento sustancial de la concentración de calcio citosólico que origina la activación de diferentes vías de señalización lo cual finalmente permite que las membranas se fusionen (39, 40).
Los resultados de nuestro estudio sugieren que las dos técnicas usadas para evaluar la reacción acrosomal inducida por ionóforo del calcio, microscopía de fluorescencia y citometría de flujo, son muy similares y nos permitió identificar un individuo que no respondía a este estímulo. La citometría de flujo tiene la ventaja de ser más objetiva en la evaluación y diferenciar las células vivas de las muertas. Los ensayos con la PSA-FITC no incluyeron el uso del colorante vital como lo describen otros autores (14), aunque los espermatozoides alterados morfológicamente no fueron incluidos en el recuento para minimizar la inclusión de espermatozoides falsos positivos; además las muestras de semen usadas con cada una de las técnicas siempre tenían altas proporciones de células móviles (>80%).
La evaluación de la reacción acrosomal mediante citometría de flujo es una prueba que permite evaluar un aspecto funcional del espermatozoide y se puede hacer en poco tiempo, por lo tanto proponemos que en los programas de reproducción asistida se realice, como una técnica de rutina, la determinación de la reacción acrosomal mediante citometría de flujo con el anticuerpo anti-CD46, simultáneamente con el espermograma. Esto permitiría obtener un beneficio económico para los pacientes que podrían evitar gastos en pruebas que no brindarán una solución al problema; por ejemplo, en un individuo que el ionóforo de calcio no induzca la reacción acrosomal, no se realizarían inseminaciones artificiales y más bien el procedimiento elegido en este caso sería la inyección intracitoplasmática del espermatozoide.
Bibliografía y lecturas recomendadas (*lectura de interés y **lectura fundamental)
**1. CARDONA MAYA, W.D.; CADAVID JARAMILLO, A.P.: Complementariedad intergamentos: breve revisión. Arch. Esp. Urol., 57: 1107, 2004. [ Links ]
2. ESTERHUIZEN, A.D.; FRANKEN, D.R.; LOURENS, J.G. y cols.: Clinical importance of zona pellucida-induced acrosome reaction and its predictive value for IVF. Hum. Reprod., 16: 138, 2001. [ Links ]
3. LILLIE, F.: Problems of Fertilization. Chicago IL: University of Chicago Press, 1919. [ Links ]
4. BALDI, E.; LUCONI, M.; BONACCORSI, L. y cols.: Intracellular events and signaling pathways involved in sperm acquisition of fertilizing capacity and acrosome reaction. Front Biosci, 5: 110, 2000. [ Links ]
5. MORTIMER, D.; CAMENZIND, A.R.: The role of follicular fluid in inducing the acrosome reaction of human spermatozoa incubated in vitro. Hum. Reprod., 4: 169, 1989. [ Links ]
6. ARNOULT, C.; KAZAM, I.G.; VISCONTI, P.E. y cols.: Control of the low voltage-activated calcium channel of mouse sperm by egg ZP3 and by membrane hyperpolarization during capacitation. Proc. Natl. Acad. Sci. USA, 96: 6757, 1999. [ Links ]
7. MUÑOZ-GARAY, C.; DE LA VEGA –BELTRAN, J.L.; DELGADO, R. y cols.: Inwardly rectifying K(+) channels in spermatogenic cells: functional expression and implication in sperm capacitation. Dev. Biol., 234: 261, 2001. [ Links ]
8. ZENG, Y.; CLARK, E.N.; FLORMAN, H.M.: Sperm membrane potential: hyperpolarization during capacitation regulates zona pellucida-dependent acrosomal secretion. Dev. Biol., 171: 554, 1995. [ Links ]
9. DAN, J.C.: Reaction to egg-water and other stimuli. Biol. Bull., 103: 54, 1952. [ Links ]
10. DAN, J.C.: Sperm entrance in echinoderms; observed with the phase contrast microscope. Biol. Bull., 99: 399, 1950. [ Links ]
11. DAN, J.C.: Effect of Ca2++ deficiency. Biol. Bull., 107: 335, 1954. [ Links ]
12. MYLES, D.G.: Molecular mechanisms of sperm-egg membrane binding and fusion in mammals. Develop. Biol., 158: 35, 1993. [ Links ]
13. SNELL, W.J.; WHITE, J.M.: The molecules of mammalian fertilization. Cell, 85: 629, 1996. [ Links ]
14. CROSS, N.; MORALES, P.; OVERSTREET, J. y cols.: Two simple methods for detecting acrosome reacted human sperm. Gamete Res., 15: 213, 1986. [ Links ]
*15. KOHN, F.M.; MACK, S.R.; SCHILL, W.B. y cols.: Detection of human sperm acrosome reaction: comparison between methods using double staining, Pisum sativum agglutinin, concanavalin A and transmission electron microscopy. Hum. Reprod., 12: 714, 1997. [ Links ]
*16. JAISWAL, B.S.; EISENBACH, M.; TUR-KASPA, I.: Detection of partial and complete acrosome reaction in human spermatozoa: which inducers and probes to use?. Mol. Hum. Reprod., 5: 214, 1999. [ Links ]
17. FIERRO, R.; FOLIGUET, B.; GRIGNON, G. y cols.: Lectin-binding sites on human sperm during acrosome reaction: modifications judged by electron microscopy/.ow cytometry. Arch. Androl., 36: 187, 1996. [ Links ]
18. BYRD, W.; WOLF, D.P.: Acrosomal status in fresh and capacitated human ejaculated sperm. Biol. Reprod., 34: 859, 1986. [ Links ]
19. FRANKEN, D.R.; BASTIAAN, H.S.; KIDSON, A. y cols.: Zona pellucida mediated acrosome reaction and sperm morphology. Andrologia, 29: 311, 1997. [ Links ]
20. STOCK, C.E.; FRASER, L.R.: Divalent cations, capacitation and the acrosome reaction in human spermatozoa. J. Reprod. Fertil., 87: 463, 1989. [ Links ]
21. YANAGIMACHI, R.: Fertilization in Mammalian. Knobil E NJ, ed. The Physiology of Reproduction. New York: Raven Press Ltd., 189–318, 1994. [ Links ]
22. PATRAT, C.; SERRES, C.; JOUANNET, P.: The acrosome reaction in human spermatozoa. Biol. Cell, 92: 255, 2000. [ Links ]
23. JAMIL, K.; WHITE, I.G.: Induction of acrosomal reaction in sperm with ionophore A23187 and calcium. Arch. Androl., 7: 283, 1981. [ Links ]
24. MORTIMER, S.T.; SWAN, M.A.; MORTIMER, D.: Fractal analysis of capacitating human spermatozoa. Hum. Reprod., 11: 1049, 1996. [ Links ]
25.CALVO, L.; VANTMAN, D.; BANKS, S.M. y cols.: Follicular fluid-induced acrosome reaction distinguishes a subgroup of men with unexplained infertility not identified by semen analysis. Fertil Steril, 52: 1048, 1989. [ Links ]
26. YANAGIMACHI, R.; YANAGIMACHI, H.; ROGERS, B.J.: The use of zona-free animal ova as a test-system for the assessment of the fertilizing capacity of human spermatozoa. Biol. Reprod., 15: 471, 1976. [ Links ]
27. RUDAK, E.; JACOBS, P.A.; YANAGIMACHI, R.: Direct analysis of the chromosome constitution of human spermatozoa. Nature, 274: 911, 1978. [ Links ]
28. CARDONA-MAYA, W.; BERDUGO, J.; DE LOS RIOS, J. y cols.: Sperm functional evaluation in fertile men. Preparación, 2005. [ Links ]
29. WHO.: WHO Laboratory Manual for the Examination of Human Semen and Sperm–Cervical Mucus Interaction. Cambridge: Cambridge University Press, 1999. [ Links ]
30. TEA, N.T.; JONDET, M.; SCHOLLER, R.: Migration-gravity sedimentation: method for collecting motile spermatozoa from human semen. Harrison R, Bonnar J, Thompson W, eds. In Vitro Fertilization, Embryo Transfer and Early Pregnancy: Lancaster: MTP Press Ltd, 117-120, 1984. [ Links ]
31. TAO, J.; CRITSER, E.S.; CRITSER, J.K.: Evaluation of mouse sperm acrosomal status and viability by flow cytometry. Mol. Reprod. Dev., 36: 183, 1993. [ Links ]
32. LIU, D.Y.; BAKER, H.W.: Calcium ionophore-induced acrosome reaction correlates with fertilization rates in vitro in patients with teratozoospermic semen. Hum. Reprod., 13: 905, 1998. [ Links ]
33. CUMMINS, J.M.; PEMBER, S.M.; JEQUIER, A.M. y cols.: A test of the human sperm acrosome reaction following ionophore challenge. Relationship to fertility and other seminal parameters. J. Androl., 12: 98, 1991. [ Links ]
34. YOVICH, J.M.; EDIRISINGHE, W.R.; YOVICH, J.L.: Use of the acrosome reaction to ionophore challenge test in managing patients in an assisted reproduction program: a prospective, double-blind, randomized controlled study. Fertil Steril, 61: 902, 1994. [ Links ]
35. LIU, D.Y.; BAKER, H.W.: Disordered acrosome reaction of spermatozoa bound to the zona pellucida: a newly discovered sperm defect causing infertility with reduced sperm-zona pellucida penetration and reduced fertilization in vitro. Hum. Reprod, 9: 1694, 1994. [ Links ]
36. LIU, D.Y.; CLARKE, G.N.; MARTIC, M. y cols.: Frequency of disordered zona pellucida(ZP)induced acrosome reaction in infertile men with normal semen analysis and normal spermatozoa-ZP binding. Hum. Reprod, 16: 1185, 2001. [ Links ]
37. CARDONA-MAYA, W.; CADAVID, A.: Evaluación de la reacción acrosomal en espermatozoides humanos inducida por los monosacaridos manosa y n-acetilglucosamina. Actas Urol. Esp. 29:676, 2005. 2005. [ Links ]
38. JAISWAL, B.S.; COHEN-DAYAG, A.; TURKASPA, I. y cols.: Sperm capacitation is, after all, a prerequisite for both partial and complete acrosome reaction. FEBS Lett., 427: 309, 1998. [ Links ]
39. BREITBART, H.: Role and regulation of intracellular calcium in acrosomal exocytosis. J. Reprod. Immunol., 53: 151, 2002. [ Links ]
40. BREITBART, H.: Intracellular calcium regulation in sperm capacitation and acrosomal reaction. Mol. Cell Endocrinol., 187: 139, 2002. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Wálter Darío Cardona-Maya
Grupo Reproducción-Biogénesis
Universidad de Antioquia
Carrera 62 #52-59
Medellín, Colombia.
wdcmaya@yahoo.com.
Recibido: 5 de mayo 2005