Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Archivos Españoles de Urología (Ed. impresa)
versión impresa ISSN 0004-0614
Arch. Esp. Urol. vol.59 no.6 jul./ago. 2006
UROLITIASIS
Estudio de factores físico-químicos en pacientes con litiasis renal
Study of the physical-chemical factors in patients with renal lithiasis
Miguel Arrabal Martín, Antonio Fernández Rodríguez1, Miguel Ángel Arrabal Polo, Mª José Ruíz García1 y
Armando Zuluaga Gómez
Servicio de Urología y Departamento de Cirugía Universidad de Granada.
Servicio de Urología y Farmacia1, Hospital San Juan de la Cruz. Úbeda. Jaén. España.
Dirección para correspondencia
RESUMEN
Objetivo: La litiasis urinaria tiene un origen multifactorial en el que participan factores físico-químicos y anatómicos.factores físico-químicos de origen renal o prerrenal, consecuencia de agentes exógenos o endógenos que se integran bajo la denominación de enfermedades sistémicas relacionadas con litiasis urinaria. El objetivo del estudio metabólico urinario es conocer y analizar los factores físico-químicos por los que cada una de estas enfermedades o entidades clínicas participan en la litogénesis.
Métodos: Realizamos un estudio sobre 320 casos distribuidos en dos grupos: Grupo A: 70 personas sanas, sin antecedentes familiares ni personales de litiasis urinaria. Grupo B: 250 pacientes con antecedentes de litiasis renal, que ha expulsado de forma tras litotricia extracorpórea o cirugía. En todos los casos se realiza un estudio metabólico urinario informatizado (EMUSYS)
Resultados: En el grupo control el 24% de los pacientes presentan una alteración metabólica y el 52% mas de una, mientras que en el grupo de pacientes el 17% de los pacientes presentan una alteración metabólica y el 81% más de una. Se observan diferencias significativas en el porcentaje de hiperoxalurias, hipocitraturias e hipercalciurias; en los subtipos de hipercalciuria absortiva tipo III y excretora-resortiva, hipomagnesuria y acidosis tubular las diferencias no son significativas, pero estas alteraciones no se detectan en el grupo control. Además se observan alteraciones frecuentes en el grupo control: hiperuricosuria enterorrenal, 34%; sobresaturación cálcica, 30%; eliminación elevada de cloruro sódico, 14%; hipercalciuria absortiva tipo II, 8%; similares a las del grupo de pacientes; alteraciones relacionadas con la alimentación y diuresis bajas.
Conclusiones: Las personas sin litiasis presentan alteraciones bioquímicas urinarias relacionadas con los hábitos de vida y alimentación similares a las de los pacientes, lo que concede valor a los factores anatómicos e hidrodinámicos en la litogénesis. Los pacientes con litiasis presentan alteraciones bioquímicas, como sobresaturación cálcica, hipercalciuria absortiva tipo II, hiperoxaluria marginal absortiva, hiperuricosuria enterorrenal, déficit de inhibidores, que pueden controlarse con dietas adecuadas. Las hipercalciurias e hiperoxalurias no dietéticas, alteraciones del pH urinario, hiperuricosuria endógena, pueden ser objeto de diagnóstico y tratamiento.
Palabras clave: Hipercalciuria. Hiperoxaluria. Hiperuricosuria. Hipocitraturia. Hipomagnesuria. pH urinario. Litogénesis renal.
SUMMARY
Objectives: Urinarylithiasis has a multifactorial origin with participation of physical, chemical and anatomical factors. Physical -chemical factors of renal-prerenal origin are the consequence of exogenous or endogenous agents, which are integrated under the name of systemic diseases associated with urinary lithiasis. The objective of the urinary metabolic study is to know and to analyze the physical-chemical factors by which each of these diseases or clinical entities participate in the lithogenesis.
Methods: We performed a study on 320 cases distributed in two groups: Group A: 70 healthy subjects without past medical history or family history of urinary lithiasis. Group B: 250 patients with history of renal lithiasis who had passed calculi spontaneously, after extracorporeal shock wave lithotripsy or surgery. Computerized urinary metabolic study (EMUSYS) was performed in all cases.
Results: 24% of the patients in the control group presented one metabolic abnormality and 52% more than one; in group B, 17% of the patients presented one metabolic abnormality and 81% more than one. There were statistically significant differences in the percentage of hyperoxaluria, hipocitraturias and hyperalciurias. There were no differences in the subtypes of type III absorptive and excretory-resorptive hyperalciuria, hipomagnesiuria, and tubular acidosis, but these abnormalities were not detected in the control group. Moreover, some abnormalities were frequently observed in the control group, similarly to the patients group: enterorenal hyperuricosuria 34%, calcium super saturation 13%, elevated excretion of sodium chloride 14%, type II absorptive hyperalciuri a 8%, alimentary abnormalities, and low diuresis.
Conclusions: People without lithiasis present biochemical urinary abnormalities in relation with life and alimentary habits similar to those found in patients, what concedes a role to the anatomical and hydrodynamical factors in lithogenesis. Patients with lithiasis present biochemical abnormalities such as calcium supersaturation, type II absorptive hyperal ciuria, marginal absorptive hyperuricosuria, enterorenal hyperuricosuria, deficit of inhibitors, which may be controlled with adequate diet. Non dietetic hyperalciurias and hyperoxalurias, abnormalities of the urinary pH, and endogenous hyperuricosuria may be subject of diagnosis and treatment.
Key words:
Hyperalciuria. Hyperoxaluria.Hyperuricosuria. Hypocitraturia. Hypomagnesiuria. Urinary pH. Renal Lithogenesis.
Introducción
La litiasis urinaria es un proceso patológico muy frecuente,con una incidencia media del 0.5-1% y prevalencia anual del 4-5% de la población mundial, con algunas diferencias raciales y geográficas. Al cálculo renal se le debe considerar como el producto final de un enfermedad subyacente, que denominamos diátesis litiásica. La formación del cristal y su crecimiento en la orina es un proceso complejo influido por numerosos factores, en la que el fenómeno central corresponde al proceso de sobresaturación/cristalización, influido por la ausencia de inhibidores de la precipitación cristalina, fenómenos de epitaxia e inducción y factores anatómicos (1).
Podemos clasificar los cálculos del aparato urinario en grupos de: a) litiasis cálcica de oxalato y fosfatos cálcicos; b) cálculos de ácido úrico y derivados; c) litiasis infecciosa de fosfato amónico magnésico, fosfatos básicos, urato amónico etc.; d) litiasis de cistina y aminoácidos; y e) grupo de litiasis menos frecuentes y raras, de origen farmacológico y compuestos orgánicos. Con frecuencia los cálculos urinarios se asocian a trastornos metabólicos que favorecen la sobresaturación de sales litógenas y la precipitación de las mismas (2).
La litiasis cálcica, es la más frecuente, se detecta en el 70-75% de los casos, y su formación está relacionada con la presencia de hipercalciuria, hiperoxaluria, hiperuricosuria, hipocitraturia, hipomagnesuria, alteraciones pH del urinario, solas o asociadas (1).
El concepto clásico de hipercalciuria de 24 horas no es suficiente para detectar hipercalciurias mínimas transitorias que pueden ser origen de una nucleación; y por otro lado, el parámetro de calciuria por kilo de peso y día, no es indicativo de sobresaturación urinaria. Bordier y cols. (3), fijaron el límite de excreción urinaria de calcio en más de 250 mg/día en las mujeres y más de 300 mg/día en los varones, con una ingesta de calcio de 400 mg/día. Puede ser más relevante en la génesis de un cálculo, la sobresaturación permanente o intermitente de calcio en la orina que la hipercalciuria global. Se considera que concentraciones de calcio urinario mayores de 150 mg/litro producen la formación de cristales (4). Se debe realizar la doble evaluación de saturación urinaria pre y post-sobrecarga oral cálcica. Las hipercalciurias se clasifican en absortivas, excretoras y resortivas (5), son frecuentes las formas mixtas (6).
La cantidad de oxalato presente en la orina, en cualquier momento, es diez veces más importante en la nucleación del oxalato cálcico que la cantidad de calcio, fosfato o ácido úrico (7). La mayoría del oxalato que es excretado por vía urinaria procede de la síntesis endógena a partir del ácido ascórbico y del ácido glioxílico, y sólo un 10-15% procede de la dieta (8).
La acidosis tubular renal, enfermedades que cursan con diarrea crónica y/o hiperoxaluria entérica, hipokaliemia, dietas hiperproteicas, etc., son causas de acidosis. En la acidosis aumenta la reabsorción tubular de citrato, disminuye su síntesis y se reduce el nivel de citrato urinario (9).
El 26% de los enfermos con litiasis cálcica presentan hiperuricosuria y el 27% de las hipercalciurias se asocian a hiperuricosuria (10). Los pacientes con cálculos de ácido úrico, generalmente presentan: volumen urinario bajo, hiperuricosuria y pH ácido. La hiperuricosuria depende de tres factores: hiperabsorción intestinal por alimentación rica en purinas, producción anormal endógena congénita o adquirida (gota primaria o secundaria), y excreción renal elevada por excesivo aporte, tubulopatías o administración de fármacos uricosúricos.
La infección urinaria se incluye entre las complicaciones de la litiasis, y como elemento etiológico de la enfermedad litiásica (11). La litiasis séptica o infecciosa por norma, corresponde a fosfato amónico magnésico (struvita) asociada a fosfatos cálcicos básicos no estequiométricos (carbonato apatito), carbonato cálcico, urato amónico. Se necesita un alto nivel de amonio en la orina para que ésta esté sobresaturada para la formación de struvita (12). Las investigaciones sobre el papel de las nanobacterias en la litogénesis, pueden aportar nuevos datos sobre el origen de los cálculos urinarios (13).
Actualmente se considera que la litiasis urinaria tiene un origen multifactorial en el que participan factores físico-químicos y anatómicos. Las alteraciones bioquímicas de la orina pueden ser de origen renal o prerrenal como consecuencia de agentes exógenos (hábitos, alimentación, fármacos, bacterias, virus ) o endógenos (endocrinos, metabólicos, inmunológicos, tubulopatías ), que pueden integrarse bajo la denominación de enfermedades sistémicas relacionadas con la litiasis urinaria: a) Enfermedades endocrinas y metabólicas. b) Síndrome hipercalcémico y enfermedades óseas. c) Enfermedades del aparato digestivo. d) Enfermedades inmunológicas y tubulopatías. e) Dietas, intoxicaciones y fármacos litógenos. f) Alteraciones del metabolismo de las purinas. A pesar de esta amplia relación de entidades con potencial litógeno, en más del 50% de los casos tenemos que continuar asumiendo el origen idiopático de los cálculos del aparato urinario o relacionarlos con fenómenos físico-químicos y anatómicos locales (14).
El objetivo del estudio metabólico urinario es conocer y analizar los factores físico-químicos por los que cada una de estas enfermedades o entidades clínicas participan en la génesis de la litiasis urinaria que nos permitan recomendar pautas de intervención útiles para la patología sistémica y renal o local.
Material y métodos
Realizamos un estudio sobre 320 casos distribuidos en dos grupos:
Grupo A: 70 personas sanas, sin antecedentes familiares ni personales de litiasis urinaria.
Grupo B: 250 paciente con antecedentes de litiasis renal, que ha expulsado de forma espontánea, tras litotricia extracorpórea o cirugía.
En todos los casos se realiza un estudio metabólico urinario (al menos 30 días después de una fase aguda o tratamiento instrumental).
Criterios de inclusión: Edad entre 18 y 65 años. Ausencia de litiasis en el momento del estudio (Rx. simple y ecografía renal).
Criterios de exclusión: Embarazo y lactancia, pacientes en tratamiento con fármacos litogénicos o con interferencia en la función renal.
ESTUDIO METABÓLICO URINARIO: El estudio metabólico urinario se realiza en régimen ambulatorio, se inicia con una dieta hipocálcica de 400 mg de calcio/24 horas, durante tres días. Al cuarto día el paciente recoge, de forma ambulatoria, orina de 24 horas. Al quinto día, el paciente acude al hospital a las 9 horas y se le analiza:
La muestra de orina recogida en las últimas 24 horas, de 8 horas a 8 horas.
Dos muestras de orina fresca recién emitida, (a las 9 horas post-ayuno nocturno) una para análisis químico-microscópico y otra para análisis bacteriológico.
Una muestra de sangre venosa.
A continuación se realiza una sobrecarga oral con un gramo de calcio y se recoge la orina durante 4 horas (de 9 a 13 horas) y otra muestra de orina fresca a las 13 horas.
En la muestra de sangre venosa se determinan: Glucosa, creatinina, ácido úrico, proteínas totales, calcio, fósforo, sodio, potasio, cloro.
En la primera muestra de orina recién emitida (Post-ayuno nocturno) se determinan pH, densidad, sedimento, creatinina, calcio, reacción de Brand.
En la segunda muestra de orina recién emitida se realizan cultivo y antibiograma.
En la muestra de orina de 24 horas se determinan: diuresis, creatinina, sodio, potasio, cloro, calcio, fósforo, magnesio, ácido úrico, ácido oxálico, citrato.
En la muestra de orina de 4 horas tras la sobrecarga oral cálcica, se determinan: diuresis, calcio, creatinina.
En la muestra de orina emitida a las 13 horas, se determinan: pH, densidad.
Los resultados analíticos se recogen en un programa informatizado (EMUSYS) que realiza el cálculo y análisis de los datos que se recogen en la Tabla I y ofrece las siguientes ayudas diagnosticas:
1/ Sobresaturación cálcica: Concentración de calcio en orina de 24 h >15 mg/dl.
2/ Hipercalciuria: Eliminación de calcio en orina de 24 horas >260 mg y/o eliminación de calcio/Kg de peso >4 mg.
2.1/ Hipercalciuria absortiva: Calcio plasmático normal,cociente calcio/creatinina en orina de las 9 horas post-ayuno < de 0.11 y tras sobrecarga oral de calcio > de 0.22.Se distinguen a su vez tres tipos de hipercalciurias absortivas:
a) Hipercalciuria absortiva tipo I: Cumple las dos condiciones anteriores (hipercalciurias e hipercalciurias absortivas) y reabsorción tubular de fosfatos (RTP) normal.
b) Hipercalciuria absortiva tipo II: Cumple las condiciones de la hipercalciuria absortiva tipo I, salvo que la calciuria de 24 horas es < de 260 mg. Se trata de una hipercalciuria transitoria, que se manifiesta sólo tras sobrecarga oral cálcica.
c) Hipercalciuria absortiva tipo III: Cumple las condiciones de la hipercalciuria absortiva tipo I salvo que la RTP esta disminuida.
2.2/ Hipercalciuria excretora: Hipercalciuria con cociente calcio/creatinina en orina de 9 horas post-ayuno >0.11 y RTP normal, normo o hipocalcemia.
2.3/ Hipercalciuria resortiva: Normo o hipercalcemia con un cociente calcio/creatinina en orina de 9 horas post-ayuno >0.11 y RTP disminuida.
3/ Hiperoxaluria: Oxalurias superiores a 40 mg en orina de 24 horas.
3.1/ Hiperoxaluria absortiva: Hiperoxaluria asociada a diarrea crónica o < de 60 mg/24 horas.
3.2/ Hiperoxaluria endógena: eliminación de oxalato en orina de 24 horas mayor de 60 mg sin diarrea crónica.
4/ Hiperuricosuria: Presencia de ácido úrico en orina de 24 horas > 750 mg.
4.1/ Hiperuricosuria enterorrenal: Hiperuricosuria con normo o hipouricemia.
4.2/ Hiperuricosuria endógena: La hiperuricosuria se asocia a hiperuricemia.
5/ Oliguria ácida: pH en orina de las 9 horas y/o de las 13 horas < 5.5 y diuresis <1000cc.
6/ Acidosis tubular renal (ATR): pH en orina de las 9 horas y de las 13 horas >6 en ausencia de infección urinaria y asociado a hipercalciuria o hipocitraturia.
7/ Cistinuria: Reacción de Brand positiva.
8/ Hipocitraturia: Eliminación de citrato en orina de 24 horas < 320 mg.
9/ Hipomagnesuria: Eliminación de magnesio < 35 mg en orina de 24 horas.
10/Litiasis infecciosa: pH en orina fresca > 7.0 y/o piuria y/o urocultivo positivo.
Realizamos análisis estadístico de los resultados aplicando los test de la t de student y chi-cuadrado.
Resultados
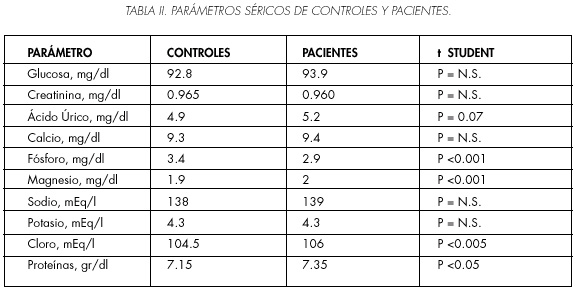
En la Tabla II se recogen los resultados de las determinaciones séricas en ambos grupos, el análisis estadístico refleja diferencias significativas entre los valores de fósforo, magnesio, cloro y proteínas totales.
En la Tabla III se recogen los resultados de las determinaciones realizadas en orina, observamos como la diuresis es más elevada en el grupo de pacientes litiásicos en relación con el grupo control.
El efecto de la dilución puede enmascarar las diferencias en las concentraciones de solutos, a pesar de ello, la concentración de oxalato es notablemente superior en el grupo de pacientes.
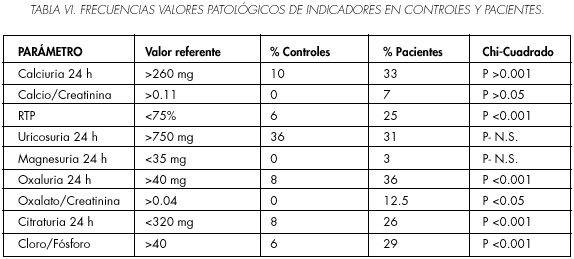
En la Tabla IV se recogen los resultados de los indicadores calculados en ambos grupos y el análisis estadístico, observamos diferencias significativas en el cociente calcio/creatinina en orina, en la RTP, en la oxaluria de 24 horas, en la citraturia de 24 horas y en el cociente cloro/fosfato en sangre. La eliminación de sodio, cloro, calcio y ácido úrico es más elevada en el grupo de pacientes frente al grupo control.
Hemos comparado las proporciones de resultados anormales entre el grupo de pacientes y grupo control mediante el test de la chi-cuadrado, observamos en la tabla V como en el grupo de pacientes la proporción de hipofosfatemias e hipercloremias es más elevada. Además observamos en la Tabla VI como en el grupo de pacientes el porcentaje de casos con el cociente cloro/fosfato en sangre elevado, RTP baja, hiperoxaluria, cociente oxalato/creatinina elevado, hipercalciuria e hipocitraturia es superior al del grupo control.
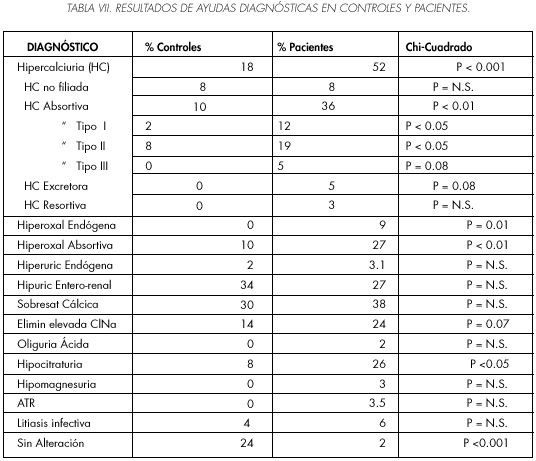
El programa EMUSYS a partir de los resultados séricos y urinarios e indicadores calculados,nos ofrece una o varias ayudas diagnósticas, observamos como en el grupo control el 24% de los estudios son normales, el 24% de los pacientes presentan una alteración metabólica y el 52% mas de una, mientras que en el grupo de pacientes el 2% de los estudios son normales, el 17% de los pacientes presentan una alteración metabólica y el 81% más de una. En la Tabla VII se recogen los resultados de las ayudas diagnósticas en pacientes y controles,se observan diferencias significativas en el porcentaje de hiperoxalurias, hipocitraturias e hipercalciurias; en los subtipos de hipercalciuria absortiva tipo III, excretora y resortiva las diferencias no son significativas, sin embargo estas alteraciones no se han detectado en el grupo control. Además se observan alteraciones frecuentes en el grupo control: hiperuricosuria enterorrenal, 34%; sobresaturación cálcica, 30%; eliminación elevada de cloruro sódico, 14%; hipercalciuria absortiva tipo II, 8%; similares a las del grupo de pacientes; alteraciones relacionadas con la alimentación y diuresis bajas, que generalmente no representan patología orgánica, sin embargo nos orientan sobre hábitos dietéticos inadecuados que el paciente debe corregir. La hipomagnesuria y ATR sólo se detectan en el grupo de pacientes.
Discusión
La litiasis urinaria tiene una incidencia elevada en los países desarrollados con tendencia a aumentar a lo largo del tiempo (15), del 5 al 10% de la población formará un cálculo a lo largo de su vida y aproximadamente el 50% de los casos tendrán otro episodio en cinco años, podemos controlar las recidivas con una asistencia sanitaria adecuada (16).
Una evaluación clínica y metabólica básica tras el primer episodio de litiasis nos permite controlar los hábitos de vida, alimentación o consumo de fármacos litógenos (17) y en algunos casos realizar el diagnóstico precoz de enfermedades graves (endocrinas, leucemia-linfomas, acidosis, gota, mieloma múltiple ). En estos casos o en pacientes con litiasis recurrente debemos realizar estudios complementarios, instaurar tratamiento médico-quirúrgico o profilaxis farmacológica de las recidivas (18).
No es fácil establecer un protocolo de estudio básico de la enfermedad litiásica,dado su origen multifactorial, que puede responder a factores anatómicos, genéticos, hábitos alimenticios, abuso de medicamentos, alteraciones de la absorción intestinal de la función renal, o endocrino-metabólicas, etc. Nosotros realizamos el estudio basal en régimen ambulatorio respetando la alimentación habitual controlamos los excesos de calcio y fósforo suprimiendo los productos lácteos durante 4 días y para detectar la hipercalciuria absortiva tipo II se realiza un test de sobrecarga oral cálcica que además facilita el reconocimiento de los subtipos de hipercalciuria (19). Debemos tener en cuenta que la dieta restrictiva en calcio puede dar lugar a hiperoxalurias marginales (oxaluria de 24 horas < 45 mg) por aumento de la absorción de oxalato como se ha detectado en el 8% de los casos del grupo control y 12% del grupo de pacientes.
Al analizar los resultados de las determinaciones séricas se observa una diferencia significativa en la hipofosfatemia del grupo de pacientes frente a los controles, resultados que coinciden con los observados por otros autores en pacientes con hipercalciuria (20), posiblemente relacionada con una menor RTP primaria o secundaria que puede modificar el metabolismo fosfocálcico (21), recomendamos investigar un posible hiperparatiroidismo incipiente normocalcémico o fuga tubular de fosfatos si detectamos fosfatemia < 3 mg/dl o cociente cloro/fosfato > 37.
En los resultados de las determinaciones urinarias se observa una diuresis más elevada en el grupo de pacientes, diferencias que pueden explicarse por el stone clinic effect, es decir, por el efecto positivo que tiene entre los pacientes litiásicos, el conocimiento de la enfermedad y su prevención con la mayor ingesta de líquidos (22). Este aumento de la diuresis hace que no se observen diferencias en las concentraciones de calcio y urato entre ambos grupos, sin embargo a pesar de la dilución las concentraciones de oxalato son superiores en los pacientes, lo que resalta la importancia de este factor en la litógenesis. El efecto de dilución al aumentar la diuresis afecta también a los factores inhibidores y así la concentración de citrato es significativamente inferior en los pacientes, lo que puede justificar el mayor riesgo de precipitación en los pacientes que en los controles, por tanto la recomendación de aumentar la ingesta de líquidos debe complementarse con aporte oral de citratos (23).
A pesar de realizar el estudio con restricción de calcio, la calciuria de 24 horas y el cociente calcio/creatinina de las 9 horas en el grupo de pacientes tienen valores superiores a los del grupo control de forma significativa, posiblemente en algunos casos en relación con el consumo de proteínas (24), azucares refinados (25)o mayor eliminación de cloruro sódico como se detecta en este estudio. La RTP también es mas baja en el grupo de pacientes.
En relación con la oxaluria se detectan diferencias significativas entre ambos grupos en la oxaluria de 24 horas y en el cociente oxalato/creatinina, lo que concuerda con el importante papel atribuido al oxalato en la formación de la litiasis oxalocálcica (26),no debemos olvidar que una dieta normocálcica puede corregir el componente absortivo de las hiperoxalurias marginales (27).
Existen diferencias muy significativas en la citraturia de 24 horas, el 80% de los controles presentan citraturias superiores a 500 mg/24 horas y el 60% de los pacientes citraturias inferiores a este valor discriminante. Desde los estudios de Shorr en 1942 numerosos estudios confirman el papel de la hipocitraturia en la litiasis recurrente y el efecto de la profilaxis con citratos (23). Algunos autores atribuyen al magnesio un efecto inhibidor en la precipitación del oxalato cálcico (28), en este estudio no se observan diferencias significativas entre ambos grupos, sin embargo ningún caso del grupo control presenta hipomagnesuria.
Aunque existe una clara tendencia a la hiperuricosuria en el grupo de pacientes, la significación estadística en relación con el grupo control es baja. Estos resultados no están en contradicción con la evidencia de que las dietas ricas en purinas predisponen a la formación de cálculos de ácido úrico (29) ni con el discutido papel del ácido úrico en la nucleación heterogénea del oxalato cálcico (10).
En general en el grupo de pacientes en todos los casos se detectan una o varias alteraciones bioquímicas y solo el 24% de los controles presentan un estudio normal. Estas ayudas diagnósticas deben ser valoradas junto con los datos clínicos y características de los cálculos, algunas solo pretenden darnos una orientación sobre excesos dietéticos (30), como es la eliminación elevada de cloruro sódico que refleja una dieta hipercalórica o poco equilibrada, la hiperuricosuria enterorrenal, presente en un elevado número de controles (31), igual ocurre con la sobresaturación cálcica, que refleja una hipercalciuria relativa intermitente generalmente relacionada con diuresis bajas < 1500 cc/24 h, en conjunto estas ayudas diagnósticas se expresan en el 78%de los controles y 89% de los pacientes. Si eliminamos las alteraciones bioquímicas relacionadas con hábitos dietéticos, en el 84% de los casos del grupo control los estudios metabólicos serían normales frente al 26% del grupo de pacientes.
La alteración metabólica más frecuente en el grupo de pacientes es la hipercalciuria, 52% de los casos, resultados similares a los de otros autores (32), predominan las de origen absortivo (16), relacionada con hipervitaminosis D (hiperdosificación, hipersensibilidad o exposición prolongada a rayos ultravioleta), sarcoidosis de Besnier-Boeck-Schauman, hipotiroidismo, síndrome de Fanconi, enfermedades óseas (33), etc. Cuando no es posible subclasificar la hipercalciuria o ésta se asocia a RTP baja se debe completar el estudio determinando PTH, Vitamina D y fosfatasa alcalina en plasma, el test de las tiacidas nos permite diferenciar entre hipercalciuria renal e hiperparatiroidismo normocalcémico (34). En otros casos la hipercalciuria puede estar relacionada con hipoparatiroidismo, exceso de glucocorticoides, administración de inhibidores de la anhidrasa carbónica, diuréticos no tiacídicos, enfermedad de Wilson, acidosis metabólica, displasias tubulares, acidosis tubular renal, sobrecarga de carbohidratos (35,36).
El 36% de los pacientes presentan hiperoxaluria, diferencia claramente significativa con el grupo control, no obstante el 12% de los casos corresponden a hiperoxalurias marginales, Hallson y Rose atribuyen a la oxaluria un importante papel en la litogénesis (37). La hiperoxaluria endógena debe ser confirmada investigando el correspondiente defecto enzimático, determinar ácido glioxólico y L-glicerido en orina (38). En la hiperoxaluria absortiva debemos distinguir entre su origen dietético: debida a un excesivo aporte de oxalato (39) o dietas hipocálcicas (16), que cursará con hiperoxaluria moderada (entre 40 y 60 mg/24 h) y por supuesto la restricción de oxalatos en la dieta normalizará la oxaluria; y el origen entérico: debida o asociada a patología intestinal (enfermedad inflamatoria, resección intestinal pancreatitis crónica, hepatopatías), que presenta generalmente niveles de oxaluria superiores a 60 mg, sin conseguir su normalización a través de la restricción dietética, persistiendo cifras superiores a 40 mg/24 h.
La hiperuricosuria se detecta en el 30% de los pacientes,frecuencia similar a la referida por otros autores en pacientes con litiasis cálcica (40), sin embargo en el grupo control se detecta en el 36% de los casos, por lo que se debe considerar como un factor litogénico complementario y relacionado con hiperabsorción intestinal y excreción renal elevada, en otros casos esta relacionada con la gota o tubulopatías (16,41). Un aclaramiento alto de ácido úrico junto a hipouricemia permite sospechar el origen renal de la hiperuricosuria. Al contrario,un aclaramiento y uricemia normales pueden indicar un origen entérico. En la precipitación de los cálculos de ácido úrico es fundamental el pH ácido mantenido (42), en ningún caso del grupo control se ha detectado oliguria ácida.
Según algunos autores la hipomanegsuria facilita la litogénesis cálcica (28), en este estudio se presenta en el 3% de los pacientes y en ningún caso del grupo control.
En la acidosis tubular renal tipo I hereditaria o relacionada con mieloma múltiple, hipergammaglobulinemias, hepatitis crónica, cirrosis, lupus eritematoso, enfermedad de Sjögren, espongiosis renal, glucogenosis tipo I, etc, se producen las alteraciones ideales para la precipitación del fosfato cálcico (43), se presenta en el 3.5% de los pacientes y en ningún caso del grupo control, su diagnóstico debe ser confirmado con análisis de pH y PCO2 en sangre y orina, el gradiente positivo de la PCO2 en orina debe ser < 20 en relación con la PCO2 plasmática y pH urinario > 6, en la ATR completa existe acidosis metabólica (33).
El conocimiento de estos factores nos permite identificar los casos con mayor riesgo de recidiva, los pacientes con niveles de calcio en orina elevados y/o pH urinario con tendencia alcalina constituyen un grupo de alto riesgo de recurrencia, otros autores encuentran niveles de citraturia más bajos en pacientes con litiasis recurrente frente a pacientes con litiasis única (44). En general, según Lancina y cols, las alteraciones bioquímicas detectadas en pacientes con litiasis recidivante no difieren de forma significativa con las detectadas en el primer episodio litiásico, sin embargo la edad de comienzo de la enfermedad litiásica fue significativamente inferior en los pacientes con varios episodios litiásicos en relación a los pacientes con litiasis monoepisódica (45).
Conclusiones
Como hemos podido observar algunas personas sin litiasis presentan alteraciones bioquímicas urinarias similares a las de los pacientes, especialmente las relacionadas con los hábitos de vida y alimentación, lo que concede valor a los factores anatómicos e hidrodinámicos en la litogénesis, como ocurre en la litiasis recurrente unilateral. En los pacientes con litiasis se detectan alteraciones bioquímicas, como sobresaturación cálcica, hipercalciuria absortiva tipo II, hiperoxaluria marginal absortiva, hiperuricosuria enterorrenal, déficit de inhibidores (hipocitraturia, hipomagnesuria), que pueden controlarse con dietas adecuadas. Las hipercalciurias e hiperoxalurias no dietéticas, alteraciones del pH urinario, hiperuricosuria endógena, pueden ser objeto de diagnóstico y tratamiento específico.
Bibliografía y lecturas recomendadas (*lectura de interés y **lectura fundamental)
*1. ARRABAL MARTÍN, M.; LANCINA MARTÍN, J.A.: Patogenia: Estudio metabólico y bacteriológico. En Arrabal Martín M., Lancina Martín J.A., García Pérez M. Criterios clínicos y tratamiento actual de la litiasis urinaria. Pag. 26-44 ENE Ed. Madrid, 1990. [ Links ]
*2. GRASES FREIXEDAS, F.; CONTE VISÚS, A.; COSTA-BAUZA, A. y cols.: Tipos de cálculos renales. Relación con la bioquímica urinaria. Arch. Esp. Urol., 54: 861, 2001. [ Links ]
3. BORDIER, P.; RYCKEWART, A.; GUERIS, J. y cols.: On the pathogenesis of so called idiopathic hypercalciuria. Am. J. Med., 63: 398, 1977. [ Links ]
4. PAK, C.Y.C.; CHU, S.: A simple technique for the determination of urinary state of saturation with respect to brushite. Invest. Urol., 11: 211, 1973. [ Links ]
5. BROADUS, A.E.; INSOGNA, K.L.; LANG, R. y cols.: Evidence for disordered control of 1, 25(OH)2D production in absorptive hypercalciuria. New Engl. J. Med., 311: 73, 1984. [ Links ]
6. COE, F.L.; DAVALCH, A.G.: Hypercalciuria and hyperuricosuria in patients with calcium nephrolithiasis. N. Engl. J. Med., 291: 1344, 1974. [ Links ]
*7. ROBERTSON, W.G.; PEACOK, M.: Review of risk factors in calcium oxalate urolithiasis. World J. Urol., 1: 114, 1983. [ Links ]
8. WATTS, R.W.; VEALL, N.; PURKISS, P.y cols.: The effect of pyridoxine on oxalate dynamics in three cases of primary hyperoxaluria (with glycollic aciduria). Clin. Sci., 69: 87, 1985. [ Links ]
9. HAMMAR, M.L.; BERG, G.E.; LARSSON, L. y cols.: Endocrine changes and urinary citrate excretion. Scand. J. Urol. Nephrol., 21: 51, 1987. [ Links ]
10. SORENSEN, C.M.; CHANDHOKE, P.S.: Hyperuricosuric calcium nephrolithiasis. Endocrinol. Metab. Clin. North Am., 31:915,2002. [ Links ]
11. NICKEL, J.; EMTAGE, J.; COSTETON, J.W.: Ultrastructural microbial ecology of infection induced urinary stones. J. Urol., 133: 622, 1985. [ Links ]
*12. GRIFFITH, D.P.; MUSHER, D.P.;MUSHER, D.M. y cols.:Urease:The primary cause of infection induced urinary stones. Invest. Urol.,13: 346, 1976. [ Links ]
13. KAJANDER, E.O.; ÇIFTCIOGLU,N.:Nano- bacteria: an alternative mechanism for pathogenic intra- and extracellular calcification and stone formation. Proc. Natl. Acad. Sci., 95: 8274, 1998. [ Links ]
14. LANCINA MARTÍN, J.A.; ARRABAL MARTÍN, M.: Enfermedades sistémicas y litiasis urinaria. Pag. 1-171 Ed. Visión Net. Madrid, 2004. [ Links ]
15. SCOTT, R.: Prevalence of calcified upper urinary tract stone disease in a random population survey. Brit. J. Urol., 59: 111, 1987. [ Links ]
**16. PREMINGER, G.M.: The metabolic evaluation of patients with recurrent nephrolithiasis: a review of comprehensive and simplified approaches. J. Urol., 141: 760, 1989. [ Links ]
17. SEFTEL, A.; RESNICK, M.I.: Metabolic evaluation of urolithiasis. Urol. Clin. North. Am., 17: 159, 1990. [ Links ]
18. PEACOCK, M.: Primary hyperparathyroidism and the kidney: biochemical and clinical spectrum. J. Bone Miner Res., 17: 87, 2002. [ Links ]
19. RIVERS, K.; SHETTY, S.; MENON, M.: When and how to evaluate a patient with nephrolithiasis. Urol. Clin. North Am., 27: 203, 2000. [ Links ]
*20. YAMAKAWA, K.; KAWAMURA, J.: Analysis of hypophosphatemia in calcium nephrolithiasis. Mol. Urol. 4: 365. 2000. [ Links ]
21. IE, D.; BECK, L.; SILVE, C. y cols.: Hypophosphatemia and calcium nephrolithiasis. Nephron Exp. Nephorl. 98: 50-4. 2004. [ Links ]
*22. HOSKING, D.H.; ERICKSON, S.B.; VAN DEN BERG, C.J. y cols.: The stone clinic effect in patients with idiopathic calcium urolithiasis. J. Urol. 130: 1115. 1983. [ Links ]
23. JIMÉNEZ VERDEJO, A.; ARRABAL MARTÍN, M.; MIJÁN ORTIZ, J.L. y cols.: Efecto del citrato potásico en la profilaxis de la litiasis urinaria. Arch. Esp. Urol. 54: 1036. 2001. [ Links ]
24. HOLMES, R.P.; GOODMAN, H.O.; HART, L.J. y cols.: Relationship of protein intake to urinary oxalate and glycolate excretion. Kidney Int. 44: 366. 1993. [ Links ]
*25. CURHAN, G.C.; WILLETT, W.C.; RIMM, E.B. y cols. A prospective study of dietary calcium and other nutrients and the risk of symptomatic kidney stones. New Engl. J. Med. 328: 833. 1993. [ Links ]
26. ASPLIN, J.R.: Hyperoxaluric calcium nephrolithiasis. Endocrinol Metab. Clin. North Am. 31: 927. 2002. [ Links ]
27. SMITH, L.H.: Diet and hiperoxaluria in the syndrome of idiopatic calcium oxalate urolithiasis. Am. J. Kidney Dis. 17: 370. 1991. [ Links ]
28. AKINCI, M.; ESEN, T.; KOCAK, T. y cols.: Role of inhibitor deficiency in urolithiasis. The rationale of urinary magnesium, citrate, pyrophosphate and glycosaminoglycan determinations. Eur. Urol. 19: 240. 1991. [ Links ]
29. MORAN, M.E.: Uric acid stone disease. Front Biosci. 8: 1339. 2003. [ Links ]
*30. HESS, B.: Nutritional aspects of stone disease. Endocrinol Metab. Clin. North. Am. 31: 1017. 2002. [ Links ]
31. WILLIAMS-LARSON, A.W.: Urinary calculi associated with purine metabolism Uric acid nephrolithiasis. Endocrinol Metab. Clin. North. Am. 19: 821. 1990. [ Links ]
32. PIERRATOS, A.E.; KHALAFF, H.; CHENG, P.T. y cols.: Clinical and biochemical differences in patients with pure calcium oxalate monohydrate and calcium oxalate dihydrate kidney stones. J. Urol. 151: 571. 1994. [ Links ]
*33. CAUDARELLA, R.; VESCINI, F.; BUFFA, A. y cols.: Bone mass loss in calcium stone disease: focus on hypercalciuria and metabolic factors. J. Nephrol. 16: 260. 2003. [ Links ]
34. ARRABAL MARTÍN, M.: Litogénesis cálcica. Acidosis tubular renal.in Lancina Martín A. Litogénesis urinaria de origén metabólico. 85-92, J & C Ediciones Médicas SL. Barcelona, 2002. [ Links ]
*35. TASCA, A.; CACCIOLA, A.; FERRARESE, P. y cols.: Bone alterations in patients with idiopathic hypercalciuria and calcium nephrolithiasis. Urology. 59: 865. 2002. [ Links ]
36. MAGEN, D.; ADLER, L.; MANDEL, H. y cols.: Autosomal recessive renal proximal tubulopathy and hypercalciuria: a new syndrome. Am. J. Kidney Dis. 43: 600 2004. [ Links ]
37. HALLSON, P.C.; ROSE, G.A.: Risk factors for urinary calcium oxalate crystals as revealed by their specific enzymatic assay. Br. J. Urol. 64: 451. 1989. [ Links ]
38. MILLINER, D.S.: The primary hyperoxalurias: an algorithm for diagnosis. Am. J. Nephrol. 25: 154. 2005. [ Links ]
39. MASSSEY, L.K.; LIEBMAN, M.; KYNAST-GALES, S.A.: Ascorbate increases human oxaluria and kidney stone risk. J. Nutr. 135: 1673. 2005. [ Links ]
**40. PAK, C.Y.; POINDEXTER, J.R.; ADAMS-HUET, B. y cols.: Predictive value of kidney stone composition in the detection of metabolic abnormalities. Am.J. Med. 115: 26. 2003. [ Links ]
41. ABATE, N.; CHANDALIA,M., CABO-CHAN, A.V. (Jr) y cols.: The metabolic syndrome and uric acid nephrolithiasis: novel features of renal manifestation of insulin resistance. Kidney Int. 65: 386. 2004. [ Links ]
42. PAK, C.Y.; SAKHAEE, K.; PETERSON, R.D. y cols.: Biochemical profile of idiopathic uric acid nephrolithiasis. Kidney Int. 60: 757. 2001. [ Links ]
43. IIDA, S.; MATSUOKA, K.; INOUE, M. y cols.: Calcium nephrolithiasis and distal tubular acidosis in type 1 glycogen storage disease. Int. J. Urol. 10: 56. 2003. [ Links ]
44. CUPISTI, A.; MORELLI,E.; LUPETTI, M. y cols.: Low urine citrate excretion as main risk factor for recurrent calcium oxalate nephrolithiasis in males. Nephron. 61: 73. 1992. [ Links ]
*45. LANCINA MARTÍN, A.; RODRÍGUEZ-RIVERA GARCÍA, J.; NOVAS CASTRO, S. y cols.: Factores pronósticos metabólicos en pacientes con urolitiasis cálcica. Arch. Esp. Urol. 54: 1017. 2001. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Miguel Arrabal Martín
C/ Profesor Agustín Escribano, 3 -3 º B1
18004 Granada. (España)
arrabalm@supercable.es
Recibido: 3 de enero 2006