Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Archivos Españoles de Urología (Ed. impresa)
versión impresa ISSN 0004-0614
Arch. Esp. Urol. vol.59 no.8 oct. 2006
Metástasis suprarrenal metacrónica en 2 pacientes sometidos a nefrectomía radical por carcinoma de células renales primario
Metachronous adrenal metastasis in two patients undergoing radical nephrectomy for primary renal cell carcinoma
José Luis Rosales Leal, Francisco Rodríguez Herrera, Manuel Ortiz Gorráiz,
Beatriz Honrubia Vílchez, Antonio Fernández Sánchez, Fernando Vázquez Alonso,
Manrique Pascual Geler, Antonio Martínez Morcillo, Javier Vicente Prados,
José Manuel Cózar Olmo, Eduardo Espejo Maldonado y Miguel Tallada Buñuel
Servio de Urología. Hospital Universitario Virgen de las Nieves. Granada. España.
Dirección para correspondencia
RESUMEN
Objetivos/Métodos: Presentamos dos casos excepcionales de metástasis suprarrenales metacrónicas de carcinoma de células renales y revisamos la literatura existente. Valorados distintos aspectos como la frecuencia, etiopatogenia, diagnóstico y seguimiento de estos pacientes concluimos que estas metástasis son poco frecuentes y suelen presentarse tardías en su evolución en pacientes con CCR con bajo estadios anatomo-patológicos.
Resultados/Conclusiones: Revisado el tratamiento y constatando que no hay directrices en cuanto al manejo terapéutico de estos pacientes con metástasis proponemos la cirugía de la metástasis suprarrenal así como el tratamiento adyuvante con inmunoterapia.
Palabras clave: Carcinoma de células renales. Glándula suprarrenal. Metástasis.
SUMMARY
Objectives: We report two exceptional cases of metachronous adrenal metastasis of renal cell carcinomas and perform a bibliographic review. After the evaluation of various features such as frequency, etiopathogenesis, diagnosis and follow-up of these patients we conclude that these metastases are rare, and they usually appear late in the evolution of patients with low stage renal cell carcinoma.
Results/Conclusions: Once reviewed the treatment and checked the absence of guidelines for the therapeutic management of these patients we propose surgery for the adrenal metastasis as well as adjuvant treatment with immunotherapy.
Key words: Renal cell carcinoma. Adrenal gland. Metastasis.
Introducción
En la actualidad, la mayoría de los tumores renales se diagnostican en fases precoces de la enfermedad, como masas incidentales o tumores de bajo estadio. Sin embargo, las metástasis pueden aparecer en el momento del diagnóstico (sincrónicas) o pueden ocurrir a lo largo de muchos años de seguimiento (metacrónicas), en diversas e inesperadas localizaciones. La mayoría de las metástasis de carcinoma de células renales (CCR) se localizan en pulmón, hígado, hueso y ganglios linfáticos. La afectación suprarrenal (SR) maligna metacrónica es excepcional. Presentamos dos casos de metástasis SR y revisamos la literatura.
Casos Clínicos
Caso 1
Mujer de 67 años, con antecedentes personales de HTA, TBC pulmonar con paquipleuritis residual, hipotiroidismo primario en tratamiento sustitutivo, suprarrenalectomía izquierda en 1992 por síndrome de Cushing, intervenida de cataratas y polipectomía colónica. Se diagnosticó incidentalmente de cáncer renal mediante estudio ecográfico y TAC y fue sometida a nefrectomía radical derecha en 1997. El diagnóstico anatomo-patológico fue compatible con adenocarcinoma renal de células claras, grado nuclear 2 de Furhman, en polo inferior, de 6 cm de diámetro (pT1bN0M0).
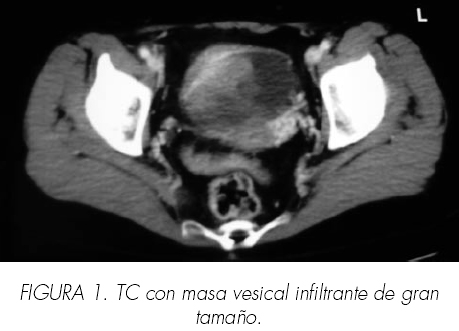
Ha sido revisada cada seis meses durante los 3 primeros años, y posteriormente cada año, mediante analítica, Rx de tórax y pruebas de imagen (TAC abdomino-pélvico y ecografía abdominal), según protocolo. Presentó una masa SR (Figura 1) en el seguimiento a los 95 meses, por lo que fue valorada por Servicio de Endocrinología que descartó funcionalidad. El estudio de extensión fue negativo. Se realizó una suprarrenalectomía derecha por vía abierta con informe anatomo-patológico de metástasis metacrónica de CCR, con patrón de células claras. Comenzó con tratamiento corticoideo sustitutivo.
Inició inmunoterapia adyuvante con Interleuquina 2 + interferón alfa según protocolo del Servicio (Tabla I A), que suspendió durante el primer ciclo por deterioro de la función renal. A los 3 meses de la intervención se evidenció la presencia de metástasis pulmonares múltiples de pequeño tamaño, mediante TAC torácico. Constatada la enfermedad metastásica pulmonar se reinició inmunoterapia al 50% bajo el esquema terapéutico según protocolo en pacientes metastáticos (Tabla I B) precisando doblar las dosis de corticoides en todos los ciclos. A los 8 meses de seguimiento desde el diagnóstico y tratamiento de la masa SR permanece estable clínicamente, con estabilización de sus metástasis pulmonares.
Caso 2
Varón de 53 años, con antecedentes personales de HTA, obesidad mórbida, TEP, TVP, timoma estadio II Masaoka, tratado en 1992 mediante timectomía y radioterapia adyuvante (45Gy) en remisión. Presentó dolor en fosa renal izquierda diagnosticándose de cáncer renal mediante estudio de ECO y TAC. Fue sometido a nefrectomía radical y suprarrenalectomía izquierdas en 1999 con diagnóstico anatomo-patológico de adenocarcinoma renal de células mixtas (claras y granulares), grado nuclear 2 de Furhman, de polo superior, de 8 cm. de diámetro (pT2N0M0).
Ha seguido el mismo protocolo de revisión. Se sometió a suprarrenalectomía derecha por presentar metástasis SR metacrónica derecha a los 70 meses de seguimiento (Figura 2), con informe anatomopatológico para metástasis de CCR con patrón mixto (células claras y mixtas). Considerado como enfermo de alto riesgo con posible evolución metastásica, ha inició protocolo de inmunoterapia adyuvante (Tabla I A) con buena tolerancia tras el primer ciclo.
A los 9 meses de seguimiento permanece estable clínicamente, presentando en TAC torácico de control engrosamiento pleural de aspecto nodular, situado en la región postero-basal derecha, pudiendo corresponder a metástasis, recomendándose punción aspiración con aguja fina para su filiación.
Por otra parte también se ha identificado una adenopatía latero-cervical izquierda de unos 2 cm clínica y ecográfica, pendiente de su exéresis y estudio anatomopatológico, ya que la PAAF realizada no fue diagnóstica.
Discusión
El CCR representa el 3% de las enfermedades malignas del adulto. Ocupa el tercer lugar en las neoplasias urológicas, por detrás del cáncer de próstata y vesical. En Estados Unidos la tasa de incidencia ajustada por edad de este proceso para hombres blancos, mujeres blancas y para negros es de 9,6, 11,1 y 4,9 por 100.000 habitantes-año respectivamente (1). En Europa la incidencia estimada en 2004 es de 3,89 y 2,26 por 100.000 habitantes-año para hombres y mujeres (2). Dependiendo de las series, aproximadamente el 60 y el 70% de los pacientes presentan enfermedad localizada o localmente avanzada potencialmente curable con tratamiento quirúrgico (3). Sin embargo, las tasas de recurrencia son elevadas (35–65%) para pacientes con tumores localmente agresivos, dependiendo del estadio patológico, grado nuclear de Furhman y ECOG-PS (4). El resto de los pacientes presentan metástasis múltiples a distancia, siendo las más frecuentes en pulmón, ganglios linfáticos, hígado o hueso (5). El comportamiento del CCR es impredecible, hasta el 50% de los pacientes sometidos a una nefrectomía radical inicialmente curativa, desarrollará enfermedad metastásica metacrónica durante su evolución en el tiempo, por lo que precisan seguimientos a largo plazo (6).
La afectación metastásica SR del CCR es poco frecuente (7). De hecho, la presencia de signos y síntomas clínicos de insu.ciencia adrenal son poco prevalentes. La frecuencia de afectación SR metastásica como hallazgo anatomopatológico en series de autopsias en pacientes con CCR se ha situado entre 10 y el 19% (10,9). La metástasis SR suele ser más frecuente en la glándula ipsilateral. Saitoh (8), en más de 400 casos, encontró un 17% de afectación ipsilateral y un 11% de afectación contralateral, con afectación exclusiva de la glándula SR contralateral del 2,5%. En una serie de 610 pacientes observaron una incidencia de afectación SR ipsilateral sincrónica del 3.4% (21/610) y contralateral del 1.1% (7/610), de las que sólo 4 fueron metacrónicas (0.6%) (9). En otra revisión publicada la frecuencia de metástasis metacrónica fue del 1,4% (5/350) (10).
La afectación suprarrenal ipsilateral puede ocurrir por diseminación hematógena de células aisladas o por trombosis tumoral a través de la vena renal, vena adrenal, venas colaterales de la grasa perinéfrica y periféricas de la glándula adrenal. La extensión directa a través de la cápsula renal puede ocurrir en tumores de gran tamaño o de polo superior. Aunque las metástasis contralaterales son menos frecuentes que la afectación suprarrenal ipsilateral, se ha sugerido que la glándula adrenal constituye un medio ambiente favorable para el desarrollo de metástasis del CCR en la diseminación hematógena (11).
En una cohorte retrospectiva de pacientes intervenidos de CCR en nuestro centro se diagnosticaron 5 casos con metástasis SR. Entre 1988 y 2005 se intervinieron 238 pacientes diagnosticados de CCR. La edad media (mediana, rango) de los pacientes intervenidos fue de 60,4 años (62, 18-89). Presentaron metástasis en diversas localizaciones en el control evolutivo el 11,7% (28/238), con un seguimiento medio (desviación típica, rango) de 36,5 meses (33,8; 3-139). Se realizó nefrectomía radical con suprarrenalectomía en el 31,9% (76/238) con afectación SR en un 3,9% (3/76) de los pacientes (1 bilateral, 1 ipsilateral, 1 contralateral). Se han descrito dos casos de metástasis SR metacrónicas que constituyen el 0,8% del total de la serie (2/238), similar a la serie de Von Knobloch (9).
Se han comunicado diagnósticos de metástasis SR metacrónicas hasta 23 años después de una nefrectomía (12). Este desfase cronológico se puede explicar debido a que algunas metástasis pueden ser de muy bajo crecimiento, sobretodo si son de bajo grado, y por fallo en el uso de estudios de imagen de rutina en algunos casos (13).
Las metástasis SR suelen ser anatómicamente y funcionalmente silentes. Se desconoce el sustrato biológico que determina la afectación contralateral aislada.
Respecto al tratamiento primario del CCR, ha sido controvertido a lo largo de los años la necesidad o no de adrenalectomía ipsilateral simultánea con la nefrectomía. Diversos estudios han concluido que este procedimiento no conlleva asociado una mejoría del pronóstico de la enfermedad salvo en determinadas circunstancias (14 - 16). Se han establecido como factores de riesgo de afectación suprarrenal estadios tumorales elevados, localización en polo superior, multifocalidad, trombosis de la vena renal así como sospecha de afectación mediante imagen por TAC (valor predictivo negativo del 99,4%) (16, 17). En nuestra serie de 238 pacientes intervenidos por CCR en el periodo 1988-2005, se indicó nefrectomía radical con suprarrenalectomía ipsilateral por afectación del hemirriñón superior en el 31,9% (76/238), con 3 casos de afectación SR, que constituyó un 3,9% (3/76). En la Tabla II se correlaciona el estadio tumoral anatomopatológico con la afectación SR.
Debido al reducido número de pacientes con este tipo de metástasis a largo plazo hace difícil llegar a conclusiones sobre su pronóstico y manejo. La supervivencia de los pacientes con enfermedad metastásica avanzada sin tratamiento tienen un pronóstico pobre, pero éste difiere en aquellos pacientes con lesiones solitarias en las que es posible su extirpación quirúrgica completa, consiguiendo una supervivencia prolongada con tasas del 23 al 35% a los 5 años. (9,10,18). El pronóstico es más favorable en aquellos pacientes diagnosticados con un intervalo de tiempo mayor desde la nefrectomía (19). Laul y cols. (13) revisaron 56 casos de metástasis SR contralaterales publicados hasta el 2001, en los que se realizó adrenalectomía como tratamiento. 24 lesiones fueron sincrónicas y 32 metacrónicas. El rango de edad fue de 43 a 82 años, el mayor tiempo comunicado de aparición de la metástasis SR después de la nefrectomía fue de 23 años, con un seguimiento de 0,3 a 14,3 años 27 permanecían sin evidencias de enfermedad y 17 pacientes murieron por CCR metastático. Actualmente se considera la vía laparoscópica como vía de abordaje inicial en el tratamiento quirúrgico de la afectación SR (20). Aunque empíricamente los pacientes sometidos a tratamiento quirúrgico de la metástasis del CCR podrían beneficiarse de tratamiento adyuvante inmunoterápico, no existen estudios que aborden esta cuestión (21,22,25).
Nosotros consideramos a este grupo pacientes de riesgo para el desarrollo de enfermedad metastásica, como ha sucedido en estos dos casos aislados. Así que proponemos la realización de tratamiento quirúrgico citorreductor (exéresis de la metástasis única cuando sea factible), asociado a pautas de inmunoterapia adyuvante, aunque en la literatura científica no se haya concluido hasta la fecha el esquema terapéutico más eficaz.
Por otra parte, los diversos esquemas quimioterápicos o radioterapicos empleados no han permitido controlar la enfermedad localmente avanzada o diseminada. Hasta este momento, para la enfermedad metastásica se han desarrollado múltiples regimenes de inmunoterapia basados en el uso del interferón alfa y la interleuquina 2, en monoterapia o en asociaciones siendo el Interferon α el que aporta mayores resultados en la literatura.
En la actualidad se están desarrollando ensayos clínicos fase III que tratan de evaluar el uso sinérgico de la IL-2 asociado a Interferon α, que han conseguido tasas de respuesta (remisión parcial o completa) entre el 15 y el 25%. Por otra parte se han identificado factores pronósticos para predecir el beneficio del tratamiento con citoquinas, y ayudar al medico a seleccionar a los pacientes. Estos factores incluyen la anemia, elevacion de la LDH, elevación del calcio, ausencia del tratamiento quirúrgico previo, un bajo Karnofsky/ECOG performal status, numero, tamaño y localización de las metástasis.
Estudios recientes han examinado la eficacia de agentes antiangiogénicos, como el bevacizumab, un inhibidor del factor de crecimiento endotelial vascular (VEGF), así como otra serie de fármacos con diferentes mecanismos de acción basados en el desarrollo del conocimiento molecular en la patogénesis de esta enfermedad, de cuya utilidad podrá disponerse en breve (23-26).
En conclusión, podemos decir que las metástasis SR de CCR metacrónicas son poco frecuentes y suelen presentarse tardías en su evolución en pacientes con CCR con bajo estadios anatomo-patológicos. Se desconocen los mecanismos de escape tumoral a tan largo plazo para el desarrollo de enfermedad metastásica. No disponemos de series amplias previas que establezcan directrices en cuanto al manejo terapéutico adecuado de estos pacientes con metástasis SR. En casos seleccionados de lesiones únicas pueden ser subsidiarias de exéresis quirúrgica. Aunque no hay evidencias científicas que apoyen el tratamiento adyuvante con inmunoterapia en CCR localmente avanzado no metastático en los ensayos clínicos publicados, todavía no se han realizado este tipo de estudios de adyuvancia en pacientes con metástasis única tratados con cirugía.
Consideramos a este tipo de pacientes de alto riesgo para el desarrollo de enfermedad metastásica múltiple, por lo que recomendaríamos tratamiento empírico adyuvante con inmunoterapia (IL2 + INFa). Creemos necesario el desarrollo de ensayos clínicos que demuestren su beneficio.
Bibliografía y lecturas recomendadas (*lectura de interés y ** lectura fundamental) ^rND^1A01^nRaquel^sGonzález Resina^rND^1A01^nMaría Luisa^sSánchez Bernal^rND^1A01^nMari Paz^sPérez Espejo^rND^1A01^nFrancisco Javier^sRodríguez Corchero^rND^1A01^nEnrique^sArgüelles Salido^rND^1A01^nPedro^sCampoy Martínez^rND^1A01^nRaquel^sGonzález Resina^rND^1A01^nMaría Luisa^sSánchez Bernal^rND^1A01^nMari Paz^sPérez Espejo^rND^1A01^nFrancisco Javier^sRodríguez Corchero^rND^1A01^nEnrique^sArgüelles Salido^rND^1A01^nPedro^sCampoy Martínez^rND^1A01^nRaquel^sGonzález Resina^rND^1A01^nMaría Luisa^sSánchez Bernal^rND^1A01^nMari Paz^sPérez Espejo^rND^1A01^nFrancisco Javier^sRodríguez Corchero^rND^1A01^nEnrique^sArgüelles Salido^rND^1A01^nPedro^sCampoy Martínez
Carcinoma epidermoide vesical. Revisión de nuestra serie
Squamous cell carcinoma of the bladder. Review of our case series
Raquel González Resina, María Luisa Sánchez Bernal, Mari Paz Pérez Espejo,
Francisco Javier Rodríguez Corchero, Enrique Argüelles Salido y Pedro Campoy Martínez
Servicio de Urología. Hospitales Universitarios Virgen del Rocío. Sevilla. España.
Dirección para correspondencia
RESUMEN
Objetivo: El carcinoma epidermoide de vejiga es un tumor infrecuente en nuestro medio, con una proporción entre 1,6% y 6,7% de todas las neoplasias vesicales. Es mas frecuente encontrar focos de diferenciación escamosa en el contexto de un carcinoma transicional.
Métodos: Han sido revisados de forma retrospectiva todos los carcinomas epidermoides vesicales diagnosticados y tratados en nuestro Hospital entre 1994- 2004. Analizamos su comportamiento biológico y tratamiento aplicado.
Resultados: Encontramos 11 casos de carcinoma epidermoide vesical, que desde el punto de vista anatomo-patologico fueron 8 formas puras y 3 formas mixtas. La edad media de los pacientes fue de 70,9 años con un rango de (49-88 anos) y la distribución por sexos era de 6 varones y 5 mujeres. En el momento del diagnóstico todos presentaban estadios locales avanzados (≥ T2). Aunque el tratamiento electivo es la cistectomia radical, esta solo se pudo aplicar en tres pacientes, en uno de los cuales se asocio quimioterapia adyuvante. En el resto se realizaron resecciones transuretrales, asociadas en dos casos a radioterapia adyuvante y en un caso a ureterostomía cutánea bilateral por el estadio avanzado en el momento del diagnostico. La media de supervivencia fue de 20 meses con un rango de 1 a 91 meses. solo 2 pacientes siguen vivos, ambos fueron sometidos a cirugía radical.
Conclusiones: El carcinoma epidermoide tanto en su forma pura como mixta, es un tumor agresivo. El diagnóstico tardío de estos tumores y su comportamiento biológico comportan un pronóstico sombrío. Sólo un diagnóstico precoz y un tratamiento radical pueden mejorar su pronóstico.
Palabras clave: Tumor vesical. Carcinoma epidermoide. Neoplasias no transicionales.
SUMMARY
Objectives: The squamous cell carcinoma of the bladder is a rare tumor in our environment, representing between 1.6-6.7% of all bladder neoplasias. It is more common to find foci of squamous differentiation associated with a transitional cell carcinoma.
Methods: We retrospectively review all squamous cell carcinomas diagnosed and treated in our hospital between 1994 and 2004. We analyze their biological behaviour and the treatment applied.
Results: We found 11 cases of squamous cell carcinoma of the bladder, which pathologically were pure squamous cell carcinomas in eight patients and mixed in another three. Mean patient age was 70.9 years ranging from 49 to 88 years, six of them were males and five females. All of them presented locally advanced tumor stages at the time of diagnosis (≥T2). Although the treatment of choice is radical cystectomy, it could only be applied in three patients; it was associated with adjuvant chemotherapy in one patient. The rest of the patients were treated by transurethral resection of the tumor, with adjuvant radiotherapy in two cases and bilateral cutaneous ureterostomy in one due to the advanced stage. Mean survival was 20 months ranging from 1 to 91 months. Only two patients are alive, both after radical surgery.
Conclusions: The squamous cell carcinoma, in both its forms, pure and mixed, is an aggressive tumor. The late diagnosis of these tumors and their biological behaviour entail a bad prognosis. Only early diagnosis and radical treatment may improve prognosis.
Key words: Bladder tumor. Squamous cell carcinoma. Non transitional cell neoplasias.
Introducción
Los tumores vesicales inusuales podemos definirlos como aquellos tumores que presentan un patrón morfológico diferente al transicional, aunque en algunos casos aparezcan asociadas áreas de carcinoma transicional (formas mixtas).
El carcinoma epidermoide vesical o carcinoma de células escamosas es un tumor epitelial maligno constituido por células de diferenciación escamosa. Es una entidad rara dentro de las neoplasias vesicales con una proporción entre el 1,6% y el 6,7% de todos los tumores vesicales (1). En general la vejiga es el órgano de más raro asiento de los carcinomas epidermoides.
Presentan dificultades de clasificación anatomo-patológica y un comportamiento clínico diferente que determina una particular actitud terapéutica.
Clínica y radiológicamente son indistinguibles los carcinomas epidermoides de los carcinomas transicionales de vejiga, aunque la sobreinfección por gérmenes gram-negativos es un hallazgo relativamente frecuente.
Existen algunos hechos que lo diferencian del carcinoma transicional. En primer lugar tiene una incidencia más elevada en mujeres, sobre todo entre la quinta y séptima década de la vida. En segundo lugar se asocia con las parasitosis vesicales, de forma que en zonas donde la bilharziosis es endémica la incidencia es mayor, así en Egipto e Irak el 65%-75% de los tumores vesicales son epidermoides y se ha establecido un intervalo de tiempo entre la primera infestación y la aparición de cáncer de 10 a 15 años. Por último, también se asocia con antecedentes de irritación vesical crónica, como son las infecciones urinarias, con la patología obstructiva del tracto urinario inferior y existe una mayor predisposición en la raza negra (2).
Inmunohistoquímicamente, no existen diferencias apreciables entre los carcinomas epidermoides vesicales y aquellos otros, también escamosos, de otras localizaciones.
Por otra parte, los carcinomas epidermoides se diferencian de los transicionales por el patrón de citoqueratinas de bajo peso molecular presentes en mayor cantidad en las células tumorales de este último, respecto a el carcinoma epidermoide que contiene, principalmente, citoqueratinas de alto peso molecular y prequeratinas.
A pesar de la elevada incidencia de enfermedad localmente avanzada en el momento del diagnóstico, el potencial de diseminación es bajo.
El pronóstico es sombrío, ya que la supervivencia a los 2 años es del 12,5% y del 0% al 3,5% a los 5 años (2,3).
Material y Métodos
Hemos realizado un estudio retrospectivo de los casos de carcinoma vesical epidermoide diagnosticados y tratados en nuestro servicio en un periodo comprendido entre 1994 y 2004, encontrando 11 casos.
El método utilizado ha consistido en revisar todas las historias clínicas de los pacientes diagnosticados de tumor vesical epidermoide puro o mixto. Los parámetros estudiados han sido sexo, edad, estadio anatomo-clínico, tratamiento utilizado, anatomia patológica y supervivencia de los mismos.
Resultados
En nuestra serie, de los 11 pacientes la distribución por sexos es 5 mujeres (45%) y 6 hombres (55%), con una media de edad de 70,9 y un rango de 49-88 años. El estadio más frecuente es T2 (6 casos) (Figura1), seguido de T3 (4 casos) (Figura 2) y un caso de T4 (Figuras 3 y 4).
El factor de riesgo asociado fue en dos casos infecciones urinarias de repetición con litiasis vesicales, tres casos relacionados con el tabaco y seis sin factor de riesgo conocido, siendo todos ellos de raza caucásica (4 - 7).
Los tratamientos aplicados fueron en tres casos cirugía radical previa resección transuretral biopsia, en un caso con quimioterapia adyuvante, ya que en el resto de los casos el tumor estaba muy avanzado, se hicieron ocho resecciones transuretrales paliativas sin posibilidad de cirugía curativa asociadas a radioterapia adyuvante en dos casos y en otro caso a ureterostomía cutánea paliativa.
Respecto a la anatomía patológica existen ocho casos de carcinoma epidermoide puro (Figura 5), y tres casos de forma mixta (Figura 6) (4,8 - 10).
La supervivencia es similar a otras series publicadas con una media de 20 meses, una mediana de 5 meses y un rango de 1 a 91 meses, con tan solo dos pacientes que viven a los 13 y 91 meses del diagnóstico y tras haberse sometido a cirugía radical previamente. (Tabla I)
Discusión
En nuestra serie el 72% de los tumores son puros, sólo en tres casos fueron mixtos, desde el punto de vista anatomopatológico. En el resto de las series revisadas predominan los tumores mixtos, es decir, transicionales con focos de diferenciación escamosa (3,8,11). Esta diferencia pudiera traducir la dificultad en la clasificación anatomopatológica de este tipo de tumores.
El carcinoma epidermoide no relacionado con bilharziosis, como es nuestra serie, a menudo está asociado a factores crónicos de irritación tales como litiasis vesicales, infecciones de repetición, catéteres permanentes y divertículos vesicales (1,2,5).
El factor de riesgo asociado en nuestra serie fue en dos casos infecciones urinarias de repetición con litiasis vesicales, tres casos relacionados con el tabaco y seis sin factor de riesgo conocido. En otras series revisadas predomina como factor de riesgo el tabaco, seguido por sondaje vesical prolongado e infecciones urinarias de repetición.
Desde el punto de vista epidemiológico existen diferencias entre el carcinoma transicional y el epidermoide de vejiga, presentándose este último en general en nuestro medio tardíamente. La media de edad de nuestros pacientes fue de 70,9 años y un rango entre (49-88 años). En las series revisadas la media de edad fue entre 61 y 69 años con un rango entre (50-82 años), (2,5,12).
Respecto a el sexo, el carcinoma epidermoide es relativamente más frecuente en mujeres que el carcinoma transicional aunque sigue predominando el sexo masculino. Se ha especulado sobre la relación entre las infecciones del tracto urinario (más frecuente en mujeres) como un factor crónico de irritación que podría ser la causa de su mayor incidencia relativa en el sexo femenino (1,3,13). En nuestra serie el 55% son hombres (6 casos) respecto a un 45% de mujeres (5 casos).
La revisión de la literatura en el manejo de este infrecuente tipo tumoral, sugiere que el tratamiento que mejor esperanza de vida proporciona es la cirugía radical (cistectomía radical) sola o combinada con quimioterapia y/o radioterapia, aunque se considera que la resección transuretral es un buen tratamiento paliativo alternativo cuando no se puede realizar una cirugía más agresiva, en asociación con tratamientos adyuvantes como quimioterapia y radioterapia que quizás puedan mejorar los resultados obtenidos (3,5,13,14).
Los tratamientos aplicados en nuestra serie fueron resección transuretral biopsia en todos los casos y en tres casos posterior cirugía radical, uno de ellos con quimioterapia adyuvante. En el resto de los casos el tumor estaba muy avanzado, por lo que sólo se realizaron ocho resecciones transuretrales paliativas sin posibilidad de cirugía curativa asociada a radioterapia adyuvante en dos casos y en otro caso a ureterostomía cutánea paliativa.
Por otro lado respecto a el pronóstico, el carcinoma epidermoide de vejiga presenta un comportamiento muy agresivo con un pobre pronóstico (3). La supervivencia a los 2 años en general es del 12,5%, y a los 5 años entre el 0% y el 3,5% (2,3).
En nuestra serie la media de supervivencia es 20 meses, con una mediana de 5 meses, actualmente sólo dos pacientes sobreviven tras la cirugía radical, un paciente con larga supervivencia (91 meses) lo cual representa una proporción de 1/11 (9%) algo superior a otras series. La diferencia respecto a la literatura puede ser por un diagnóstico precoz de este paciente y un tratamiento mediante cirugía radical que no siempre es posible, por ser frecuente que la enfermedad esté localmente avanzada al diagnóstico.
Conclusiones
El carcinoma epidermoide vesical se relaciona con la bilharziasis hasta en un 80%, no así en países occidentales en el que el factor de riesgo más importante parece ser la irritación vesical crónica.
Los tratamientos utilizados son variados y poco protocolizados y con un pronóstico pobre debido en parte a la agresividad del tumor, aunque con un potencial de diseminación bajo y al diagnóstico tardío del mismo.
En general respecto a el tratamiento y pronóstico, la mayoría de los autores opinan que la cirugía radical es el tratamiento ideal para frenar la progresión local de este tipo de tumor (6).
Por tanto una buena técnica quirúrgica radical y un diagnóstico precoz son dos factores que contribuyen a mejorar el pronóstico.
Bibliografía y lecturas recomendadas (*lectura de interés y **lectura fundamental)
**1. RICOS TORRENT, J.V.; MAZCUÑAN FUENTES, F.; IBORRA JUAN, I. y cols.: El carcinoma epidermoide de vejiga un tumor poco común. Arch. Esp. Urol., 42: 205, 1989. [ Links ]
**2. LAGUNA URRACA, G.; GARCÍA ROJO, M.; TUDELA PATON, M.P. y cols.: Carcinoma epidermoide primario de vejiga. Diagnóstico, tratamiento y revisión de la literatura. Actas Urol. Esp., 18: 573, 1994. [ Links ]
***3. BUDIA ALBA, A.; QUEIPO ZARAGOZA, J.A.; PEREZ EBRI, M.L. y cols.: Estudio comparativo del carcinoma epidermoide de vejiga puro y el carcinoma transicional con focos de diferenciación escamosa o mixto. Actas Urol. Esp., 23:111, 1999. [ Links ]
*4. EBLE, J.N. y cols.: Pathology and Genetics of Tumours of the Urinary System and Male Genital Organs. Lyon, IARCPress, 2004. [ Links ]
*5. QUEIPO ZARAGOZA, J.A.; CHICOTE PÉREZ, F.; BORRELL PALANCA, A. y cols.: Tumores vesicales inusuales: carcinoma epidermoide, adenocarcinoma y sarcoma primarios. Comportamiento clínico. Nuestra experiencia. Actas Urol. Esp., 27: 123, 2003. [ Links ]
*6. VARO SOLÍS, C.; SOTO DELGADO, A.; HENS PÉREZ, A. y cols.: Neoplasias primitivas no transicionales de vejiga. Actas Urol. Esp., 23:587, 1999. [ Links ]
7. YOUNG, R.H.; EBLE, J.N.: Unusual forms of carcinoma of the urinary bladder. Hum. Pathol., 22: 948, 1991. [ Links ]
8. LOPEZ, J.L.; ANGULO-CUESTA, J.; FLORES CORRAL, N. y cols.: Carcinoma de células escamosas de la vejiga urinaria. Estudio clínico-patológico de 7 casos. Arch. Esp. Urol., 47: 756,1992. [ Links ]
9. ZAIDI, S.Z.; THEAKER, J.M.; SMART, C.J.: Squamous cell carcinoma in a patient on clean intermittent self-catheterization. Br. J. Urol., 80:352, 1997. [ Links ]
10. SERRETTA, V.; POMARA, G.; PIAZZA, F. y cols.: Pure squamous cell carcinoma of the bladder in western countries. Eur. Urol., 37: 85,2000. [ Links ]
11. FORTUNY, J.; KOGEVINAS, M.; CHANGCLAUDE, J. y cols.: Tobacco, occupation and non-transitional-cell carcinoma of the bladder: an international case-control study. Int. J. Cancer,80: 44, 1999. [ Links ]
12. NAVON, J.D.; SOLIMAN, H.; KHONSARI, F. y cols.: Screening cystoscopy and survival of spinal cord injured patients with squamous cell cancer of the bladder. J. Urol., 157: 2109, 1997. [ Links ]
13. DEBBAGH, A.; BENNANI, S.; HAFIANI, M. y cols.: Epidermoid carcinoma of the bladder: a propos of 14 cases. Ann. Urol. (París), 31: 199,1997. [ Links ]
14. MURPHY, W.M.: Urothelial neoplasia. Monogr.Pathol., 34: 77, 1992. [ Links ]
 Dirección para correspondencia:
Dirección para correspondencia:
Raquel González Resina
C/ Cardenal Ilundain, 24. esc.4, 2º C.
41013. Sevilla. (España)
E-mail: raqgores@yahoo.es
E-mail: raqgores@auna.com
Recibido: 18 de abril 2006
^rND^sRICOS TORRENT^nJ.V^rND^sMAZCUÑAN FUENTES^nF^rND^sIBORRA JUAN^nI^rND^sLAGUNA URRACA^nG^rND^sGARCÍA ROJO^nM^rND^sTUDELA PATON^nM.P^rND^sBUDIA ALBA^nA^rND^sQUEIPO ZARAGOZA^nJ.A^rND^sPEREZ EBRI^nM.L^rND^sQUEIPO ZARAGOZA^nJ.A^rND^sCHICOTE PÉREZ^nF^rND^sBORRELL PALANCA^nA^rND^sVARO SOLÍS^nC^rND^sSOTO DELGADO^nA^rND^sHENS PÉREZ^nA^rND^sYOUNG^nR.H^rND^sEBLE^nJ.N^rND^sLOPEZ^nJ.L^rND^sANGULO-CUESTA^nJ^rND^sFLORES CORRAL^nN^rND^sZAIDI^nS.Z^rND^sTHEAKER^nJ.M^rND^sSMART^nC.J^rND^sSERRETTA^nV^rND^sPOMARA^nG^rND^sPIAZZA^nF^rND^sFORTUNY^nJ^rND^sKOGEVINAS^nM^rND^sCHANGCLAUDE^nJ^rND^sNAVON^nJ.D^rND^sSOLIMAN^nH^rND^sKHONSARI^nF^rND^sDEBBAGH^nA^rND^sBENNANI^nS^rND^sHAFIANI^nM^rND^sMURPHY^nW.M^rND^1A01^nJesús^sMoreno Sierra^rND^1A01^nIsabel^sGalante Romo^rND^1A01^nNatalia^sPérez Romero^rND^1A01^nMiguel Ángel^sAlonso Prieto^rND^1A01^nSara^sPrieto Nogal^rND^1A01^nEnrique^sBlanco Jiménez^rND^1A01^nJuan Carlos^sLópez Corral^rND^1A01^nAngel^sSilmi Moyano^rND^1A01^nJesús^sMoreno Sierra^rND^1A01^nIsabel^sGalante Romo^rND^1A01^nNatalia^sPérez Romero^rND^1A01^nMiguel Ángel^sAlonso Prieto^rND^1A01^nSara^sPrieto Nogal^rND^1A01^nEnrique^sBlanco Jiménez^rND^1A01^nJuan Carlos^sLópez Corral^rND^1A01^nAngel^sSilmi Moyano^rND^1A01^nJesús^sMoreno Sierra^rND^1A01^nIsabel^sGalante Romo^rND^1A01^nNatalia^sPérez Romero^rND^1A01^nMiguel Ángel^sAlonso Prieto^rND^1A01^nSara^sPrieto Nogal^rND^1A01^nEnrique^sBlanco Jiménez^rND^1A01^nJuan Carlos^sLópez Corral^rND^1A01^nAngel^sSilmi MoyanoUROLOGÍA NEUROLÓGICA Y URODINÁMICA
Cabestrillo de tensión regulable "Remeex" en el tratamiento de la incontinencia urinaria femenina: Técnica quirúrgica personal
Suburethral readjustable sling (Remeex) for the treatment of female urinary incontinence: Personal surgical technique
Jesús Moreno Sierra, Isabel Galante Romo, Natalia Pérez Romero,
Miguel Ángel Alonso Prieto, Sara Prieto Nogal, Enrique Blanco Jiménez,
Juan Carlos López Corral y Angel Silmi Moyano
Servicio de Urología. Hospital Clínico San Carlos. Universidad Complutense. Madrid. España.
Dirección para correspondencia
RESUMEN
Objetivo: Describir los elementos que componen el sistema Remeex femenino, sus indicaciones y la técnica quirúrgica mediante la que se implanta y ajusta adecuadamente.
Método: Indicaciones: Las indicaciones para la utilización del sistema Remeex en incontinencia urinaria femenina son hipermobilidad uretral, uretra fija, disfunción esfinteriana primaria, fracaso de otras técnicas antiincontinencia, incontinencia urinaria en hiperrreflexia vesical 1,2. Protocolo de estudio: El diagnóstico se realiza con una adecuada historia y exploración física y se completa con uretrocistografía y estudio urodinámico, ecografía urológica y opcionalmente uretrocistoscopia. Características de la prótesis Remeex: Este sistema esta compuesto por los siguientes elementos: malla de polipropileno, baritensor, introductor y desacoplador.
Técnica: 1. Anestesia El procedimiento puede realizarse bajo anestesia raquídea o general. 2. Preparación y colocación de la paciente. 3. Técnica quirúrgica paso a paso. 1) Acceso Abdominal. Incisión suprapúbica de 4-6 cm, creación de un lecho supraaponeurotico, para alojar el baritensor. 2) Acceso vaginal. Incisión longitudinal a 1cm del meato uretral, disección del plano vésico-vaginal y creación de un lecho que permita colocar la malla de polipropileno. 3) Acceso combinado abdomino-vaginal. Maniobra de punción mediante una aguja pasahilos de 20 cm en sentido abdominovaginal (bilateral), paso de los dos extremos de la malla a través del espacio parauretral, enhebrado de los hilos en el sistema baritensor de la prótesis Remeex y cierre de las incisiones vaginales y abdominales. 3.Uretrocistoscopia -Ajuste de tensión y control postoperatorio.
Conclusiones: 1. Es una técnica reproducible y el sistema es fácil de implantar. 2. Esta técnica evita la morbilidad de las técnicas abdominales. 3. Permite realizar. 4. Permite reajuste al cabo del tiempo con anestesia local a través de una pequeña incisión suprapúbica. 5. Se han descrito buenos resultados a corto y medio plazo.
Palabras clave: Incontinencia urinaria femenina. Sistema de tensión regulable. Cabestrillo. Remeex
SUMMARY
Objectives: Currently, there is not agreement about the adequate tension for each patient with female stress urinary incontinence treated with urethral slings. The adjustable tension sling Remeex (external mechanic regulation) allows adjustment to ideal tension tr ying to avoid or minimize possible reoperations. The objective of these paper is to describe the components of the Remeex system, its indications, and the surgical technique to implant and adjust it.
Methods: Indications: The Remeex system is indicated female urinary incontinence in cases of urethral hypermobility, fixed urethra, primary sphincteric dysfunction, failure of other incontinence repaired techniques, and urinary incontinence in bladder hyperreflexia. Study protocol: The diagnosis is made with appropriate history and physical examination and completed with voiding cystourethrogram and urodynamic study, urinar y tract ultrasound and, optionally, urethrocystoscopy. Remeex prosthesis characteristics: The system has three elements: polypropylene mesh, pressure tensor, and disconnection tool.
Technique: 1. Anesthesia: It maybe performed under general or spinal anesthesia. 2. Preparation and patient position. 3. Surgical technique step-by-step: -Abdominal access: 4-6 cm suprapubic incision and development of a supra-aponeurotic space to place the pressure tensor. -Vaginal access: longitudinal incision 1 cm from the urethra meatus, dissection of the vesicovaginal plane, and development of the space to place the polypropylene mesh. -Combined abdominal-vaginal access: bilateral punction with a 20 cm suture-passing needle from the abdomen to the vagina and passage of the mesh from the paraurethral espace threading its sutures in the pressure tensor system,and closure of the incisions.-Cystoscopy.-Tension adjustment and postoperative control.
Conclusions: 1. It is an easy to implant system and a reproducible operation. 2. This technique avoids the morbidity of abdominal operations. 3. It allows the readjustment after surgery through a small suprapubic incision under local anesthesia. 4. Good results have been described in the short and mid-term.
Keywords: Female urinary incontinence. Adjustable tension system. Sling. Remeex.
Introducción
En la actualidad no hay acuerdo sobre que tensión es la adecuada para cada paciente con incontinencia urinaria femenina de esfuerzo, utilizándose los cabestrillos con tensión regulable y los libres de tensión (1,2). El cabestrillo de tensión regulable Remeex (Regulador Mecánico Externo) es un sistema que permite ajustar la tensión ideal intentando evitar o minimizar posibles reintervenciones (1-5).
La colpouretrosuspensión mediante sling suburetral asociado a la prótesis Remeex supone una combinación de las técnicas abdominales y vaginales para la corrección de la incontinencia urinaria de esfuerzo, asociada o no al prolapso pélvico. Con la prótesis Remeex se pretende unificar la efectividad a largo plazo de los sling suburetrales, solventando al mismo tiempo los principales defectos de los cabestrillos sin tensión (probabilidad de incontinencia de esfuerzo residual o posibilidad de provocar una retención crónica en caso de tener un exceso de tensión)(1-8).
El sistema requiere de una mínima disección suprapúbica, evitando la morbilidad de las técnicas abdominales. La colocación del sistema Remeex puede asociar en el mismo acto quirúrgico otras técnicas destinadas a la corrección de prolapsos pélvicos en el caso de que sea preciso. Del mismo modo, el sistema puede ser utilizado en pacientes que hayan sido intervenidas previamente por técnicas abdominales que no hayan sido por completo efectivas.
Objetivo
Describir los elementos que componen el sistema Remeex femenino, sus indicaciones y la técnica quirúrgica mediante la que se implanta y ajusta adecuadamente.
Material y Método
Indicaciones
Las indicaciones para la utilización del sistema Remeex en incontinencia urinaria femenina son hipermobilidad uretral, uretra fija, disfunción esfinteriana primaria, fracaso de otras técnicas anti-incontinencia, incontinencia urinaria en hiperrrefiexia vesical (1,2).
Protocolo de estudio
El diagnóstico se realiza con una adecuada historia y exploración física y se completa con la realización de las siguientes pruebas complementarias: uretrocistografía y estudio urodinámico, ecografía urológica y opcionalmente uretrocistoscopia.
Previo a la intervención quirúrgica el paciente deberá ser informado sobre las características del procedimiento y el sistema a implantar, con sus ventajas y posibles inconvenientes, riesgos y alternativas a este sistema. Este consentimiento que inicialmente sera verbal, deberá ser firmado por el propio paciente.
Características de la prótesis Remeex
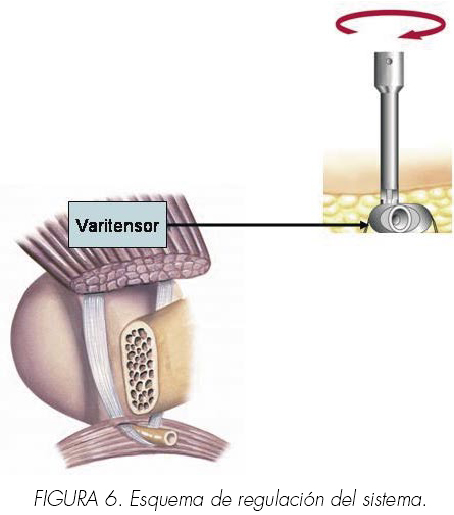
Este sistema esta compuesto por los siguientes elementos: malla, baritensor, introductor y desacoplador.
1. Malla
Fabricada de polipropileno monofilamento (3,5cm x 1,5cm) cuyos extremos finalizan en una sutura festoneada de prolene del Nº 1.
2. Baritensor
Sistema que se coloca a nivel suprapúbico, por encima de la aponeurosis de los rectos donde se fijan las suturas de los extremos de la malla. A modo de sistema de poleas permite administrar o restar tensión a la malla mediante el giro a favor o en contra del sentido de las agujas del reloj. Se deberá colocar inicialmente sin ninguna tensión, debiendo estar separado unos dos dedos del lecho creado sobre la aponeurosis de los rectos.
3. Introductor
Mecanismo que acoplado al baritensor permite el giro de la misma para aumentar o disminuir la tensión de la malla suburetral.
4. Desacoplador
Se trata de un diseño especial de destornillador que permite desacoplar el introductor del baritensor, una vez que se ha conseguido la tensión correcta de la malla.
Técnica
1. Anestesia
El procedimiento puede realizarse bajo anestesia raquídea o general.
2. Preparación y colocación de la paciente
Profilaxis antibiótica, higiene y aseptización del área hipogastrica y urogenital con povidona yodada, sondaje uretrovesical (Foley nº 14-16 Ch), colocación del paciente en posición adecuada (litotomia y moderado Trendelemburg) y colocación del campo quirúrgico.
3. Técnica quirúrgica paso a paso
- La colocación de un separador nos facilitará el abordaje quirúrgico.
1. Acceso Abdominal
- Incisión suprapúbica de 4-6 cm.
- Creación de un lecho supraaponeurotico, para alojar el baritensor.
- Hemostasia cuidadosa
2. Acceso vaginal
- Hidrodisección: inyección de suero fisiológico
- Incisión longitudinal a 1cm del meato uretral.
- Disección del plano vésico-vaginal
- Creación de un lecho que permita colocar la malla de polipropileno.
3. Acceso combinado abdomino-vaginal
- Maniobra de puncion mediante una aguja pasahilos de 20 cm en sentido abdominovaginal (Figura 1)
- Se repite la maniobra de punción en el lado contralateral
- Paso de los dos extremos de la malla a través del espacio parauretral, atravesando la fascia endopélvica, el espacio de Retzius y la aponeurosis del recto anterior hasta llegar al espacio subcutáneo suprapúbico (Figura 2).
- Fijación opcional de la malla con puntos sueltos de material reabsorbible a nivel parauretral (Figura 3).
- Enhebrado de los hilos en el sistema baritensor de la prótesis Remeex (Figura 4).
- Cierre de las incisiones vaginales y abdominales
- Taponamiento vaginal opcional, dependiendo del control de la hemostasia (que se mantendrá 12 horas)
4. Uretrocistoscopia
- Siempre realizamos una exploración endoscópica de la vejiga, para comprobar la integridad de la misma.
5. Ajuste de tensión y control postoperatorio
- Retirada de taponamiento vaginal.
- Regular el sistema de tensión a las 24 h y programar el alta hospitalaria.
- Llenamos la vejiga con 300 cc de suero fisiológico, retiramos la sonda y comprobamos el grado de incontinencia urinaria en decubito supino y en bipedestación.
- Ante el hallazgo de incontinencia rotaremos el manipulador en sentido horario, comprobando la continencia cada 4 vueltas completas. Cada giro completo del manipulador externo en sentido horario enrolla los hilos 1 mm el varitensor, elevando el cabestrillo (Figuras 5 y 6).
- Una vez que la paciente ha vaciado espontáneamente su vejiga procedemos a comprobar el residuo postmiccional, que debe ser inferior a 100 cc.
- A continuación se desconecta el manipulador utilizado en el desacoplador, rotamos un cuarto de vuelta y tiramos suavemente hasta su extracción.
Conclusiones
1. Es una técnica reproducible y el sistema es fácil de implantar.
2. Esta técnica evita la morbilidad de las técnicas abdominales.
3. Permite realizar.
4. Permite reajuste al cabo del tiempo con anestesia local a través de una pequeña incisión suprapúbica.
5. Se han descrito buenos resultados a corto y medio plazo.
Bibliografía y lecturas recomendadas (*lectura de interés y ** lectura fundamental)
*1. MORENO SIERRA, J.; MARQUES QUEIMADELOS; ARAÑO BELTRAN, P. y cols.: Registro español del sistema TRT Remeex en mujeres con incontinencia urinaria de esfuerzo. Arch.Esp. Urol., 59: 169, 2006. [ Links ]
*2. MORENO, J.; SILMI, A.; RESEL, L.: Clinicas Urológicas de la Complutense (8) 2000. Publicaciones UCM. 2000. [ Links ]
3. MARTÍN, A.; MEDINA, N.: Análisis of retropubic colpourethrosuspension results by suburethral sling with REMEEX prótesis. Eur. J. Obstet. Gynecol. Reprod. Biol., 106: 179, 2003. [ Links ]
*4. IGLESIAS, X.; ESPUNA, M.: Surgical treatment of urinary stress incontinence using a method for postoperative adjustment of sling tension (Remeex System). Int. Urogynecol. J. Pelvic Floor Dys funct., 14: 326, 2003. [ Links ]
5. MANTOVANI, F.; CASTENUOVO, C.: Re-MeEx device (external mechanical regulator) for incontinence: implantation and regulation procedure, complications and results at 3 years followup. Arch. Ital. Urol. Androl., 49, 2004. [ Links ]
6. CEREZUELA, J.; MEDINA, N.; MARTIN, A. y cols.: Analysis of the results of retropubic colposuspension using a suburethral readjustable sling (Remeex). Eur. J. Obst. Gynecol. Reprod. Biol.,106: 179, 2003. [ Links ]
7. ERRANDO, C.; PRADOS, M.; GAUSSSAL, L. y cols.: Treatment of stress urinary incontinence with Remeex Sling. Fundacio Puigvert. ICS, 345, 2003. [ Links ]
8. MARTIN MARTÍNEZ, N.; MEDINA RAMOS, J.F.; CEREZUELA REQUENA, J.A. y cols.: Análisis of retropubic colpourethrosuspension results by suburethral sling with REMEEX prosthesis. European Journal of Obstetrics & Gynecolory and Reproductive Biology, 106: 179,2003. [ Links ]
 Dirección para correspondencia:
Dirección para correspondencia:
Jesús Moreno Sierra
Servicio de Urología
Hospital Clínico Universitario San Carlos
C/Martín Lagos s/n
28034 Madrid.(España)
E-mail: dr_jmoreno@hotmail.com
Recibido: 24 de mayo 2006
^rND^sMORENO SIERRA^nJ^rND^sMARQUES QUEIMADELOS^rND^sARAÑO BELTRAN^nP^rND^sMARTÍN^nA^rND^sMEDINA^nN^rND^sIGLESIAS^nX^rND^sESPUNA^nM^rND^sMANTOVANI^nF^rND^sCASTENUOVO^nC^rND^sCEREZUELA^nJ^rND^sMEDINA^nN^rND^sMARTIN^nA^rND^sMARTIN MARTÍNEZ^nN^rND^sMEDINA RAMOS^nJ.F^rND^sCEREZUELA REQUENA^nJ.A^rND^1A01 A02^nRafael^sLuque Mialdea^rND^1A01^nRosa^sMartín-Crespo Izquierdo^rND^1A01^nLuis^sDíaz^rND^1A03^nAngustias^sFernández^rND^1A03^nDolores^sMorales^rND^1A04^nJesús^sCebrían^rND^1A01 A02^nRafael^sLuque Mialdea^rND^1A01^nRosa^sMartín-Crespo Izquierdo^rND^1A01^nLuis^sDíaz^rND^1A03^nAngustias^sFernández^rND^1A03^nDolores^sMorales^rND^1A04^nJesús^sCebrían^rND^1A01 A02^nRafael^sLuque Mialdea^rND^1A01^nRosa^sMartín-Crespo Izquierdo^rND^1A01^nLuis^sDíaz^rND^1A03^nAngustias^sFernández^rND^1A03^nDolores^sMorales^rND^1A04^nJesús^sCebrían
Biopsia renal por abordaje retroperitoneoscópico: Nuestra experiencia en 53 pacientes pediátricos
Renal biopsy through a retroperitoneoscopic approach: Our experience in 53 pediatric patients
Rafael Luque Mialdea1,2, Rosa Martín-Crespo Izquierdo1, Luis Díaz1,
Angustias Fernández3, Dolores Morales3 y Jesús Cebrían4
1Servicio de Cirugía Pediátrica Complejo Hospitalario de Toledo.
2Sección de Urología Pediátrica. Servicio Cirugía Pediátrica Hospital General Universitario Gregorio Marañón.
3Nefrología. Departamento Pediatría. Hospital General Universitario Gregorio Marañón.
4Sección de Anestesiología Pediátrica. Hospital General Universitario Gregorio Marañón. Madrid. España.
Dirección para correspondencia
RESUMEN
Objetivo: El abordaje retroperitoneoscópico posibilita una adecuada visualización de la fosa renal y de las estructuras retroperitoneales. Planteamos como objetivo la realización de biopsia renal por retroperitoneoscopia en aquellos Servicios de Cirugía Pediátrica en los que se realiza por cirugía convencional.
Métodos: Hemos realizado 53 biopsias renales por abordaje retroperitoneoscopico Se realizaron en 28 varones y 25 mujeres, de edades entre los 13 meses y 19 años ( rango medio de edad de 4 años). Los diagnósticos por los que sé biopsió fueron: Síndrome nefrótico (n=20); Síndrome hemolítico-urémico (n=3); Hematuria (n=15); Purpura idiopàtica (2 ); proteinuría (n=13), de estos pacientes, 10 estaban en insuficiencia renal. En todos los casos el abordaje retroperitoneoscópico se realizó según nuestra técnica.
Resultados: En todos los casos la exposición del riñón fue adecuada y la toma de biopsia concluyente con un diagnóstico anatomopatológico, realizándose pruebas de immunohistoquímica y estudio morfológico de la muestra. Se reconvirtió 1 caso por sangrado del lecho renal. En 51 casos el sangrado del procedimiento no alcanzó los 20 cc. No se precisó drenaje postoperatorio. La estancia media fue en los primeras 20 casos de 48 horas y en el resto de 24 a 36 horas.
Conclusiones: La biopsia renal retroperitoneoscópica es adecuada para la edad pediátrica siendo una alternativa real de la cirugía abierta y en las situaciones de contraindicación de la biopsia percutánea ecodirigida por: 1. Excelente exposición del riñón. 2. Adecuada cantidad de tejido renal para estudio. 3. Mínima morbilidad intra y postoperatoria. 4. Disminución de estancias hospitalarias con incorporación precoz a la vida cotidiana.
Palabras clave: Biopsia renal. Retroperitoneoscopia. Biopsia renal por abordaje retroperitoneoscopico. Edad pediátrica.
SUMMARY
Objectives: The retroperitoneoscopic approach enables adequate vision of the renal fossa and retroperitoneal structures. Our objective is to support the performance of renal biopsies through a retroperitoneoscopic approach in those pediatric surgery departments still doing open biopsies.
Methods: We performed 53 renal biopsies through a retroperitoneoscopic approach. Twenty-eight patients were males and 25 females, with ages between 13 months and 19 years (mean age range 4 years). The biopsies were indicated after the following diagnosis: nephrotic syndrome (n = 20), hemolytic-uremic syndrome (n = 3), hematuria (n = 15), idiopathic purpura (n = 2), proteinuria (n = 13). Ten patients were in renal failure. We performed our technique of retroperitoneoscopic approach in all cases.
Results: Adequate exposure of the kidney was achieved in all cases, and the biopsy sample gave a pathologic diagnosis after immunohistochemical and morphologic studies. One case was converted to open surgery due to bleeding from the kidney. In 51 cases the estimated blood loss was lower than 20 cc. No drainage was necessary after surgery. Mean hospital stay was 48 hours for the first 20 cases and between 24-36 hours for the remainder.
Conclusions: The Retroperitoneoscopic renal biopsy is an adequate procedure for the pediatric patients and represents a real alternative to open biopsy, and in cases of contraindication for ultrasound guided percutaneous biopsy, because: 1. It offers an excellent exposure of the kidney. 2. It obtains a kidney sample enough for the study. 3. The morbidity associated with the procedure is minimal. 4. Diminishes the hospital stay and shortens the time to return back to normal life.
Keywords: Renal biopsy. Retroperitoneoscopy. Retroperitoneoscopic approach renal biopsy. Children.
Introducción
La biopsia renal es un procedimiento necesario para el diagnóstico y pronóstico de patologías renales, con o sin insuficiencia renal. Desde la década de los 80, el método de elección es la biopsia renal percutánea ecodirigida en la edad pediátrica (1-7). Pero han descrito contraindicaciones, relativas y absolutas, para la biopsia renal percutánea ecodirigida (8-12), que necesita la realización de la biopsia por cirugía convencional: coagulopatías, discrasia sanguínea, riñón solitario (con la excepción de injerto renal), hipertensión arterial severa mal controlada, aneurisma de la arteria renal, riñón alto, obesidad, mala localización renal por ecografía, fallo de la punción percutánea ecodirigida y falta de colaboración del paciente. La cirugía convencional se realiza por incisión de lumbotomía clásica o modificada por minilumbotomía (13), dorsal o lateral, con la desventaja de que es un procedimiento invasivo con estancia prolongada en el hospital y un índice de complicaciones, locales y generales (14), que hacen poco atractivo su uso, como método diagnóstico. Exponemos nuestra experiencia en la realización de la biopsia renal mediante abordaje retroperitoneoscópico utilizando la técnica del balón de distensión para la disección retroperitoneal (8,15,16) como alternativa tanto para aquellos servicios que la realizan sistemáticcamente por cirugía convencional como en aquellos casos en los que la biopsia renal percutánea ecodirigida no esté indicada.
Material y Métodos
Desde el año de 1995 hemos realizado 53 biopsias renales por abordaje retroperitoneoscopico mediante técnica del balón de disección. Varones 28 y mujeres 25, con edad media de 4 años (rango de edad 13 meses y 19 años). En 10 pacientes con insuficiencia renal en grado variable. Los diagnósticos por los que se indicó realizar biopsia renal fueron: Síndrome nefrótico (n=20); Síndrome hemolítico-urémico (n=3); Hematuria (n=15), Purpura idiopàtica (n=2) y proteinuría (n=13).
El abordaje retroperitoneoscópico fue realizado con el paciente en posición de lumbotomía situado hacia posterior y bajo anestesia general. No drenaje vesical ni gástrico. El inicio del abordaje fue abierto con utilización de 3 trocares en 47 casos y 2 trocares en 6 casos.
La técnica habitual de nuestro abordaje retorperitoneoscópico consistió en incisión de 1 cm. a nivel del ángulo conformado por la 12º costilla y la masa lumbar, y posterior disección digital hasta la fascia de la Gerota, apertura de la misma y una vez palpado el polo renal inferior, se introdujo el balón de disección procediéndose a disecar el retroperitoneo mediante insuflación de 150 a 200 cc de aire, hasta obtener un adecuado espacio retroperitoneal.
Tras la retirada del balón de insuflación e introducción de trocar de Hasson se realizó retroneumoperitoneo, con presión media de 11 mm de Hg. Bajo visión directa se introdujeron el resto de trocares, por incisión de 5 mm, en disposición triangular con respecto al primer trocar. La toma de biopsia se obtuvo del polo renal inferior, generalmente del riñón derecho, mediante tijera realizando el corte y la electrocoagulación de la periferia de la corteza renal en el mismo acto y posteriormente electrocoagulación bipolar hemostática, tanto periférica como del lecho renal.
Tras hemostasia del lecho se retiran los trocares y cierran los puertos. En todos los casos se infiltró con bupivacaina 0.25% los puertos y se cerraron las heridas incisionales con aplicación de sutura o bien pegamento. No se dejaron drenajes.
Resultados
En los 53 casos la exposición del riñón fue adecuada y la toma de biopsia concluyente con un diagnóstico anatomopatológico en el 100% de los casos, realizándose estudio histológico, immunohistoquímica y estudio por microscopia electrónica. En ningún caso la electrocoagulación de la periferia de la muestra de la biopsia impidió o alteró el resultado diagnóstico. El tiempo medio quirúrgico fue de 45 minutos (30-90 min.). En toda nuestra serie tuvimos complicación de sangrado en 2 pacientes.
En 1 paciente precisó conversión (1.3%), su causa fue por sangrado del lecho renal, aunque la toma ya se había extraído, en este caso fue necesario realizar una minilumbotomía, por ampliación de unos de los puertos de entrada de 1 cm.
En el otro caso, una vez finalizada la cirugía presenta hematoma de un puerto incisional que precisó revisión en quirófano.
En el resto de los 51 casos, el sangrado del procedimiento no alcanzó los 20 cc. No se precisó drenaje postoperatorio, destacando la ausencia de sangrado del lecho renal. En nuestra serie no hubo complicaciones en el postoperatorio inmediato (locales – infección de puertos, hematomas, hernia- ni generales - hematuria macroscópica, complicaciones respiratorias-), ni tardío. No hubo descenso del hematocrito relevante en toda nuestra serie, y ningún paciente requirió transfusión sanguínea. La estancia media fue en los primeras 20 casos de 48 horas y en el resto ha sido de 24 a 36 horas.
Destacamos la ausencia de complicaciones postoperatorias generales, siendo los controles ecográficos posteriores normales.
Discusión
Los estudios histopatológicos mantienen su estándar para el diagnóstico de enfermedad renal con o sin insuficiencia renal. La biopsia renal ecodirigida se establece como método de elección, aún en la edad pediátrica, con analgesia local o sedación-analgesia, desde la década de los 80 (1-7). La existencia de contraindicación absoluta o relativa del procedimiento en pacientes de alto riesgo (8-12), precisa de la cirugía convencional como método diagnóstico alternativo.
En nuestra experiencia, que hasta 1995 la biopsia renal la realizábamos sistemáticamente por cirugía convencional, el abordaje retroperitoneoscópico (8,15) nos ofreció una clara alternativa, fundamentalmente en aquellos pacientes de alto riesgo para la biopsia renal percutánea ecodirigida.(figura 1).
En todos nuestros pacientes, la cantidad de tejido renal obtenida mediante disección con corte y electrocoagulación de tijera, fue optimo para el 100% de diagnósticos histopatológicos, sin que la electrocoagulación alterara el resultado de la misma. La realización del abordaje retroperitoneoscopio (figura 1)para la realización de nefrectomía (17), nos ofreció un método alternativo de la cirugía abierta para la biopsia renal, nuestra metodología a diferencia de otros autores la realizamos siempre mediante tijera y tres trocares, habiéndose descrito la realización de la misma con tres (8,15), dos (8,10-12) y un único trocar (18), con pinzas de fórceps para biopsia.
En nuestra serie, tuvimos una morbilidad intraoperatoria del 1.3% por sangrado, que conllevó a su conversión y un 1.3% de hematoma postcirugía que se debió a sangrado de la pared del 2º puerto y necesitó reexploración quirúrgica. En ambos casos no hubo repercusión en el hematocrito ni en la estancia hospitalaria postoperatoria.
Destacamos que no hemos tenido complicaciones postoperatorias secundarias al procedimiento biopsico, a diferencia de las descritas tanto en cirugía convencional (8) como en realizados por punción percutánea ecodirigida (19-23): hematoma renal o perirenal, hematuria macroscópica, infección de herida, íleo intestinal, neumotorax y atelectasia, nefrectomía, fístula arteriovenosa renal. El abordaje retroperitoneoscópico ofrece todas las ventajas inherentes de éste tipo de procedimiento con respecto a la cirugía abierta (Tabla I), y además nos ha ofrecido una visión renal general del retroperitoneo con visión directa de la zona de la biopsia, así como las características macroscópicas renales y en nuestra experiencia, como en la de otros autores (8-12,16,18), ofrece la misma eficacia para la obtención de tejido renal que la cirugía abierta, convencional o modificada, pero siendo menos invasivo el procedimiento.
Nuestra conclusión es que desde que el abordaje retroperitoneoscópico fue utilizado para la realización de biopsia renal en la edad pediátrica (8), podemos decir que es un método de abordaje adecuado para sustituir la cirugía abierta en pacientes en los que la biopsia renal percutánea ecodirigida esté contraindicada, o bien en aquellos servicios en los que se realiza de forma sistemática por cirugía abierta. El abordaje retroperitoneoscópico consigue una excelente exposición del riñón, adecuada cantidad de tejido renal para estudio anatomopatológico y una baja tasa de morbilidad por complicaciones intra o postoperatorias, ausencia de pérdida de riñón secundaria al procedimiento y disminución con respecto a la cirugía convencional de estancia hospitalaria, siendo similar a la estancia en los casos de biopsia percutánea ecodirigida.
Bibliografía y lecturas recomendadas (*lectura de interés y ** lectura fundamental)
*1. CHAN, J.C.; BREWER, W.H.; STILL, W.J.: Renal biopsies under ultrasound guidance: 100 consecutive biopsies in childrens Ural. 129: 103,1983. [ Links ]
2. BACHMANN, H.; HECKEMANN, R.; OLBING, H.: Percutaneous renal biopsy in children under guidance of ultrasonic real time technique. Int. J. Pediatr. Nephrol., 5: 175, 1984. [ Links ]
*3. NADEL, L.; BAUMGARTNER, B.R.; BERNARDINO, M.E.: Percutaneous renal biopsies: accuracy, safety, and indications. Urol. Radiol.,8: 67, 1986. [ Links ]
4. FENEBERG, R.; SCHAEFER, F.; ZIEGER, B. y cols.: Percutaneous renal biopsy in children: a 27-year experience. Nephron, 79: 438, 1998. [ Links ]
5. SAHNEY, S.; MOHAN, G.C.: Renal biopsy in infants and children. Am. J. Kidney Dis., 23: 31,1994. [ Links ]
6. WEBB, N.J.; PEREIRA, J.K.; CHAIT, P.G. y cols.: Renal biopsy in children: comparison of two techniques. Pediatr. Nephrol., 8: 486, 1994. [ Links ]
**7. BOHLIN, A.B.; EDSTROM, S.; ALMGREN, B. y cols.: Renal biopsy in children: indications, technique and efficacy in 119 consecutive cases. Pediatr. Nephrol., 9: 201, 1995. [ Links ]
**8. GAUR, D.R.; AGARWAL, M.V.; KHOCHIKAR, V.y cols.: Laparoscopic renal biopsy via retroperitoneal approach. 151: 925, 1994. [ Links ]
*9. SHETYE, K.R.; KAVOUSSI, L.R.; RAMAKUMAR, S. y cols.: Laparoscopic renal biopsy: a 9-year experience. BJU International, 817, 2003. [ Links ]
*10. CAIONE, P.; MICALI, S.; RINALDI, S. y cols.: Retroperitoneal laparoscopy for renal biopsy in children. J. Urol., 164: 1080, 2000. [ Links ]
*11. GIMENEZ, L.F.; MICALI, S.; CHEN, R.N. y cols.: Laparoscopic renal biopsy. Kidney Int., 54: 525, 1998. [ Links ]
12. MUKHTAR, Z.; STEINBRECHER, H.; GILBERT, R.D.; y cols.: Laparoscopic renal biopsy in obese children. Pediatr. Nephrol., 20: 495, 2005. [ Links ]
*13. THOMAS, J.H.; PIERCE, G.E.; HERMRECK, A.S.: Open renal biopsy. Surgical technique and results. Am. Surg., 49: 400, 1983. [ Links ]
14. ALMKUIST, R.; BUKALEW, V.M. Jr.: Techniques of renal biopsy. Urol. Clin. N. Amer., 6:503, 1979. [ Links ]
15. LUQUE MIALDEA, R.; MARTIN-CRESPO, R.; BARRIENTOS, G. y cols.: Indications from the laparoscopic approach in pediatric urological surgery:our experience in 49 patients. Actas Urol.Esp., 23: 483, 1999. [ Links ]
**16. LUQUE MIALDEA, R.; MARTIN-CRESPO, R.: Laparoscopia en Urología Pediátrica. Arch. Esp. Urol., 55: 737, 2002. [ Links ]
17. LUQUE MIALDEA, R.; MARTIN-CRESPO, R.; NAVASCUES DEL RIO, J.A. y cols.: Nefrectomia laproscópica retroperitoneal en la infancia. Act. Urol. Esp., 21: 637, 1997. [ Links ]
18. MARTINO, A.; ZAMPARELLI, M.; COBELLIS, G. y cols.: One-trocar surgery: a less invasive videosurgical approach in childhood. J. Pediatr. Surg., 36: 811, 2001. [ Links ]
**19. DE MEDINA MORALES, F.; VIDAL CASTRO, M.A.; MOTA HERNANDEZ, F.: Technic and complications of percutaneous renal biopsy. Bol. Med. Hosp. Infant. Mex., 35: 397, 1978. [ Links ]
20. PFISTER, R.C.; NEWHOUSE, J.H.; YODER, I.C. y cols.: Complications of pediatric percutaneous renal procedures: incidence and observations. Urol. Clin. North Am., 10: 563, 1983. [ Links ]
21. KAMITSUJI, H.; YOSHIOKA, K.; ITO, H.: Percutaneous renal biopsy in children: survey of pediatric nephrologists in Japan. Pediatr. Nephrol., 13: 693, 1999. [ Links ]
22. BOGDANOVIC, R.; OGNJENOVIC, M.; CVORIC, A. y cols.: Percutaneous biopsy of the kidney in children: indications, results, and complications. Srp. Arh. Celok. Lek., 118: 243, 1990. [ Links ]
23. GRAU, J.H.; GONICK, P.; WILSON, A.: Postbiopsy intrarenal arteriovenous fistula. J. Urol.,122: 233, 1979. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
R. Luque Mialdea
Servicio de Cirugía Pediátrica
Complejo Hospitalario de Toledo
Avd Barber, 40
45005 Toledo. (España)
E-mail: rluque@sescam.jccm.es
Recibido: 19 de junio 2006
^rND^sCHAN^nJ.C^rND^sBREWER^nW.H^rND^sSTILL^nW.J^rND^sBACHMANN^nH^rND^sHECKEMANN^nR^rND^sOLBING^nH^rND^sNADEL^nL^rND^sBAUMGARTNER^nB.R^rND^sBERNARDINO^nM.E^rND^sFENEBERG^nR^rND^sSCHAEFER^nF^rND^sZIEGER^nB^rND^sSAHNEY^nS^rND^sMOHAN^nG.C^rND^sWEBB^nN.J^rND^sPEREIRA^nJ.K^rND^sCHAIT^nP.G^rND^sBOHLIN^nA.B^rND^sEDSTROM^nS^rND^sALMGREN^nB^rND^sGAUR^nD.R^rND^sAGARWAL^nM.V^rND^sKHOCHIKAR^nV^rND^sSHETYE^nK.R^rND^sKAVOUSSI^nL.R^rND^sRAMAKUMAR^nS^rND^sCAIONE^nP^rND^sMICALI^nS^rND^sRINALDI^nS^rND^sGIMENEZ^nL.F^rND^sMICALI^nS^rND^sCHEN^nR.N^rND^sMUKHTAR^nZ^rND^sSTEINBRECHER^nH^rND^sGILBERT^nR.D^rND^sTHOMAS^nJ.H^rND^sPIERCE^nG.E^rND^sHERMRECK^nA.S^rND^sALMKUIST^nR^rND^sBUKALEW^nV.M. Jr^rND^sLUQUE MIALDEA^nR^rND^sMARTIN-CRESPO^nR^rND^sBARRIENTOS^nG^rND^sLUQUE MIALDEA^nR^rND^sMARTIN-CRESPO^nR^rND^sLUQUE MIALDEA^nR^rND^sMARTIN-CRESPO^nR^rND^sNAVASCUES DEL RIO^nJ.A^rND^sMARTINO^nA^rND^sZAMPARELLI^nM^rND^sCOBELLIS^nG^rND^sDE MEDINA MORALES^nF^rND^sVIDAL CASTRO^nM.A^rND^sMOTA HERNANDEZ^nF^rND^sPFISTER^nR.C^rND^sNEWHOUSE^nJ.H^rND^sYODER^nI.C^rND^sKAMITSUJI^nH^rND^sYOSHIOKA^nK^rND^sITO^nH^rND^sBOGDANOVIC^nR^rND^sOGNJENOVIC^nM^rND^sCVORIC^nA^rND^sGRAU^nJ.H^rND^sGONICK^nP^rND^sWILSON^nA^rND^1A01 A02^nPablo^sPizzi^rND^1A02 A03^nOctavio^sCastillo^rND^1A01 A02^nDavid^sCarvajal^rND^1A03^nGonzalo^sVitagliano^rND^1A01 A02^nFernando^sHidalgo^rND^1A01 A02^nPablo^sPizzi^rND^1A02 A03^nOctavio^sCastillo^rND^1A01 A02^nDavid^sCarvajal^rND^1A03^nGonzalo^sVitagliano^rND^1A01 A02^nFernando^sHidalgo^rND^1A01 A02^nPablo^sPizzi^rND^1A02 A03^nOctavio^sCastillo^rND^1A01 A02^nDavid^sCarvajal^rND^1A03^nGonzalo^sVitagliano^rND^1A01 A02^nFernando^sHidalgoENDOUROLOGÍA, ESWL Y LAPAROSCOPIA
Diverticulectomía vesical laparoscópica transperitoneal
Transperitoneal laparoscopic bladder diverticulectomy
Pablo Pizzi1,2, Octavio Castillo2,3, David Carvajal1,2,
Gonzalo Vitagliano3 y Fernando Hidalgo1,2
1Servicio de Urología, Hospital del Salvador, Santiago.
2Departamento de Urología, Facultad de Medicina, Universidad de Chile.
3Unidad de Endourología y Laparoscopía Urológica, Clínica Santa María. Santiago. Chile.
Dirección para correspondencia
RESUMEN
Objetivo: Reportar el primer caso de la diverticulectomía vesical laparoscópica en un paciente femenino.
Métodos: Paciente de sexo femenino, de 74 años de edad, con antecedentes de infección recurrente del tracto urinario bajo de aproximadamente 2 años de evolución y diagnóstico de gran divertículo vesical. Se efectuó una diverticulectomía vesical laparoscópica.,
Resultados: El tiempo operatorio fue de 90 minutos. La paciente evolucionó en forma satisfactoria, retirándose el drenaje al tercer día postoperatorio y siendo dada de alta ese mismo día con sonda uretrovesical. Se retira la sonda al 7° día postoperatorio. El control cistográ.co muestra ausencia del divertículo y vejiga normal.
Conclusiones: Consideramos que la cirugía laparoscópica del divertículo vesical es una alternativa absolutamente comparable a los procedimientos clásicos, y que debe ser considerada como una opción en el manejo de los divertículos vesicales que requieren resolución quirúrgica.
Palabras clave: Divertículo vesical. Laparoscopía.
SUMMARY
Objectives: To report the first case of bladder diverticulectomy in a female patient.
Methods: 74-year-old female patient with a two-year history of recurrent lower urinary tract infection and the diagnosis of big bladder diverticulum. A laparoscopic bladder diverticulectomy was performed.
Results: Operative time was 90 minutes. The patient had a satisfactory outcome with the drainage being retrieved on postoperative day three and discharged home the same day with bladder catheter. The catheter was retrieved on postoperative day 7. Cystography showed a normal bladder without diverticulum.
Conclusions: We considered that laparoscopic surgery of the bladder diverticulum is an alternative, completely comparable to classic surgery, and it should be considered an option in the management of bladder diverticula requiring surgery.
Keywords: Bladder diverticulum. Laparoscopy.
Introducción
En la actualidad, las técnicas de cirugía laparoscópica son ampliamente usadas para la resolución de variadas patologías urológicas. Ya sea por vía transperitoneal como extraperitoneal esta técnica permite el tratamiento de patología oncológica y benigna. El tratamiento quirúrgico de los divertículos vesicales puede realizarse tanto por vía abierta, como por vía endoscópica o laparoscópica (1). Son solo 6 los casos reportados en la literatura y según nuestro conocimiento hasta la fecha, no se ha reportado el uso de ésta técnica en la mujer.
Caso Clínico
Paciente de sexo femenino, de 74 años de edad, con antecedentes de infección recurrente del tracto urinario bajo de aproximadamente 2 años de evolución. Se le realiza ecografía renal y pelviana, cistografía y cistoscopia encontrándose resultados compatibles con divertículo vesical gigante de aproximadamente 600 cc. de capacidad, con cuello diverticular de 1.7 cm, ubicado en posición supratrigonal en pared posterolateral derecha, sin evidencias de litiasis o tumor urotelial en el interior del divertículo (Figuras 1 y 2). Se comprueba la ausencia de anomalías del tracto urinario alto.
Se informa a la paciente acerca de las alternativas terapéuticas decidiéndose la realización de diverticulectomía vesical por vía laparoscópica transperitoneal.
Técnica operatoria: Bajo anestesia general y profilaxis antibiótica con cefalosporina de segunda generación, se coloca a la paciente en decúbito dorsal y posición de litotomía. Utilizando aguja de Veress umbilical se obtiene neumoperitoneo hasta 14 mm Hg. Introducción de óptica de 0º mediante la cual se realiza laparoscopia sin hallazgos de importancia. Se colocan tres trócares, uno de 10 mm en fosa iliaca derecha, otro de 5 mm en fosa iliaca izquierda y finalmente uno de 5 mm suprapúbico (Figura 3). Se realiza simultáneamente cistoscopia con cistoscopio rígido 17 F con irrigación con suero fisiológico para facilitar la identificación del divertículo. Identificada la cavidad diverticular se procede a su disección y liberación completa por vía laparoscópica, seccionando y separando el peritoneo con hemostasia de pequeños vasos perivesicales hasta llegar al cuello del divertículo, el que se identi.ca mediante transiluminación del cistoscopio. Se secciona el cuello del divertículo, teniendo cuidado de evitar el escape del neumoperitoneo a través de la vejiga al comunicar el divertículo con la cavidad peritoneal. Se realiza disección de la pared diverticular, separándola de divertículo vesical (DV) y el cuello diverticular. la vejiga hasta lograr su resección completa. Se procede al cierre del cuello diverticular mediante cistorrafia en 1 plano a través de puntos separados intracorpóreos con sutura de poliglactina (vicryl®) 2-0 en aguja CT-1. Se comprueba impermeabilidad de la sutura mediante llene de ésta con 350 cc de suero fisiológico, instalando sonda Foley 18F. Finalmente se extrae el divertículo a través de trocar de 10 mm. Se coloca drenaje aspirativo tipo Redon® en lecho operatorio, el que se extrae a través de trocar de 5 mm suprapúbico. Se realiza sutura de puntos de inserción de trocares con cierre aponeurótico en trocares de 10 mm.
El tiempo operatorio fue de 90 minutos. La paciente evolucionó en forma satisfactoria, retirándose el drenaje al tercer día postoperatorio y siendo dada de alta ese mismo día con sonda uretrovesical. Se retira la sonda al 7° día postoperatorio. El control cistográfico muestra ausencia del divertículo y vejiga normal (Figura 4).
Discusión
La definición de divertículo vesical corresponde a la protrusión de la mucosa a través de un defecto de la musculatura del detrusor. De acuerdo a su origen, los divertículos vesicales se clasifican en congénitos y adquiridos.
Divertículos congénitos: se describen los divertículos del uraco, producidos por la obliteración incompleta del canal alantoideo, y los divertículos de Hutch, cuya presentación corresponde a una saculación paraureteral producto de una deficiencia muscular de la inserción del uréter en el trígono (1,2).
Divertículos adquiridos: en general los divertículos vesicales adquiridos son la consecuencia de una obstrucción del tracto urinario bajo o la presencia de una vejiga neurogénica, existiendo habitualmente una hipertro.a reactiva del detrusor que forma trabéculas musculares separadas por zonas de debilidad con aspecto de celdas, siendo a través de éstas por donde se hernia la mucosa vesical formando el divertículo (1). Existen divertículos adquiridos relacionados con el síndrome de Ehlers – Danlos que se presentan en niños (2), sin embargo la mayoría de los divertículos vesicales adquiridos se presentan en el hombre adulto secundarios habitualmente a la presencia de uropatía obstructiva baja. En estos casos el tratamiento del divertículo debe estar asociado al tratamiento de la patología obstructiva de base en forma previa o simultánea, y el tipo de tratamiento debe ser individualizado de acuerdo a la naturaleza y severidad de la obstrucción.
La mayoría de los divertículos vesicales son pequeños y asintomáticos y corresponden a hallazgos dentro del estudio de la vía urinaria por diferentes patologías, no requiriendo tratamiento específico del divertículo. Las indicaciones de resolución quirúrgica incluyen el hallazgo de grandes divertículos, la presencia de complicaciones del vaciamiento incompleto que incluyen la formación de cálculos (5-16%) e infecciones recurrentes del tracto urinario (13-73%), ruptura espontánea, retención urinaria, hidroureteronefrosis tanto por reflujo vesicoureteral como por obstrucción ureteral, y el desarrollo de carcinoma de células transicionales (0,8-10%) (3-5). Este último presenta habitualmente un mal pronóstico (58% sobrevida a 2 años) debido al alto grado y a la facilidad de penetración en la delgada pared sin soporte muscular del divertículo (6,7).
El primer reporte de un divertículo vesical fue hecho en 1614 en la autopsia de un hombre que habría presentado un divertículo con una capacidad 6 veces mayor a la de la vejiga (8). Desde la primera descripción de la diverticulectomía vesical por Czerny en 1897 se han desarrollado numerosos procedimientos quirúrgicos para la corrección de esta patología (8). Las técnicas empleadas para el tratamiento de los divertículos han estado orientadas a restituir el drenaje adecuado de la cavidad diverticular o a la ablación completa de ésta e incluyen:
a) Diverticulectomía abierta extra o transvesical (8).
b) Resección endoscópica del cuello del divertículo, asociada o no a fulguración de la mucosa diverticular con el objeto de producir su retracción (9).
c) Diverticulectomía vesical laparoscópica transperitoneal o extraperitoneal (10-15).
La primera descripción de la técnica de diverticulectomía vesical por vía laparoscópica fue hecha por Parra en Septiembre de 1992, realizándola en un hombre de 87 años portador de un divertículo vesical asociado a infección del tracto urinario recurrente, con un tiempo operatorio de 290 minutos mediante acceso transperitoneal y con el uso de sutura automática (11). Prácticamente en forma inmediata, en Diciembre de 1992, Das publica la realización de una diverticulectomía por vía laparoscópica transperitoneal, en este caso con cistorráfia mediante sutura intracorpórea en un paciente de 72 años con infección urinaria recurrente y portador de múltiples divertículos, el mayor de ellos de 11 x 8 cm, con un tiempo operatorio de 165 minutos (12). En Marzo de 1995 Nadler describe el primer caso de cirugía laparoscopica extraperitoneal de un divertículo vesical con el uso combinado de sutura mecánica y puntos intracorpóreos para la cistorráfia, con un tiempo operatorio de 380 minutos para la diverticulectomía más 80 minutos adicionales para realizar una incisión transuretral de próstata debido a uropatía obstructiva baja asociada (10). Desde esa fecha se han publicado reportes aislados de casos clínicos o muy pequeñas series retrospectivas de diverticulectomía laparoscópica, probablemente debido a lo inhabitual del procedimiento. No hemos encontrado reportes de diverticulectomía laparoscópica en una mujer en la literatura internacional. Algunos autores describen ciertos procedimientos para optimizar el resultado de la cirugía por vía laparoscópica,
a) identificación del divertículo mediante transiluminación a través de cistoscopia rígida o flexible.
b) colocación por vía endoscópica de sondas tipo Foley, Councill y/o Tiemann, las que se inflan en el interior de la cavidad diverticular y/o vesical para facilitar su identi.cación y disección permitiendo el aislamiento y llene de ambas cavidades por separado.
c) uso de catéteres ureterales para la correcta ubicación del uréter y disminución del riesgo de lesión de éste en aquellos divertículos cercanos al trayecto ureteral.
d) uso de ultrasonografía intraoperatoria (10-15).
Existe controversia respecto al tipo de abordaje para la cirugía laparoscópica del divertículo. Si bien la vía extraperitoneal reproduce la técnica abierta habitual, evitando la manipulación de estructuras intraperitoneales y confinando las eventuales complicaciones al espacio de Retzius, presenta desventajas como el pequeño espacio operatorio que genera dificultad en la disección y la realización de nudos intracorpóreos, y el evidente problema para el acceso en los divertículos situados en la cara posterior de la vejiga. La elección de la vía de acceso debe tomar en cuenta la ubicación y tamaño del divertículo, así como la experiencia del cirujano respecto a los diferentes abordajes.
Algunos autores opinan que la cirugía laparoscópica del divertículo vesical si bien es posible, no es aconsejable debido a los largos tiempos quirúrgicos descritos (1). Creemos que esta idea está fundamentada en series antiguas y que los tiempos quirúrgicos son absolutamente comparables a los de cirugía abierta si la técnica es realizada por cirujanos abierta si la técnica es realizada por cirujanos experimentados y con una adecuada selección de los casos, tal como lo demuestra este reporte.
Conclusión
Consideramos que la cirugía laparoscópica del divertículo vesical es una alternativa absolutamente comparable a los procedimientos clásicos, y que debe ser considerada como una opción en el manejo de los divertículos vesicales que requieren resolución quirúrgica.
Bibliografía y lecturas recomendadas (*lectura de interés y **lectura fundamental)
1. LINKE, C.; MONGIAT-ARTUS, P.: Management of vesical diverticula. Ann. Urol. (Paris), 38: 103, 2004. [ Links ]
2. PIERETTI, R.V.; PIERETTI-VANMARCKE, R.V.:Congenital bladder diverticula in children. J. Pediatr. Surg., 34: 468, 1999. [ Links ]
3. BLACKLOCK, A.R.; GEDDES, J.R.; SHAW, R.E.:The treatment of large bladder diverticula. Br. J. Urol., 55:17, 1983. [ Links ]
**4. GEPI-ATTEE, S.; FENELEY, R.C.: Bladder diverticulectomy revisited: case reports of retention of urine caused by diverticula and discussion. J. Urol., 152:954, 1994. [ Links ]
5. LIVNE, P.M.; GONZALES, E.T. Jr.: Congenital bladder diverticula causing ureteral obstruction. Urology, 25: 273, 1985. [ Links ]
6. PACE, A.M.; POWELL, C.: Congenital Vesical Diverticulum in a 38-year-old Female. Int. Urol. Nephrol., 37: 473, 2005. [ Links ]
**7. DAS, S.; AMAR, A.D.: Vesical diverticulum associated with bladder carcinoma: therapeutic implications. J. Urol., 136: 1013, 1986. [ Links ]
8. GRONLUND, A.; LENDORF, A.; LAURITZEN, A.F. y cols.: Bladder diverticulectomy: operative technique. Scand. J. Urol. Nephrol., 32: 98, 1998. [ Links ]
9. CLAYMAN, R.V.; SHAHIN, S.; REDDY, P. y cols.: Transurethral treatment of bladder diverticula. Alternative to open diverticulectomy. Urology, 23: 573, 1984. [ Links ]
*10. NADLER, R.B.; PEARLE, M.S.; McDOUGALL, E.M. y cols.: Laparoscopic extraperitoneal bladder diverticulectomy: initial experience. Urology, 45: 524, 1995. [ Links ]
11. PARRA, R.O.; JONES, J.P.; ANDRUS, C.H. y cols.: Laparoscopic diverticulectomy: preliminary report of a new approach for the treatment of bladder diverticulum. J. Urol., 148: 869, 1992. [ Links ]
12. DAS, S.: Laparoscopic removal of bladder diverticulum. J. Urol., 148: 1837, 1992. [ Links ]
13. KHONSARI, S.; LEE, D.I.; BASILLOTE, J.B. y cols.: Intraoperative catheter management during laparoscopic excision of a giant bladder diverticulum. J. Laparoendosc. Adv. Surg. Tech., 14: 47, 2004. [ Links ]
14. PORPIGLIA, F.; TERRONE, C.; COSSU, M. y cols.: Real time ultrasound in laparoscopic bladder diverticulectomy. Int. J. Urol., 12: 933, 2005. [ Links ]
*15. PORPIGLIA, F.; TARABUZZI, R.; COSSU, M. y cols.: Sequential transurethral resection of the prostate and laparoscopic bladder diverticulectomy: comparison with open surgery. Urology, 60: 1045, 2002. [ Links ]
 Dirección para correspondencia:
Dirección para correspondencia:
Octavio Castillo
Av. Santa María 0500
Providencia. Santiago. (Chile)
E-mail: octaviocastillo@vtr.net
Recibido: 18 de mayo 2006
^rND^sLINKE^nC^rND^sMONGIAT-ARTUS^nP^rND^sPIERETTI^nR.V^rND^sPIERETTI-VANMARCKE^nR.V^rND^sBLACKLOCK^nA.R^rND^sGEDDES^nJ.R^rND^sSHAW^nR.E^rND^sGEPI-ATTEE^nS^rND^sFENELEY^nR.C^rND^sLIVNE^nP.M^rND^sGONZALES^nE.T. Jr^rND^sPACE^nA.M^rND^sPOWELL^nC^rND^sDAS^nS^rND^sAMAR^nA.D^rND^sGRONLUND^nA^rND^sLENDORF^nA^rND^sLAURITZEN^nA.F^rND^sCLAYMAN^nR.V^rND^sSHAHIN^nS^rND^sREDDY^nP^rND^sNADLER^nR.B^rND^sPEARLE^nM.S^rND^sMcDOUGALL^nE.M^rND^sPARRA^nR.O^rND^sJONES^nJ.P^rND^sANDRUS^nC.H^rND^sDAS^nS^rND^sKHONSARI^nS^rND^sLEE^nD.I^rND^sBASILLOTE^nJ.B^rND^sPORPIGLIA^nF^rND^sTERRONE^nC^rND^sCOSSU^nM^rND^sPORPIGLIA^nF^rND^sTARABUZZI^nR^rND^sCOSSU^nM^rND^1A01^nJosé Luis^sRosales Leal^rND^1A01^nFrancisco^sRodríguez Herrera^rND^1A01^nManuel^sOrtiz Gorráiz^rND^1A01^nBeatriz^sHonrubia Vílchez^rND^1A01^nAntonio^sFernández Sánchez^rND^1A01^nFernando^sVázquez Alonso^rND^1A01^nManrique^sPascual Geler^rND^1A01^nAntonio^sMartínez Morcillo^rND^1A01^nJavier^sVicente Prados^rND^1A01^nJosé Manuel^sCózar Olmo^rND^1A01^nEduardo^sEspejo Maldonado^rND^1A01^nMiguel^sTallada Buñuel^rND^1A01^nJosé Luis^sRosales Leal^rND^1A01^nFrancisco^sRodríguez Herrera^rND^1A01^nManuel^sOrtiz Gorráiz^rND^1A01^nBeatriz^sHonrubia Vílchez^rND^1A01^nAntonio^sFernández Sánchez^rND^1A01^nFernando^sVázquez Alonso^rND^1A01^nManrique^sPascual Geler^rND^1A01^nAntonio^sMartínez Morcillo^rND^1A01^nJavier^sVicente Prados^rND^1A01^nJosé Manuel^sCózar Olmo^rND^1A01^nEduardo^sEspejo Maldonado^rND^1A01^nMiguel^sTallada Buñuel^rND^1A01^nJosé Luis^sRosales Leal^rND^1A01^nFrancisco^sRodríguez Herrera^rND^1A01^nManuel^sOrtiz Gorráiz^rND^1A01^nBeatriz^sHonrubia Vílchez^rND^1A01^nAntonio^sFernández Sánchez^rND^1A01^nFernando^sVázquez Alonso^rND^1A01^nManrique^sPascual Geler^rND^1A01^nAntonio^sMartínez Morcillo^rND^1A01^nJavier^sVicente Prados^rND^1A01^nJosé Manuel^sCózar Olmo^rND^1A01^nEduardo^sEspejo Maldonado^rND^1A01^nMiguel^sTallada Buñuel
Metástasis suprarrenal metacrónica en 2 pacientes sometidos a nefrectomía radical por carcinoma de células renales primario
Metachronous adrenal metastasis in two patients undergoing radical nephrectomy for primary renal cell carcinoma
José Luis Rosales Leal, Francisco Rodríguez Herrera, Manuel Ortiz Gorráiz,
Beatriz Honrubia Vílchez, Antonio Fernández Sánchez, Fernando Vázquez Alonso,
Manrique Pascual Geler, Antonio Martínez Morcillo, Javier Vicente Prados,
José Manuel Cózar Olmo, Eduardo Espejo Maldonado y Miguel Tallada Buñuel
Servio de Urología. Hospital Universitario Virgen de las Nieves. Granada. España.
Dirección para correspondencia
RESUMEN
Objetivos/Métodos: Presentamos dos casos excepcionales de metástasis suprarrenales metacrónicas de carcinoma de células renales y revisamos la literatura existente. Valorados distintos aspectos como la frecuencia, etiopatogenia, diagnóstico y seguimiento de estos pacientes concluimos que estas metástasis son poco frecuentes y suelen presentarse tardías en su evolución en pacientes con CCR con bajo estadios anatomo-patológicos.
Resultados/Conclusiones: Revisado el tratamiento y constatando que no hay directrices en cuanto al manejo terapéutico de estos pacientes con metástasis proponemos la cirugía de la metástasis suprarrenal así como el tratamiento adyuvante con inmunoterapia.
Palabras clave: Carcinoma de células renales. Glándula suprarrenal. Metástasis.
SUMMARY
Objectives: We report two exceptional cases of metachronous adrenal metastasis of renal cell carcinomas and perform a bibliographic review. After the evaluation of various features such as frequency, etiopathogenesis, diagnosis and follow-up of these patients we conclude that these metastases are rare, and they usually appear late in the evolution of patients with low stage renal cell carcinoma.
Results/Conclusions: Once reviewed the treatment and checked the absence of guidelines for the therapeutic management of these patients we propose surgery for the adrenal metastasis as well as adjuvant treatment with immunotherapy.
Key words: Renal cell carcinoma. Adrenal gland. Metastasis.
Introducción
En la actualidad, la mayoría de los tumores renales se diagnostican en fases precoces de la enfermedad, como masas incidentales o tumores de bajo estadio. Sin embargo, las metástasis pueden aparecer en el momento del diagnóstico (sincrónicas) o pueden ocurrir a lo largo de muchos años de seguimiento (metacrónicas), en diversas e inesperadas localizaciones. La mayoría de las metástasis de carcinoma de células renales (CCR) se localizan en pulmón, hígado, hueso y ganglios linfáticos. La afectación suprarrenal (SR) maligna metacrónica es excepcional. Presentamos dos casos de metástasis SR y revisamos la literatura.
Casos Clínicos
Caso 1
Mujer de 67 años, con antecedentes personales de HTA, TBC pulmonar con paquipleuritis residual, hipotiroidismo primario en tratamiento sustitutivo, suprarrenalectomía izquierda en 1992 por síndrome de Cushing, intervenida de cataratas y polipectomía colónica. Se diagnosticó incidentalmente de cáncer renal mediante estudio ecográfico y TAC y fue sometida a nefrectomía radical derecha en 1997. El diagnóstico anatomo-patológico fue compatible con adenocarcinoma renal de células claras, grado nuclear 2 de Furhman, en polo inferior, de 6 cm de diámetro (pT1bN0M0).
Ha sido revisada cada seis meses durante los 3 primeros años, y posteriormente cada año, mediante analítica, Rx de tórax y pruebas de imagen (TAC abdomino-pélvico y ecografía abdominal), según protocolo. Presentó una masa SR (Figura 1) en el seguimiento a los 95 meses, por lo que fue valorada por Servicio de Endocrinología que descartó funcionalidad. El estudio de extensión fue negativo. Se realizó una suprarrenalectomía derecha por vía abierta con informe anatomo-patológico de metástasis metacrónica de CCR, con patrón de células claras. Comenzó con tratamiento corticoideo sustitutivo.
Inició inmunoterapia adyuvante con Interleuquina 2 + interferón alfa según protocolo del Servicio (Tabla I A), que suspendió durante el primer ciclo por deterioro de la función renal. A los 3 meses de la intervención se evidenció la presencia de metástasis pulmonares múltiples de pequeño tamaño, mediante TAC torácico. Constatada la enfermedad metastásica pulmonar se reinició inmunoterapia al 50% bajo el esquema terapéutico según protocolo en pacientes metastáticos (Tabla I B) precisando doblar las dosis de corticoides en todos los ciclos. A los 8 meses de seguimiento desde el diagnóstico y tratamiento de la masa SR permanece estable clínicamente, con estabilización de sus metástasis pulmonares.
Caso 2
Varón de 53 años, con antecedentes personales de HTA, obesidad mórbida, TEP, TVP, timoma estadio II Masaoka, tratado en 1992 mediante timectomía y radioterapia adyuvante (45Gy) en remisión. Presentó dolor en fosa renal izquierda diagnosticándose de cáncer renal mediante estudio de ECO y TAC. Fue sometido a nefrectomía radical y suprarrenalectomía izquierdas en 1999 con diagnóstico anatomo-patológico de adenocarcinoma renal de células mixtas (claras y granulares), grado nuclear 2 de Furhman, de polo superior, de 8 cm. de diámetro (pT2N0M0).
Ha seguido el mismo protocolo de revisión. Se sometió a suprarrenalectomía derecha por presentar metástasis SR metacrónica derecha a los 70 meses de seguimiento (Figura 2), con informe anatomopatológico para metástasis de CCR con patrón mixto (células claras y mixtas). Considerado como enfermo de alto riesgo con posible evolución metastásica, ha inició protocolo de inmunoterapia adyuvante (Tabla I A) con buena tolerancia tras el primer ciclo.
A los 9 meses de seguimiento permanece estable clínicamente, presentando en TAC torácico de control engrosamiento pleural de aspecto nodular, situado en la región postero-basal derecha, pudiendo corresponder a metástasis, recomendándose punción aspiración con aguja fina para su filiación.
Por otra parte también se ha identificado una adenopatía latero-cervical izquierda de unos 2 cm clínica y ecográfica, pendiente de su exéresis y estudio anatomopatológico, ya que la PAAF realizada no fue diagnóstica.
Discusión
El CCR representa el 3% de las enfermedades malignas del adulto. Ocupa el tercer lugar en las neoplasias urológicas, por detrás del cáncer de próstata y vesical. En Estados Unidos la tasa de incidencia ajustada por edad de este proceso para hombres blancos, mujeres blancas y para negros es de 9,6, 11,1 y 4,9 por 100.000 habitantes-año respectivamente (1). En Europa la incidencia estimada en 2004 es de 3,89 y 2,26 por 100.000 habitantes-año para hombres y mujeres (2). Dependiendo de las series, aproximadamente el 60 y el 70% de los pacientes presentan enfermedad localizada o localmente avanzada potencialmente curable con tratamiento quirúrgico (3). Sin embargo, las tasas de recurrencia son elevadas (35–65%) para pacientes con tumores localmente agresivos, dependiendo del estadio patológico, grado nuclear de Furhman y ECOG-PS (4). El resto de los pacientes presentan metástasis múltiples a distancia, siendo las más frecuentes en pulmón, ganglios linfáticos, hígado o hueso (5). El comportamiento del CCR es impredecible, hasta el 50% de los pacientes sometidos a una nefrectomía radical inicialmente curativa, desarrollará enfermedad metastásica metacrónica durante su evolución en el tiempo, por lo que precisan seguimientos a largo plazo (6).
La afectación metastásica SR del CCR es poco frecuente (7). De hecho, la presencia de signos y síntomas clínicos de insu.ciencia adrenal son poco prevalentes. La frecuencia de afectación SR metastásica como hallazgo anatomopatológico en series de autopsias en pacientes con CCR se ha situado entre 10 y el 19% (10,9). La metástasis SR suele ser más frecuente en la glándula ipsilateral. Saitoh (8), en más de 400 casos, encontró un 17% de afectación ipsilateral y un 11% de afectación contralateral, con afectación exclusiva de la glándula SR contralateral del 2,5%. En una serie de 610 pacientes observaron una incidencia de afectación SR ipsilateral sincrónica del 3.4% (21/610) y contralateral del 1.1% (7/610), de las que sólo 4 fueron metacrónicas (0.6%) (9). En otra revisión publicada la frecuencia de metástasis metacrónica fue del 1,4% (5/350) (10).
La afectación suprarrenal ipsilateral puede ocurrir por diseminación hematógena de células aisladas o por trombosis tumoral a través de la vena renal, vena adrenal, venas colaterales de la grasa perinéfrica y periféricas de la glándula adrenal. La extensión directa a través de la cápsula renal puede ocurrir en tumores de gran tamaño o de polo superior. Aunque las metástasis contralaterales son menos frecuentes que la afectación suprarrenal ipsilateral, se ha sugerido que la glándula adrenal constituye un medio ambiente favorable para el desarrollo de metástasis del CCR en la diseminación hematógena (11).
En una cohorte retrospectiva de pacientes intervenidos de CCR en nuestro centro se diagnosticaron 5 casos con metástasis SR. Entre 1988 y 2005 se intervinieron 238 pacientes diagnosticados de CCR. La edad media (mediana, rango) de los pacientes intervenidos fue de 60,4 años (62, 18-89). Presentaron metástasis en diversas localizaciones en el control evolutivo el 11,7% (28/238), con un seguimiento medio (desviación típica, rango) de 36,5 meses (33,8; 3-139). Se realizó nefrectomía radical con suprarrenalectomía en el 31,9% (76/238) con afectación SR en un 3,9% (3/76) de los pacientes (1 bilateral, 1 ipsilateral, 1 contralateral). Se han descrito dos casos de metástasis SR metacrónicas que constituyen el 0,8% del total de la serie (2/238), similar a la serie de Von Knobloch (9).
Se han comunicado diagnósticos de metástasis SR metacrónicas hasta 23 años después de una nefrectomía (12). Este desfase cronológico se puede explicar debido a que algunas metástasis pueden ser de muy bajo crecimiento, sobretodo si son de bajo grado, y por fallo en el uso de estudios de imagen de rutina en algunos casos (13).
Las metástasis SR suelen ser anatómicamente y funcionalmente silentes. Se desconoce el sustrato biológico que determina la afectación contralateral aislada.
Respecto al tratamiento primario del CCR, ha sido controvertido a lo largo de los años la necesidad o no de adrenalectomía ipsilateral simultánea con la nefrectomía. Diversos estudios han concluido que este procedimiento no conlleva asociado una mejoría del pronóstico de la enfermedad salvo en determinadas circunstancias (14 - 16). Se han establecido como factores de riesgo de afectación suprarrenal estadios tumorales elevados, localización en polo superior, multifocalidad, trombosis de la vena renal así como sospecha de afectación mediante imagen por TAC (valor predictivo negativo del 99,4%) (16, 17). En nuestra serie de 238 pacientes intervenidos por CCR en el periodo 1988-2005, se indicó nefrectomía radical con suprarrenalectomía ipsilateral por afectación del hemirriñón superior en el 31,9% (76/238), con 3 casos de afectación SR, que constituyó un 3,9% (3/76). En la Tabla II se correlaciona el estadio tumoral anatomopatológico con la afectación SR.
Debido al reducido número de pacientes con este tipo de metástasis a largo plazo hace difícil llegar a conclusiones sobre su pronóstico y manejo. La supervivencia de los pacientes con enfermedad metastásica avanzada sin tratamiento tienen un pronóstico pobre, pero éste difiere en aquellos pacientes con lesiones solitarias en las que es posible su extirpación quirúrgica completa, consiguiendo una supervivencia prolongada con tasas del 23 al 35% a los 5 años. (9,10,18). El pronóstico es más favorable en aquellos pacientes diagnosticados con un intervalo de tiempo mayor desde la nefrectomía (19). Laul y cols. (13) revisaron 56 casos de metástasis SR contralaterales publicados hasta el 2001, en los que se realizó adrenalectomía como tratamiento. 24 lesiones fueron sincrónicas y 32 metacrónicas. El rango de edad fue de 43 a 82 años, el mayor tiempo comunicado de aparición de la metástasis SR después de la nefrectomía fue de 23 años, con un seguimiento de 0,3 a 14,3 años 27 permanecían sin evidencias de enfermedad y 17 pacientes murieron por CCR metastático. Actualmente se considera la vía laparoscópica como vía de abordaje inicial en el tratamiento quirúrgico de la afectación SR (20). Aunque empíricamente los pacientes sometidos a tratamiento quirúrgico de la metástasis del CCR podrían beneficiarse de tratamiento adyuvante inmunoterápico, no existen estudios que aborden esta cuestión (21,22,25).
Nosotros consideramos a este grupo pacientes de riesgo para el desarrollo de enfermedad metastásica, como ha sucedido en estos dos casos aislados. Así que proponemos la realización de tratamiento quirúrgico citorreductor (exéresis de la metástasis única cuando sea factible), asociado a pautas de inmunoterapia adyuvante, aunque en la literatura científica no se haya concluido hasta la fecha el esquema terapéutico más eficaz.
Por otra parte, los diversos esquemas quimioterápicos o radioterapicos empleados no han permitido controlar la enfermedad localmente avanzada o diseminada. Hasta este momento, para la enfermedad metastásica se han desarrollado múltiples regimenes de inmunoterapia basados en el uso del interferón alfa y la interleuquina 2, en monoterapia o en asociaciones siendo el Interferon α el que aporta mayores resultados en la literatura.
En la actualidad se están desarrollando ensayos clínicos fase III que tratan de evaluar el uso sinérgico de la IL-2 asociado a Interferon α, que han conseguido tasas de respuesta (remisión parcial o completa) entre el 15 y el 25%. Por otra parte se han identificado factores pronósticos para predecir el beneficio del tratamiento con citoquinas, y ayudar al medico a seleccionar a los pacientes. Estos factores incluyen la anemia, elevacion de la LDH, elevación del calcio, ausencia del tratamiento quirúrgico previo, un bajo Karnofsky/ECOG performal status, numero, tamaño y localización de las metástasis.
Estudios recientes han examinado la eficacia de agentes antiangiogénicos, como el bevacizumab, un inhibidor del factor de crecimiento endotelial vascular (VEGF), así como otra serie de fármacos con diferentes mecanismos de acción basados en el desarrollo del conocimiento molecular en la patogénesis de esta enfermedad, de cuya utilidad podrá disponerse en breve (23-26).
En conclusión, podemos decir que las metástasis SR de CCR metacrónicas son poco frecuentes y suelen presentarse tardías en su evolución en pacientes con CCR con bajo estadios anatomo-patológicos. Se desconocen los mecanismos de escape tumoral a tan largo plazo para el desarrollo de enfermedad metastásica. No disponemos de series amplias previas que establezcan directrices en cuanto al manejo terapéutico adecuado de estos pacientes con metástasis SR. En casos seleccionados de lesiones únicas pueden ser subsidiarias de exéresis quirúrgica. Aunque no hay evidencias científicas que apoyen el tratamiento adyuvante con inmunoterapia en CCR localmente avanzado no metastático en los ensayos clínicos publicados, todavía no se han realizado este tipo de estudios de adyuvancia en pacientes con metástasis única tratados con cirugía.
Consideramos a este tipo de pacientes de alto riesgo para el desarrollo de enfermedad metastásica múltiple, por lo que recomendaríamos tratamiento empírico adyuvante con inmunoterapia (IL2 + INFa). Creemos necesario el desarrollo de ensayos clínicos que demuestren su beneficio.
Bibliografía y lecturas recomendadas (*lectura de interés y ** lectura fundamental) ^rND^1A01^nJosé Luis^sRosales Leal^rND^1A01^nFrancisco^sRodríguez Herrera^rND^1A01^nManuel^sOrtiz Gorráiz^rND^1A01^nBeatriz^sHonrubia Vílchez^rND^1A01^nAntonio^sFernández Sánchez^rND^1A01^nFernando^sVázquez Alonso^rND^1A01^nManrique^sPascual Geler^rND^1A01^nAntonio^sMartínez Morcillo^rND^1A01^nJavier^sVicente Prados^rND^1A01^nJosé Manuel^sCózar Olmo^rND^1A01^nEduardo^sEspejo Maldonado^rND^1A01^nMiguel^sTallada Buñuel^rND^1A01^nJosé Luis^sRosales Leal^rND^1A01^nFrancisco^sRodríguez Herrera^rND^1A01^nManuel^sOrtiz Gorráiz^rND^1A01^nBeatriz^sHonrubia Vílchez^rND^1A01^nAntonio^sFernández Sánchez^rND^1A01^nFernando^sVázquez Alonso^rND^1A01^nManrique^sPascual Geler^rND^1A01^nAntonio^sMartínez Morcillo^rND^1A01^nJavier^sVicente Prados^rND^1A01^nJosé Manuel^sCózar Olmo^rND^1A01^nEduardo^sEspejo Maldonado^rND^1A01^nMiguel^sTallada Buñuel^rND^1A01^nJosé Luis^sRosales Leal^rND^1A01^nFrancisco^sRodríguez Herrera^rND^1A01^nManuel^sOrtiz Gorráiz^rND^1A01^nBeatriz^sHonrubia Vílchez^rND^1A01^nAntonio^sFernández Sánchez^rND^1A01^nFernando^sVázquez Alonso^rND^1A01^nManrique^sPascual Geler^rND^1A01^nAntonio^sMartínez Morcillo^rND^1A01^nJavier^sVicente Prados^rND^1A01^nJosé Manuel^sCózar Olmo^rND^1A01^nEduardo^sEspejo Maldonado^rND^1A01^nMiguel^sTallada Buñuel
Metástasis suprarrenal metacrónica en 2 pacientes sometidos a nefrectomía radical por carcinoma de células renales primario
Metachronous adrenal metastasis in two patients undergoing radical nephrectomy for primary renal cell carcinoma
José Luis Rosales Leal, Francisco Rodríguez Herrera, Manuel Ortiz Gorráiz,
Beatriz Honrubia Vílchez, Antonio Fernández Sánchez, Fernando Vázquez Alonso,
Manrique Pascual Geler, Antonio Martínez Morcillo, Javier Vicente Prados,
José Manuel Cózar Olmo, Eduardo Espejo Maldonado y Miguel Tallada Buñuel
Servio de Urología. Hospital Universitario Virgen de las Nieves. Granada. España.
Dirección para correspondencia
RESUMEN
Objetivos/Métodos: Presentamos dos casos excepcionales de metástasis suprarrenales metacrónicas de carcinoma de células renales y revisamos la literatura existente. Valorados distintos aspectos como la frecuencia, etiopatogenia, diagnóstico y seguimiento de estos pacientes concluimos que estas metástasis son poco frecuentes y suelen presentarse tardías en su evolución en pacientes con CCR con bajo estadios anatomo-patológicos.
Resultados/Conclusiones: Revisado el tratamiento y constatando que no hay directrices en cuanto al manejo terapéutico de estos pacientes con metástasis proponemos la cirugía de la metástasis suprarrenal así como el tratamiento adyuvante con inmunoterapia.
Palabras clave: Carcinoma de células renales. Glándula suprarrenal. Metástasis.
SUMMARY
Objectives: We report two exceptional cases of metachronous adrenal metastasis of renal cell carcinomas and perform a bibliographic review. After the evaluation of various features such as frequency, etiopathogenesis, diagnosis and follow-up of these patients we conclude that these metastases are rare, and they usually appear late in the evolution of patients with low stage renal cell carcinoma.
Results/Conclusions: Once reviewed the treatment and checked the absence of guidelines for the therapeutic management of these patients we propose surgery for the adrenal metastasis as well as adjuvant treatment with immunotherapy.
Key words: Renal cell carcinoma. Adrenal gland. Metastasis.
Introducción
En la actualidad, la mayoría de los tumores renales se diagnostican en fases precoces de la enfermedad, como masas incidentales o tumores de bajo estadio. Sin embargo, las metástasis pueden aparecer en el momento del diagnóstico (sincrónicas) o pueden ocurrir a lo largo de muchos años de seguimiento (metacrónicas), en diversas e inesperadas localizaciones. La mayoría de las metástasis de carcinoma de células renales (CCR) se localizan en pulmón, hígado, hueso y ganglios linfáticos. La afectación suprarrenal (SR) maligna metacrónica es excepcional. Presentamos dos casos de metástasis SR y revisamos la literatura.
Casos Clínicos
Caso 1
Mujer de 67 años, con antecedentes personales de HTA, TBC pulmonar con paquipleuritis residual, hipotiroidismo primario en tratamiento sustitutivo, suprarrenalectomía izquierda en 1992 por síndrome de Cushing, intervenida de cataratas y polipectomía colónica. Se diagnosticó incidentalmente de cáncer renal mediante estudio ecográfico y TAC y fue sometida a nefrectomía radical derecha en 1997. El diagnóstico anatomo-patológico fue compatible con adenocarcinoma renal de células claras, grado nuclear 2 de Furhman, en polo inferior, de 6 cm de diámetro (pT1bN0M0).
Ha sido revisada cada seis meses durante los 3 primeros años, y posteriormente cada año, mediante analítica, Rx de tórax y pruebas de imagen (TAC abdomino-pélvico y ecografía abdominal), según protocolo. Presentó una masa SR (Figura 1) en el seguimiento a los 95 meses, por lo que fue valorada por Servicio de Endocrinología que descartó funcionalidad. El estudio de extensión fue negativo. Se realizó una suprarrenalectomía derecha por vía abierta con informe anatomo-patológico de metástasis metacrónica de CCR, con patrón de células claras. Comenzó con tratamiento corticoideo sustitutivo.
Inició inmunoterapia adyuvante con Interleuquina 2 + interferón alfa según protocolo del Servicio (Tabla I A), que suspendió durante el primer ciclo por deterioro de la función renal. A los 3 meses de la intervención se evidenció la presencia de metástasis pulmonares múltiples de pequeño tamaño, mediante TAC torácico. Constatada la enfermedad metastásica pulmonar se reinició inmunoterapia al 50% bajo el esquema terapéutico según protocolo en pacientes metastáticos (Tabla I B) precisando doblar las dosis de corticoides en todos los ciclos. A los 8 meses de seguimiento desde el diagnóstico y tratamiento de la masa SR permanece estable clínicamente, con estabilización de sus metástasis pulmonares.
Caso 2
Varón de 53 años, con antecedentes personales de HTA, obesidad mórbida, TEP, TVP, timoma estadio II Masaoka, tratado en 1992 mediante timectomía y radioterapia adyuvante (45Gy) en remisión. Presentó dolor en fosa renal izquierda diagnosticándose de cáncer renal mediante estudio de ECO y TAC. Fue sometido a nefrectomía radical y suprarrenalectomía izquierdas en 1999 con diagnóstico anatomo-patológico de adenocarcinoma renal de células mixtas (claras y granulares), grado nuclear 2 de Furhman, de polo superior, de 8 cm. de diámetro (pT2N0M0).
Ha seguido el mismo protocolo de revisión. Se sometió a suprarrenalectomía derecha por presentar metástasis SR metacrónica derecha a los 70 meses de seguimiento (Figura 2), con informe anatomopatológico para metástasis de CCR con patrón mixto (células claras y mixtas). Considerado como enfermo de alto riesgo con posible evolución metastásica, ha inició protocolo de inmunoterapia adyuvante (Tabla I A) con buena tolerancia tras el primer ciclo.
A los 9 meses de seguimiento permanece estable clínicamente, presentando en TAC torácico de control engrosamiento pleural de aspecto nodular, situado en la región postero-basal derecha, pudiendo corresponder a metástasis, recomendándose punción aspiración con aguja fina para su filiación.
Por otra parte también se ha identificado una adenopatía latero-cervical izquierda de unos 2 cm clínica y ecográfica, pendiente de su exéresis y estudio anatomopatológico, ya que la PAAF realizada no fue diagnóstica.
Discusión
El CCR representa el 3% de las enfermedades malignas del adulto. Ocupa el tercer lugar en las neoplasias urológicas, por detrás del cáncer de próstata y vesical. En Estados Unidos la tasa de incidencia ajustada por edad de este proceso para hombres blancos, mujeres blancas y para negros es de 9,6, 11,1 y 4,9 por 100.000 habitantes-año respectivamente (1). En Europa la incidencia estimada en 2004 es de 3,89 y 2,26 por 100.000 habitantes-año para hombres y mujeres (2). Dependiendo de las series, aproximadamente el 60 y el 70% de los pacientes presentan enfermedad localizada o localmente avanzada potencialmente curable con tratamiento quirúrgico (3). Sin embargo, las tasas de recurrencia son elevadas (35–65%) para pacientes con tumores localmente agresivos, dependiendo del estadio patológico, grado nuclear de Furhman y ECOG-PS (4). El resto de los pacientes presentan metástasis múltiples a distancia, siendo las más frecuentes en pulmón, ganglios linfáticos, hígado o hueso (5). El comportamiento del CCR es impredecible, hasta el 50% de los pacientes sometidos a una nefrectomía radical inicialmente curativa, desarrollará enfermedad metastásica metacrónica durante su evolución en el tiempo, por lo que precisan seguimientos a largo plazo (6).
La afectación metastásica SR del CCR es poco frecuente (7). De hecho, la presencia de signos y síntomas clínicos de insu.ciencia adrenal son poco prevalentes. La frecuencia de afectación SR metastásica como hallazgo anatomopatológico en series de autopsias en pacientes con CCR se ha situado entre 10 y el 19% (10,9). La metástasis SR suele ser más frecuente en la glándula ipsilateral. Saitoh (8), en más de 400 casos, encontró un 17% de afectación ipsilateral y un 11% de afectación contralateral, con afectación exclusiva de la glándula SR contralateral del 2,5%. En una serie de 610 pacientes observaron una incidencia de afectación SR ipsilateral sincrónica del 3.4% (21/610) y contralateral del 1.1% (7/610), de las que sólo 4 fueron metacrónicas (0.6%) (9). En otra revisión publicada la frecuencia de metástasis metacrónica fue del 1,4% (5/350) (10).
La afectación suprarrenal ipsilateral puede ocurrir por diseminación hematógena de células aisladas o por trombosis tumoral a través de la vena renal, vena adrenal, venas colaterales de la grasa perinéfrica y periféricas de la glándula adrenal. La extensión directa a través de la cápsula renal puede ocurrir en tumores de gran tamaño o de polo superior. Aunque las metástasis contralaterales son menos frecuentes que la afectación suprarrenal ipsilateral, se ha sugerido que la glándula adrenal constituye un medio ambiente favorable para el desarrollo de metástasis del CCR en la diseminación hematógena (11).
En una cohorte retrospectiva de pacientes intervenidos de CCR en nuestro centro se diagnosticaron 5 casos con metástasis SR. Entre 1988 y 2005 se intervinieron 238 pacientes diagnosticados de CCR. La edad media (mediana, rango) de los pacientes intervenidos fue de 60,4 años (62, 18-89). Presentaron metástasis en diversas localizaciones en el control evolutivo el 11,7% (28/238), con un seguimiento medio (desviación típica, rango) de 36,5 meses (33,8; 3-139). Se realizó nefrectomía radical con suprarrenalectomía en el 31,9% (76/238) con afectación SR en un 3,9% (3/76) de los pacientes (1 bilateral, 1 ipsilateral, 1 contralateral). Se han descrito dos casos de metástasis SR metacrónicas que constituyen el 0,8% del total de la serie (2/238), similar a la serie de Von Knobloch (9).
Se han comunicado diagnósticos de metástasis SR metacrónicas hasta 23 años después de una nefrectomía (12). Este desfase cronológico se puede explicar debido a que algunas metástasis pueden ser de muy bajo crecimiento, sobretodo si son de bajo grado, y por fallo en el uso de estudios de imagen de rutina en algunos casos (13).
Las metástasis SR suelen ser anatómicamente y funcionalmente silentes. Se desconoce el sustrato biológico que determina la afectación contralateral aislada.
Respecto al tratamiento primario del CCR, ha sido controvertido a lo largo de los años la necesidad o no de adrenalectomía ipsilateral simultánea con la nefrectomía. Diversos estudios han concluido que este procedimiento no conlleva asociado una mejoría del pronóstico de la enfermedad salvo en determinadas circunstancias (14 - 16). Se han establecido como factores de riesgo de afectación suprarrenal estadios tumorales elevados, localización en polo superior, multifocalidad, trombosis de la vena renal así como sospecha de afectación mediante imagen por TAC (valor predictivo negativo del 99,4%) (16, 17). En nuestra serie de 238 pacientes intervenidos por CCR en el periodo 1988-2005, se indicó nefrectomía radical con suprarrenalectomía ipsilateral por afectación del hemirriñón superior en el 31,9% (76/238), con 3 casos de afectación SR, que constituyó un 3,9% (3/76). En la Tabla II se correlaciona el estadio tumoral anatomopatológico con la afectación SR.
Debido al reducido número de pacientes con este tipo de metástasis a largo plazo hace difícil llegar a conclusiones sobre su pronóstico y manejo. La supervivencia de los pacientes con enfermedad metastásica avanzada sin tratamiento tienen un pronóstico pobre, pero éste difiere en aquellos pacientes con lesiones solitarias en las que es posible su extirpación quirúrgica completa, consiguiendo una supervivencia prolongada con tasas del 23 al 35% a los 5 años. (9,10,18). El pronóstico es más favorable en aquellos pacientes diagnosticados con un intervalo de tiempo mayor desde la nefrectomía (19). Laul y cols. (13) revisaron 56 casos de metástasis SR contralaterales publicados hasta el 2001, en los que se realizó adrenalectomía como tratamiento. 24 lesiones fueron sincrónicas y 32 metacrónicas. El rango de edad fue de 43 a 82 años, el mayor tiempo comunicado de aparición de la metástasis SR después de la nefrectomía fue de 23 años, con un seguimiento de 0,3 a 14,3 años 27 permanecían sin evidencias de enfermedad y 17 pacientes murieron por CCR metastático. Actualmente se considera la vía laparoscópica como vía de abordaje inicial en el tratamiento quirúrgico de la afectación SR (20). Aunque empíricamente los pacientes sometidos a tratamiento quirúrgico de la metástasis del CCR podrían beneficiarse de tratamiento adyuvante inmunoterápico, no existen estudios que aborden esta cuestión (21,22,25).
Nosotros consideramos a este grupo pacientes de riesgo para el desarrollo de enfermedad metastásica, como ha sucedido en estos dos casos aislados. Así que proponemos la realización de tratamiento quirúrgico citorreductor (exéresis de la metástasis única cuando sea factible), asociado a pautas de inmunoterapia adyuvante, aunque en la literatura científica no se haya concluido hasta la fecha el esquema terapéutico más eficaz.
Por otra parte, los diversos esquemas quimioterápicos o radioterapicos empleados no han permitido controlar la enfermedad localmente avanzada o diseminada. Hasta este momento, para la enfermedad metastásica se han desarrollado múltiples regimenes de inmunoterapia basados en el uso del interferón alfa y la interleuquina 2, en monoterapia o en asociaciones siendo el Interferon α el que aporta mayores resultados en la literatura.
En la actualidad se están desarrollando ensayos clínicos fase III que tratan de evaluar el uso sinérgico de la IL-2 asociado a Interferon α, que han conseguido tasas de respuesta (remisión parcial o completa) entre el 15 y el 25%. Por otra parte se han identificado factores pronósticos para predecir el beneficio del tratamiento con citoquinas, y ayudar al medico a seleccionar a los pacientes. Estos factores incluyen la anemia, elevacion de la LDH, elevación del calcio, ausencia del tratamiento quirúrgico previo, un bajo Karnofsky/ECOG performal status, numero, tamaño y localización de las metástasis.
Estudios recientes han examinado la eficacia de agentes antiangiogénicos, como el bevacizumab, un inhibidor del factor de crecimiento endotelial vascular (VEGF), así como otra serie de fármacos con diferentes mecanismos de acción basados en el desarrollo del conocimiento molecular en la patogénesis de esta enfermedad, de cuya utilidad podrá disponerse en breve (23-26).
En conclusión, podemos decir que las metástasis SR de CCR metacrónicas son poco frecuentes y suelen presentarse tardías en su evolución en pacientes con CCR con bajo estadios anatomo-patológicos. Se desconocen los mecanismos de escape tumoral a tan largo plazo para el desarrollo de enfermedad metastásica. No disponemos de series amplias previas que establezcan directrices en cuanto al manejo terapéutico adecuado de estos pacientes con metástasis SR. En casos seleccionados de lesiones únicas pueden ser subsidiarias de exéresis quirúrgica. Aunque no hay evidencias científicas que apoyen el tratamiento adyuvante con inmunoterapia en CCR localmente avanzado no metastático en los ensayos clínicos publicados, todavía no se han realizado este tipo de estudios de adyuvancia en pacientes con metástasis única tratados con cirugía.
Consideramos a este tipo de pacientes de alto riesgo para el desarrollo de enfermedad metastásica múltiple, por lo que recomendaríamos tratamiento empírico adyuvante con inmunoterapia (IL2 + INFa). Creemos necesario el desarrollo de ensayos clínicos que demuestren su beneficio.
Bibliografía y lecturas recomendadas (*lectura de interés y ** lectura fundamental)
1. CHOW, W.H.; DEVESA, S.S.; WARREN, J.L. y cols.: Rising incidence of renal cell cancer in the United States. JAMA, 281: 1628, 1999. [ Links ]
2. BOYLE, P.; FERLAY, J.: Cancer incidence and mortality in Europe, 2004. Ann. Oncol., 16: 481, 2005. [ Links ]
*3. ORTIZ GORRAIZ, M.; VICENTE PRADOS, F.J.; ROSALES LEAL, J.L. y cols.: Valoración de los factores pronósticos de la supervivencia en una serie de 202 pacientes intervenidos por carcinoma de células renales. Actas Urol. Esp., 29:179, 2005. [ Links ]
**4. LAM, J.S.; LEPPERT, J.T.; BELLDEGRUN, A,.S. y cols.: Adjuvant therapy of renal cell carcinoma: patient selection and therapeutic options. BJU Int., 96: 483, 2005. [ Links ]
5. KOZLOWSKI, J.M.: Management of distant solitary recurrence in the patient with renal cancer: contralateral kidney and other sites. Urol. Clin.North Am., 21: 601, 1994. [ Links ]
6. SANCHEZ ZALABARDO, D.; AROCENA GGARCIA-TAPIA, J.; REGOJO BALBOA, J.M. y cols.: Factores pronóstico en carcinoma renal pT3. Actas Urol. Esp., 27: 26, 2003. [ Links ]
*7. CRUZ GUERRA, N.A.; LINARES QUEVEDO, A.; CLEMENTE RAMOS, L. y cols.: Metástasis adrenal metacronica solitaria contralateral de un carcinoma renal primario: aportación de un nuevo caso. Arch. Esp. Urol., 54: 825, 2001. [ Links ]
8. SAITOH, H.; NAKAYAMA, M.; NAKAMURA, K. y cols.: Distant metastasis of adenocarcinoma in nephrectomized cases. J. Urol., 127: 1092,1982. [ Links ]
9. VON KNOBLOCH; HEGELE, A.; KÄLBLE, T. y cols.: Management of contralateral adrenal metastasis from renal cell carcinoma: possibility of inferior vena cava tumour thrombus. Scand. J. Urol. Nephrol., 34: 109, 2000. [ Links ]
**10. KESSLER, O.J.; MUKAMEL, E.; WEINSTEIN, R. y cols.: Metachronous renal cell carcinoma metastasis to the contralateral adrenal gland. Urology, 51: 539, 1998. [ Links ]
11. SAGALOWSKY, A.I.; MOLBERG, K.: Solitary metastasis of renal cell carcinoma to the contralateral adrenal gland 22 years after nephrectomy. Urology, 54: 162, 1999. [ Links ]
12. MESOROLLE, B.; MIGNON, F.; TRAVAGLI, J.P. y cols.: Late presentation of solitary contralateral adrenal metastasis of renal cell carcinoma. Eur. Radiol., 7: 557, 1997. [ Links ]
*13. LAU, W.K.; ZINCKE, H.; LOHSE, C.M. y cols.: Contralateral adrenal metastasis of renal cell carcinoma: treatment, outcome, and review. BJU Int., 91: 775, 2003. [ Links ]
*14. YOKOYAMA, H.; TANAKA, M.: Incidence of adrenal involvement and assessing adrenal function in patients with renal cell carcinoma: is ipsilateral adrenalectomy indispensable during radical nephrectomy?. BJU Int., 95: 526, 2005. [ Links ]
15. PAUL, R.; MORDHORST, J.; LEYH, H. y cols.: Incidence and outcome of patients with adrenal metastases of renal cell cancer. Urology, 57: 878, 2001. [ Links ]
16. TSUI, K.H.; SHVARTS, O.; BARBARIC, Z. y cols.: Is adrenalectomy a necessary component of radical nephrectomy? UCLA experience with 511 radical nephrectomies. J. Urol., 163: 437,2000. [ Links ]
17. MOUDOUNI, S.M.; EN-NIA, I.; PATARD, J.J. y cols.: Real indications for adrenalectomy in renal cell carcinoma. Scand. J. Urol. Nephrol., 36:273, 2002. [ Links ]
**18. SENGUPTA, S.; LEIBOVICH, B.C.; BLUTE, M.L. y cols.: Surgery for metastatic renal cell cancer. World J. Urol., 23: 155, 2005. [ Links ]
19. DRUCKER, B.J.: Renal cell carcinoma: current status and future prospects. Cancer Treat. Rev., 31: 536, 2005. [ Links ]
20. ELASHRY, O.M.; CLAYMAN, R.V.; SOBLE, J.J. y cols.: Laparoscopic adrenalectomy for solitary metachronous contralateral adrenal metastasis from renal cell carcinoma. J. Urol., 157:1217, 1997. [ Links ]
21. JEON, S.H.; CHANG, S.G.; KIM, J.I.: The role of adjuvant immunotherapy after radical nephrectomy and prognostic factors in pT3N0M0 renal cell carcinoma. Anticancer Res., 19: 5593,1999. [ Links ]
*22. LAM, J.S.; LEPPERT, J.T.; BELLDEGRUN, A.S. y cols.: Adjuvant therapy of renal cell carcinoma: patient selection and therapeutic options. BJU Int., 96: 483, 2005. [ Links ]
*23. CÓZAR, J.M.; TALLADA, M.; ESPEJO, E. y cols.: Estado actual de la inmunoterapia en el cáncer renal diseminado. Rev. Urol., 3: 62,2002. [ Links ]
24. LAM, J.S.; LEPPERT, J.T.; BELLDEGRUN, A.S. y cols.: Novel approaches in the therapy of metastatic renal cell carcinoma. World J. Urol., 23: 202, 2005. [ Links ]
**25. COPPIN, C.; PORZSOLT, F.; AWA, A. y cols.: Immunotherapy for advanced renal cell cancer. The Cochrane Database of Systematic Reviews 2004, Issue 3. Art. No.: CD001425. DOI:10.1002/14651858.CD001425.pub2. [ Links ]
*26. COHEN, H.T.; McGOVERN, F.J.: Renal cell carcinoma. N. Engl. J. Med., 353: 2477, 2005. [ Links ]
 Dirección para correspondencia:
Dirección para correspondencia:
José Luis Rosales Leal
C/ Periodista José Fernández Martínez
Nº4, Portal 1, 2ºA
18014 Granada. (España)
E-mail: jrosal@fundacionhvn.org
Recibido: 29 de mayo 2006