Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Archivos Españoles de Urología (Ed. impresa)
versión impresa ISSN 0004-0614
Arch. Esp. Urol. vol.59 no.10 dic. 2006
CÁNCER DE PRÓSTATA: NUEVAS TÉCNICAS DIAGNÓSTICAS
Cáncer de próstata: nuevas técnicas diagnósticas. Estado actual de la biopsia de próstata.
Prostate cancer. New diagnostic techniques. Current status of prostate biopsy
Enrique Trilla y Juan Morote.
Servicio de Urología. Hospital Vall d´Hebrón. Universidad Autónoma de Barcelona. Barcelona. España.
Dirección para correspondencia
RESUMEN
Objetivo: La biopsia de próstata ecodirigida constituye el único método para obtener el diagnóstico de naturaleza de cáncer de próstata. Desde su introducción a finales de la década de los 80, se han producido múltiples modificaciones de la técnica con el objetivo de aumentar la tasa de detección de cáncer y disminuir la tasa de falsos negativos con el máximo confort y menor posibilidad de complicaciones.
Métodos: Análisis crítico y revisión de conjunto de la literatura publicada sobre biopsia prostática hasta el momento.
Resultados/Conclusiones: Los estudios publicados sugieren que los esquemas de biopsia extensos, tanto en las primeras biopsias como en las rebiopsias, aumentan la tasa de detección de cáncer en comparación con la biopsia por sextantes, siendo necesario incluir muestras procedentes de las porciones más laterales y apico-dorsales de la glándula donde el rendimiento diagnóstico es mayor. La rebiospia, tras una primera biopsia negativa, se indicará en los casos de primeras biopsias con PIN de AG y/o ASAP, elevación persistente de PSA y/o incremento del tiempo de doblaje de PSA total. No existe consenso respecto en que momento parar de rebiospiar, si bien parece que la tasa de detección de cáncer desciende a partir de la tercera rebiopsia. La introducción de las técnicas de bloqueo anestésico periprostático han permitido el control de dolor asociado en especial en la biopsias más extensas.
Palabras clave: Cáncer de próstata. Biopsia prostática ecodirigida. Antígeno prostático específico.
SUMMARY
Objetives: Ultrasound guided prostate biopsy is the only method to obtain the confirmation diagnosis of prostate cancer. Since its introduction at the end of the `80s multiple modifications of the technique have been implemented to improve cancer detection rates and to diminish the rate of false negative results, with maximum patient comfort and less complications.
Methods: Bibliographic review and critical analysis of the literature on prostate biopsy.
Results/Conclusions: Published studies suggest extensive biopsy schemes increase detection rates in comparison to sextant biopsies, both first and successive biopsies, being necessary to sample the most lateral areas of the gland and the dorsal apex where the diagnostic yield is greater. The indications for repeated biopsies after a negative one include high grade PIN and/or Atypical Small Acinar Proliferation (ASAP), persistent PSA elevation and/or total PSA doubling time increase. There is no consensus about the time for repeating biopsies, although it seems that cancer detection rates descend after the third biopsy. The introduction of periprostatic anesthetic blockage techniques has enabled pain control, mainly in more extensive biopsies.
Key words: Prostate cancer. Ultrasound guided prostate biopsy. PSA.
Introducción
El cáncer de próstata representa un grave problema de salud en los países desarrollados, constituyendo una de las causas más importantes de fallecimiento en varones de más de 50 años. Históricamente el diagnóstico de la enfermedad se limitaba al tacto rectal y la biopsia prostática digito-dirigida. Desde la introducción en la década de los ochenta del antígeno especifico prostático (PSA) en la práctica urológica diaria, la detección de cáncer de próstata ha aumentado de forma espectacular, en especial en fases precoces y, por tanto, potencialmente curables. Con los métodos actuales disponibles para su detección, el riesgo de detectar un cáncer de próstata durante la vida de un varón adulto se estima en torno al 16% con un riesgo de fallecimiento del 3,5% (1).
Indicaciones actuales de biopsia de próstata:
La biopsia prostática es necesaria y constituye el único procedimiento disponible para confirmar el diagnóstico de cáncer de próstata pero ¿quién es el principal candidato a biopsiar?. Actualmente la mayoría de los enfermos con sospecha clínica muestran un buen estado de salud y por tanto la sospecha real se establece por la elevación de las cifras de antígeno específico prostático (PSA) en los análisis rutinarios o, en menor medida, por una palpación prostática anormal (nódulo palpable, induración o asimetrías) (2). Sin embargo a pesar de que la palpación prostática tiene un elevado valor predictivo positivo, en pocas ocasiones los pacientes con tacto rectal anormal presentan enfermedad organoconfinada. Otro de los problemas de la palpación rectal es la baja reproducibilidad en la interpretación de los resultados debido a la variabilidad interexaminador (3).
Biopsia prostática: PSA e isoformas.
Uno de los principales problemas que se plantean a la hora de indicar una biospia prostática, es a partir de que valor de PSA total (PSAt) es necesario biopsiar. Sabemos que el valor predictivo positivo (VPP) del PSAt depende además de su valor absoluto, de la edad del paciente (4). Los rangos de PSAt ajustados a la edad persiguen aumentar la tasa de detección de cáncer en varónes jóvenes y reducir aquellas biopsias innecesarias en pacientes mayores. Además el VPP aumenta de forma directamente proporcional al valor de PSAt (4). En nuestro medio el punto de corte consensuadamente establecido para indicar la biopsia prostática es de > 4 ng/ml. Con cifras de PSAt entre 4,1-10 ng/ml la tasa global de detección de cáncer es de un 25% y por encima de 10 ng/ml asciende a 42%. Por tanto, en el rango de PSAt entre 4-10 ng/ml plantea la duda de biopsiar en exceso para detectar un porcentaje bajo de cánceres, siendo necesario el incremento de la especificidad del PSAt.
Uno de los parámetros más estudiados con el fin de aumentar la especificidad ha sido el ajuste del valor del PSA total en función del volumen global de la glándula prostática (5,6). Es la denominada densidad de PSA (DPSA). Seaman y col. determinaron la DPSA en un conjunto de pacientes con cifras de PSAt entre 4,1-10 ng/ml siendo de < 0,15. Biopsiando con una DPSA mayor o igual a 0,12 observaron que podían obviarse entre un 16-55% de biopsias en éste grupo de pacientes, ahora bien también se objetivó una reducción en la tasa de detección de cánceres en torno a un 4-25% (7). La principal limitación del cálculo de la DPSA es la variabilidad del explorador a la hora de determinar el volumen real de la glándula por ecografía transrectal. Otro parámetro estudiado ha sido la DPSA limitada a la zona de transición (ZT). Para algunos autores permite afinar más que la DPSA en la detección de cáncer (8,9) aunque tanto la DPSA y DPSA-ZT lógicamente no pueden ser utilizados de forma aislada sino formando parte de algoritmos diagnósticos que incorporen e integren diferentes factores de decisión como la edad y otros.
El cálculo de la ratio de PSA libre y PSAt ha demostrado incrementar la especificidad del PSAt para valores entre 2,5-10 ng/ml en torno a un 90%. Por tanto podemos evitar en torno a un 20-30% de biopsias innecesarias . En el rango de PSAt de 2,6-4 ng/ml, un umbral ratio libre/total del 25% permite detectar hasta un 85% de cánceres, si bien evita un 19% de biopsias negativas. Si incrementamos el punto de corte al 30% detectamos hasta un 90% de cánceres y evitamos tan sólo un 9% de biopsias negativas. (10). Para valores entre 4-10 ng/ml de PSAt la probabilidad de detectar tumor es del 28% al 8% dependiendo de si se toma de referencia el umbral de < 15% o bien > 25% respectivamente (Cooperative group for the diagnosis of prostate Cancer, 1997).
La velocidad de PSA (VPSA) es, finalmente junto a la determinación del PSA complex o complejo (PSA unido a alfa-1 antiquimotripsina), son otros parámetros evaluados en la detección de pacientes con cáncer. En relación a la VPSA, un incremento del PSA total superior a 0,75 ng/ml por año en como mínimo tres determinaciones consecutivas durante un periodo de 2 años se ha asociado a un incremento de las tasas de detección de cáncer prostático (11). En relación al PSA complex, parece tener una especificidad equiparable a la ratio de PSA libre/total en el rango de valores entre 2-4 ng/ml, no mejora en cambio en el rango de PSAt entre 4,1-10 ng/ml.
Como conclusión podríamos decir que la determinación de las cifras de PSAt junto con las diferentes isoformas deberían de formas parte integral de diferentes algoritmos de decisión en cuanto a la realización de la biopsia prostática con el objetivo de aumentar la tasa de detección de cánceres en fases incipientes sin aumentar con ello el número de biopsias inecesarias.
La biopsia prostática inicial: ¿ sextantes o biopsia extensa?
La ecografia tranrectal en patología prostática se introdujo con el objetivo de identificar lesiones sospechosas, normalmente de carácter hipoecóico. Sin embargo diferentes estudios concluyen que hasta un 70% de los tumores prostáticos no se muestran con un patrón ecográfico hipoecóico y, por tanto es posible identificar lesiones isoecóicas e hiperecóicas respecto al parénquima adyacente sano (12). La ecografia transrectal constituye la via de abordaje común para la realización de la biopsia sistemática prostática a pesar de que algunos grupos utilizan también el abordaje transperineal. Básicamente, la probabilidad de detectar un cáncer en la biopsia va ha depender de tres factores: el patrón o localización de las biopsias, el volumen prostático global y, finalmente del número de biopsias obtenidas.
Hodge describe por primera vez en 1989 la técnica de biopsia sistemática transrrectal prostática por sextantes en una muestra de 136 pacientes con tacto rectal sospechoso (1). La técnica original de biopsia incluía seis cilindros obtenidos en un plano parasagital y con un intérvalo de un centímetro del ápex prostático, zona media y base de cada lóbulo (Figura 1). La evidencia mostró que la biopsia sistemática ecoguiada obtenía un mayor rendimiento diagnóstico global que la biopsia digito-guiada, resultando mayor en pacientes con próstatas de menor volumen (13). Uno de los problemas planteados del esquema inicial propugnado por Hodge es la muestra limitada que se obtiene de la zona periférica de la glándula en proporción al volumen prostático global y por tanto su limitación a la hora de detectar tumores de mayores a 1 cc o en los casos de afectación multifocal. Un estudio de Bott y col. mostró que la biopsia sextante permite identificar hasta un 73% de tumores > de 0,5 cc pero tan sólo detecta un 18% de tumores menores de 0,5 cc, quizás esto pueda explicar la baja tasa de detección de cáncer en la biopsia sextante y justificaría, por tanto la realización de tomas adicionales (biopsia extensa) (14).
Las biopsias adicionales a la biopsia clásica por sextantes incrementan las probabilidades de detección de cáncer (15). Las técnicas de biopsia extensa permiten obtener muestras de biopsia de diferentes regiones de la próstata con el objetivo de incrementar la tasa de detección de cáncer. Diferentes estudios clínicos a partir de piezas de prostatectomia radical ex vivo han demostrado la importancia relativa de la localización de las muestras biópsicas. Epstein in col. demostraron que la adición a la biopsia sextante de muestras procedentes de la línea media, región posterolateral y apical prostática incrementaba la tasa de detección de cáncer (16,17). Así mismo Eskew observó que la detección de cáncer sólo en las muestras adicionales acontecía en el 35% de pacientes biopsiados y sobre todo el rendimiento diagnóstico era mayor en los cores adicionales de las porciones más laterales de la próstata (15). Chen en un estudio de 147 pacientes sometidos a un esquema de biopsia extensa de 10 cores concluye que la biopsia del ápex prostático, porción anterior de la zona de transición (ZT), y la porción más lateral periférica de cada lóbulo prostático permite la detección del 96% de cánceres (18). Por tanto parece claro que la asociación de biospias adicionales de las regiones comentadas aumenta la tasa de detección de cáncer y por tanto dichas localizaciones deberían de incluirse en los esquemas de biopsia extensa. Por el contrario no se ha demostrado una mayor eficacia en la tasa de detección de cáncer en relación a la biopsias inicial adicional sobre la vesícula seminal (19) si bien y, dado el mal pronóstico que supone dicha invasión, algunos trabajos aceptan su realización con un objetivo meramente de estadiaje (5).
Otro de los elementos que parecen influir en la tasa de detección de cáncer es el volumen de la glándula. Parece obvio que en glándulas de gran volumen la probabilidad de detección de cáncer es menor en tanto que el porcentaje global de tejido a biopsiar es superior (20) Además la probabilidad de detección de tumores de pequeño volumen también es menor. Presti investigó la tasa de detección de cáncer en un total de 483 pacientes sometidos a un esquema extenso de biopsia (10 cores) en próstatas de > 50 cc de volumen. La biopsia incluía una toma de la ZT. Observó que la biopsia clásica por sextantes dejó de diagnosticar un 22% de tumores y la biopsia adicional de la ZT incrementó en un 5,5% la tasa de detección. Así mismo la diferencia en la tasa de detección de cáncer en glándulas de menos de 50 cc respecto a próstatas de > 50 cc fue mayor utilizando un esquema de biopsia extensa de 10 cores respecto a la biopsia por sextante clásica (9,5 % versus 20% respectivamente) (21). En todo caso no todos los estudios han podido probar de forma clara la relación inversamente proporcional entre el volumen de la glándula y la tasa de detección de cáncer (22,23). Tampoco queda claro el valor de la biopsia de la ZT en los pacientes sometidos a una primera biopsia por sextantes (24)
Rebiopsia prostática: ¿Qué problemas plantea?
Una biopsia inicial prostática negativa no excluye del diagnóstico de cáncer. Los pacientes siguen presentando riesgo lo que justifica, en la mayoría de casos, el seguir investigando para no obviar su detección en los pacientes potencialmente curables. Diversos estudios demuestran que los tumores no diagnosticados en la biopsia inicial no necesariamente son de pequeño tamaño y baja agresividad y, por tanto queda justificada su detección (25). Así mismo se ha intentado valorar que pasa durante el seguimiento de los pacientes con una biopsia prostática inicial negativa (26-28) concluyendo que la tasa de detección de la rebiopsia es relativamente elevada en especial en el periodo más reciente tras la biopsia inicial. El problema que se plantea es por tanto, ¿quién es el candidato a rebiopsiar?, ¿cómo rebiosiar? Y finalmente ¿cuando rebiopsiar?.
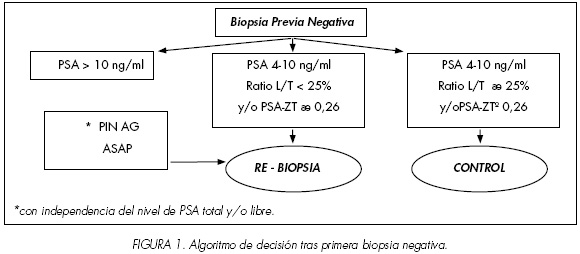
La indicación principal de rebiopsia tras una primera biopsia prostática negativa es la elevación persistente de las cifras de PSAt (> 4 ng/ml) evidenciadas en los diferentes controles posteriores tal y como recomienda la guidelines de la AEU(29). Djavan además sugiere el cálculo de la ratio PSA libre/total en los rangos de PSAt entre 4-10ng/ml, estableciendo como punto de corte el valor < 30%. También sugiere la rebiopsia en éstos pacientes si la densidad de PSA en la zona de transicional (DPSA-ZT) es superior a 0,26 (30-31). Otra indicación clara de rebiopsia es la detección de neoplasia intraepitelial prostática de alto grado (PINAG) en la biopsia inicial con independencia de las cifras de PSAt. Como es conocido el PINAG representa, muy probablemente, una lesión precursora del cáncer de próstata, suele ser multifocal y parece localizarse con mayor frecuencia a nivel de ápex (32). Su presencia se cifra entre un 0,7-23% de biopsias iniciales según las series publicadas. A pesar de que no siempre coexisten ambas lesiones, su presencia indica una elevada probabilidad de detectar carcinomas ocultos en biopsias posteriores. El valor predictivo positivo de la detección de PINAG aumenta cuando se asocia con un tacto rectal anormal, elevación de la cifras de PSAt, ratio PSA libre/total bajo o bien presencia de atipia glandular adyacente. Estudios recientes concluyen que el riesgo de cáncer es mayor en función del porcentaje total de PINAG en las muestras de biopsia que por su propia presencia (33).
La presencia de pequeños grupos glandulares atípicos (ASAP) en la biopsia inicial se ha asociado hasta en un 50% de casos con la detección de cáncer de próstata en la rebiopsia (34-36). Por tanto la mayoría de autores recomiendan biopsiar aquellos pacientes que presentan ASAP en la primera biopsia con independencia de las cifras de PSA total.
La influencia del volumen prostático total en la tasa de detección de cáncer ha sido claramente reconocida en el caso de la biopsia inicial no así en el caso del volumen de la zona transicional (ZT). Parece claro que cuando la próstata tiene un volumen superior a 45 cc y el volumen de la ZT es > 22,5 cc, la realización de la biopsia por sextante es insuficiente (31). Se han realizado diferentes nomogramas utilizando diferentes variables como la presencia de PINAG o ASAP y el número de muestras negativas en la biopsia inicial con el fin de identificar aquellos pacientes que podrían beneficiarse de una rebiopsia , obteniendo tasas de detección al menor en torno a un 20% en una segunda toma biópsica.
1-¿Cómo rebiopsiar?
Parece claro que cuando nos disponemos a rebiopsiar la utilización de esquemas de biopsia extensa de cómo mínimo 10 muestras permiten un mejor rendimiento diagnóstico. Hemos de incluir el área apico-dorsal y posterolateral. También se recomienda biopsiar la zona transicional sobre todo si persisten elevadas las cifras de PSAt y en caso de próstatas grandes (37). Otros autores propugnan la realización de biopsias muy extensas (24 cores) en pacientes con biopsias previas negativas. Son las llamadas biopsias por saturación que permitirian a priori realizar un mapeo global de la glándula incluyendo la ZT (38) con una baja tasa de morbilidad incluso bajo anestésia local. Su utilización como método de biopsia inicial no parece ofrecer un beneficio superior a los esquemas de biopsia extensa de 10-12 muestras (39).
2-¿Cuándo rebiopsiar?
Uno de los problemas que se plantean a la hora de indicar una nueva biopsia de próstata es en que momento realizarla. Parece claro que va ha depender de la indicación de la rebiopsia. Djavan recomienda su realización en un intérvalo de tiempo entre 6 y 12 meses tras la biopsia inicial sobre todo en los pacientes en que se indica por elevación persistente de las cifras de PSAt (31). Donde no existe un claro consenso es en los pacientes que presentan PIN AG en la biopsia inicial. Determinados autores justifican su realización precoz (40), otros en cambio no la justifican por la posibilidad de malinterpretar las imágenes ecográficas transrectales como los hematomas o distorsiones en la estructura glandular secundarios a la biopsia previa (41). En todo caso parece aceptarse su realización en un intérvalo de tiempo razonable entre los 3-6 meses tras la biopsia inicial (42).
3-¿ Cuándo no realizar más biopsias?
Uno de los problemas planteados es cuando desistir en la realización de nuevas biopsias en aquellos pacientes que presentan al menos dos biopsias previas. Se han comparado diferentes parámetros bioquímicos y anatomo-patológicos de los tumores detectados en segundas, terceras y cuartas biopsias de pacientes con cifras de PSA total entre 4-10 ng/ml respecto a aquellos tumores detectados en biopsias iniciales. Las tasas de detección de cáncer en 1ª, 2ª, 3ª y 4ª biopsia fueron de 22%, 10%, 5% y 4% respectivamente. Así mismo no se detectaron diferencias bioquímicas ni patológicas en los tumores detectados en las primeras y segundas biopsias. Los tumores detectados en terceras y cuartas biopsias, en cambio presentaron un menor grado de Gleason, un menor volumen y menor estadio (30) (Tabla II). Por tanto todo ello parece sugerir que terceras y cuartas biopsias sólo quedarian justificadas en pacientes con elevada sospecha de cáncer a pesar de dos biopsias previas negativas (30,31).
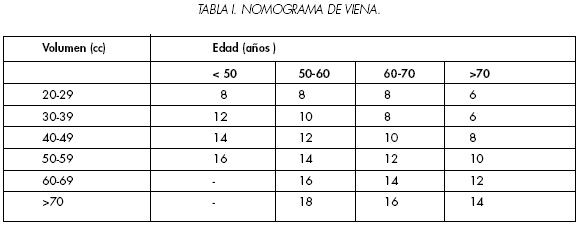
Como conclusión final, tras una primera biopsia inicial negativa hemos de establecer un algoritmo diagnóstico razonable que nos permita decidir a que paciente y ante que circunstancias hemos de repetir la biopsia prostática con el fin de optimizar el proceso diagnóstico. Djavan y cols. del grupo de Viena proponen un algoritmo de decisión (Figura 1) así como un nomograma donde reflejan las indicaciones de re-biopsia y el número de biopsias recesarias a realizar con el fin de asegurar un 90% de certeza en la detección de cáncer basados en la edad de paciente y el volumen global de la glándula prostática calculado por ecografia transrectal (30,31) (Tabla I).
Morbilidad de la biopsia de próstata.
A pesar de considerarse un procedimiento relativamente seguro, la biopsia de próstata no está exenta de riesgos. Las complicaciones menores asociadas son relativamente frecuentes y se estima que aproximadamente un 70% de los pacientes sometidos a una biopsia prostática experimentan al menos un episodio menor. Entre las complicaciones menores asociadas destacan principalmente el sangrado rectal (2,3%), la hematuria macroscópica (14-22,6%) con una duración superior a las 48 horas, hemospermia (36-50%) y el dolor local (43). La presentación de complicaciones mayores como la sépsis grave por inoculación de gérmenes procedentes del recto, es muy infrecuente (1%) principalmente debido a la utilización de pautas de profilaxis antibióticas frente a gérmenes gram negativos previas a la realización de la biopsia, principalmente las fluoquinolonas. La aplicación de enemas de limpieza intrarectales previos muestran resultados contradictorios en relación a la prevención de la sépsis (43,44). Djavan y cols. tan sólo comunican dos episodios sépticos graves de un total de 1871 biospias realizadas (30,31). A pesar de que la mayoría de complicaciones menores son autolimitadas, es necesario informar adecuadamente de la posibilidad de su aparición.
Otro de los aspectos más preocupantes es el disconfort y/o dolor asociado en especial en la 950 rebiospia, dado que éste hecho puede condicionar la realización de biopsias ulteriores. Irani y cols. no mostraron diferencias en la tolerancia en relación a primeras biopsias y rebiopsias en un grupo de 81 pacientes (45). En cambio Collins y Clemens y cols. comunican un 30% de biopsias especialmente dolorosas (46,47). Así mismo Djavan y cols. del grupo de Viena, comunican una menor tolerancia a la biopsia en los pacientes más jóvenes (< 60 años) respecto a los de mayor edad (31). Múltiples estudios han evaluado la seguridad y eficacia de los métodos para reducir el dolor y disconfort asociado a la biopsia concluyendo que la infiltración local (bloqueo nervioso periprostático) con lidocaina o bupivacaina parece ser el mejor método para controlar, con un tiempo adicional mínimo, el dolor asociado a la técnica de biopsia sin aumentar el riesgo de infección y/o hemorrágia (48-53). Otros métodos evaluados como la aplicación tópica de gel anestésico intrarectal y/o antiinflamatorios no esteroideos enterales o tópicos, no han demostrado una mejoria clara respecto al bloqueo anestésico periprostático (54, 55).
Conclusiones
La detección de cáncer de próstata en las rebiopsia es poco frecuente (10-20%). Cuando indicamos la rebiospia en función del nivel de PSAt, el porcentaje de PSA libre y PSA-ZT parecen ser predictores utiles en la detección de cáncer en las muestras de rebiopsia. No queda claro cuantas muestras son necesarias para aumentar la tasa de detección de cáncer tanto en la biopsia inicial como en rebiopsia si bien existe consenso en establecer esquemas de biospia extensa de al menos 10-12 muestras especialmente en pacientes con próstatas de gran volumen. Así mismo y de forma general los tumores detectados en la rebiopsia tienen un estadio, volumen y grado similares a los encontrados en la biopsia inicial, lo que sugiere características biológicas similares. En cuanto a la localización de los tumores sabemos que los tumores no detectados en la biopsia inicial y diagnosticados en la rebiopsia se localizan con mayor frecuencia a nivel la región apico-dorsal y por tanto dichas regiones deberían de ser incluídas en los algoritmos de rebiopsia. Finalmente los datos apuntan que las tasas de detección de cáncer en terceras y cuartas biopsias son bajas y los tumores detectados presentan un bajo grado, son de menos volumen y bajo estadio. Por tanto tras una primera rebiopsia negativa la indicación de nuevas biopsias debería establecerse en casos seleccionados con elevada sospecha.
Bibliografía y lecturas recomendadas (*lectura de interés y ** lectura fundamental)
**1. OCHIAI, A.; BABAIAN, J.: Update on prostate biopsy technique. Curr. Op. Urol., 14: 157, 2004. [ Links ]
**2. HODGE, K.K.; McNEAL, J.E.; TERRIS, M.K. y cols.: Random systematic versus directed ultrasound guided transrectal core biopsies of the prostate.J. Urol., 142: 71, 1989. [ Links ]
3. RICHIE, J.P.; CATALONA, W.J.; AHMANN, F.R. y cols.: Effect of patient age on early detection of prostate cancer with serum prostate-specific antigen and digital rectal examination. Urology, 42: 365, 1993. [ Links ]
4.SCHRODER, F.H.; WILDHAGEN, M.F.: Screening for prostate cancer. Evidence and perspectives. BJU Int., 88: 811, 2001. [ Links ]
5. WYMENGA, L.F.; DUISTERWINKEL, F.J.; GRONIER, K. y cols.: Ultrasound-guided seminal vesicle biopies in prostate cancer. Prostate Cancer Prostatic Dis., 3: 100, 2000. [ Links ]
6. HAYECK, O.R.; NOBLE, C.B.; DE LA TAILLE, A. y cols.: The necessity of a second prostate biopsy cannot be predicted by PSA or PSA derivatives (density or free: total ratio) in men with prior negative prostatic biopsies. Curr. Opin. Urol., 9: 371, 1999. [ Links ]
7. SEAMAN, E.; WHANG, M.; OLSSON, C.A. y cols.: PSA density (PSAD). Role in patient evaluation and management. Urol. Clin. North. Am., 20: 653, 1993. [ Links ]
8. REMZI, M.; DJAVAN, B.; WAMMACK, R. y cols.: Can total and transition zone volume of the prostate determine whether to perform a repeat biopsy?. Urology, 61: 161, 2003. [ Links ]
**9. DJAVAN, B.; REMZI, M.; ZLOTTA, A.R. y cols.: Complexed prostate-specific antigen, complexed prostate-specific antigen density of total and transicional zone, complexed/total prostate-specific antigen ratio, density of total and transition zone prostate-specific antigen: results of the prospective multicenter European trial. Urology, 60: 4, 2002. [ Links ]
10. ROEHL, K.A.; ANTENON, J.A.; CATALONA, W.J.: Robustness of free prostate specific antigen measurements to reduce unnecesary biopsies in the 2,6-4,0 ng./ml. Range. J. Urol., 168: 922, 2002. [ Links ]
11. CARTER, H.B.; PEARSON, J.D.: Prostate-specific antigen velocity and repeated measures of prostate-specific antigen. Urol. Clin. North. Am., 24: 333, 1997. [ Links ]
12. FLANIGAN, R.C.; CATALONA, W.J.; RICHIE, J.P. y cols.: Accuracy of digital rectal examination and transrectal ultrasonography in localizing prostate cancer. J. Urol., 152: 1506, 1994. [ Links ]
*13. UZZO, R.G.; WEI, J.T.; WALDBAUM, R.S. y cols.: The influence of prostatic size on cancer deteccion. Urology, 46: 831, 1995. [ Links ]
14. BOTT, S.R.; YOUNG, M.P.; KELLETT, M.J. y cols.: Anterior prostate cancer: is it more difficult to diagnose?. BJU Int., 89: 886, 2002. [ Links ]
*15. ESKEW, L.A.; BARE, R.L.; McCULLOGH, D.L.: Systematic 5 region prostate biopsy is superior to sextant method for diagnosing carcinoma of the prostate. J. Urol., 147: 199, 1997. [ Links ]
16. EPSTEIN, J.I.; WALSH, P.C.; SAUVAGEOT, J. y cols.: Use of repeat sextant and transition zone biopsies for assesing extent of prostate cancer. J. Urol., 158: 1886, 1997. [ Links ]
17. EPSTEIN, J.I.; WALSH, P.C.; CARTER, H.B.: Importance of posterolateral needle biopsies in the deteccion of prostate cancer. Urology, 57: 1112, 2001. [ Links ]
*18. CHEN, M.E.; TRONCOSO, P.; JOHNSTON, D. y cols.: Optimization of prostate biopsy strategy using computer based analysis. J. Urol., 158: 2168, 1997. [ Links ]
**19. TERRIS, M.K.; PHAM, T.Q.; ISSA, M.M. y cols.: Routine transition zone and seminal vesicle biopsies in all patients undergoing transrectal ultrasound guided prostate biopsies are not indicated. J. Urol., 157: 204, 1997. [ Links ]
*20. LEVINE, M.A.; ITTMAN, M.; MELAMED, J. y cols.: Two consecutive set of transrrectal ultrasound guided sextant biopsies of the prostate for the detection of prostate cancer. J. Urol., 159: 471, 1998. [ Links ]
**21. PRESTI, J.C. Jr.; CHANG, J.J.; BHARGAVA, V. y cols.: The optimal systematic prostate biopsy scheme should include 8 rather than 6 biopsies. Results of a prospective clinical trial. J. Urol., 163: 163, 2000. [ Links ]
*22. BABAIAN, R.J.; TOI, A.; KAMOI, K. y cols.: A comparative analysis of sextant and extended 11-core multisite directed biopsy strategy. J. Urol., 163: 152, 2000. [ Links ]
23. UNG, J.O.; SAN FRANCISCO, I.F.; REGAN, M.M. y cols.: The relashionship of prostate gland volume to extended needle biopsy on prostate cancer detection. J. Urol., 169: 130, 2003. [ Links ]
**24. MOROTE, J.; LÓPEZ, M.; ENCABO, G. y cols.: Value of routine transition zone biopsies in patients undergoing ultrasound-guided sextant biopsies for the first time. Eur. Urol., 35: 294, 1999. [ Links ]
25. O´DOWD, G.J.; MILLER, M.C.; OROZCO, R. y cols.: Analysis of repeated biopsy results within 1 year after a noncancer diagnosis. Urology, 55: 553, 2000. [ Links ]
26. BILL-AXELSON, A.; HOLMBERG, L.; NORLEN, B. y cols.: No increased prostate cancer incidence after negative transrectal ultrasoud guided multiple biopsies in men with increased prostate specific antigen and/or abnormal digital rectal examination. J. Urol., 170: 1180, 2003. [ Links ]
27. HAYEK, O.R.; NOBLE, C.B.; DE LA TAILLE, A. y cols.: The necessity of a second prostate cannot be predicted by PSA or PSA derivatives (density or free:total ratio) in men with prior negative prostatic biopsies. Curr. Opin. Urol., 9: 371, 1999. [ Links ]
28. BODDY, J.L.; PIKE, D.J.; MALONE, P.R.: A seven-year follow-up of men following a bening prostate biopsy. Eur. Urol., 44: 17, 2003. [ Links ]
29. RIETBERGEN, J.B.; HOEDEMAEKER, R.F.; KRUGER, A.E. y cols.: The changing pattern of prostate cancer at the time of diagnosis: characteristics of screen detected prostate cancer in a population based screening study. J. Urol., 161: 1192, 1999. [ Links ]
30. DJAVAN, B.; REMZI, M.; SCHULMAN, C. y cols.: Repeat prostate biopsy: who, how and when? A review. Eur. Urol., 42: 93, 2002. [ Links ]
31. DJAVAN, B.; REMZI, M.; MARBERGER, M.: When to biopsy and when to stop biopsying. Urol. Clin. North. Am., 30: 253, 2003. [ Links ]
32. GREEN, J.S.; KNIGHT, R.J.; HUNTER-CAMPBELL, P. y cols.: An investigation into the spatial relationship between prostate intraepithelial neoplasia and cancer. Prostate cancer Prostatic Dis., 4: 97, 2001. [ Links ]
33. NAYA, Y.; AYALA, A.G.; TAMBOLI, P. y cols.: Can the number of cores with high-grade neoplasia predict cancer in men who undergo repeat biopsy?. Urology, 63: 503, 2004. [ Links ]
34. CHAN, T.Y.; EPSTEIN, J.I.: Follow-up of atypical prostate needle biopsies suspicious for cancer. Urology, 53: 351, 1999. [ Links ]
35. HOEDEMAEKER, R.F.; VAN DER KWAST, T.H.; SCHRODER, F.H.: The clinical significance of a small focus of well-differentiated carcinoma at prostate biopsy. BJU Int., 92: 92, [ Links ]
36. MIAN, B.M.; NAYA, Y.; OKIHARA, K. y cols.: Predictors of cancer in repeat extended multisite prostate biopsy in men with previous negative extended multi-site biopsy. Urology, 60: 836, 2002. [ Links ]
37. LUI, P.D.; TERRIS, M.K.; McNEAL, J.E. y cols.: Indications for ultrasound guided transition zone biopsies in the detection of prostate cancer. J. Urol., 153: 1000, 1995. [ Links ]
38. RABETS, J.; JONES, S.; PATEL, A. y cols.: Prostate cancer detection with office based saturation biopsy in a repeat biopsy population. J. Urol., 172: 94, 2004. [ Links ]
39. STEPHEN JONES, J.; PATEL, A.; SCHOENFIELD, L. y cols.: Saturation technique does not improve cancer detection as an initial prostate biopsy strategy. J. Urol., 175: 485, 2006. [ Links ]
40. AUS, G.; ABBOU, C.C.; PACIK, D. y cols.: Guidelines on prostate cancer: European Association of Urology. www.uroweb.org, 2003. [ Links ]
**41. LEFKOWITZ, G.K.; SIDHU, G.S.; TORRE, P. y cols.: Is repeat prostate biopsy for high-grade prostatic intraepithelial neoplasia necessary after routine 12-core sampling?. Urology, 58: 999, 2001. [ Links ]
42. MONTIRONI, R.; MAZZUCCHELLI, R.; SCARPELLI, M.: Precancerous lesions and conditions of the prostate: from morphological and biological characterization to chemoprevention. Ann. NY Acad. Sci., 963: 169, 2002. [ Links ]
*43. BERGER, A.P.; GOZZI, C.; STEINER, H. y cols.: Complication rate of transrectal ultrasound guided prostate biopsy: a comparison among 3 protocols with 6, 10 and 15 cores. J. Urol., 171: 1478, 2004. [ Links ]
44. CARREY, J.M.; KORMAN, H.J.: Transrectal ultrasound guided biopsy of the prostate. Do enemas decrease clinically significant complications?. J. Urol., 166: 82, 2001. [ Links ]
45. IRANI, J.; FOURNIER, F.; BON, D. y cols.: Patient tolerance of transrectal ultrasound-guided biopsy of the prostate. Br. J. Urol., 79: 608, 1997. [ Links ]
46. COLLINS, G.N.; LLOYD, S.N.; HEHIR, M. y cols.: Multiple transrectal ultrasound-guided prostatic biopsies-true morbidity and patient acceptance. Br. J. Urol., 71: 460, 1993. [ Links ]
47. CLEMENS, R.; AIDEYAN, O.U.; GRIFFITHS, G.J. y cols.: Side effects and patient acceptability of transrectal biopsy of the prostate. Clin. Radiol., 47: 125, 1993. [ Links ]
48. SEYMOUR, H.; PERRY, M.J.; LEE-ELLIOT, C. y cols.: Pain after trasnrectal ultrasonography-guided prostate biopsy. The advantages of periprostatic local anaesthesia. BJU Int., 88: 540, 2001. [ Links ]
*49. WALKER, A.E.; SCHELVAN, C.; ROCKALL, A.G. y cols.: Does pericapsular lignocaine reduce pain during transrectal ultrasonography-guided biopsy of the prostate?. BJU Int., 90: 883, 2002. [ Links ]
50. WU, C.L.; CARTER, H.B.; NAQIBUDDIN, M. y cols.: Effect of local anesthetics on patient recovery after transrectal biopsy. Urology, 57: 925, 2001. [ Links ]
51. RABETS, J.C.; JONES, J.S.; PATEL, A.R. y cols.: Bupivacaine provides rapid, effective periprostatic anesthesia for transrectal prostate biopsy. BJU Int., 93: 1216, 2004. [ Links ]
52. SOLOWAY, M.S.; OBECK, C.: Periprostatic local anesthesia before ultrasound guided prostate biopsy. J. Urol., 163: 172, 2000. [ Links ]
**53. LYNN, N.N.; COLLINS, G.N.; BROWN, S.C. y cols.: Periprostatic nerve block gives better analgesia for prostatic biopsy: BJU Int., 90: 424, 2002. [ Links ]
54. DESGRANDCHAMPS, F.; MERIA, P.; IRANI, J. y cols.: The rectal administration of lidocaine gel and tolerance of transrectal ultrasonography-guided biopsy of the prostate: a prospective randomized placebo-controlled study. BJU Int., 83: 1007, 1999. [ Links ]
55. HAQ, A.; PATEL, H.R.; HABIB, M.R. y cols.: Diclofenac suppository analgesia for transrectal ultrasoun guided biopsies of the prostate: a double-blind, randomized controlled trial. J. Urol., 171: 1498, 2004. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Enrique Trilla Herrera
Servicio de Urología
Hospital General Universitario Vall d´Hebrón
Passeig Vall d´Hebrón 119-129
08035 Barcelona. (España)
etrilla@vhebron.net