Meu SciELO
Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Archivos Españoles de Urología (Ed. impresa)
versão impressa ISSN 0004-0614
Arch. Esp. Urol. vol.60 no.2 Mar. 2007
Adenocarcinoma de células renales: factores pronósticos y estadificación
Renal cell carcinoma: prognostic factors and staging
Antonio Jalón Monzón, Miguel Álvarez Múgica, Jesús María Fernández Gómez, José Luis Martín Benito, Francisco Martínez Gómez, Jorge García Rodríguez, Roberto Carlos González Álvarez y Francisco Javier Regadera Sejas
Servicio de Urología-1. Hospital Universitario Central de Asturias. Oviedo. Asturias. España.
Dirección para correspondencia
RESUMEN
Objetivo: Valorar el significado pronóstico de la clasificación tumoral TNM de 2002 para el carcinoma de células renales (CCR), así como otros factores implicados en la supervivencia.
Métodos: Estudio retrospectivo de historias clínicas de 316 carcinomas renales intervenidos entre los años 1970 y 2003. Se analizaron 25 variables implicadas en el pronóstico de pacientes con CCR.
Resultados: En un 90,5% de pacientes el tipo histológico fue de células renales. La mayoría de los tumores fueron T1b o T2, con un grado nuclear de Fuhrman I o II. La media del tamaño tumoral fue de 7,17 +/- 3,4 cm. En la mayoría de casos existió tumor único. En un 8,2% hubo afectación ganglionar en el momento del diagnóstico y en un 8,6% existían metástasis a distancia. La clínica más frecuente fue hematuria y/o dolor. El seguimiento medio fue de 57,8 meses. Recidivaron un 24,1% de los cuales más del 50% ocurrió en el primer año. Los tumores avanzados (T3, T4) tendieron a presentar un grado nuclear III-IV, mayor tamaño, necrosis, afectación vascular, afectación ganglionar y metástasis a distancia. Al finalizar el seguimiento la mayor parte de pacientes estaba vivo libre de tumor. Los factores que influyeron de forma independiente en la mortalidad cáncer específica fueron los meses libres de enfermedad, la presencia de adenopatías metastásicas, el tratamiento de la primera recidiva y la presencia de anemia.
Conclusión: La modificación de la actual clasificación de los tumores renales pT3 y pT4, ayudaría a la mejor toma de decisiones en cuanto a la actitud terapéutica de tumores con afectación vascular, de grasa perirrenal y de glándulas adrenales. La anemia y el tratamiento de la primera recidiva son factores importantes implicados en la supervivencia cáncer específica.
Palabras clave: Carcinoma de células renales. Clasificación TNM. Factores pronóstico.
SUMMARY
Objectives: To evaluate the prognostic significance of the 2002 TNM tumor classification for renal cell carcinoma, as well as other factors intervening in its survival.
Methods: Retrospective chart review of 316 renal carcinomas operated between 1970 and 2003. Twenty- five prognostic variables were analyzed.
Results: The histological type was renal cell carcinoma in 90.5% of the patients. Most tumors were T1b or T2, with a Fuhrman nuclear grade I or II. Mean tumor size was 7.17 ± 3.4 cm. Most cases had a solitary tumor. 8.2% of the patients had lymph node involvement at the time of diagnosis, and 8.6% metastases. The most frequent clinical presentations were hematuria and/or pain. Mean follow-up was 57.8 months. 24.1% of the cases had recurrence, more than 50% of them during the first year. Advanced tumors (T3, T4) had the tendency to have a nuclear grade III-IV, bigger size, necrosis, vascular involvement, lymph node involvement, and metastases. At the end of follow-up, most patients were alive and disease free. The number of months free of disease, the presence of metastatic lymph nodes, the treatment of the first recurrence and the presence of anemia were independent factors for cancer specific mortality.
Conclusions: The modification of the current classification of renal tumors pT3 and pT4 would help to a better decision-making in the therapy of tumors with vascular, perirenal fat or adrenal involvement. Anemia and treatment of the first recurrence are important factors for cancer specific survival.
Key words: Renal cell carcinoma. TNM classification. Prognostic factors.
Introducción
Los tumores del parénquima renal representan aproximadamente el 3% de los tumores renales del adulto, siendo adenocarcinomas el 90% de los mismos, responsables del 2% de las muertes por cáncer (1).
En la última década se ha observado un aumento entre un 2,3% y un 4,3% (1) en la incidencia de los adenocarcinomas renales (CCR), debido en parte al empleo de mejores técnicas diagnósticas. Pero por otro lado, en estudios europeos también se ha observado un aumento de la mortalidad por adenocarcinoma renal (2).
La OMS en 1998 propone una clasificación histológica de los diferentes tipos de tumores renales, incluyendo los tumores del sistema pielocalicial y lesiones pseudotumorales. El carcinoma renal es un tumor epitelial maligno con patrones morfológicos variables. Se ha clasificado clásicamente en función del tipo celular (células claras, células granulares, células cromófobas o células fusiformes) y del patrón de crecimiento (acinar, papilar o sarcomatoide). En 1986 aparece la clasificación de Heildelberg que mezcla los patrones genéticos con los hallazgos morfológicos (3). En 1998 la OMS introduce cambios en su nueva clasificación, la cual sigue basándose en las características microscópicas de los tumores. No es infrecuente que el tumor tenga más de un tipo celular, siendo el tipo predominante el que determinará la categoría en la que se clasifica la neoplasia (4).
El carcinoma renal convencional (CCR o de células claras) representa más del 80% de todas las neoplasias renales del adulto, originándose en células del túbulo proximal de la nefrona. Pueden ser múltiples, sobre todo cuando aparecen asociados a la enfermedad quística adquirida y a la enfermedad de Von Hippel-Lindau. Expresan citoqueratinas (fundamentalmente tipos 8 y 18) y EMA (antígeno epitelial de membrana). Aquellos con un grado histológico alto y los tumores con un componente sarcomatoide son los que con más frecuencia expresan vimentina. En estudios citológicos el 96% de estas neoplasias se ha encontrado la pérdida de un alelo en la región 3p (5).
El comportamiento y la evolución del CCR son impredecibles. En ocasiones el tumor no se manifiesta clínicamente, siendo hallazgo incidental en el transcurso de la biopsia (6). En la mayoría de las ocasiones el tumor una vez diagnosticado acaba con la vida del paciente en un tiempo más o menos corto. Existen también casos con recurrencia tardía donde las metástasis se expresarán después de los 10 años de la realización de la nefrectomía (7).
Debido al crecimiento relativamente lento cuando comienza el proceso de crecimiento y desdiferenciación del carcinoma renal, clásicamente se diagnosticaba cuando el paciente presentaba síntomas locales, síntomas derivados de las metástasis o por la expresión de un síndrome paraneoplásico. Debido a esto, también se conoce al carcinoma renal como tumor del internista o el gran simulador. Desde la generalización en la década de los 80 de la ecografía y la TC en el estudio de patología intra y retroperitoneal y en el seguimiento de las neoplasias abdominales, ha aumentado extraordinariamente el hallazgo de cánceres renales asintomáticos. Por esto, se observa una migración de estadio tumoral en el momento del diagnóstico, aumentando los pacientes con enfermedad localizada al órgano. Se añade además, un aumento de la supervivencia a los 5 años desde el 37%-73% de las series clásicas (7, 8), al 86% en los pacientes con adenocarcinoma de células renales incidental (9).
Las manifestaciones clínicas del CCR pueden ser secundarias al crecimiento local o manifestaciones sistémicas. El crecimiento de los carcinomas renales, debido a la disposición anatómica de los riñones, puede pasar inadvertida hasta alcanzar un tamaño considerable. La tríada clásica de Guyon -hematuria, dolor en flanco y masa palpable-, se presenta en menos del 10% de las ocasiones (10). Su presencia indica enfermedad avanzada, descubriéndose metástasis en el 47% de los casos.
El CCR es la neoplasia urológica que más frecuentemente se asocia a síndromes paraneoplásicos afectando aproximadamente al 30% de los pacientes (11). Estos pueden ser inespecíficos (anemia, eosinofilia, elevación de VSG, fiebre, disfunción hepática, neuropatía, amiloidosis) o específicos (hipertensión, eritrocitosis, hipercalcemia, elevación de HCG, síndrome de Cushing, hiperprolactinemia, insulina/glucagón ectópico). Como consecuencia del gran venotropismo del CCR, no es infrecuente que debute clínicamente por síntomas a partir de una metástasis.
En los últimos años se han llevado a cabo múltiples revisiones de series de CCR con el fin de evaluar la validez de la clasificación TNM. El sistema de clasificación TNM es una herramienta importante tanto para investigadores como para clínicos, siendo definido como uno de los predictores exactos de supervivencia más seguros en el CCR (12, 13).
La clasificación TNM para tumores malignos se estableció en 1943 (14). En 1958, Flocks y Kadesky proponen un sistema de clasificación basada en la extensión de la lesión primaria (15). Robson y cols en 1969, realizan una modificación de esta clasificación basada en hallazgos patológicos y factores pronósticos, con gran aceptación en la práctica clínica (16). En 1978 la Internacional Union Against Cancer (UICC) formula una clasificación por estadios basada en el sistema TNM. En las últimas dos décadas esta última clasificación ha sufrido varias modificaciones por la American Joint Comisión on Cancer (AJCC) y la UICC. En la edición de 1997 de la UICC/AJCC se establece el punto de corte para clasificar un tumor como pT1 ó pT2, dependiendo que el tamaño tumoral fuese de 2,5 ó 7 cm.
En el año 2002 se estableció la 6ª revisión de la TNM (17). En relación a la 5ª revisión de 1997, en lo referente a tumores renales, la revisión del 2002 hizo una subestadificación del tumor primario T1 en T1a (tumor de 4 cm. o menos) y T1b (tumor de más de 4 cm. pero menor de 7 cm). La clasificación clínica del tumor primario en T2 (tumor de diámetro máximo mayor de 7 cm., limitado al riñón), T3 (tumor que se extiende a las venas principales o invade la glándula suprarrenal o los tejidos perirrenales, pero sin atravesar la fascia de Gerota) y T4 (tumor que atraviesa la fascia de Gerota), no sufrió variación.
Este nuevo punto de corte de los tumores renales en T1a y T1b se estableció por ser el más recomendado en la cirugía parcial con preservación de órgano, ayudando al clínico a plantear la estrategia quirúrgica. Así, en pacientes con tumores T1a se les puede preservar el órgano, no siendo recomendable esta actuación en tumores T1b cuando el riñón contralateral funciona correctamente (12, 18, 19).
El objetivo de este trabajo es conocer los factores clínicos e histológicos implicados en la evolución y pronóstico del carcinoma renal, con especial atención al estadio tumoral, dada la controversia existente actualmente.
Material y métodos
Se llevó a cabo una revisión exhaustiva de las historias clínicas, de manera retrospectiva, de 316 carcinomas renales sometidos a resección quirúrgica entre los años 1970 y 2003. Los casos elegidos comprendió a pacientes con una edad media al diagnóstico de 61,4 ± 12,15 años y un rango entre 12-88 años. En todos los casos existió informe anatomopatológico que confirmaba la histología de adenocarcinoma de células renales. Todas las intervenciones fueron realizadas en el Hospital Universitario Central de Asturias por diferentes cirujanos.
De todos los casos se recogió nombre y apellidos del paciente con su número de historia, año de nacimiento y número de anatomía patológica. Se analizaron las variables que se mencionan a continuación, siendo posible recoger todas ellas en 212 casos:
1. Edad: menos de 50 años, entre 50-69 años, mayores o igual a 70 años.
2. Tipo histológico: células claras, granular, cromófobas, papilar o sarcomatoide.
3. Estadio local: se utilizó la clasificación de tumores malignos TNM, de la UICC, en su sexta edición del año 2002.
4. Grado nuclear de Fuhrman: se clasificaron en grado I, II, III o IV.
5. Necrosis: presencia o ausencia en la pieza.
6. Existencia o no de Invasión microvascular.
7. Tamaño tumoral en centímetros.
8. Número de tumores en la pieza de nefrectomía: único, dos, tres o múltiple.
9. Existencia de Tumor contralateral de manera simultánea.
10. Afectación ganglionar regional: Nx (no se pueden evaluar), N0 (no se demuestran metástasis ganglionares), N1 (metástasis en un único ganglio linfático) y N2 (metástasis en más de un ganglio linfático).
11. Metástasis a distancia en el momento del diagnóstico.
12. Localización de la metástasis en el momento del diagnóstico.
13. Clínica al diagnóstico: asintomático, local (hematuria, dolor y/o masa palpable), de la metástasis, ambas (local y la de la metástasis) o síndrome general (incluida fiebre e insuficiencia renal).
14. Anemia al diagnóstico.
15. Síndrome paraneoplásico: hipercalcemia, hipergammaglobulinemia, poliglobulia, síndrome de Stauffer o tromboflebitis.
16. Tratamiento inicial: paliativo, nefrectomía radical, nefrectomía parcial o nefrectomía con trombectomía.
17. Recidiva: definida como si o no.
18. Número de recidivas: no, una, dos o más de dos.
19. Localización de la primera recidiva: local, ganglionar, torácica, hepática, difusa, ósea u otras vísceras (cerebral, cutánea, ocular, parotidea, adrenal, yeyuno o vejiga).
20. Tratamiento de la primera recidiva: paliativo, exéresis, radioterapia o inmunoterapia.
21. Localización de la segunda recidiva: local, torácica, hepática, difusa, ósea u otras vísceras (cerebral, cutánea, bazo, SNC).
22. Tratamiento de la segunda recidiva: paliación, exéresis, radioterapia o inmunoterapia.
23. Meses transcurridos hasta la primera recidiva.
24. Seguimiento total en meses.
25. Estado actual.
El análisis estadístico se realizó mediante el programa SPSS, versión 11. Se consideró la existencia de significación estadística cuando la p fue menor de 0,05. Se recogieron variables de cada tumor referidas a las características de la neoplasia y a la evolución de los pacientes en cuanto a tiempo libre de enfermedad y mortalidad. Fueron 25 variables recogidas de cada tumor primario o de cada recidiva.
Las variables cuantitativas se expresan como media ± D.E. (desviación estándar) o bien como mediana (percentil 50) en los casos pertinentes (tiempo de supervivencia). Se utilizó el test de Student para comparar las medias de dos categorías dentro de una misma variable dependiente y el Análisis de la Varianza ANOVA (razón F) para comparar más de dos medias. Algunas de las variables cuantitativas fueron categorizadas para un análisis ulterior más sencillo. Las variables cualitativas se expresaron como frecuencias y porcentajes. Se realizaron agrupaciones de variables cualitativas en conjuntos homogéneos para facilitar el estudio multivariante posterior. Para conocer la existencia de asociación entre variables se llevaron a cabo tablas de contingencia y la prueba de Chi2 de Pearson. Se calculó la significación para este estadístico.
El análisis de supervivencia (tiempo libre de enfermedad y de supervivencia libre de cáncer) se realizó mediante el método de Kaplan-Meier, lo cual permitió su representación gráfica. Posteriormente, se realizó la prueba del rango logarítmico (log-rank), comparando de forma univariante las curvas de supervivencia y evaluando así el efecto de cada uno de los factores pronósticos sobre los tiempos libres de recurrencia y progresión.
Por último, consideramos las variables que fueron significativas en el análisis univariante como covariantes en la prueba del modelo de riesgos proporcionales de Cox, con la intención de determinar el efecto conjunto de los factores pronósticos que resultan significativos de forma independiente y cuantificar los riesgos relativos (odds ratio) e intervalos de confianza (IC) del 95% de recurrencia y supervivencia. Se eligió el procedimiento por pasos hacia delante, determinando el estadístico de Wald, que introduce y selecciona variables en un orden que depende del porcentaje de la varianza.
Resultados
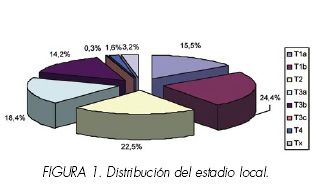
Descripción de la serieEn un 90,5% de pacientes (n: 286) el tipo tisular fue el de células claras, seguido del papilar (n: 10) y el granular (n: 8), con muy pocos casos correspondientes a células cromófobas o con un patrón sarcomatoide (n: 5). La mayoría de los tumores presentaron un estadio tumoral pT1b o pT2, si bien hubo 109 pacientes con tumores pT3-4 (Figura 1). La distribución del grado nuclear correspondió en la mayoría de los casos a grados I o II de Fuhrman. Se encontró necrosis en 165 tumores (52,2%) e invasión microvascular en 78 tumores (24,7%). La media del tamaño tumoral fue de 7,17 ± 3,4 (2-20) cms , existiendo 111 tumores de 7 o más cms, 57 casos (18%) de 4 o menos cms y 94 de 4,1 a 7 cms (29,7%), no recogiéndose este dato en 54 pacientes. En la mayoría de los casos se trataba de un tumor único (n: 290), existiendo afectación contralateral simultánea sólo en 6 pacientes.
En 26 casos (8,2%) hubo afectación ganglionar en el momento del diagnóstico (Tabla I). Además en 27 casos (8,6%) existían metástasis a distancia, con 289 pacientes sin evidencia de las mismas (Mo). De mayor a menor, las metástasis fueron pulmonares (n: 8), cerebrales (n: 6), óseas (n: 5), hepáticas (n: 2) y un caso por cada una de las siguientes: riñón contralateral, bazo, muscular, peritoneal única, carcinomatosis peritoneal y masa retroperitoneal.
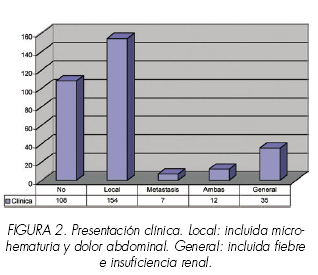
Se produjo clínica en 208 casos, destacando la local (48,7%) por hematuria (micro o macroscópica) y/o dolor, seguida de la general (11,1%) que incluyó fiebre y/o insuficiencia renal (Figura 2). Se objetivó anemia en 69 pacientes (21,8%) y síndrome paraneoplásico en 19 (6%). Este último consistió en poliglobulia (n: 10), síndrome de Stauffer (n: 5), tromboflebitis (n: 2), hipercalcemia (n: 1) e hipergammaglobulinemia (n: 1).
El tratamiento inicial consistió en nefrectomía radical en 287 pacientes (90,8%), debiendo realizarse trombectomía por trombo venoso (vena renal y/o cava) en 7 casos más. Se realizaron 18 nefrectomías parciales (5,7%), y se empleó terapia sintomática (paliativa) en 4 casos con tumores inoperables.
El seguimiento medio ha sido de 57,8 meses con una mediana de 49 meses (3 muertes en el postoperatorio inmediato). En este tiempo se han encontrado 76 recidivas (24,1%), de los cuales recidivaron 39 (51,3%) en el primer año, llamando la atención que en 18 casos (23,7% de las recidivas) se evidenciaron a partir del 5º año. Además, en 19 pacientes (6%) se encontró más de una recidiva durante el seguimiento. La media de tiempo libre de enfermedad fue de 36,26 meses (1-187) con una mediana de 13,5 meses. La mayor proporción de recidivas se produjeron a nivel toracopulmonar (n: 30), seguidas por las óseas (n: 14) y las locales (n: 9). El tratamiento de las recidivas consistió en paliación en 39 casos (52%), seguida de exéresis en 21 (28%) que consistió en RTU vesical (implante vesical), linfadenectomía o cirugía de la masa. Además se empleó radioterapia en 6 pacientes (8% de recidivas) tratados con inmunoterapia posteriormente y en 9 pacientes (12%) se utilizó inmunoterapia de forma aislada. Se produjo una segunda recidiva en 32 casos, la mayoría a nivel torácico (n: 7), hepático (n: 6) y óseo (n: 5). En la tabla II se especifican el lugar de la 2ª recidiva en relación con la primera y el tratamiento empleado.
Asociaciones univariantes y la comparación de medias
Se encontraron varias asociaciones significativas (prueba de Chi2), destacando:
Los pacientes de mayor edad tuvieron significativamente mayor proporción de anemia (p: 0,011).
Los tumores papilares tendieron a ser de bajo grado y los sarcomatoides de grados III-IV (p: 0,003). Estos últimos se asociaron más frecuentemente a la presencia de anemia (p: 0,008).
Los tumores avanzados (T3-T4) tendieron a presentar un grado nuclear III-IV, mayor tamaño, necrosis, afectación vascular, N+, M+ (p < 0,001). Además, tendieron a tener más frecuentemente clínica y anemia (p < 0,001), síndrome paraneoplásico asociado (p: 0,003) y a requerir un tratamiento más agresivo (p < 0,001).
El tamaño tumoral mayor se asoció a la presencia de metástasis (M) (p: 0,003), clínica (p < 0,001), s. paraneoplásico (p: 0,02) y tipo de cirugía empleada (radical vs parcial) (p: 0,02).
El grado nuclear avanzado se asoció a la presencia de clínica (p: 0,01) y anemia (p: 0,008). Además se encontró con mayor frecuencia necrosis (p < 0,001), afectación microvascular de la pieza (p: 0,002), mayor tamaño (p: 0,013), presencia de adenopatías (p: 0,009) y metástasis a distancia (p: 0,038).
Los tumores con necrosis tumoral tendieron a ser de mayor tamaño (p < 0,001), a presentar afectación vascular (p < 0,001) y ser N+ (p: 0,001) y M+ (p: 0,03).
La infiltración vascular histológica se asoció a mayor tamaño, N+, M+ (p < 0,001) y a presentar más clínica (p < 0,001), anemia (p: 0,005) y síndrome paraneoplásico (p: 0,001).
La presencia de clínica se asoció a la existencia de anemia (p < 0,001) y al tratamiento inicial (p < 0,001) (terapia sintomática).
La afectación ganglionar se asoció con la existencia de clínica (p: 0,01) y de metástasis a distancia (p: 0,003). Estas últimas se asociaron a la existencia de clínica (p < 0,001). Lógicamente la existencia de adenopatías o de metástasis a distancia se asociaron al tratamiento empleado (p < 0,001) (paliativo).
Estudio de supervivencia
Con una mediana de seguimiento de 49 meses (0-272 meses), el estado de los pacientes al finalizarlo se expresa en la Tabla III.
a) Estudio de factores implicados en la mortalidad cáncer específica.
1. Estudio univariante
Los factores que demostraron significación estadística en el tiempo de supervivencia relacionada con el carcinoma renal (prueba de log rank) en nuestra serie fueron los siguientes:
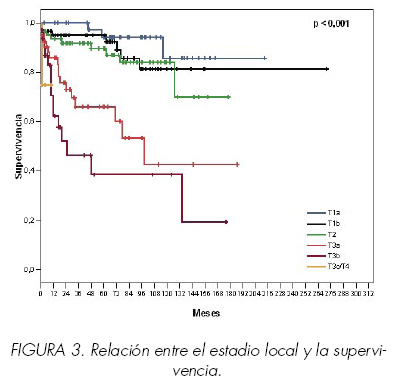
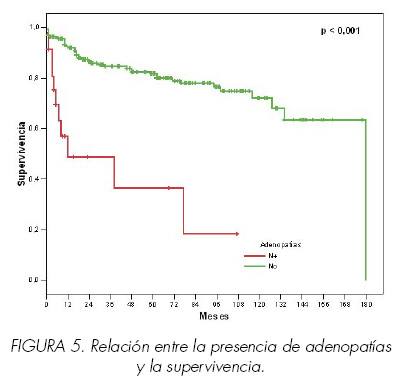
Estadio local tumoral (T) (p < 0,001), disminuyendo la probabilidad de supervivencia al aumentar el estadio (Figura 3).
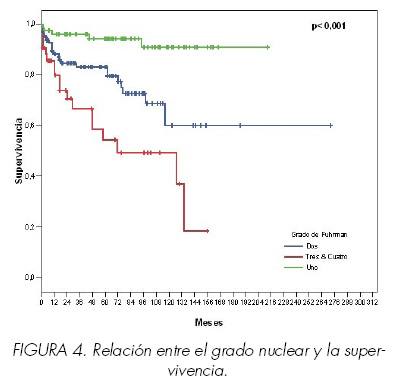
Grado nuclear (p < 0,001), disminuyendo la probabilidad de supervivencia al aumentar el grado (Figura 4). Se agrupó el grado III y IV para el estudio posterior, dada la semejanza en la supervivencia y el escaso nº de casos con un grado nuclear IV.
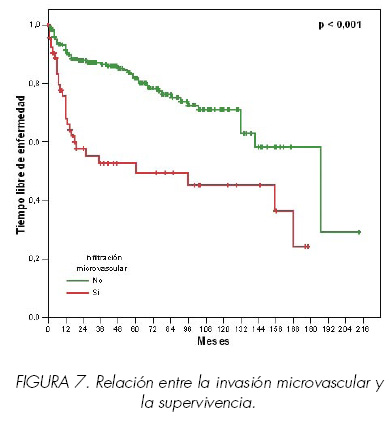
Necrosis (p: 0,017), invasión microvascular (p< 0,001). Su existencia empeoró la supervivencia significativamente. Igualmente, al aumentar el tamaño disminuyó significativamente la supervivencia (p: 0,012).
Presencia de ganglios tumores (p < 0,001) y de metástasis a distancia (p< 0,001). Su existencia empeoró la supervivencia (Figura 5).
Presencia de clínica (p: 0,0023) y de anemia (p: 0,004). Disminuyó la supervivencia significativamente, no existiendo diferencia entre los que tuvieron clínica sistémica o local.
Tipo de tratamiento inicial (p< 0,0001). Los que mejor supervivencia tuvieron fueron los sometidos a una nefrectomía parcial, si bien eran pacientes muy seleccionados previamente, por lo que no se incluyó esta variable en el estudio multivariante de Cox.
Tiempo libre de enfermedad (p< 0,001). En caso de recidiva, los que mejor supervivencia tuvieron fueron los pacientes que la presentaron más tardíamente.
Tratamiento de la 1ª recidiva. Cuando la exéresis fue posible como tratamiento único en la 1ª recidiva, la supervivencia fue significativamente mejor que con otros tratamientos (p: 0,044). Puede decirse además, que esto ocurrió para cualquier recidiva (tanto en la primera como en la segunda), es decir si la exéresis había sido el único tratamiento, la supervivencia ha sido significativamente mejor (p: 0,027) (Figura 6).
2. Estudio multivariante
Se estudiaron los factores que influían de forma independiente en la mortalidad cáncer específica, calculándose las odds ratio (OR) para cada factor, incluyéndose también los valores del índice de confianza del 95% de la OR. Resultaron los siguientes (no se incluyó el tipo de nefrectomía empleada, pero sí el resto de factores que mostraron diferencias significativas en el estudio univariante):
-Meses libre de enfermedad hasta la recidiva (2 o menos de 2 años frente a más de 2 años) (OR: 18,8; IC 95%: 4,1-84,8), cuando esta se produjo
-N+: presencia de adenopatías metastásicas (OR: 13,01; IC 95%: 2,8-60,9)
-Tratamiento de la primera recidiva cuando ésta se produjo (exéresis frente a otros tratamientos) (OR: 8,9; IC 95%: 2,5-31,6).
-Presencia de anemia (OR: 6,8; IC 95%: 1,8-25,8).
b) Estudio de factores implicados en el tiempo libre de enfermedad
Dada la importancia del tiempo libre de enfermedad hasta la recidiva, ya que influye de forma independiente en la mortalidad cáncer específica, se investigaron los factores propios del tumor que influyeron en el mismo.
1. Estudio univariante
Primero se estudiaron dichos factores de forma univariante. Los factores que demostraron significación estadística en el tiempo de supervivencia relacionada con el carcinoma renal (prueba de log rank) en nuestra serie fueron los siguientes
Tipo celular (p: 0,001). Los mejores son los papilares y los peores los sarcomatoides, aunque, como ya se dijo el nº de casos es escaso.
Estadio T (p< 0,001).
Grado nuclear de Fuhrman (p< 0,001).
Presencia de necrosis (p: 0,017) y de invasión microvascular (p< 0,001) (Figura 7).
Tamaño (p: 0,012): al aumentar el tamaño disminuye significativamente la supervivencia. No hubo diferencias significativas en la supervivencia entre los pT1a y pT1b, ni entre los pT3a y pT3b, pero si cuando se agrupan los pT1-pT3 frente a los pT3 (con algún pT4 escaso que existe). Los pT3c son muy pocos para poder analizarlos.
Presencia de clínica (p: 0,03) y anemia (p: 0,001).
2. Estudio multivariante
Se realizó igualmente un estudio multivariante de Cox para conocer los factores independientes, a partir de los aquí estudiados, que podrían influir en el tiempo hasta la recidiva, resultando sólo la anemia como el factor independiente implicado en la recidiva, con una OR de 5,4 (IC 95%: 2,56-11,33).
Discusión
En los últimos años se ha planteado un debate acerca de la importancia pronóstica del tamaño tumoral para el CCR convencional localizado, y si puede o no mejorarse la actual clasificación TNM en relación al tamaño tumoral. Con independencia de las múltiples revisiones de series de CCR con el fin de evaluar la validez de la clasificación TNM, esta continúa siendo uno de los predictores exactos de supervivencia más seguros en el CCR (12, 13).
En nuestra serie, en el estudio univariante de los factores implicados en el tiempo libre de enfermedad, el aumento del tamaño tumoral disminuía significativamente la supervivencia, sin haber diferencias significativas en la supervivencia entre pT1a y pT1b. De 116 casos de CCR con tamaño tumoral recogido en la serie de Delahunt y cols (20), encuentran que en el análisis univariante sólo el grado Fuhrman y el score AgNOR estaban asociados con la supervivencia y, sin embargo, en el análisis multivariante sólo el tamaño tumoral se mantuvo significativo. Concluyen que aunque el punto de corte de la clasificación TNM en pT1 y pT2, y el propósito de subdividir el estadio pT1 se correlacionan con la supervivencia, el tamaño como parámetro pronóstico del CCR es relativo más que indicativo al ser una variable continua.
Salama y cols (21) estudian el impacto del tamaño tumoral sobre la supervivencia cáncer específica y la recurrencia, en una serie de 259 pacientes con tumores renales. Proponen que subestratificar el CCR en pT1a y pT1b produce información pronóstica importante, validando las modificaciones del TNM del 2002. El punto de corte de 4.0 y 7.0 cm es razonable y práctico para tumores pT1a-T1b y pT1b-T2. Así mismo, concluyen que la subestratificación de pT1 es particularmente útil en tumores con histología de CCR y que no parece justificada ninguna modificación de los tumores pT1 y pT2.
No hemos evaluado la implicación pronóstica por separado de los 111 tumores clasificados como pT2 (tumor de diámetro máximo mayor de 7.0 cm, limitado al riñón). Frank y cols (22), en base a anteriores estudios que sugerían que la categoría pT2 conformaba un grupo heterogéneo de pacientes con tumores pequeños que tenían mejores resultados que aquellos con tumores grandes, realizan una revisión de 544 pacientes con CCR clasificados como pT2 con el fin de determinar un punto de corte en relación al tamaño tumoral dentro de esta categoría, y si tal subclasificación podría proporcionar capacidad pronóstica. Encuentran que un tamaño tumoral mayor o igual a 10 cm era predictor de recurrencia abdominal y torácica, independientemente de otras variables patológicas. Sugieren que la exactitud pronóstica de tumores pT2 de la actual clasificación TNM del año 2002 podría ser más apropiada subclasificándose la categoría pT2 en tumores mayores de 7.0 pero menores de 10 cm como pT2a, y aquellos con tamaño mayor de 10 cm en pT2b.
La actual clasificación TNM define a los tumores pT3 como aquellos tumores que se extienden a las venas principales o invaden la glándula suprarrenal o los tejidos perirrenales, pero sin atravesar la fascia de Gerota. De este modo los subclasifica en pT3a (invade glándula suprarrenal o tejidos perirrenales), pT3b (si se extiende de forma importante en las venas renal o cava por debajo del diafragma) o pT3c (si se extiende de forma importante en la vena cava por encima del diafragma). Debido a esta amplia clasificación clínica de los tumores pT3, se han llevado a cabo múltiples revisiones estudiando los factores que influirían en la supervivencia cáncer específica de estos pacientes, con el fin de mejorar la actual clasificación. En nuestra serie encontramos diferencias significativas cuando agrupábamos los tumores en pT1-pT2 frente a los pT3, pero no las encontramos entre tumores pT1a y pT1b, ni entre pT3a y pT3b. Los tumores clasificados de manera global como pT3-pT4 tendieron a presentar un grado nuclear III-IV, mayor tamaño, necrosis, afectación vascular, afectación de ganglios linfáticos y metástasis a distancia. Además, tendieron a presentar con más frecuencia clínica, síndrome paraneoplásico asociado y requirieron un tratamiento más agresivo.
En un estudio retrospectivo llevado a cabo por Han y cols (23), observaron que pacientes con tumores pT3a que infiltraban la glándula suprarrenal ipsilateral tenían un pronóstico de supervivencia poco favorable, superponible a los pacientes con tumores pT4. Siemar y cols (18), realizan un estudio retrospectivo en el que incluyen 1794 pacientes clasificándose 694 (39%) como pT3, y de estos 241 como pT3a. Mediante un análisis tipo ROC establecieron un punto de corte de 7.0 cm en 237 pacientes con pT3a, mostrando por separado dos grupos pronósticos, ya que los pT3a con un tamaño tumoral menor de 7.0 cm presentaban una supervivencia cáncer específica significativamente mejor que los pT3a mayores de 7.0 cm. No encontraron diferencias significativas entre los pT3a con tumores menores de 7.0 cm y los pT1, ni entre los pT3a con tumores mayor de 7.0 cm y los pT2. Concluyen que los tumores con afectación de la glándula suprarrenal ipsilateral presentan una supervivencia muy corta, recomendándose su reclasificación en pT4. Así mismo, como la infiltración de grasa perirrenal suele ser diagnosticada por el patólogo en el postoperatorio, y por tanto no afecta a la decisión clínica tomada para el tratamiento de estos tumores, no debería usarse este criterio para asignar al tumor en una categoría T determinada. La categoría pT3 debería sólo incluir los casos de invasión vascular (actualmente clasificados como pT3b y pT3c).
Gómez Pérez y cols, en una revisión reciente (24) donde evalúan la categoría pT3a de la actual clasificación TNM del cáncer renal, concluyen que los tumores de células renales pT3aNx por infiltración grasa sin metástasis, de tamaño menor o igual a 5,5 cm, se comportan como tumores organoconfinados respecto a la supervivencia, y su reclasificación no modifica el valor pronóstico independiente del TNM como predictor de progresión tumoral.
Pese a lo anterior, hay estudios que han determinado que la infiltración del tejido adiposo perinefrítico es una variable pronóstica independiente de supervivencia (25, 26), indicando que la afectación de la grasa próxima al seno renal parece presentar una mayor predilección por la infiltración venosa o por las metástasis a distancia al tener mejor acceso al sistema vascular (27).
Lebovich y cols (28), sobre una muestra de 675 pacientes tratados mediante nefrectomía radical o parcial para tumores pT3a, pT3b, pT3c o pT4, estudian la asociación entre el nivel del trombo tumoral (clasificándolo en 5 estadios) y la invasión grasa. Encuentran diferencias significativas en cuanto al fallecimiento debido al tumor, entre pacientes que tenían invasión vascular y afectación grasa, incluso cuando se ajustaba teniendo en cuenta la presencia de ganglios y metástasis a distancia. Concluyen que debería hacerse una reclasificación de los tumores clasificados como pT3, tomando como variables independientes la afectación grasa y el nivel del trombo.
Los mismos autores en otra serie de 424 pacientes estudiaron la presencia de invasión directa adrenal ipsilateral en tumores clasificados como pT3a y pT3b, para comparar la supervivencia con los pT4 (29). Determinaron que los tumores renales que invaden directamente la glándula adrenal se comportan de forma más agresiva que los que afectan a grasa perirrenal, presentando una evolución similar a aquellos que se extienden por fuera de la fascia de Gerota, por lo que deberían ser clasificados como pT4.
El estudio de amplias series de ACR se ha centrado en los últimos años en la búsqueda de otros factores pronósticos diferentes del estadio, que influyan en la supervivencia de estos tumores. Nosotros hemos encontrado en el estudio univariante de los factores implicados en la mortalidad cáncer específica, que los siguientes factores demuestran significación estadística en el tiempo de supervivencia relacionada con el carcinoma renal: estadio tumoral, el grado nuclear, la existencia de necrosis e invasión microvascular, la presencia de clínica y anemia, así como la afectación ganglionar y de metástasis a distancia. No obstante, en el estudio multivariante, los únicos factores que influían de forma independiente en la mortalidad cáncer específica fueron: los meses libres de enfermedad hasta la recidiva cuando esta se produjo, la presencia de adenopatías metastásicas, el tratamiento de la primera recidiva y la presencia de anemia. Es quizás este último factor el que más nos ha llamado la atención, sobre todo por la escasa aparición en publicaciones relativas a los factores pronósticos del adenocarcinoma de células renales.
La anemia es referida en el estudio de Rivas y cols (30), donde en la evaluación de 229 carcinomas de células renales encuentran una correlación entre la hipercalcemia, bajos niveles de hemoglobina y altos niveles de fosfatasa alcalina, y baja supervivencia. Nosotros no hemos encontrado significación estadística entre los factores implicados en la mortalidad cáncer específica al síndrome paraneoplásico (donde incluimos la hipercalcemia).
Chillon y cols (31), en un análisis descriptivo de 57 casos de ACR sobre el estudio de variables que modifican la supervivencia, concluyen que el estadio tumoral es uno de los principales factores pronósticos. Así, los estadios I y II (T1-2 N0 M0) presentaban una supervivencia a los 24 meses de 95,83% frente al 48,48% para los estadios III y IV. En este mismo estudio, la tasa de supervivencia a los 24 meses entre los casos diagnosticados de forma incidental es del 100%, descendiendo hasta el 59% en el resto de casos diagnosticados cualquiera que fuera su clínica.
En la identificación de factores pronósticos en una serie de 233 carcinomas de células renales, Koutani y cols concluyen que los tres factores pronósticos con mayor relevancia son la presencia de metástasis viscerales, la invasión linfática y la presencia de síntomas (32).
Conclusiones
Si bien, por los estudios anteriormente citados, la clasificación en cuanto al pronóstico de los tumores pT1 y pT2 parece adecuada, debería modificarse la actual clasificación en lo referente a tumores pT3 y pT4, lo que ayudaría a la mejor toma de decisiones en cuanto a la actitud terapéutica de tumores con afectación vascular, de grasa perirrenal y de glándulas adrenales.
Cabe destacar que no sólo factores conocidos como el estadio tumoral, la presencia de ganglios tumorales o la afectación metastásica a distancia, están implicados en la supervivencia. Otros a tener en cuenta que hemos demostrado en esta serie son la presencia de anemia o el tratamiento de la primera recidiva.
Bibliografía y lecturas recomendadas (*lectura de interés y **lectura fundamental)
1. CHOW, W.H.; DEVESA, S.S.; WARREN, J.L. y cols.: Rising incidence of renal cell cancer in the United States. JAMA ; 281: 1628. 1999. [ Links ]
2. LA VECCHIA, C.; LEVI, F.; LUCCHINI, F. y cols.: Descriptive epidemiology of kidney cancer in Europe. J Nephrol ; 5: 37. 1992. [ Links ]
3. THOENES, W.; STORKEL, S.; RUMPEL, H.J.: Histopathology and classification of renal cell tumors (adenomas, oncocytomas and carcinomas): The basic cytological and histopathologycal elements and their use for diagnostics. Pathol Res Pract ; 181: 125. 1986. [ Links ]
4. MOSTOFI, F.K.; DAVIS, C.J.: Histological typing of the kidney tumours. World Health Organization. International classification of tumours. 2nd Ed. Springer-Verlag 1998. [ Links ]
5. KOVACS, G.: Molecular differential pathology of renal cell tumours. Histopathology. 43: 7. 1993. [ Links ]
6. HELLSTENS, S.; BERGE, T.; WEHLIN, L.: Unrecognized renal cell carcinoma. Clinical and diagnostic aspects. Scand. J. Urol. Nephrol. ; 15: 269. 1981. [ Links ]
7. MCNICHOLLS, D.W.; SEGURA, J.W.; DEWEERD, J.H.: Renal cell carcinoma: long-term survival and late recurrence. J. Urol.; 126: 17. 1981. [ Links ]
8. GIBERTI, C.; ONETO, F.; MARTORANA, G. y cols.: Radical nephrectomy for renal cell carcinoma: long-term results and prognostic factors on a series of 328 cases. Eur. Urol.; 31: 40. 1997. [ Links ]
9. ASO, Y.; HOMMA, Y.: A survey on incidental renal cell carcinoma in Japan. J. Urol. 147: 340. 1992. [ Links ]
10. NOVICK, A.C.; CAMPBELL, S.C.: Tumores renales. En: Walsh, P.C.; Resnick, M.; Retik, A.B. y cols. Eds Campbell Urología. Buenos Aires. Ed. Panamericana SA; Cap 75: 2938. 2004. [ Links ]
11. ANDREWS, P.C.; NOVICK, D.E.: Síndromes urológicos paraneoplásicos. AUA Update series; Lección 32: 69. 1996. [ Links ]
**12. JAVIDAN, J.; STRICKER, H.J.; TAMBOLI, P. y cols.: Prognostic significance of the 1997 TNM classification of renal cell carcinoma. J Urol Oct; 162: 1277. 1999. [ Links ]
**13. GETTMAN, M.T.; BLUTE, M.L.; SPOTTS, B. y cols.: Pathologic staging of renal cell carcinoma: significance of tumor classification with the 1997 TNM staging system. Cancer; 91: 354. 2001. [ Links ]
14. DENOIX, P.F.: Note on the possible role of the International Union against cancer in nomenclature, classification, analytical index, bibliography and documentation. Acta Unio Int Contra Cancrum; 8: 92. 1952. [ Links ]
15. FLOCKS, R.H.; KADESKY, M.C.: Malignant neoplasm of the kidney: an analysis of 353 patients followed 5 years or more. J. Urol.; 79: 196. 1958. [ Links ]
16. ROBSON, C.J.; CHURCHILL, B.M.; ANDERSON, W.: The results of radical nephrectomy for renal cell carcinoma. J. Urol.; 101: 297. 1969. [ Links ]
*17. SOBIN, L.H.; WITTEKIND, C.H.: TNM classifications: Kidney. In: TNM Classifications of Malignant Tumours, 6th ed. New York: Wiley-Liss, 2002. [ Links ]
**18. SIEMER, S.; PÖNICKE, C.; HUMKE, U. y cols.: Prognostic significance of the TNM classification of renal cell carcinoma: a comparison of the 4th and 5th editions. Aktuel Urol; 32: 308. 2000. [ Links ]
19. HAFEZ, K.S.; FERGANY, A.F.; NOVICK, A.C.: Nephron sparing surgery for localized renal cell carcinoma: impact of tumor size on patient survival, tumor recurrence and TNM staging. J. Urol.; 162: 1930. 1999. [ Links ]
20. DELAHUNT, B.; KITTELSON, J.M.; MCCREDIE, M.R.E. y cols.: Prognostic importance of tumor size for localized conventional (clear cell) renal cell carcinoma. Assessment of TNM T1 and T2 tumor categories and comparison with other prognostic parameters. Cancer; 94: 658. 2002. [ Links ]
**21. SALAMA, M.E.; GURU, K.; STRICKER, H. y cols.: pT1 substaging in renal cell carcinoma: validation of the 2002 TNM staging modification of malignant tenal epithelial tumors. J. Urol. 173: 1492. 2005. [ Links ]
*22. FRANK, I.; BLUTE, M.L.; LEIBOVICH, B.C. y cols.: pT2 classification for renal cell carcinoma. Can its accuracy be improved?. J. Urol. 173: 380. 2005. [ Links ]
23. HAN, K.R.; BUI MHT PANTUCK, A.J.; FREITAS, D.G. y cols.: TNM T3a renal cell carcinoma: adrenalgland involvement is not the same as renal fat invasion. J. Urol. 169: 899. 2003. [ Links ]
24. GÓMEZ PÉREZ, L.; BUDÍN ALBA, A.; PONTONES MORENO, J.L. y cols.: Evaluación del estadio pT3a de la actual clasificación TNM del cáncer renal. Actas Urol. Esp.; 30: 287. 2006. [ Links ]
25. FICARRA, V.; PRAYER-GALETTI, T.; NOVELLA, G. y cols.: Incidental detection beyond pathological factors as prognostic predictor of renal cell carcinoma. Eur. Urol.; 43: 663. 2003. [ Links ]
26. PATTARD, J.J.; LERAY, E.; RODRÍGUEZ, A. y cols.: Correlation between symptom graduation, tumor characteristics and survival in renal cell carcinoma. Eur. Urol.; 44: 226. 2003. [ Links ]
*27. THOMPSON, R.H.; LEIBOVICH, B.C.; CHEVILLE, J.C. y cols.: Is renal sinus fat invasion the same as perinephric fat invasion for pT3a renal cell carcinoma?. J. Urol. 174: 1218. 2005. [ Links ]
*28. LEIBOVICH, B.C.; CHEVILLE, J.C.; LOHSE, C.H.M. y cols.: Cancer specific survival for patients with pT3 renal cell carcinoma –can the 2002 primary tumor classification be improved?. J. Urol.; 173: 716. 2005. [ Links ]
*29. THOMPSON, R.H.; LEIBOVICH, B.C.; CHEVILLE, J.C. y cols.: Should direct ipsilateral adrenal invasion from renal cell carcinoma be classified as pT3a?. J. Urol.; 173: 918. 2005. [ Links ]
30. RIVAS DEL FRESNO, M.; FERNÁNDEZ GÓMEZ, J.M.; SAN MARTÍN BLANCO, A. y cols.: Nuestra experiencia con el adenocarcinoma renal (II): curso clínico, diagnóstico, y factores pronósticos antes del tratamiento quirúrgico. Arch. Esp. Urol. 48: 67. 1995. [ Links ]
31. CHILLÓN SEMPERE, F.S.; GARCÍA TABAR, P.J.; MEGÍAS GARRIGÓS, J. y cols.: Adenocarcinoma renal. Factores pronósticos. Arch. Esp. Urol.; 56: 1005. 2003. [ Links ]
*32. KOUTANI, A.; BRETHEAU, D.; LECHEVALLIER, E. y cols.: Prognostic factors of renal adenocarcinoma: study of a series of 233 patients. Prog Urol. Dec; 6: 884. 1996 [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Antonio Jalón Monzón
Electra, 1 - 4º L, Escalera Posterior.
33208 Gijón. Asturias. (España)
ajalonm@hotmail.com
Trabajo recibido: 27 de julio 2006