My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista de Diagnóstico Biológico
Print version ISSN 0034-7973
Rev Diagn Biol vol.50 n.1 Jan./Mar. 2001
REVISIÓN
Fenobarbital: farmacocinética, toxicología y monitorización por el Laboratorio
J. Varona, E. Escribano, JL. Martín-Calderón
Servicio de Bioquímica. Hospital General Universitario Gregorio Marañón. Madrid
Palabras clave: fenobarbital, farmacocinética, monitorización, antiepilépticos, niveles plasmáticos, barbitúricos.
Key Words: phenobarbital, pharmacokinetics, Therapeutic monitoring, antiepileptic, plasma levels, barbiturates.
Resumen
El fenobarbital es un agente antiepiléptico muy utilizado en el tratamiento de las crisis tónico-clónicas parciales y generalizadas. Su estrecho rango terapéutico y su elevada capacidad depresora del sistema nervioso central junto con su capacidad de producir autoinducción enzimática hace que sea uno de los fármacos más frecuentemente monitorizados en el laboratorio clínico. En este trabajo revisamos la farmacología del fenobarbital, estudiando además la farmacocinética, las reacciones adversas debidas a la intoxicación, las indicaciones de su monitorización y los métodos empleados en el laboratorio para la medida de los niveles plasmáticos.
Summary
Phenobarbital is an antiepileptic agent widely used for treatment partial and generalised tonic-clonic seizures. Its narrow therapeutic range and its high ability for depressing central nervous system together with its capacity to produce enzymatic self-induction make that it is one of the most frequently drugs monitored at clinical laboratory. In this work we review pharmacological proprieties of the phenobarbital, studying in addition pharmacokinetics, adverse reactions due to poisoning, the indications of monitoring and analytical methods used for its measure at clinical laboratory.
Recibido: 11-II-00
Aceptado: 4-IX-00
Correspondencia:
José Luis Martín-Calderón
Hospital General Universitario Gregorio Marañón
Doctor Esquerdo 46
28007 Madrid
Propiedades farmacológicas
El fenobarbital es el prototipo del grupo de barbitúricos que poseen actividad antiepiléptica específica a dosis inferiores a las que producen sueño. Es eficaz en crisis tónico-clónicas generalizadas y tiene valor limitado en crisis parciales simples, pero no es activo en las ausencias, que incluso puede agravar.
Como todo barbitúrico el fenobarbital es químicamente una diamida cíclica de seis miembros, derivado de la estructura del ácido barbitúrico (malonilurea). Su denominación sistemática es 5-etil-5-fenil-2,4,6-(1H,3H,5H)pirimidina triona. La fórmula molecular de este compuesto aparece en la figura 1. Es un ácido débil, con un Pka=7.3. El grupo fenilo de la posición 5 dota al fenobarbital de una actividad antiepiléptica específica.
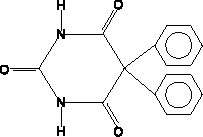
Figura 1. Estructura química del fenobarbital.
Como se ha señalado además de la acción sedante-hipnótica y anestésica propia de todos los barbituratos, el fenobarbital presenta acción anticonvulsiva, a dosis inferiores a las hipnóticas, que no es antagonizada por anfetaminas. Igual que la fenitoína, suprime la fase tónica de la respuesta al electroshock, pero a diferencia de esta aumenta el umbral de electroshock necesario para producir convulsiones. Es capaz de deprimir la actividad de ciertos focos y reduce los fenómenos de propagación, lo que indica que actúa sobre neuronas anormalmente activas1.
El mecanismo de acción no está totalmente aclarado, y se supone que está relacionado en parte con el responsable de la acción hipnosedante. Es conocido que el fenobarbital actúa como estabilizante de la membrana neuronal por afinidad fisicoquímica por los lípidos de membrana, afectando a su permeabilidad y al flujo iónico; en efecto, presinápticamente reduce la entrada de calcio en la neurona y con ello la exocitosis de neurotransmisores, mientras que de modo no sináptico reduce la conductancia a los iones Na+ y K+, bloqueando las descargas repetidas. Los estudios a nivel celular muestran depresión de la transmisión sináptica, sin disminución de la excitabilidad neuronal, pero esta acción no es uniforme en todas las neuronas. Además de esta acción "inespecífica" el fenobarbital actúa postsinápticamente facilitando la inhibición mediada por GABA y reduciendo la excitación producida por glutamato y/o acetilcolina. A las dosis en que se emplea en la clínica este mecanismo postsináptico es el predominante2.
En cuanto a las indicaciones clínicas cabe señalar que encuentra su máximo uso en el gran mal, pero también puede utilizarse en el tratamiento de las epilepsias focales y estados convulsivos del niño. Es uno de los fármacos de elección en el tratamiento del status epilepticus y de las convulsiones febriles3. Otras indicaciones son el síndrome de abstinencia en niños nacidos de madres adictas a los opiáceos o barbitúricos4y la hiperbilirrubinemia debido a la inducción de enzimas microsomales hepáticas, lo que acelera el aclaramiento de la bilirrubina.
El rango de dosis utilizado es de 4-5 mg/kg en el niño y de 2-3 mg/kg en el adulto.
El fenobarbital es un fármaco con grandes posibilidades de interacción con otros. Las interacciones más frecuentes son de tipo farmacocinético, relacionadas con su capacidad inductora de enzimas hepáticas. Así disminuye los niveles plasmáticos de carbamacepina, corticosteroides, anticoagulantes cumarínicos, hipoglucemiantes orales, anticonceptivos hormonales, griseofulvina, vitamina D, teofilina, doxiciclina, antidepresivos tricíclicos, beta-bloqueantes, digitoxina, cloramfenicol, codeína, relajantes mus culares, por inducción de su metabolismo, haciendo necesario un aumento de la dosis de dichos fármacos5. Por otra parte valproato, cloramfenicol, carbamacepina, clonazepam, y etosuximida aumentan la semivida del fenobarbital, por inhibición parcial de su metabolismo6. Las cumarinas, fenilbutazona y doxiciclina reducen la semivida del fenobarbital. En el caso de las cumarinas conviene hacer la apreciación de que en una primera fase el fenobarbital las desplaza de su unión a proteínas plasmáticas, aumentando la fracción libre activa, con el riesgo de hemorragias; pero en una segunda fase debido a la inducción enzimática se aumenta el aclaramiento metabólico de los anticoagulantes, incrementándose los índices de coagulabilidad de la sangre. La interacción con fenitoína es compleja debido a que ambos son inductores enzimáticos y en el tratamiento combinado se muestra un extremo grado de variación de los niveles plasmáticos7,haciéndose necesaria en estos casos una cuidadosa monitorización de ambos.
Interacciones de tipo farmacodinámico son las que tienen lugar con las bases xánticas (cafeína, teofilina), las cuáles reducen la eficacia protectora del fenobarbital frente al electroshock en ratón, haciéndose necesario un aumento de la dosis de antiepiléptico para controlar las convulsiones8.Algunos antagonistas del calcio también dan lugar a interacción con el fenobarbital sin alteración de los niveles plasmáticos de ninguno de los fármacos; así flunarizina y nimodipino potencian el poder anticonvulsivante del fenobarbital en ratón, pero no ocurre esto con el verapamil o diltiazem9.
Farmacocinética
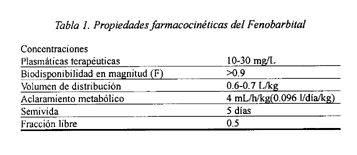
La absorción por vía oral es completa, pero algo lenta apareciendo la máxima concentración plasmática 9-10 horas después de una sola dosis oral10.
La unión a proteínas plasmáticas se produce en un 40-60% de la concentración total presente en el plasma. Rápidamente se alcanza en cerebro una concentración igual a la plasmática debido a su afinidad por los lípidos y proteínas cerebrales. El volumen aparente de distribución es de 0.5 l/kg11.
El 25% de la dosis se excreta inalterada por el riñón, siendo esta excreción dependiente del pH y aumentando la fracción excretada con la alcalinización de la orina. El principal metabolito es el derivado p-hidroxifenílico, que se excreta en forma de glucurónido. La semivida es larga, de 2 a 6 días, siendo más larga en neonatos que en adultos y más corta y variable en niños.
Se ha establecido la ventana terapéutica del fenobarbital en 15-35 mg/l, sin embargo en tratamientos crónicos se pueden alcanzar concentraciones de 70 mg/l sin que se produzcan efectos secundarios, debido al desarrollo de tolerancia. Los niveles terapéuticos tardan unos 10 días en alcanzarse y el estado de equilibrio se produce en 14-21 días.
Toxicología
Reacciones adversa dependientes de la dosis administrada son , la sedación (que se produce en todos los pacientes al inicio del tratamiento), falta de concentración, y otros efectos propios de fármacos con actividad hipnosedante; a dosis altas se manifiestan ataxia y nistagmus12. En niños se manifiesta irritabilidad e hiperactividad y en ancianos confusión y agitación13.Efectos tóxicos sin relación con la dosis son: erupción escarlatiforme( se presenta en el 1-2% de los casos) y dermatitis exfoliativa; porfiria en pacientes predispuestos (debido a la inducción de la síntesis del grupo hemo), hepatomegalia, depleción de ácido fólico, vitamina D y protrombina; a lo que se debe respectivamente la presentación de anemia megaloblástica, osteomalacia y hemorragias en recién nacidos descendientes de madres tratadas. Tras un tratamiento crónico puede precipitar una crisis de status epilepticus14.
El tratamiento con fenobarbital produce aumento en los niveles de colesterol total, recomendándose una monitorización de los niveles de colesterol y un control dietético durante el curso de la terapia15.
En roedores el fenobarbital aumenta la toxicidad del valproato, dando lugar a hígado graso.
Interés de su monitorización
El fenobarbital es un fármaco que se monitoriza de rutina debido a varios motivos que ya se han apuntado y que aquí resumiremos: 1) Toxicidad dentro de márgenes terapéuticos relativamente estrechos, que puede manifestarse en adultos con sedación y estimulación paradójica en niños. 2) La interrupción de la dosificación de modo brusco puede precipitar una crisis de status epilepticus16.La relación entre niveles plasmáticos y dosis administrada puede establecerse del siguiente modo:
1) Niveles inferiores a 10 mg/l tienen escasa o nula eficacia en el control de las crisis.
2) Niveles de 10-15 mg/l pueden ser suficientes para controlar a pacientes con epilepsias leves, pero no para prevenir convulsiones febriles. Si con estos niveles se observan efectos secundarios y no son transitorios puede ser conveniente cambiar de antiepiléptico.
3) Con 15-25 mg/l pueden controlarse la mayor parte de los pacientes y se previenen las convulsiones febriles. Si se observan efectos secundarios no transitorios puede ensayarse a reducir dosis para que desaparezcan estos efectos con niveles que todavía sean efectivos frente a las crisis.
4) Concentraciones plasmáticas de 25-40 mg/l pueden ser necesarias para controlar algunos pacientes con epilepsias más severas. Se observan con frecuencia efectos tóxicos, especialmente somnolencia, en los pacientes en que se inicia el tratamiento, pero suelen desaparecer cuando se continua.
5) Por encima de 40 mg/l no está demostrado que aumente la eficacia y sí la frecuencia de presentación de efectos tóxicos. La mínima concentración plasmática del fármaco que se ha visto asociada a sobredosis mortal ha sido 60 mg/l. En asociación con alcohol y otros depresores del SNC la muerte se produce con concentraciones inferiores.
Monitorización de niveles plasmáticos
La determinación de niveles de fenobarbital puede realizarse en plasma, suero o incluso saliva17,21. No se han observado interferencias debidas a los anticoagulantes.
Como casi todos los fármacos el fenobarbital puede ser medido por dos grandes grupos de métodos: los métodos cromatográficos y los métodos inmunoquímicos.
Los métodos cromatográficos son más específicos, pero son menos rápidos y su manejo requiere entrenamiento especial lo que les hace menos adecuados para el laboratorio de urgencias. La cromatografía de gases tiene la sensibilidad analítica adecuada, aunque presenta problemas debido a la presencia de productos de descomposición por las altas temperaturas a que se opera. La derivatización del compuesto puede minimizar estas dificultades18. La cromatografía líquida de alta resolución (HPLC) parece ser el método analítico que ofrece una determinación más precisa y exacta, considerándose el método de referencia19,20,21.
Los procedimientos inmunoquímicos son de fácil manejo y resultan adecuados para la automatización, lo que les hace cómodos para un laboratorio de urgencias. Sin embargo tienen el problema de que se puede presentar reactividad cruzada con otros barbitúricos.
BIBLIOGRAFÍA
1. MacDonald,R.L:,and McLean, M.J. Cellular bases of barbiturate and phenytoin anticonvulsiant drug action. Epilepsia, 1982, 23 Suppl. 1: S7-S18. [ Links ]
2. Twyman, R.E., Rogers C.J., and Macdonad R.L. Differential regulation of g-aminobutyric acid receptor channles by diazepam and phenobarbital. Annals of Neurology, 1989, 25: 213-220. [ Links ]
3. Rogawiski, M.A. and Porter R.J. Antiepileptic drugs: pharmacological mechanism and clinical efficacy with consideration of promising developmental stage compounds. Pharmacology Review, 1990, 42: 223-286. [ Links ]
4. Brignolio F., Vreze L. And Baruchello M. Evaluation of the effectiviness of monotherapy in the treatment of epilepsy. Minerva Medica, 1991. 82: 859-862. [ Links ]
5. Bun H., Monjael-Mouterde S., Noel F., Durand A. And Cano J.P. Effects of age and antiepileptic drugs on plasma levels and kinetics of clobazam and N-desmetylclobazam. Pharmacology and Toxicology, 1990, 67: 136-140. [ Links ]
6. Ramsay R.E., McManus D.Q., Guterman A., Briggle T.V., Vazquez D.,Perchalski R., Yost R. A. And Wong P. Carbamazepin metabolism in humans: effect of concurrent anticonvulsant therapy. Therapeutic Drug Monitoring, 1990, 12: 235-241. [ Links ]
7. Singh L.M., Mentha S., Vorha R.M. and Nain C.K. Monitoring of drug therapy in epileptic children. International Journal of Clinical Pharmacology, Therapeutic and Toxicology, 1987. 25: 251-254. [ Links ]
8. Wlaz P., Rolinski Z., Kleinrok Z. and Czucwar S.J. Influence of chronic aminophyline on the anticonvulsant efficacy of phenobarbital and valproate in mice. Epilepsia, 1993, 34: 385-389. [ Links ]
9. De Sarro G.B., De Sarro A., Trimarchi G.R., Nistico G. Effects of some calcium antagonist upon the acyivity of common antiepieptc compounds on sound-induced seizures in DBA/2 mice. Gen Pharmacology, 1992, 23: 75-82. [ Links ]
10. Watari N., Sugiyama Y., Kaneniwa N. and Hiura M. Prediction of hepatic first-pass metabolism and plasma levels folowing intravenous and oral administration of barbiturates in the rabit based on quantitative structure-pharmacokinetics relationship. Journal of Pharma cokietic and Biopharmaceutics. 1988, 16. 279-301. [ Links ]
11. Durán J.A., Sánchez A., Serrano M.I. and Serrano J.S. Phenobarbital plasma level/dose ratio in monotherapy. Influence of age, sex and dose. Methods and Findings in Experimental and Clinical Pharmacology, 1988, 10: 337-340. [ Links ]
12. Tedechi G., Casucci G., Alloca S., Riva R., DiConstanzo A., Tata M.R., Quatrone A., Baruzzi A. And Bonavita V. Neurocular side effects of carbamazepine and phenobarbital in epileptic patients as measured by saccadic eye movements analysis. Epilepsia, 1989, 30:62-66. [ Links ]
13. Herranz J.L., Armijo J.A., Arteaga R. Clinical side effects of phenobarbital, primidone, phenytoin, carbamazepine and valproate during chemotherapy in children. Epilepsia, 1988, 29: 794-804. [ Links ]
14. Franzoni E., Govoni M., D'Addato S., Gualandi S., Sangiorgi Z., Descovich G.C., and Salvioli G.P. Total cholesterol, high density liopoprotein cholesterol and triglycerides in children receiving antiepileptic drugs. Epilepsia, 1992, 33: 932-935. [ Links ]
15. Franzoni E., Mambelli M., Mansoni P. and Govoni M. Usefulness of the evaluation of plasma levels of primidone and phenobarbital. Pediatric Medica Chirurgica, 1987, 9: 599-600. [ Links ]
16. Feely M., Cooke J., Price D., Sinleton S., Mehta A., Bradford L. and Calvert R. Low dose phenobarbitone as an indicator of compliance with drug therapy. British Journal of Clinical Pharmacology, 1987, 24: 77-83. [ Links ]
17. Tokugawa K., Ueda K., Fujito H. And Kurokawa T. Correlation between the saliva and free serum concentration of phenobarbital in epileptic children. European Journal of Pediatric, 1986; 145: 401-402. [ Links ]
18. Benchekroun Y., Ribon B., Desage M. And Brazier J.L. Simultaneous quantitation of phenobarbitone and p-hydroxyphenobarbitone and their perdeuteroethyl analogues in biological fluids by combined gas chromatography-mass spectrometry. Journal of Chromatography Biomedical Applications, 1987; 420: 287-296. [ Links ]
19. Schmermund J.T., Locke D.C. Design of photoionization detector for high performance liquid chromatography using an automated liquid to vapor interface and application to phenobarbital in an animal eed and to amantidine. Journal of Chromatography, 1990; 505: 319-328. [ Links ]
20. Liu H., Delgado M., Forman L.J., Eggers C.M. and Montoya J.L. Simultaneous determination of carbamazeoine, phenytoi, phenobarbital, primidone and their principal metabolites by high-performance liquid chromatography with photodiode-array detection. Journal of Chromatography Bomedical Applications, 1993; 616: 105-115. [ Links ]
21. Herkes G.K., McKinnon G.E., and M.J. Eadie. Simultaneous quantitation of salivary carbamazepine, carbamazepine-10,11-epoxide, phenytoin and phenobarbitone by high performance liquid chromatography. Journal of Chromatography Biomedical Applications, 1989; 496: 147-154. [ Links ]