Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista de Diagnóstico Biológico
versión impresa ISSN 0034-7973
Rev Diagn Biol vol.50 no.1 ene./mar. 2001
ORIGINAL
Estudio de correlación de Homocisteína plasmática por cromatografía de intercambio iónico e inmunoanálisis de fluorescencia polarizada
de intercambio iónico e inmunoanálisis de fluorescencia polarizada
A. Latorre*, P. Gómez*, T. Navarro*, P. Díaz-Rubio*, C. Fernández-Miranda**, A. Martínez*
(*)Servicio de Bioquímica. (**)Servicio de Medicina Interna. Hospital Universitario 12 de Octubre. Madrid.
Palabras clave: Homocisteína, cromatografía, Inmunoanálisis.
Key Words: Homocysteine, chromatography, inmunoanalysis.
Resumen
La determinación de Homocisteína plasmática tiene interés por ser un factor de riesgo independiente de padecer enfermedad cardiovascular. Los laboratorios clínicos deben ofrecer métodos para su determinación que sean rápidos y fiables, debido al importante papel que presentan los diferentes parámetros bioquímicos en el diagnóstico de la aterosclerosis.
Nuestro laboratorio desarrolló un método de cromatografía de intercambio iónico utilizando un sistema de detección postcolumna de ninhidrina, el cual es lento y unido al aumento de la demanda de peticiones para la determinación de Homocisteína plasmática, nos llevó a evaluar un nuevo método de inmunoanálisis de fluorescencia polarizada completamente automatizado.
Hemos evaluado y comparado ambos métodos. Los coeficientes de variación intra e interserie oscilaron entre 0,93 y 5,31%. La media de las recuperaciones obtenidas fue de 98,5 % para ambos métodos. El límite de detección obtenido fue de 0,75 µmol/L y 0,79 µmol/L para el método cromatográfico y para el de inmunoanálisis de fluorescencia polarizada respectivamente.
Encontramos una buena correlación entre el método de cromatografía de intercambio iónico y el de inmunoanálisis de fluorescencia polarizada (y = 0,81 + 1,65x; r = 0,98).
En conclusión, el método de inmunoanálisis de fluorescencia polarizada es un procedimiento rápido y fiable que puede ser de gran utilidad para el análisis de rutina de los niveles de Homocisteína plasmática.
Abstract
The determination of plasma Homocysteine concentration is considered to be of particular interest for being as an independent risk factor for cardiovascular disease. Therefore, clinical laboratories should measure Homocysteine levels with reliable and rapid procedures in order to provide a correct approach to the biochemical factors playing a role in atherosclerosis.
Our laboratory developed an ion-exchange chromatography method based on the use of a post-column ninhydrin reaction, but this procedure was time consuming, which along with the increasing demand for the determination of total Homocysteine in plasma prompted us to evaluate a new automated fluorescence polarization inmunoanalysis.
We have developed and compared both methods. The within run and between run imprecisions ranged from 0.93 to 5.31%. The analytical recovery was 98.5 % for both methods. The detection limit study was 0.75 µmol/L and 0.79 µmol/L for the ion-exchange chromatography method and the fluorescence polarization inmunoanalysis respectively.
We found a significant relationship between the fluorescence polarization inmunoanalysis method and the ion-exchange chromatography method (y = 0.81 + 1.65x; r = 0.98).
In conclusion, the fluorescence polarization inmunoanalysis method is a reliable procedure that can be used for routine analysis of Homocysteine levels.
Recibido: 9-VI-00
Aceptado: 9-XI-00
Correspondencia:
Adela Latorre Ibarra.
Gonzalo de Córdoba 17, 4ºB. 28010-Madrid
adela.latorre@prontomail.com
Introducción
En los últimos años, se ha incrementado el interés por la determinación de la concentración de Homocisteína (Hcy) plasmática debido al elevado número de estudios clínicos y epidemiológicos que demuestran que una elevación moderada de ésta es un factor de riesgo independiente de enfermedad cardiovascular1-3. La determinación de Hcy total plasmática también puede ser de utilidad como marcador del estado vitamínico del organismo, al estar implicadas la cobalamina, la piridoxina y el ácido fólico en su metabolismo4. Además, su análisis está indicado para el diagnóstico de errores innatos del metabolismo (homocistinurias congénitas)5 e incluso para valorar el riesgo de padecer defectos del tubo neural6. También se han descubierto moderados aumentos de la Hcy plasmática en situaciones de fallo renal7, estados malignos8 y en tratamientos farmacológicos con antifolatos8.
La Hcy es un aminoácido sulfurado que proviene del metabolismo de la metionina, por un proceso de transmetilación dependiente de S-adenosilmetionina. Su metabolismo tiene lugar por dos vías, una remetilación a metionina usando 5-metiltetrahidrofolato como dador de grupos metilo y cobalamina como cofactor o bien sufre una transulfuración, utilizando la piridoxina como cofactor9. En el plasma circula en un 70 % unida a proteínas plasmáticas, principalmente la albúmina, un 30 % en distintos estados de oxidación y una pequeña proporción en forma libre10. La suma de todas las formas circulantes es lo que se considera la Hcy total y es la que tiene interés diagnóstico y la que se debe determinar en el laboratorio clínico de rutina.
La determinación de la Hcy plasmática es de gran importancia, tanto por su papel en la patogénesis de la enfermedad vascular, como por las repercusiones sobre la estrategia terapéutica a emplear. En un principio, se utilizaron métodos basados en técnicas de radioinmunoanálisis11, después se pasó a emplear otros basados en técnicas de cromatografía. Se ha utilizado la cromatografía de gases acoplada a espectrometría de masas12, la cromatografía líquida de alta resolución13 y la cromatografía de intercambio iónico14. Esta última permite la determinación simultánea de otros aminoácidos plasmáticos en analizadores convencionales de aminoácidos.
Actualmente se ha desarrollado un método de inmunoanálisis de fluorescencia polarizada (FPIA), totalmente automatizado15.
En nuestro laboratorio, en un primer momento, desarrollamos un método de cromatografía de intercambio iónico para la determinación de la Hcy plasmática16. Ante el aumento de la demanda de niveles plasmáticos de Hcy, decidimos evaluar el nuevo método de FPIA17 con el fin de mejorar la calidad asistencial. El objetivo de este estudio es evaluar la correlación entre el método de cromatografía de intercambio iónico utilizado en nuestro laboratorio de rutina con el nuevo método de FPIA, con el fin de ofrecer una alternativa con un método de elevada precisión y rapidez en su ejecución.
Material y Métodos
Material.
DL-Homocisteína, L-Homocistina, L-Metionina, L-Valina, Ditioeritritol (DTE) y ácido 5-sulfosalicílico son suministrados por Sigma (St. Louis, EE.UU.). Los reactivos, materiales de control y calibradores para el método de FPIA son suministrados por Abbott Laboratories (Abbott Park, Illinois, EE.UU.). Las soluciones amortiguadoras y el reactivo de ninhidrina utilizados en el método cromatográfico son suministrados por Beckman Instruments (Palo Alto, California, EE.UU.).
Población.
Como sujetos control se seleccionaron 120 individuos sanos, 54 hombres y 66 mujeres, con edades comprendidas entre 19 a 74 años (x- ± DS = 46,90 ± 14,15 años) procedentes de la plantilla de nuestro hospital y de consultas externas que acudían para exámenes de rutina. Todos ellos tenían análisis hematológicos y bioquímicos, así como concentraciones séricas de cobalamina y folato, dentro de la normalidad. Ninguno padecía enfermedad vascular previa o actual y no estaban sometidos a tratamiento.
Para el estudio de correlación se seleccionaron 137 individuos, con valores de Hcy comprendidos entre 3,8 y 51,4 µmol/L.
Preparación de la muestra.
Las muestras fueron recogidas en tubos con EDTA y colocadas inmediatamente en hielo. El plasma fue separado y congelado a 20 ºC hasta su posterior análisis.
Para el análisis por el método cromatográfico, se realizó previamente una reducción con DTE y una desproteinización con ácido sulfosalicílico al 30%.Cuantificación de la Homocisteína.
* Cromatografía de intercambio iónico.
Las concentraciones plasmáticas de Hcy fueron determinadas en un analizador automático de aminoácidos (Beckman System 6300) con un sistema de detección postcolumna de ninhidrina. La detección se realizó a una absorbancia de 570 nm. La solución standard utilizada fue L-Homocisteína (12,5 µmol/L), L-Metionina ( 25 µmol/L) y L-Valina (50 µmol/L). La solución amortiguadora empleada fue citrato de litio (pH = 3,2) con un flujo de 20mL por hora y 33,5 ºC de temperatura. El tiempo de retención para la Hcy fue de 24 minutos. El tiempo total del análisis fue de 60 minutos por muestra.* Inmunoanálisis de fluorescencia polarizada.
La determinación se realizó en un sistema automático IMx® (Abbot Laboratories).
Para la curva de calibración se utilizó S-adenosil-L-homocisteína con seis concentraciones diferentes (0, 2,5, 5, 10, 20 y 50 µmol/L). Los calibradores se introdujeron por duplicado. Como material de control se utilizaron tres concentraciones de L-Homocistina disuelta en suero humano (7, 12,5 y 25 µmol/L)
Para el análisis de las concentraciones plasmáticas de Hcy existen tres fases: 1. Reducción con DTE y tratamiento enzimático con adenosina y S-adenosil-L-homocisteína-hidrolasa (t=30 min.) 2. Adición de un anticuerpo monoclonal antiS-adenosil-L-homocisteína (t=10 min.). 3. Adición de un trazador de S-adenosil-L-homocisteína marcado con fluoresceína (t=10 min.). El tiempo total del análisis fue de 60 minutos para 20 muestras.
Protocolo de evaluación.
Estudio de imprecisión: para el estudio de imprecisión se utilizaron dos muestras de concentraciones normal y elevada de Hcy. Para el estudio de precisión intraserie se determinaron cada una de las muestras 20 veces durante un mismo día. Para la precisión interserie se analizaron las mismas muestras en 20 días diferentes, dentro del mismo mes.
Estudio de recuperación: se realizaron diluciones seriadas (1:2, 1:4 y 1:8) de una muestra de plasma, para obtener 4 concentraciones de Hcy entre 20 y 50 µmol/L. Las muestras se analizaron por duplicado. También se añadieron diferentes concentraciones de homocistina disuelta en solución amortiguadora de fosfato a una muestra de plasma.
Estudio del límite de detección: en el método cromatográfico se consideró como límite de detección la mínima concentración de Hcy capaz de ser integrada por el sistema. En el método de inmunofluorescencia polarizada se analizaron 4 series con 10 replicados del calibrador A (0 µmol/L) y 2 replicados del calibrador B (2,5 µmol/L). Se consideró como límite de detección, el límite superior (percentil 97,5) de la sensibilidad media de las cuatro series analizadas del calibrador A.
Intervalo de referencia: se analizaron las 120 muestras control por los dos métodos. Los valores obtenidos fueron tratados estadísticamente con el test de Kolmogorov-Smirnov para comprobar su ajuste a la normalidad. Los resultados obtenidos se expresaron en x- ± 2DS.
Estudio de correlación: se determinaron las 137 muestras problema con diferentes concentraciones plasmáticas de Hcy por los dos métodos en estudio. Los resultados obtenidos fueron analizados por el método de regresión lineal.
Análisis estadístico: además del test de Kolmogorov-Smirnov y del método de regresión lineal ya comentados, se utilizó la t de student como método paramétrico para la comparación de medias en el estudio del intervalo de referencia.
Resultados
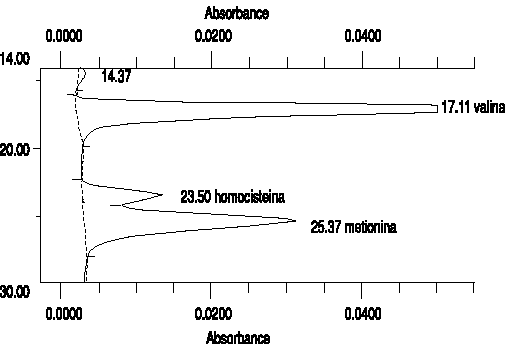
La figura 1 muestra el estándar de calibración utilizado en el método de cromatografía de intercambio iónico.Figura 1. Estándar de calibración de la Homoscisteína plasmática por el método cromatográfico.
Imprecisión: la tabla I muestra los coeficientes de variación intra e interensayo hallados para cada uno de los métodos.
Recuperación: la media de las recuperaciones obtenidas fue de 98,5 % para la Hcy y 101,7 % para la homocistina en el método cromatográfico y de 98,5 % y 89,0 % respectivamente para el método de FPIA.
Límite de detección: en el método cromatográfico la sensibilidad analítica fue de 0,75 µmol/L. En el método de FPIA, la de tectabilidad media fue de 0,49 µmol/L con un límite superior de 0,79 µmol/L.
Intervalo de referencia: los valores de Hcy obtenidos siguieron una distribución normal. La tabla II muestra los valores de referencia hallados por ambos métodos. Se hallaron diferencias estadísticamente significativas al comparar ambos sexos, pero no se hallaron diferencias en los valores de Hcy entre el método cromatográfico y el de FPIA.
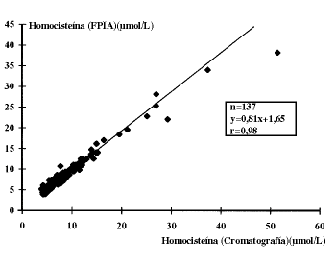
Estudio de correlación: la figura 2 muestra la recta obtenida en el análisis por regresión lineal. Se obtuvo un coeficiente de correlación de 0,98. La ecuación de la recta obtenida fue: y =0,81x + 1,65.
Figura 2. Estudio de la correlación de Homocisteína plasmática por el método de cromatografía
de intercambio iónico y el de FPIA.
Discusión
El interés despertado en los últimos años por la determinación de la concentración plasmática de la Hcy, debido a su papel como factor de riesgo de padecer enfermedad cardiovascular, crea la necesidad por parte de los laboratorios clínicos de desarrollar nuevos métodos cada vez más rápidos y precisos para poder asegurar una buena actividad asistencial. Para conseguir este objetivo, lo ideal es implantar métodos automatizables que ofrezcan resultados de manera rápida y que reduzcan al mínimo el manejo de la muestra.
Hasta ahora se han utilizado técnicas cromatográficas, como es la cromatografía de intercambio iónico14 que es larga y laboriosa, ya que precisa un pretratamiento de la muestra basado en una reducción y una posterior desproteinización y sólo permite el análisis de una muestra por hora, lo que conlleva un retraso en el tiempo de respuesta y posibilidad de errores debido a los complicados procesos manuales.
Ante la demanda en nuestro laboratorio de un elevado número de peticiones de Hcy plasmática, evaluamos un nuevo método basado en FPIA, realizado en un analizador automático IMx® (Abbott Lab.) que elimina los procesos de pretratamiento de la muestra y que además permite el análisis de 20 muestras por hora. Además, este método evita reacciones cruzadas con aminoácidos similares a la Hcy al utilizar un anticuerpo específico.
El tratamiento de la muestra, una vez extraída en tubo con EDTA, es igual para ambos métodos. Es de gran importancia el evitar la liberación de la Hcy del interior de los hematíes18, ya que podría dar valores falsamente elevados de Hcy plasmática y sería de interés en aquellos casos en que se encontraran valores cercanos al límite de la normalidad. Para evitarlo, la muestra recién extraída es colocada inmediatamente en hielo y centrifugada siempre antes de transcurrida una hora de la extracción.
Los dos métodos presentan una buena precisión intra e interensayo con coeficientes de variación que van de 0,93 a 5,31 %, lo que evita el análisis por duplicado de las muestras.
El método de FPIA presenta la ventaja del uso de calibradores y controles comerciales suministrados por Abbott, evitándose así el tener que prepararlos diariamente debido a la tendencia a oxidarse fácilmente que tiene la Hcy.
Los estudios de recuperación y detectabilidad son similares para los dos métodos. La buena recuperación obtenida para concentraciones moderadas y elevadas de Hcy permite que se detecten tanto errores innatos del metabolismo, que cursan con valores altos de Hcy, como moderados aumentos que permiten seguir la evolución del tratamiento.
El estudio de correlación demuestra que al tener un valor de coeficiente de correlación entre ambos métodos de 0,98, son totalmente comparables. Además, al comparar los valores de referencia obtenidos por ambos métodos, no se encuentran diferencias estadísticamente significativas.
Los valores de Hcy plasmática obtenidos para determinar los intervalos de referencia son similares a otros autores19, 20. Por otro lado, se encuentran diferencias estadísticamente significativas entre ambos sexos tal y como está descrito en la bibliografía21, 22.
En conclusión, tanto el método cromatográfico como el de FPIA son métodos que ofrecen resultados fiables y precisos, pero a nivel asistencial el método de cromatografía de intercambio iónico tiene un mayor número de inconvenientes ya que es un método que necesita una reducción y desproteinización de la muestra, es largo y precisa de personal especializado. En cambio, el método de FPIA está completamente automatizado, es más rápido y además evita el proceso de pretratamiento, lo cual hace que sea el método de elección para la implantación en un laboratorio de rutina.
Agradecimientos
Expresamos nuestro agradecimiento a Manuela Gómez, Blanca Navalón y Juan Carlos Nieto por su ayuda técnica en este estudio.
Bibliografía
1. Clarke R, Daly L, Robinson K, Naughten E, Cahalane S, Fowler B et al. Hyperhomocysteinemia: an independent risk factor for vascular disease. N Engl J Med 1991; 324: 1149-55. [ Links ]
2. Kang S-S, Wong PWK, Malinow MR. Hyperhomocysteinemia as a risk factor for occlusive vascular disease. Ann Rev Nutr 1992; 12: 279-98. [ Links ]
3. Boushey CJ, Beresford SAA, Omenn GS, Motulsky AG. A quantitative assessment of plasma homocysteine as a risk factor for vascular disease. Probable benefits of increasing folic acid intakes. JAMA 1995; 274: 1049-57. [ Links ]
4. Stabler SP, Marcell PD, Podell ER, Allen RH, Savage DG, Lindenbaum J. Elevation of total homocysteine in the serum of patients with cobalamin or folate deficiency detected by capillary gas chromatography-mass spectrometry. J Clin Invest 1988; 81: 466-74. [ Links ]
5. Carson NAJ, Cusworth DC, Dent CE. Homocystinuria: a new inborn error of metabolism associated with mental deficiency. Arch Dis Child 1963; 38: 425-36. [ Links ]
6. Mills JL, Mc Partlin JM, Kirke PN, Lee YJ, Conley MR, Weir DG et al. Homocysteine metabolism in pregnancies complicated by neural-tube defects. Lancet 1995; 345: 149-51. [ Links ]
7. Wilcken DEL, Gupta VJ, Betts AK. Homocysteine in the plasma of renal trasplant patients: effects of cofactors for methionine metabolism. Clin Sci 1981; 61: 743-9. [ Links ]
8. Refsum H, Wesenberg F, Ueland PM. Plasma homocysteine in children with acute lymphoblastic leukemia. Changes during a chemotherapeutic regimen including methotrexate. Cancer Res 1991; 51: 828-35. [ Links ]
9. Mudd SH, Levy HL, Skorby F. Disorder of transulfuración. In: Scriber CR, Beaudet AL, Sly WS, Valle D, Eds. The metabolic and molecular bases of inherited disease, 7 th ed. New York Mc Graw-Hill, 1995: 1229-327. [ Links ]
10. Fiskerstrand T, Refsum H, Koalheim G, Ueland PM. Homocysteine and other tiols in plasma and urine: automated determination and sample stability. Clin Chem 1993; 39: 263-71. [ Links ]
11. Refsum H, Helland S, Ueland PM. Radioenzymic determination of homocysteine in plasma and urine. Clin Chem 1985; 31: 624-8. [ Links ]
12. Stabler SP, Marcell PD, Podell ER, Allen RH. Quantitation of total homocysteine, total cysteine, and methionine in normal serum and urine using capillary gas chromatography-mass spectrometry. Annal Biochem 1987; 162: 185-96. [ Links ]
13. Jacobsen DW, Gatautis VJ, Green R. Determination of plasma homocysteine by high-performance liquid chromatography with fluorescence detection. Anal Biochem 1989; 178: 208-14. [ Links ]
14. A. Andersson, L. Brattström, A. Isaksson, B. Israelsson, B. Hultberg. Determination of homocysteine in plasma by ion-exchange chromatography. Scand J Clin Lab Invest 1989; 49: 445-9. [ Links ]
15. Schipchandler MT, Moore EG. Rapid, fully automated measurement of plasma homocyst(e)ine with the Abbott IMx® analyzer. Clin Chem 1995; 41: 991-4. [ Links ]
16. Gómez P, Latorre A, Guzmán JM, Vargas C, Fernández-Miranda C, Díaz-Rubio P et al. Desarrollo de un nuevo método cromatográfico de intercambio iónico para la determinación de homocisteína total plasmática. Anal Clin 2000; 25: 25-32. [ Links ]
17. Gómez P, Navarro T, Díaz-Rubio P, Fernández-Miranda C, Latorre A, Vargas C et al. Evaluación de un procedimiento para determinar homocisteína en plasma por inmunoanálisis de fluorescencia polarizada. Quim Clin 2000; 19: 22-6. [ Links ]
18. Ueland P, Refsum H, Stabler S, Malinow R, Andersson A, Allen RH. Total homocysteine in plasma or serum: methods and clinical application. Clin Chem 1993; 39: 1764-79. [ Links ]
19. Jacobsen DW, Gatautis VJ, Green R, Robinson K, Savon SR, Secic M et al. Rapid HPLC determination of total homocysteine and other thiols in serum and plasma: sex differences and correlation with cobalamine and folate concentrations in healthy subjects. Clin Chem 1994; 40: 873-81. [ Links ]
20. Pastore A, Massoud R, Motti C, Lo Russo A, Fucci G, Cortesse C et al. Fully automated assay for total homocysteine, cysteine, cysteinilglycine, glutathionine, cysteamine and 2-mercaptopropionylglycine in plasma and urine. Clin Chem 1998; 44: 825-32. [ Links ]
21. Boers GH, Smals AG, Trijbels FY, Leermakers AI, Kloppenborg W. Unique efficiency of methionine metabolism in premenopausal women may protect against vascular disease in reproductive years. J Clin Invest 1983; 72: 1971-6. [ Links ]
22. Wilcken DEL, Gupta VJ. Cysteine-homocysteine mixed disulphide: Differing plasma concentrations in normal men and women. Clin Sci 1979; 57: 211-5. [ Links ]