Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO  Similares en Google
Similares en Google
Compartir
Revista de Diagnóstico Biológico
versión impresa ISSN 0034-7973
Rev Diagn Biol vol.50 no.3 jul./sep. 2001
ORIGINAL
Detección mediante RT-PCR de células tumorales circulantes
en pacientes con melanoma maligno en estadio III.
Correlación con el grosor y la histología del tumor.
E. Carrillo*, J. Prados**, C. Melguizo**, J. A. Marchal***, H. Boulaiz*, S. Serrano****, A. Aránega*.
* Departamento de Ciencias Morfológicas, Facultad de Medicina, E-18071, Granada.
** Departamento de Ciencias de la Salud, Universidad de Almería E-04002, Almería.
*** Departamento de Ciencias de la Salud, Universidad de Jaén, E-23071.
**** Departamento de Dermatología, Facultad de Medicina, E-18071, Granada.
Palabras clave: Melanoma maligno; ARNm tirosinasa; RT-PCR; células tumorales circulantes; enfermedad metastásica
Key words: Malignant Melanoma; tyrosinase mRNA; RT-PCR; circulating tumor cell; metastatic disease.
Resumen
El objetivo de nuestro estudio ha sido evaluar la utilidad de la Transcriptasa reversa y Reacción en cadena de la polimerasa (RT-PCR) en la detección de la enzima tirosinasa como marcador de la presencia de células derivadas de melanocitos en pacientes con melanoma maligno en estadio III y su correlación con factores pronósticos como el grosor y la forma clínico-histológica del tumor. La detección de células de melanoma circulantes mediante RT-PCR se ha realizado en un grupo de 28 pacientes con melanoma maligno en estadio III (clasificación de la AJCC). Nuestros resultados demuestran una alta positividad de la PCR en este grupo de pacientes siendo más frecuente en tumores con un grosor > 4mm (75%). No obstante, no encontramos correlación entre la positividad de la PCR y la forma clínico-histológica del tumor. Nuestros resultados sugieren la posibilidad de aplicar la detección del ARNm de la tirosinasa mediante RT-PCR como un nuevo marcador en el pronóstico del melanoma maligno.
Summary
The objetive of our study was to evaluate the utility of the reverse transcriptase-polymerase chain reaction (RT-PCR) in the detection of the tyrosinase enzyme as a marker of circulating melanocites in melanoma patients (stage III) and the correlation with prognostic factors such as thickness and histologic type tumors. Melanoma cells were identified through the tyrosinase mRNA by RT-PCR from 28 patients with stage III of malignant melanoma (classified to the AJCC guidelines). Our findings showed a high PCR positivity from patients in stage III, which were more frequent in primary tumors measuring > 4mm (75%). However, no correlation was observed between the positive PCR results and the histological appearance of the primary tumor. Our results suggest the possible application of the PCR assay for tyrosinase mRNA as a new marker in judging the prognosis of malignant melanoma.
Recibido: 19-IX-00
Aceptado: 29-III-01
Correspondencia: Antonia Aránega, Departamento de Ciencias Morfológicas, Facultad de Medicina, Universidad de Granada, E-18071 Granada, España. Tel: 958-243534 Fax: 958-246296
E-mail: e.carrillo@caramail.com
Este trabajo ha sido subvencionado por el Fondo de Investigaciones Sanitarias Proyecto FISS 95/0974
y por la empresa Schering-Ploung
Introducción
En los últimos años se ha producido un aumento en la tasa de incidencia del melanoma maligno MM debido a un diagnóstico más precoz y a la acción acumulativa de carcinógenos como los rayos solares1. Sin embargo, el pronóstico del MM, aunque ha sido relacionado con diferentes factores como el grosor del tumor, el nivel de invasión2, y la histología del tumor3, es difícil de establecer4. La posibilidad de detectar células de melanoma en sangre periférica se relaciona con la predicción del desarrollo de metástasis5 y se presenta como un nuevo factor pronóstico. La detección precoz de estas células circulantes permitiría aplicar un tratamiento en estadios tempranos de la enfermedad y por tanto mejorar el pronóstico del paciente6.
La enzima tirosinasa, implicada en el último paso de la biosíntesis de melanina, es un marcador específico para la detección de células derivadas de melanoma debido a que solo se expresa en grandes cantidades en melanocitos7. La utilización de la transcriptasa reversa y reacción en cadena de la polimerasa (RT-PCR) para amplificar el ARNm de la tirosinasa se presenta como una metodología útil con la que detectar células circulantes derivadas de melanoma en pacientes afectados por esta enfermedad8-9.
El objetivo de nuestro estudio es determinar mediante RT-PCR la presencia de la enzima tirosinasa en sangre periférica de pacientes con MM en estadio III, y establecer su posible correlación con el grosor de Breslow y la histología del tumor, dos factores utilizados clásicamente en el pronóstico de esta patología.
Material y métodos
Selección de los pacientes
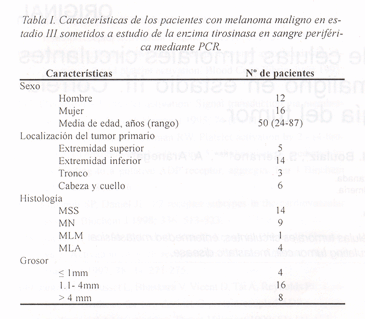
Las muestras de sangre han sido obtenidas en la Unidad de Melanomas del Servicio de Dermatología del Hospital Clínico San Cecilio de Granada. El grupo de análisis ha estado formado por 28 pacientes con MM en estadio III, según la clasificación de la AJCC, que presentaban metástasis ganglionar sin evidencias de enfermedad en otras localizaciones y que habían sido sometidos a disección ganglionar (Tabla I). Como controles negativos se han utilizado muestras de sangre de 10 pacientes sanos sin evidencia de enfermedad, que han sido obtenidas del Banco de Sangre del Hospital de San Cecilio de Granada. Utilizamos como muestra biológica positiva un ganglio extirpado de un paciente afecto de melanoma en estadio IV.
Proceso de extracción de ARN de muestras de sangre
Las muestras de sangre (5-10 ml) se recogieron en 5 tubos con etilenodiaminotetraacetato (EDTA), se guardaron a 4oC y se procesaron en un periodo de tiempo entre 2-4 h después de la obtención. La sangre fue centrifugada a 2500 rpm durante 5 min, desechando el plasma y recogiendo el suero que se transfirió a un tubo de policarbonato. Se añadieron 45 ml de H20-dietil pirocarbonato (DEP) y PBS-10x, agitando y centrifugando a 2500 rpm, durante 5 min, para obtener un pellet exento de glóbulos rojos. Para la extracción de ARN de linfocitos se utilizó el Kit isoRNA-FAST PLUS (Master Diagnóstica, Granada, España). La cuantificación del ARN se realizó mediante un espectrofotómetro de luz ultravioleta (ultrospec 2000, Cambridge, England) a una densidad óptica entre 260 nm y 280 nm. Posteriormente, el ARN se chequeó mediante electroforesis en mini gel de agarosa al 1%. Los geles se visualizaron con un transiluminador de ultravioletas (TFP 35M,Vilber Lourmat) y se fotografiaron con una Cámara Polaroid MP-4, con película Polaroid 665.
Oligonucleótidos
Los oligonucleótidos utilizados para la amplificación del gen de la tirosinasa fueron: ME-1 (sentido): 5'-TTG GCA GAT TGT CTG TAGCC-3' y ME-2 (antisentido): 5' AGG CAT TGT GCA TGCTGCTT-3', que amplifican un fragmento de 284pb. La integridad del ARN fue determinada usando los primers correspondientes al ADNc de ß-actina: 5' ATC ATG TTT GAG ACC TTC AA 3' (sentido) y 5' CAT CTC TTG CTC GAA GTC CA 3' (antisentido). Estos primers amplifican un fragmento de 248 pb8.
Transcriptasa Reversa
Las muestras de ARN se incubaron con la enzima de transcripción inversa que, en presencia de cebadores y desoxinucleótidos trifosfatos (dNTP), cataliza la reacción de síntesis de las cadenas de ADN complementarias a las de ARN (ADNc) y cuya temperatura óptima de transcripción es de 42oC. El proceso se realizó mediante un Kit comercial (Promega) donde cada tubo de reacción contenía un volumen total de 20 µl, compuesto de: ARN (1 µgr), tampón de transcriptasa reversa (100 mM Tris-HCl, pH 8,8 a 25oC; 500 mM KCl; Tritón X-100), proteína inhibidora de ARNasa (rRNAsin) (0.4 µmol), transcriptasa reversa (AMV) (24 U), Poli T (oligo-dTprimer) (1 mmol), dNTPs (10 mM) y agua hasta 20 µl. La transcriptasa reversa se realizó en el autociclador LINUS Autocycler 32 (Linus) a 42oC durante 15 min.
Reacción en cadena de la polimerasa
El resultado de la transcriptasa reversa se diluyó al 1/10 en H2O-DEP, utilizándose una alícuota de 5 µl para la PCR. Cada tubo de reacción contenía: resultado de la transcriptasa reversa (5µl), tampón de la enzima Taq polimerasa (10 µl), dNTPs (0,2mM), enzima Taq polimerasa (Boehringer Mannheim, Germany) (5U/µl), primers ME-1 y ME-2 (1 µmol) y agua hasta 100 µl. Los ciclos utilizados para la amplificación del gen de la tirosinasa fueron 1 min para la desnaturalización del ADN a 94oC, 2 min de acoplamiento entre los cebadores y el ADN diana a 58o C, y 3 min de extensión a 72oC. Se realizaron 30 ciclos con una extensión final de 7 min a 72oC. El resultado de la PCR se chequeó mediante electroforesis en gel de agarosa al 2%, de forma similar a la anteriormente descrita. Para poder extrapolar el peso de los fragmentos de ADN, se utilizó el marcador de peso molecular VI (Boehringer Mannheim).
Resultados
Determinación de la enzima tirosinasa en pacientes con estadio III.
La determinación de la presencia de tirosinasa en sangre periférica mediante PCR con los primers específicos M1 y M2, se realizó en el mismo momento de la disección ganglionar y demostró que de los 28 pacientes en estadio III, 20 (71,4%) presentaban células de melanoma en sangre periférica (PCR positiva); en los 8 pacientes restantes (28,6%) no pudimos demostrar la presencia de células tumorales en sangre periférica, siendo la PCR negativa. La RT-PCR de las muestras de sangre de los 10 individuos sanos utilizados como controles fue negativa.
Correlación entre la PCR y el grosor de tumor.
Se realizó un estudio de la posible relación entre la presencia de células melánicas en sangre y el grosor del tumor de los pacientes con MM en estadio III. Tan sólo uno de los 4 pacientes con un grosor menor de 1,0 mm fue positivo para la PCR (25%). Sin embargo, de los 14 pacientes con un grosor entre 1,1-4 mm, 9 fueron positivos (64%) y de los 8 con un grosor mayor de 4 mm, 6 fueron positivos (75%). Nuestros resultados señalan un aumento del porcentaje de pacientes PCR positivos conforme aumenta el grosor de la lesión. La aplicación de un análisis estadístico chi-cuadrado de tendencia lineal permitió demostrar una asociación significativa (p= 0,005) entre las variables PCR y grosor de la lesión.
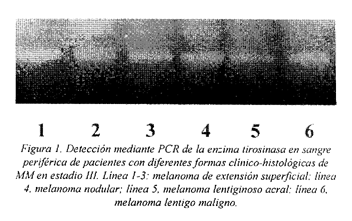
Correlación entre la determinación mediante PCR de células de melanoma en sangre periférica y la forma clínico-histológica del tumor.
Los pacientes se agruparon en función de la forma clínico-histológica del tumor en 4 grupos: melanoma de extensión superficial (SSM), melanoma lentiginoso acral (MLA), melanoma nodular (MN) y melanoma lentigo maligno (LMM). El estudio mediante PCR para detectar la enzima tirosinasa en sangre periférica de pacientes en estadio III determinó que de los 14 pacientes con SSM, 10 fueron PCR positivos (71,4%); de los 9 pacientes diagnosticados con MN, 5 presentaron células de melanoma en sangre periférica (55,5%), mientras que de los 4 pacientes con MLA, todos fueron PCR positivos (100%). El único paciente en este grupo con LMM fue PCR positivo (Fig. 1). El estudio estadístico de chi-cuadrado demostró que la positividad de la PCR es independiente de la forma clínico-histológica del tumor.
Discusión
En la actualidad, la enzima tirosinasa se presenta como el mejor marcador para la detección de células derivadas de melanoma10. La utilización de la RT-PCR permite amplificar el ARNm de la tirosinasa presente en sangre periférica y por tanto es una metodología útil para detectar pequeñas cantidades de células malignas circulantes en esta patología8,11.
Nuestro estudio demuestra una alta detección de la enzima tirosinasa en sangre periférica de pacientes con melanoma en estadio III (71,4%) lo que es apoyado por los resultados de Battayani y cols.12 y Alao y cols.13, sugiriendo que la progresión tumoral de los melanomas provoca también una progresiva liberación de células melánicas a sangre.
El grosor del tumor ha sido un factor pronóstico claramente relacionado con la supervivencia de los pacientes afectados de MM.. Así, los melanomas cutáneos con un grosor ≤ 1 mm presentan un buen pronóstico, entre 1,1-4 mm deben someterse a estrecha vigilancia y los de > 4 mm presentan un mal pronóstico14. Proebstle y cols15 sugieren que la detección de células tumorales en sangre periférica de pacientes con MM podría estar asociada a los niveles de Breslow, hipótesis que es compartida por Smith y cols16 y Battayani y cols12. Nuestros resultados demuestran que conforme aumenta el grosor del tumor en los pacientes con estadio III, existe una mayor proporción de positividad de la PCR para la tirosinasa. Así, en los pacientes con un grosor ≤ 1 mm, entre 1,1-4 mm y > 4 mm, la proporción de PCR positiva fue de un 25%, un 64% y un 75% respectivamente. Estos resultados son apoyados por los de Farthmann y cols17, quienes demuestran que la positividad de la PCR es más frecuente en pacientes con Breslow mayor de 4 mm, y contradice los de Hoon y cols6 quienes no encuentran correlación entre los resultados de la PCR y el grosor de Breslow. Sin embargo y en contraposición a Farthmann y cols17, no hemos podido demostrar una correlación entre la positividad de la PCR y la forma clínico histológica del melanoma, debido posiblemente, al reducido número de algunas de las formas clínico-histológicas utilizadas en el estudio.
En conclusión, nuestros resultados indican un alto nivel de positividad de la PCR para la tirosinasa en sangre periférica de pacientes con MM en estadio III y una clara correlación con el grosor del tumor, lo que sugiere la posible aplicación de esta técnica para la detección de células circulantes de melanoma en sangre periférica como un nuevo factor pronóstico en estos pacientes.
Agradecimientos
Nuestro agradecimiento al Servicio de Dermatología del Hospital Universitario de Granada por la recogida de las muestras de sangre, en especial a la enfermera Mª Jesús Moreno.
Bibliografía
1. Garbe C, Orfanos CE. Epidemiology of malignant melanoma in central Europe: Risk factors and prognostic predictors. Results of the Central Malignant Melanoma Registry of the German Dermatological Society. Pigment Cell Res 1992;2:285-294. [ Links ]
2. Breslow A. Thickness, cross-sectional areas and depth of invasion in the prognosis of cutaneous melanoma. Ann Surg 1970;172:902-908. [ Links ]
3. Clark WH Jr, From L, Benardino EA, Mihm MC. The histogenesis and biologic behaviour of primary human malignant melanomas of the skin. Cancer Res 1969;29:705-727. [ Links ]
4. Evans RD, Kopf AW, Lew RA. Risk factors for the development of malignant melanoma: review of case-control studies. J Dermatol Surg Oncol 1988;14:393-408. [ Links ]
5. Proebstle TM, Huber R, Sterry W: Detection of early micrometastases in subcutaneoneous fat of primary malignant melanoma patients by identification of tyrosinase-mRNA. Eur J Cancer 1996;32:1664-1667. [ Links ]
6. Hoon DS, Wang Y, Dale PS, et al. Detection of occult melanoma cells in blood with a multiple-marker polymerase chain reaction assay. J Clin Oncol 1995;13:2109-2116. [ Links ]
7. Prota G. Progress in the chemistry of melanins and related metabolites. Med Res Rev 1988;8:525-556. [ Links ]
8. Carrillo E, Marchal JA, Prados J, et al. Optimization of the tyrosinase mRNA probe to detect circulating melanocytes with reverse transcription and polymerase chain reaction. Cell Mol Biol 1998;44:1247-1252. [ Links ]
9. Ghossein RA, Bhattacharya S. Molecular detection and characterisation of circulating tumour cells and micrometastases in solid tumours. Eur J Cancer 2000;36:1681-1694. [ Links ]
10. Stevens GL, Sheer WD, Levine EA. Detection of tyrosinase mRNA from the blood of melanoma patients. Cancer Epidemiol Biomarkers Prev 1996;5:293-296. [ Links ]
11. Brossart P, Shmier JW, Krüger S, et al. A polymerase chain reaction-based semiquantitative assessment of malignant melanoma cells in peripheral blood. Cancer Res 1995;55:4065-4068. [ Links ]
12. Battayani Z, Grob JJ, Xerri L, et al. Polymerase chain reaction detection of circulating melanocytes as a prognostic marker in patients with melanoma. Arch Dermatol 1995;131:443-447. [ Links ]
13. Alao JP, Mohammed MQ, Slade MJ, Retrsas S. Detection of tyrosinase mRNA by RT-PCR in the peripheral blood of patients with advance metastatic melanoma. Melanoma Res 1999;9:395-399. [ Links ]
14. Urist MM. Management of patients with intermediate-thickness melanona. Annu Rev Med 1996;47:211-217. [ Links ]
15. Proebstle TM, Huber R, Sterry W. Detection of early micrometastases in subcutaneous fat of primary malignant melanoma patients by identification of tyrosinase-mRNA. Eur J Cancer 1996;32:1664-1667. [ Links ]
16. Smith B, Selby P, Southgate J, et al. Detection of melanoma cells in peripheral blood by means of reverse transcriptase and polymerase chain reaction. Lancet 1991;338:1227-1229. [ Links ]
17. Farthmann B, Eberle J, Krasagakis K, et al. RT-PCR for tyrosinase-mRNA positive cells in peripheral blood: Evaluation strategy and correlation with known prognostic markers in 123 melanoma patients. J Invest Dermatol 1998;110:263-267. [ Links ]