Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO  Similares en Google
Similares en Google
Compartir
Revista de Diagnóstico Biológico
versión impresa ISSN 0034-7973
Rev Diagn Biol vol.51 no.2 abr./jun. 2002
ORIGINAL
Estudio de la influencia de la hemólisis en un perfil básico de coagulación
C. Aulesa, G. Ruiz, J. Durán, R. Galimany
Unidad de Laboratorios. Ciudad Sanitaria Valle de Hebrón (Barcelona)
Palabras clave: Analizador de coagulación, hemólisis, interferencia, TP (tiempo de protrombina), TTPA (tiempo de protromina parcial activado), fibrinógeno derivado, fibrinógeno funcional VonClaus, ATIII (antitrombina III), Tiempo de trombina, Tiempo de Reptilase, Practicabilidad.
Key Words: Coagulation analyzer, hemolysis, interferences, PT (prothrombin time), APTT (activated partial thromboplastin time), Fibrinogene derived, Fibrinogen Von Claus, TT (thrombin time), TR (reptilase time), ATIII (Antithrombin III), Practicability.
Resumen
Se han procesado 40 muestras de pacientes provenientes de cirugía ambulatoria con un perfil básico de coagulación compuesto por TP (tiempo de protrombina), TTPA (tiempo de tromboplastina parcial activado), fibrinógeno derivado, fibrinógeno VonClaus, TT (tiempo de trombina) y TR (tiempo de reptilase) y ATIII (antitrombina III).
Seguidamente se ha realizado una hemólisis controlada "in vitro" de las muestras mediante la aplicación de ultrasonidos y se ha repetido el mismo perfil a las muestras hemolizadas, midiendo la cuantía de la hemólisis mediante la determinación de la Hemoglobina (mg/dl) del plasma sobrenadante.
Aplicando la t de Student para muestras apareadas, entre los resultados de la muestra normal y la misma hemolizada se deduce que: las muestras hemolizadas muestran diferencias significativas en el TP medido por metodos ópticos a partir de 150 mg/dl de Hb.
El fibrinógeno derivado, presenta descensos muy significativos de su concentración a partir de >75 mg/dl Hb de hemólisis. El TT se ve afectado también significativamente por un pequeño grado de hemólisis.
Finalmente se analiza las alternativas tecnológicas que ofrecen los analizadores actuales de coagulación, para la resolución de los problemas de hemólisis, como puede ser la posible utilización alternativa de los métodos mecánicos de medición de la coagulación, frente a los métodos ópticos más generalizados, estableciendo una normativa para la realización correcta, de las pruebas de coagulación de las muestras hemolizadas que nos llegan al Laboratorio Central, remitidas sobre todo, desde centros de extracción periféricos.
Summary
40 specimens from banal ambulatory surgery, have been proceded with a basic coagulation panel, composed by the parameters PT (prothrombin time), APTT (activated partial thromboplastin time), fibrinogen (derived), Fibrinogen Von Claus, TT (thrombin time), RT (reptilase time) and ATIII (antithrombin III).
Afterwards, we hemolyze the samples "in vitro" by the aplication of ultrasonic and performance the basic panel in the hemolyze samples again. The determination of the hemolysis grade, has been measured by the free haemoglobin (mg/dl) of the plasma.
The study of the results after the aplication of the parametric appeared Student test, both results normal and hemolyze, concluded that de PT measured by optics methods present significances diferences over 150 mg/dl of Hb. And other parameter that present significance diferences, has been the derived fibrinogen that reduced his concentration significantly over 75 mg Hb/dl of hemolysis. The Thrombine time increase also significantly with a low hemolyze grade.
In conclusion, we analyze diferences ways to solve the problem of the hemolyze samples by the use of the mecanics methods of measure of the coagulation time in front of the routinary optical methods and we have established with theese experiences, the rules of processing the hemolyze samples, that have been sended, from a periferical bleeding Centres to our Central Laboratory.
Recibido: 20-IX-01
Aceptado: 11-IV-02
Correspondencia: Carlos Aulesa.
Unidad de laboratorios, Ciudad Sanitaria del Valle de Hebrón.
Valle de Hebrón 119-129
08035-Barcelona.
Introducción
Las tendencias actuales de la centralización de los laboratorios para la optimización de recursos, puede comportar el envío de las muestras desde centros de extracción periférica1,2, que provoca muchas veces, la aparición de hemólisis "in vitro" en las mismas3. El presente trabajo, estudia el efecto de este factor de la hemólisis en un perfil básico de coagulación.
Para ello, se han procesado 40 muestras de pruebas de coagulación en el analizador de coagulación Amelung AMAX CS 400 Plus y posteriormente se les ha sometido a hemólisis controlada por ultrasonidos y se ha estudiado el efecto de dicha hemólisis en las determinaciones analíticas.
El análisis de los resultados, nos lleva a plantear la posible utilización de metodologías de coagulación ópticas y mecánicas según cada caso , como alternativa válida4-6 para resolver la problemática creciente de las muestras hemolizadas.
Material y Métodos
Muestras: las muestras fueron recogidas con sistema Vacutainer con citrato sódico a una concentración de 0.123 M, centrifugadas 20 min a 3000 rpm a 4ºC. Las determinaciones se efectuaron antes de dos horas después de la extracción(3,4).
Analizador de coagulación Amelung CS-400 (Versión 1.6.14B) de Movaco Grifols.
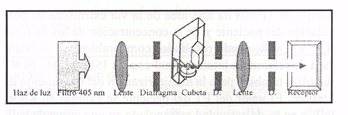
El CS400,es un analizador automático integral, multiparamétrico selectivo para test cronométricos(óptico y mecánico) y cromogénicos que presenta las siguientes características técnicas:
Metodología Mecánica. El método patentado por Amelung esta basado en el empleo de una cubeta de reacción especial con una bola de acero incorporada. La bola se mantiene fija en una posición en la cubeta, gracias a la acción de un imán magnético.
Con la adición del reactivo, la cubeta empieza a rotar alrededor de su eje longitudinal, manteniéndose la bola en su sitio gracias al campo magnético,la formación de filamentos de fibrina, desplaza la bola de su posición original y este cambio de posición es registrado por un sensor electromagnético de efecto Hall, que automáticamente registra el tiempo de formación del coágulo. Para evitar que la inercia de la bola al rotar pueda romper mallas de fibrina débiles, el sensor posee la posibilidad de realizar giros intermitentes, lo que aumenta significativamente la sensibilidad de detección.
Metodología Óptica. El fundamento de esta tecnología de medición de la coagulación, se basa en el incremento de la absorbancia que se produce con la formación de coágulo de fibrina de la muestra , quedando esta variación registrada con un sensor-receptor óptico.
El CS-400 utiliza la misma cubeta que con la metodología mecánica, provista de una bola sin que ello interfiera la determinación.Con la adición del reactivo la medición comienza y es monitorizada por un sensor que registra el cambio de absorbancia en una gráfica, calculándose el tiempo de inicio de la coagulación, a partir de la segunda derivada (primer máximo después de estabilizar un cero). La medición se efectúa a 405 nm. A esta longitud de onda el analizador permite también la determinación de de métodos cromogénicos y turbidimétricos.
Características técnicas analizador:
El analizador permite procesar también muestras urgentes, priorizando su realización y resultados sobre los ya programados anteriormente, con un tiempo de respuesta de unos 7 minutos para unas pruebas de coagulación normales.
Los resultados pueden expresarse para el TP en %, INR y ratio, para el TTPA en segundos y ratios y para el fibrinógeno en mg/dl o g/L.
Respecto al "software", que comanda todo el proceso del análisis y de los resultados, permite conexión on-line bidireccional, monitoriza en todo momento la reacción con visualización de gráficas y resultados; tiene una memoria de 3000 muestras en lista de trabajo y otras 33.000 en un fichero de pacientes. Realiza una calibración automática de hasta 8 por duplicado. Permite, además, la edición de gráficas, recálculo de resultados y su validación no selectiva, para su envío al ordenador central o impresión opcional, con otras opciones como estadísticas diarias de resultados, almacén de resultados en diskettes, etc.
Además hay que señalar, la incorporación de un buen Control de Calidad de fácil acceso, consulta, con gráficas de Levey-Jennings y con alarmas basadas en el Sistema de Multireglas de Westgard.
Cabe señalar ,que los resultados que no entran en el margen de linealidad de cada técnica se diluyen automáticamente, desencadenándose asimismo el montaje de técnicas mecánicas alternativas a las ópticas cuando existen interferencias o para los valores patológicos que nosotros hemos establecido.
Por último, CS400 permite la programación de otras técnicas y asimismo, variar volúmenes, tiempos, etc., lo que constituye un sistema abierto y automatizado de hemostasia.
Método de determinación del tiempo de protrombina (TP) y fibrinógeno derivado.
El equipo de determinación TP(Tromboplastina,Diagnostic Grifols, S.A.), está constituido por tromboplastina de cerebro de conejo con estabilizantes, tampón y conservantes. El tiempo de TP nos da una idea de la vía extrínseca de coagulación del paciente y de la concentración de los factores II,V, VII, y X, dando resultados comparables con el estándard de referencia internacional con un ISI de 1.16. El PT se utiliza también para la monitorización del tratamiento de Sintrom. El valor del PT del paciente se expresa en Ratio, INR o en % de actividad extrapolado en una curva de calibración. El fibrinógeno es derivado, calculándose a partir de la diferencia de absorbancia inicial y final, y monitorizada desde el inicio de coagulación hasta 10 seg. después de estabilizarse la absorbancia por agotamiento de la fibrina de la muestra7-9.
Método de determinación del tiempo de tromboplastina parcial activado (TTPA).
El equipo TTPA (APTT-L,Diagnostic Grifols S.A.), está constituido por cefalina de cerebro de conejo con activador de partículas semicoloidales de silicato de magnesio y aluminio y cloruro cálcico como desencadenante de la reacción El tiempo de APTT nos da una idea de la vía intrínseca de coagulación del paciente y de la concentración de los factores VIII,IX,XI,XII y del factor de Fletcher y también se utiliza para la monitorización de la terapia con heparina. El resultado se expresa en segundos o en Ratio (tiempo paciente/tiempo control)10,11.
Método de determinación de fibrinógeno funcional (método Von Claus).
El equipo de determinación de fibrinógeno funcional (Trombina, Diagnostic Grifols, S.A),está constituido por trombina bovina (100 NIH) con estabilizantes y conservantes. El test mide el tiempo de transformación de fibrinógeno a fibrina al incubar el plasma, diluído 1:10 con tampón de Owren y en exceso de trombina, siendo la concentración de fibrinógeno proporcional al tiempo medido por métodos mecánico por el analizador, extrapolándose el resultado del paciente en su correspondiente curva de calibración. Si el tiempo medido está fuera de rango de la curva de calibración, por exceso o defecto de fibrinógeno de la muestra, se repite automáticamente la técnica con dilución 1:20 ó 1:5, recalculándose el resultado según el factor de dilución aplicado12.
Método de determinación de tiempo de trombina.
El equipo de determinación del tiempo de trombina (TrombinaTT, Diagnostic Grifols, S.A.), está constituido por trombina diluida de bovina (3 NIH) con estabilizantes y conservantes con una actividad establecida. El test mide el tiempo de transformación de fibrinógeno a fibrina al incubar el plasma citratado del paciente, en exceso de trombina de actividad conocida. El tiempo que transcurre desde que se añade la trombina hasta la formación del coágulo se denomina tiempo de trombina y depende de la concentración de fibrinógeno, de la antitrombina y de la actividad de la heparina o de la estreptoquinasa que se utilice para fines terapéuticos. Así el tiempo de trombina se utiliza para la monitorización de la heparina y estreptoquinasa, como screening de coagulación y la detección de productos de degradación de fibrinógeno y de la fibrina y de la presencia de anticoagulantes lúpicos. El resultado se expresa en segundos junto con los segundos del control normal13.
Método de determinación de tiempo de Reptilase.
El equipo de determinación del tiempo de Reptilase (Fibroclotin, Diagnostic Grifols, S.A), está constituído por la enzima proteolítica Reptilase con estabilizantes y conservantes. La reptilasa es una enzima que actúa liberando los fibrinopéptidos A del Fibrinógeno produciéndose la formación de monómeros de fibrina, la reptilasa no es sensible a la heparina puesto que no es neutralizada por ella. El tiempo de Reptilase se utiliza en un perfil básico de coagulación para detectar las hipofibrinogenemias,disfibrinogenemias, detección de globulinas anormales (mielomas) que ocasionan una polimerización anormal de los monómeros de fibrina, diagnóstico diferencial entre un alargamiento del tiempo de trombina debido a un anticoagulante tipo heparina y la acción antitrombínica de los productos de degradación del fibrinógeno (sospecha de CID). El resultado se expresa en segundos junto con el tiempo del control normal13-15.
Método de determinación de antitrombina III.
El equipo de determinación de ATIII (Coamatic LR Antitrombina, Chromogenix-Instrumentation Laboratory SpA), está constituido por factor Xa en presencia de heparina a una actividad conocida con estabilizantes y conservantes. La determinación de la antitrombina del plasma citratado está basada en que el plasma del paciente se incuba en exceso de factor Xa en presencia de heparina, la antitrombina es el inhibidor del factor Xa, y la cantidad residual del Xa se determina por la velocidad de hidrólisis del sustrato cromogénico S-2772. La liberación de pNa determinada a 405 nm es inversamente proporcional al nivel de ATIII en un rango normal de 0-125%16,17.
Sonicador Sonicon 300 (Hielscher, diagnostic Laboratoris). Este sonicador permite, gracias a una soda, la aplicación a la muestra de ultrasonidos con una frecuencia de 24 Khz ,con un rango de pulso de 0-100% y control de potencia 20-100%( previa protección autitiva mediante auriculares acústicos homologados).
El análisis estadístico se ha efectuado con el programa informático SPSS pc aplicando la t de Student para muestras apareadas18,19.
Método de determinación de la hemólisis. Se ha efectuado con el analizador Hitachi 747 mediante la lectura de la absorbancia a dos longuitudes de onda 570-600 nm(ASAT assay) y expresándose el resultado en mg Hb/dl20,21.
Resultados
A los 40 plasmas normales no hemolizados, se ha determinado un perfil básico de coagulación formado por: TP (óptico y mecánico), TTPA (óptico y mecánico), fibrinógeno derivado y fibrinógeno (Von Claus), tiempo de trombina, tiempo de Reptilase y AT (antitrombina ). La media de los resultados obtenidos se muestra en la Tabla I.
Seguidamente se les ha sometido a hemólisis controlada, con el sonicador Sonicon 300 (Hielscher, diagnostic Laboratoris ) que permite, sumergiendo la sonda sonicadora en el tubo de muestra, la aplicación de ultrasonidos a diversas frecuencias y tiempos (previa protección acústica con auriculares homologados), para conseguir hemólisis crecientes, según la frecuencia y tiempo aplicada. Una vez hemolizadas se centrifugaron las muestras en las mismas condiciones señaladas y se volvió a determinar el perfil básico en el mismo analizador AMAX 400Plus.La media de los resultados obtenida se muestra en la Tabla I, encontrándose diferencias significativas (p<0.05) en el TP óptico, TP mecánico, fibrinógeno derivado y tiempo de trombina entre las muestras sin hemolizar y hemolizadas. Finalmente se ha medido el grado de hemólisis en mg/dl de Hb, procesando los plasmas de estas 40 muestras hemolizadas en un Hitachi 747, con una media de hemólisis de 184 mg/dl con un rango de 25-687 mg/dl.
Con el fin de analizar mas finamente la influencia de la hemólisis en las pruebas que han presentado diferencias significativas, hemos clasificado los plasmas en cuatro grupos, según el grado de hemólisis expresado en mg/dl de Hb (Tabla II).La media de los resultados en los cuatro grupos se muestran en la Tabla III. Respecto a los TP ópticos, se observa que la hemólisis disminuye los tiempos de coagulación y el INR y aumenta si se expresa el resultado en % de una manera no significativa (grupos 1 y 2), pero a partir del grupo de hemólisis 3 (150 a 300 mg/dl) el descenso del TP, si que es significativo en cualquiera de sus formas de expresión (seg,%,INR) (p=0.047,0.048 y 0.040). Finalmente en el grupo 4 (> 300 mg/dl) los resultados del TP óptico ahora se alargan,cuando salen(muchas veces no coagula), y son aberrantes por su aumento y no fiables.
En los TP mecánicos, también se observan disminuciones de los tiempos de coagulación, pero en este caso no son significativas en ningún grupo de hemólisis,ni siquiera en el grupo de mayor hemólisis (>300 mg/dl Hb).
El fibrinógeno derivado hemolizado en el primer grupo de hemólisis (<75 mg) no presenta diferencias significativas (p=0.152) respecto al mismo sin hemolizar, pero a partir de este grupo de hemólisis, en el 2,3,4, se observa que presentan diferencias significativas respectivamente (p=0.002, 0.001, 0.001) con valores decrecientes en la concentración del fibrinógeno hemolizado frente al normal, con unas diferencias medias crecientes de 0.58 g/dl para el grupo 2, 1.88 g/dl en grupo 3 y 3.43 g/dl en el grupo 4. Otro fenómeno que también se ha observado en el fibrinógeno derivado es que, a mayor concentración de fibrinógeno inicial, el descenso al hemolizarse era mayor. En el grupo de los fib <4 g/dl (n =29)la media de diferencias entre el normal y el hemolizado fue de 1.15 g/dl; en el grupo con fibrinógenos entre 4-6 g/dl(n=9) la media de diferencia fue de 1.75 g/dl y en el grupo de fibrinógenos >6 g/dl(n=3) la media de diferencias fue de 1.77 g/dl).
Por último respecto al tiempo de trombina se observa un alargamiento de los tiempos de coagulación con la hemólisis, pero sólo en el primer grupo de hemólisis (Hb<75 mg/dl ) este aumento (24.99 seg a 28.77 seg) presenta diferencias significativas ( p=0.029). No se observan diferencias significativas en los pequeños incrementos de los tiempos de trombina en los demás grupos de hemólisis (p=0.563, p=0.428, p=0.426).
Discusión
Los tiempo protrombina ópticos algo hemolizados ( inferior a 150 mg/dl Hb) son fiables, pero a partir de un grado de hemólisis superior a 150 mg/dl Hb, se acortan los tiempos de una manera significativa y a partir de hemólisis superiores a 300 mg/dl Hb se alargan dando resultados aberrantes y no creíbles. Los tiempos de protrombina medidos por métodos mecánicos se acortan de una manera no significativa (p>0.05), aún en el grupo de máxima hemólisis, por lo que a pesar de la hemólisis, no se observa diferencias significativas y son muy fiables constituyendo una alternativa válida para muestras con un grado de hemólisis significativa.
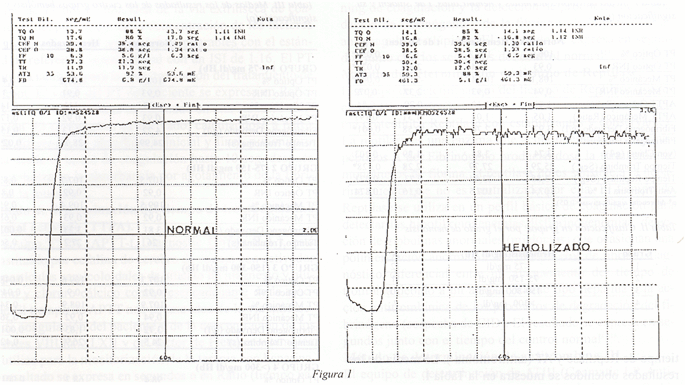
El fibrinógeno derivado, cuando esta hemolizado con cifras superiores a 75 mg/dl Hb, presenta cifras significativamente inferiores a las reales, que pueden oscilar entre 0.5 g/dl a 3.4 g/dl, según el nivel de fibrinógeno de la muestra y el grado de hemólisis y puede constituir un error analítico importante, con repercusiones clínicas en determinadas patologías.La explicación para este fenómeno de reducción del fibrinógeno derivado con la hemólisis con métodos ópticos,creemos que es debido, a la propia metodología que se emplea para calcular el fibrinógeno derivado, que utiliza la magnitud del incremento de absorbancia entre el tiempo inicial y el tiempo final de coagulación de la muestra, medido por el fotómetro, y este aumento es directamente proporcional a la concentración del fibrinógeno (curva de calibración interna). En los plasmas hemolizados el primer punto de medición de la absorbancia, ha aumentado en la escala de densidades ópticas y el segundo punto de medición cuando se produce la coagulación, esta por encima del limite del fotómetro de 3 0.E(extinción óptica) y la magnitud del aumento de absorbancia no se registra en su totalidad, siendo la concentración del fibrinógeno medido menor del real (Fig. 1), siendo esta explicación compatible con el fenómeno que se observa también en los fibrinógenos altos, de una mayor reducción de los mismos con la hemólisis, produciéndose esta interferencia en todos los analizadores de coagulación que utilizan los métodos ópticos, ya que todos tienen como máximo de medición 3 0.E.
El tiempo de trombina aumenta de una manera significativa con una pequeña hemólisis(<75 mg/dl Hb), fenómeno que no parece producirse sinificativamente con grados de hemólisis superiores, no teniendo este aumento a nuestro parecer, ninguna trascendencia clínica
Resumiendo, la hemólisis parece influir poco en un perfil básico de coagulación en las condiciones "in vitro" ensayadas, si bien se observa que los fibrinógenos derivados del TP óptico se reducen significativamente cuando hay mucha hemólisis y que los mismos TP se alargan de una manera aberrante a altos grados de hemólisis, fenómeno que no se registra con los TP mecánicos ni con los fibrinógenos funcionales de Claus, por lo que estos constituyen una alternativa válida sólo cuando los plasmas están muy hemolizados, no observándose ningún efecto por la hemólisis en los demás parámetros ensayados TTPA óptico y mecánico, AT, tiempo de Reptilase. Respecto la TT se observa solamente un aumento significativo, sin transcendencia clínica a pequeños grados de hemólisis.
De índole práctico, hemos establecido una normativa de actuación ante muestras hemolizadas, con la utilización de una planilla como la de la Fig 2, en la que tenemos escaneadas en colores una escala de tubos con diversos grados de hemólisis, que nos sirve para comparar las hemólisis de nuestras muestras "in situ" y establecer más o menos, el grado de hemólisis(mg/dl Hb), sin necesidad de cuantificarlas y así programar el TP mecánico en vez del TP óptico stándard, para valores de hemólisis superiores a 150 mg/dl Hb y el fibrinógeno funcional Von Claus a partir de hemólisis superiores a 75 mg/dl Hb.Los demás parámetros del perfil de coagulación, no se ven en absoluto interferidos aún por grados de hemólisis muy altos.
Bibliografía
1. Ballesta A, Pascual C, Reventos J. Las tareas de gestión del director del laboratorio clínico.Todo Hospital 1994;107,13-17. [ Links ]
2. Erroz A. Estudio de costes de un área sanitaria. Todo Hospital 1994;107,51-55. [ Links ]
3. National committe for clinical laboratory standards Collection,transport and processing of blood specimens for coagulation testing and performance of caogulation assay.NCCLSD Document H21-A2,1988,vol 11,nº23. [ Links ]
4. Dixon JS, Musgrove KA: Special laboratory evaluation of coagulation. Clinical Hematology,Lippincott Company,Philadelphia,1992,611-15. [ Links ]
5. Martínez Brotons F. Situación actual de la automatización de las pruebas de coagulación.Sangre 1991;36,217-219. [ Links ]
6. Aulesa C, Petit M, Sentis M, Ortega JJ. Primera evaluación del analizador de coagulación ACL-Futura.Sangre 1996;5,417-426. [ Links ]
7. Poller L, Thomson JM, Taberner DA. Effect of automation on prothrombin time test in NEQAS surveys. J Clin Pathol 1989;42:688-699. [ Links ]
8. Loeliger EA, Poller L, Samama M, Thomson JM. Questions and answers on prothrombin time standaritation in oral anticoagulant control.Thromb Haemostas 1985;54:515. [ Links ]
9. Rosse E, Mondonico P, Lombardi A. Preda L. Method for the determination of functional (clottable) fibrinogen by the new family of ACL coagulometers. Thrombosis Reseach 1988;52:453-468. [ Links ]
10. Koepke JA, Partial Thromboplastin Time test. Proposed Performance Guidelines. Thromb Haemostas 1986;55:143-144. [ Links ]
11. Stevenson KJ, Easton AC, Curry A, Thomson JM, Poller L. The Reliability of Activated Partial Thromboplastin Time Methods and the relationship to lipid composition and ultrastructure. Thromb Haemostas 1986;55:250-258. [ Links ]
12. Claus A. Gerinnugphysiologische Schnellmethode wur Bestimmung des Fibrinogens. Acta Haemat 1957;17:237-246. [ Links ]
13. Latallo. Z, Teisseyre. E. Evaluation of Reptilase and Thrombin clotting time in presence of FDP and heparin. Scand J Haematol suppl 1971,13,261-266. [ Links ]
14. Soria J, Yer. J and Samama.M. Temp de Reptilase. Etude de la polymerisation de la fibrine en presence de Reptilase. Coagulation 1969;2:173-175. [ Links ]
15. Okuno. T, and Nelson. CA. Plasma fibrinogen estimation by Reptilase clotting time. Ame J Med Tech1973;39:503-506. [ Links ]
16. Demers. C et al. An antithrombin III assay based on factor Xa inhibition provides a more reliable test to identify congenital antithrombin III deficiency than an assay based on thrombin inhibition. Thromb Haemost 1993;69:213-235. [ Links ]
17. Tollefsend DM. Laboratory diagnosis of antithrombin andheparin cofactor II deficiency. Semi in Thromb 1990;16:162-169. [ Links ]
18. Schwartz D. Métodos estadísticos para médicos y biólogos. Ed. Herder,Barcelona,1988 [ Links ]
19. Colton T. Estadística en medicina, Salvat Ed, Barcelona 1989 [ Links ]
20. Thefeld.W. Assay Got. Dtsch med Wschr 1974;99:343 [ Links ]
21. Wallnofeu H, E. Schmidt and F. Schmidt, Synopsis der Leberkrankheisten, 1974, Geog Thieme Veulag, Stuttgart. [ Links ]