Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Actas Urológicas Españolas
versión impresa ISSN 0210-4806
Actas Urol Esp vol.29 no.10 nov./dic. 2005
ORIGINAL
Importancia de las proteínas G heterotriméricas
en la biología molecular del cáncer de próstata
J.C. Prieto Villapun*, R.M. Solano Haro*, M.J. Carmena Sierra*, M. Sánchez-Chapado**,***
*Departamento de Bioquímica y Biología Molecular. **Departamento de Cirugía, Universidad de Alcalá.
***Servicio de Urología, Hospital Universitario Príncipe de Asturias. Alcalá de Henares.
|
Las proteínas G heterotriméricas son esenciales para numerosos aspectos fisiológicos y patológicos1-3. Actúan como transportadores de la información de muchas hormonas, neurotransmisores, quimioquinas y factores autocrinos y paracrinos a través de la membrana plasmática; las señales extracelulares son recogidas por receptores de una gran superfamilia (GPCRs) que presentan siete regiones transmembrana y están acoplados a proteínas G, activándolas4,5. En este panorama han aparecido recientemente nuevos e interesantes componentes como son las proteínas modificadoras de la actividad del receptor (RAMPs) y las proteínas reguladoras de la señalización por proteínas G (proteínas RGS)6. Las proteínas G, localizadas en la cara interna de la membrana, están formadas por tres subunidades, α, β y γ, de las que se han identificado hasta la fecha 27, 5 y 14 isoformas, respectivamente7. La subunidad a presenta actividad GTPasa intrínseca. Cuando los GPCRs son activados por un estímulo adecuado, el receptor interacciona con las proteínas G y cataliza el intercambio de GDP por GTP en la subunidad a, lo que induce la disociación del complejo heterotrimérico en α- GTP y βγ, iniciándose toda una compleja cascada de eventos intracelulares. Así, α-GTP interacciona con efectores tales como las enzimas adenilil ciclasa (AC), fosfolipasa C β (PLC β) y la fosfodiesterasa de GMP cíclico. Por su parte, βγ interacciona y regula distintos efectores como algunas AC y fosfolipasa A2. Intervienen a nivel intracelular enzimas tan importantes como proteína quinasa A (PKA), proteína quinasa C (PKC), fosfatidil inositol 3 quinasa (PI3K) y proteína quinasas activables por mitógenos (MAPKs). Se ponen así en marcha diferentes rutas de señalización integradas por múltiples elementos en un puzzle que, finalmente, desemboca en la regulación de actividades celulares tan importantes como la transcripción de la información genética, proliferación, diferenciación, secreción o motilidad8,9. Por su parte, la actividad GTPasa de la subunidad a hidroliza el GTP a GDP, induciendo la reasociación del trímero αβγ y la inactivación de la proteína G. De particular interés es la potencial utilidad de muchos de los componentes de este microsistema de señalización como nuevas dianas terapéuticas en el cáncer y otras patologías10.
La presencia de mutaciones específicas en genes que codifican proteínas reguladoras de la función celular puede transformarlos en oncogenes cuyos productos sean responsables del desarrollo y crecimiento de células malignas. Estudios realizados en tumores de tipo neuroendocrino han demostrado la presencia de mutaciones específicas en las subunidades αs (estimuladora de la actividad AC) y αi2 (inhibidora de la actividad AC)11,12. La codificación de la síntesis de estas proteínas mutadas la llevan a cabo los oncogenes gsp y gip2, respectivamente13-15. Las mutaciones descritas para el oncogen gsp se localizan a nivel de los codones que codifican para Arg201 (que puede mutar a Cys o His) y para Gln227 (que muta a Arg o Leu), dando lugar a una subunidad αs que, debido a su baja o nula actividad GTPasa, está estabilizada en su forma activa. La activación constitutiva de αs induce una hiperactivación de la vía de transducción de señales dependiente de AC, dando lugar a una proliferación celular anormal12.
La presencia del oncogen gip2 ha sido detectada en tumores ováricos y adrenocorticales16. En este caso, las mutaciones descritas se localizan en los codones que codifican para Arg179 y Gln205 de la subunidad αi2. Ambos aminoácidos ocupan posiciones equivalentes a las ya citadas para αs y, asimismo, la proteína αi2 tiene muy baja actividad GTPasa y, por tanto, está activada constitutivamente. Dicha activación constitutiva disminuye los niveles intracelulares de AMPc, induciendo la activación de la proteína raf-1, una Ser/Thr quinasa que forma parte de la vía de las MAPKs que finalizan su señal en el núcleo, donde se activan distintos factores de transcripción17.
El cáncer de próstata es la neoplasia más diagnosticada en el hombre, constituyendo un grave problema, tanto sanitario como socio-económico, a nivel mundial18,19. A pesar de que numerosos factores epigenéticos y genéticos están implicados en la oncogénesis y progresión del carcinoma prostático, se desconocen actualmente en gran medida los mecanismos moleculares subyacentes a este carcinoma. El funcionamiento normal de la próstata requiere una apropiada diferenciación celular estrechamente controlada durante el desarrollo de la glándula. Este proceso es regulado por toda una serie de factores de transcripción que dan lugar a una estratégica puesta en marcha y regulación de diferentes genes, de tal forma que una alteración de esta vía provoca una diferenciación aberrante, inmortalización, proliferación celular incontrolada y, eventualmente, desarrollo de un cáncer prostático20.
Las interrelaciones entre andrógenos, PKA y otras vías de señalización son críticas para el conocimiento de los mecanismos de proliferación, diferenciación y oncogénesis en la próstata. La importancia de las proteínas G en la señalización intracelular y la proliferación en el adenocarcinoma prostático es evidente21-23. Así lo apoyan la dependencia de estos procesos respecto de la activación de proteínas Gi a través de la liberación de subunidades βγ o la aceleración de la capacidad tumorigénica y metastatizante en células cancerosas prostáticas tras activación persistente de subunidades α. El presente estudio profundiza en la implicación de las subunidades αs y αi de las proteínas G en el cáncer prostático humano analizando su expresión (mRNA y proteína), funcionalidad (actividad AC) y posibilidad de mutaciones.
MATERIAL Y MÉTODOS
Pacientes. Obtención y procesamiento de tejido prostático. Se obtuvo tejido prostático de 9 pacientes no tratados que se sometieron a prostatectomía radical por adenocarcinoma (edad 51-70 años, T1-T2) y 5 controles a los que se practicó cistoprostatectomía por carcinoma de vejiga infiltrante sin invasión prostática. Los pacientes dieron consentimiento por escrito para el estudio, que fue aprobado en el Comité de Ética del Hospital Príncipe de Asturias. Las muestras de tejido fueron clasificadas histológicamente; el material usado para estudio bioquímico se congeló en N2 líquido y se conservó a - 80°C. Se prepararon membranas prostáticas por homegeneización del tejido y centrifugación22, conservándose a -80°C.
Actividad adenilil ciclasa. De acuerdo a lo publicado anteriormente22, se incubaron membranas prostáticas (0,1 mg proteína/ml) a pH 7,4 y 0,1 ml de volumen final durante 10 min a 30°C. Tras hervir 3 min a 100°C y refrigerar, se añadió 0,2 ml de una suspensión de alúmina, se centrifugó y se separó el sobrenadante para la valoración de AMPc por radioinmunoanálisis.
Aislamiento de RNA y RT-PCR para subunidades de proteínas G. Se extrajo RNA total de tejido prostático con un Kit Ultraspec (Biotecx, Houston, TX, USA) y se valoró por espectrofotometría a 260 y 280 nm. Tal como se describió anteriormente22, se desnaturalizaron 6 µg de RNA total (10 min a 94°C) y se obtuvo el DNA complementario por retrotranscripción (10 min a 23°C y 2 h a 39°C). Se realizó la PCR a continuación con oligonucleótidos apropiados (sentido y antisentido) para subunidades αs y αi, con glutaraldehido 3P deshidrogenasa como control. Los productos se sometieron a electroforesis en gel de agarosa al 2% seguida por tinción con bromuro de etidio para visualizar las bandas de DNA. Se incluyó un marcador de pesos moleculares de DNA (Boehringer, Barcelona, España).
Inmunodetección de subunidades de proteínas G. De acuerdo a lo publicado anteriormente22, se solubilizaron membranas prostáticas y se sometieron a electroforesis en gel de poliacrilamida/ SDS. Se transfirieron las proteínas a una membrana de nitrocelulosa y se detectaron subunidades de proteínas G por inmunoblot con anticuerpos específicos: RM/1 (αs), AS/7 (αi1/2) y EC/2 (αi3/0) obtenidos de Dupont (Boston, MA, USA) y T-20 (β) obtenido de Santa Cruz Biotechnology (Santa Cruz, CA, USA). Se utilizó un sistema de peroxidasa para el análisis, así como marcadores de peso molecular apropiados (Bio-Rad, Hercules, CA, USA).
RESULTADOS Y DISCUSIÓN
Amplificación de proteínas G por RT-PCR en muestras control y con cáncer de próstata. A partir de las muestras de tejido prostático, se aisló RNA total y se sometió a retrotranscripción al correspondiente cDNA. Posteriormente, se amplificó mediante PCR utilizando cebadores específicos elegidos a partir de las secuencias publicadas para las distintas subunidades α de las proteínas G. En la Figura 1 se presentan los resultados obtenidos para las subunidades αs y αi2, tanto en tejido sano como canceroso. Del mismo modo, se detectó la expresión de subunidades αi1 y αi3 en ambos tipos de tejido (datos no mostrados). Estos resultados confirman otros previos en hiperplasia benigna de próstata24 y demuestran el mantenimiento de esta información genética durante la transformación neoplásica.
FIGURA 1. Amplificación mediante RT-PCR de las subunidades
αs y αi2 de las proteínas G en próstata control y con cáncer.
Inmunodetección de subunidades de proteínas G por Western-blot. Una vez demostrada la presencia en próstata humana, tanto en tejido control como canceroso, del mRNA que codifica para las distintas subunidades α de las proteínas G, el siguiente paso fue estudiar la presencia de dichas proteínas. Para ello, se realizaron ensayos de Western-blot utilizando anticuerpos comerciales contra dichas subunidades (Fig. 2). La posterior densitometría de las bandas obtenidas indica una disminución en la expresión de las subunidades α estudiadas (en un 25% para αs y 40% para αi1,2) en el tejido procedente de pacientes con carcinoma prostático con respecto al tejido control. También disminuyó la expresión de subunidades αi3,0 (resultados no mostrados). En cambio, no se encontraron variaciones en la expresión de la subunidad β. La baja expresión de las subunidades αi1,2 parece ser específica del tejido canceroso, dado que en las mismas condiciones de detección se encuentran altos niveles de expresión de dichas proteínas en la próstata sana. El descenso selectivo de subunidades proteicas αs y αi puede deberse a expresión génica reducida o a inestabilidad de las proteínas o de sus mRNAs en el tejido canceroso, aunque su mayor caída en el caso de las subunidades αi apunta a modificaciones diferenciales de la respuesta celular a agentes que actúen vía GPCRs24,25. Además, el hecho de que los niveles de subunidades ß no se modifiquen en tejido canceroso sugiere la existencia en esta condición de complejos βγ libres, apoyando la sugerida dependencia de la proliferación celular en el cáncer de próstata con respecto a GPCRs acoplados a proteínas Gi20. Por otro lado, resultados no mostrados indican una correlación inversa entre los niveles de subunidades αs o αi y de PSA sérico. La expresión anormal de proteínas G se ha descrito en diversos tejidos y patologías, incluyendo el cáncer3,12, si bien con patrones ciertamente heterogéneos.
FIGURA 2. Inmunodetección de las subunidades αs´ αi2 y ß de las
proteínas G, en membranas de próstata control y con cáncer.
Actividad basal de la enzima adenilil ciclasa. El estudio de la actividad enzimática AC puede servir para conocer el estado de activación de subunidades α, tanto estimuladoras (αs) como inhibidoras (αi). Los resultados obtenidos a este nivel se presentan en la Fig. 3, observándose que los pacientes con cáncer de próstata presentan niveles de actividad basal de la enzima inferiores en un 40% a los encontrados para los pacientes control. Está descrito que el gen que codifica para la subunidad αi2 de las proteínas G tiene en su secuencia un sitio de unión para el elemento de respuesta a cAMP (factor CREB)1,2; este hecho sugiere que la baja actividad basal de la enzima adenilil ciclasa encontrada en los pacientes con cáncer de próstata estudiados podría provocar una disminución de la síntesis de dicha subunidad.
FIGURA 3. Actividad adenilil ciclasa basal en membranas de
próstata control y con cáncer.
Estudio de la presencia de mutaciones en subunidades αs y αi.. La presencia de mutaciones descritas en otros tejidos para las subunidades αs y αi2 de las proteínas G se estudió en próstata humana (sana y cancerosa) mediante análisis de restricción enzimática y secuenciación del cDNA amplificado de dichas subunidades3.
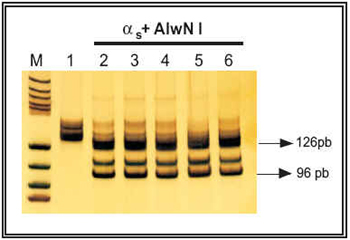
En el caso de la subunidad αs, la digestión del fragmento amplificado mediante PCR (134 pb) con las distintas enzimas utilizadas debe dar lugar a los siguientes fragmentos: a) digestión con Eag I (37°C o/n): no mutación en Arg201 = 22 pb + 94 pb + 18 pb, mutación en Arg201 = 116 pb + 18 pb; b) digestión con AlwN I (37°C o/n): no mutación en Gln227 = 13 pb + 96 pb + 25 pb, mutación en Gln227 = 13 pb + 121 pb. Así, en la Figura 4 se presenta el perfil de digestión encontrado para αs con la enzima Eag I, observándose que todas las muestras analizadas, ya sean controles o de cáncer de próstata, presentan una banda débil con un tamaño aproximado de 94 pb, lo que implica la ausencia de mutación a este nivel. Además, se observan otras dos bandas de mayor intensidad y con tamaño aproximado de 112 pb y 116 pb. La presencia de la banda de 116 pb hace pensar en la existencia de una mutación en la Arg201, lo que se descartó secuenciando el producto de PCR amplificado de dos de estos pacientes. Para estudiar la presencia de mutaciones en la Glu227 de la subunidad αs, se procedió a digerir el producto de PCR amplificado con la enzima de restricción AlwN I. El perfil de digestión encontrado se presenta en la Figura 5, observándose una banda de 126 pb producida por la digestión del producto amplificado en la primera PCR. Igualmente, en todos los pacientes analizados se observó la presencia de una banda de 96 pb, lo que indica la ausencia de mutación en la Glu227 de la subunidad αs12,13.
FIGURA 4. Análisis de restricción enzimática con la enzima
Eag I (37°C o/n) de la subunidad αs en próstata humana
(control y con cáncer). Carril 1: producto de PCR no digerido;
carril 2: producto de PCR de próstata control digerido con
Eag I; carriles 3-6: productos de PCR de cáncer de próstata
digeridos con Eag I.
FIGURA 5. Análisis de restricción enzimática con la enzima
AlwN I (37°C o/n) de la subunidad αs en próstata humana
(control y con cáncer). Carril 1: producto de PCR no digerido;
carril 2: producto de PCR de próstata control digerido con
AlwN I; carriles 3-6: productos de PCR de cáncer de próstata
digeridos con AlwN I.
Para la subunidad αi2, con un fragmento amplificado de 225 pb, la digestión con BstU I (60°C o/n) debe dar lugar a: no mutación en Arg179: 18 pb + 53 pb + 154 pb, mutación en Arg179: 18 pb + 207 pb. La Figura 6 muestra como, además de los fragmentos esperados, correspondientes a la ausencia de mutación en la Arg179 (bandas a 154 pb y 53 pb), se encontraron otros dos fragmentos, de un tamaño aproximado de 133 pb y 71-75 pb, lo que sería indicativo bien de la presencia de nuevos sitios de corte (uno o más) para esta enzima de restricción en la zona amplificada de la subunidad αi2 ó de la ausencia de digestión en alguna de las zonas de reconocimiento de la enzima. Para poder comprobar este resultado, se procedió a realizar la secuenciación del producto de PCR de varios de los pacientes analizados. Al analizar la secuencia se observa que, aunque en muy pequeña proporción, la Gln205 (triplete CAG) de alguna de las moléculas del cDNA amplificado podría tener mutada la adenina a citosina, cambiando el triplete CAG por CCG (Pro), mutación que daría lugar a la presencia de un nuevo sitio de corte para la enzima BstU I (zona de reconocimiento: CGCG). Con todos estos datos, la digestión de la zona amplificada de subunidad αi2 daría lugar a los siguientes fragmentos: a) no mutación en Arg179: 18 pb + 53 pb +154 pb; mutación de Gln205 por Pro: 18 pb+ 53 pb + 80 pb+ 75 pb. Sin embargo, el hecho de no observar banda alguna a 80 pb podría ser debido a que la cantidad de enzima utilizada no sea suficiente para digerir por completo el DNA utilizado y, en algunos casos, la digestión en la Arg179 no se esté realizando (puesto que en la secuenciación no se observa que haya mutaciones a este nivel), dando lugar a un fragmento de 133 pb3,12,14,16.
FIGURA 6. Análisis de restricción enzimática con la enzima
BstU I (60°C o/n) de la subunidad ai2 en próstata humana
(control y con cáncer). Carril 1: producto de PCR no digerido;
carril 2: producto de PCR de próstata control digerido con
BstU I; carriles 3-7: productos de PCR de cáncer de próstata
digeridos con BstU I.
CONCLUSIONES
Los resultados presentados en este trabajo indican que: a) en próstata humana, tanto normal como cancerosa, se expresan y traducen a proteína los genes que codifican para las subunidades αs y αi de las proteínas G; b) el tejido procedente de próstatas con cáncer presenta niveles de expresión de las subunidades αs y αi menores a los detectados en el tejido sano; c) la actividad basal AC en membranas de cáncer de próstata es un 40% inferior a la encontrada para el tejido control, lo que podría indicar que se diera una hiperactivación de la subunidad αi inhibidora de la enzima; d) el análisis de restricción enzimática y la secuenciación del fragmento amplificado para la subunidad αi2 parece indicar que en una pequeña población del cDNA amplificado se da la sustitución de una adenina por una citosina en el triplete que codifica para la Glu205 (CAG) dando lugar a una Pro (triplete CCG). La presencia de esta mutación en otros tejidos conlleva que la proteína αi2 resultante tenga muy baja actividad GTPasa y, por tanto, se encuentra estabilizada en su forma activa. En resumen, la funcionalidad y expresión de las subunidades de las proteínas G heterotriméricas están modificadas selectivamente en el adenocarcinoma prostático humano, concurriendo además alguna mutación puntual cuyas consecuencias deben discernirse.
Agradecimientos: Proyecto de Investigación dotado con un Premio Pedro Cifuentes Díaz 2001 (Fundación para la Investigación en Urología).
REFERENCIAS
1. Cabrera-Vera TM, Vanhauwe J, Thomas TO, Medkova M, Preininger A, Mazzoni Mr, Hamm HE. Insights into G protein structure, function, and regulation. Endocr Rev 2003;24:765-781. [ Links ]
2. Offermanns S. G-proteins as transducers in transmembrane signalling. Progr Biophys Mol Biol 2003;83:101-130. [ Links ]
3. Spiegel AM, Weinstein LS. Inherited diseases involving G proteins and G protein-coupled receptors. Ann Rev Med 2004;55:27-39. [ Links ]
4. Karnik SS, Gogonea C, Patil S, Saad Y, Takezako T. Activation of G-protein-coupled receptors: a common molecular mechanism. Trends Endocrinol Metab 2003;14:431-437. [ Links ]
5. Hermans E. Biochemical and pharmacological control of the multiplicity of coupling at G-protein-coupled receptors. Pharmacol Therap 2003;99:25-44. [ Links ]
6. Hepler JR. RGS proteins and G protein interactions: a little help from their friends. Mol Pharmacol 2003;64:547-549. [ Links ]
7. Albert PR, Robillard L. G protein specificity: traffic direction required. Cell Signal 2002;14:407-418. [ Links ]
8. Neves SR, Ram PT, Iyengar R. G protein pathways. Science 2002;31:1636-1639. [ Links ]
9. Rashid AJ, Odowd BF, George SR. Minireview: Diversity and complexity of signalling through peptidergic G proteincoupled receptors. Endocrinology 2004;145:2645-2652. [ Links ]
10. Liebmann C. G protein-coupled receptors and their signalling pathways: classical therapeutical targets susceptible to novel therapeutic concepts. Curr Pharm Des 2004; 10:1937-1958. [ Links ]
11. Dumont JE, Jauniaux JC, Roger PP. The cyclic AMP-mediated stimulation of cell proliferation. Trends Biochem Sci 1989;14:67-71. [ Links ]
12. Vallar L. Oncogenic role of heterotrimeric G proteins. Cancer Surv 1996;27:325-338. [ Links ]
13. Lania A, Mantovani G, Spada A. Genetics of pituitary tumors: focus on G-protein mutations. Exp Biol Med 2003; 228:1004-1017. [ Links ]
14. Landis C, Masters S, Spada A, Pace A, Bourne H, Vallar L. GTPase inhibiting mutations activate the α chain of Gα and stimulate adenylyl cyclase in human pituitary tumors. Nature 1989;340:692-696. [ Links ]
15. Pace AM, Wong YH, Bourne HR. A mutant alpha subunit of Gi2 induces neoplastic transformation of Rat-1 cells. Proc Natl Acad Sci USA 1991;88:7031-7035. [ Links ]
16. Lyons J, Landis CA, Harsh G, Vallar L, Grünewald K, Feichtinger H, Duh QY, Clark OH, Kawasaki E, Bourne HR, Mccormick F. Two G protein oncogenes in human endocrine tumors. Science 1990;249:655-659. [ Links ]
17. Gupta SK, Gallego C, Lowndes JM, Pleiman CM, Sable C, Eisfelder BJ, Johnson GL. Analysis of the fibroblast transformation potential of GTPase-deficient gip2 oncogenes. Mol Cell Biol 1992;12,190-197. [ Links ]
18. Logothetis CJ. Prostate Cancer I. Sem Oncol 1999;26:139-248. [ Links ]
19. Logothetis C.J. Prostate Cancer II. Sem Oncol 1999;26: 369-474. [ Links ]
20. Sadar MD. Androgen-independent induction of prostatespecific antigen gene expression via cross-talk between the androgen receptor and protein kinase A signal transduction pathways. J Biol Chem 1999;274:7777-7788. [ Links ]
21. Kue PF, Daaka Y. Essential role for G proteins in prostate cancer cell growth and signaling. J Urol 2000;164:2162-2167. [ Links ]
22. García-Fernández MO, Solano RM, Sánchez-Chapado M, Ruiz-Villaespesa A, Prieto JC, Carmena MJ. Low expression of Gα protein subunits in human prostate cancer. J Urol 2001;166:2512-2517. [ Links ]
23. Daaka Y. G proteins in cancer: the prostate cancer paradigm. Sci STKE 2004;13: 216. [ Links ]
24. Solano RM, Carmena MJ, Carrero I, Cavallaro S, Román F, Hueso C, Travali S, López-Fraile N, Guijarro LG, Prieto JC. Characterization of vasoactive intestinal peptide/pituitary adenylate cyclase-activating peptide receptors in human benign hyperplastic prostate. Endocrinology 1996;137: 2815-2822. [ Links ]
25. Solano RM, Carmena MJ, Busto R, Sánchez-Chapado M, Guijarro LG, Prieto JC. Identification and functional properties of the pituitary adenylate cyclase activating peptide (PAC1) receptor in human benign hyperplastic prostate. Cell Signal 1999;11:813-819. [ Links ]
Prof. M. Sánchez-Chapado
Departamento de Cirugía. Universidad de Alcalá,
28871 Alcalá de Henares (Madrid)
E-mail: msanchez.hupa@salud.madrid.org
(Trabajo recibido el 30 de marzo de 2005)