Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Actas Urológicas Españolas
versión impresa ISSN 0210-4806
Actas Urol Esp vol.33 no.5 may. 2009
Nefrectomía parcial abierta. Experiencia del Hospital Universitario 12 de Octubre
Open partial nephrectomy. Experience at the 12 de Octubre University Hospital
M. Domínguez Esteban, Juan Passas Martínez, Javier Romero Otero, J. Medina Polo, Alfredo Rodríguez Antolín
Servicio de Urología. Hospital Universitario 12 de Octubre. Madrid. España
Dirección para la correspondencia
RESUMEN
Introducción: La nefrectomía radical ha sido considerada clásicamente como el tratamiento estándar de los tumores renales. Desde hace ya dos décadas se comenzó a extender el uso de cirugía conservadora. Con el paso del tiempo los resultados oncológicos y funcionales han justificado su expansión. En nuestro centro la introdujimos en 1991. Presentamos nuestra serie de nefrectomía parcial abierta como tratamiento de neoplasias.
Material y métodos: Realizamos una revisión de las 83 nefrectomías parciales abiertas, indicadas con fines oncológicos, desde el año 1991 hasta la actualidad. Describimos los resultados poblacionales, intraoperatorios, postoperatorios, oncológicos, funcionales, análisis de supervivencia y evaluación de la evolución de la función renal para el total de los enfermos y para las nefrectomías parciales no electivas.
Resultados: De las 83 nefrectomías parciales abiertas, 34 (42%) han sido no electivas. El tamaño tumoral medio fue de 36 mm (12-120). La localización tumoral fue en el 52% exofítica y en el 38% endofítica. Las variables intraoperatorias más importantes fueron, mediana del tiempo de cirugía de 160 min; tiempo de isquemia 15 min; sangrado 500 ml y hospitalización 9 días. El 24% de los enfermos sufrieron algún tipo de complicación, la más frecuente fue fístula en 6 (8,8%) de los casos. El estudio anatomopatológico mostró un 57% de carcinoma renal de células claras y un 25% de tumores benignos. El 61% presentaron estadio pT1A , 27% pT1B, 3% pT2 y 9% pT3. El grado 2 de Furham fue el más habitual (40%). Un 4% mostraron márgenes positivos. La supervivencia cáncer específica a los 5 años fue del 94% y a los 10 años del 85 %. En cuanto a la función renal, se objetivó un escaso incremento del valor de la mediana de creatininemia post cirug de 0,04; 0,11; 0,08 y 0,03 a los 6, 12, 24 y 36 meses respectivamente. Se evidenció un aumento mínimo del valor medio de creatinina al evaluarlo pre y postquirúrgico a los 6, 12, 24 y 36 meses con significación estadística.
Conclusiones: La NPA es una técnica factible e integrada en nuestro medio. Los resultados oncológicos alcanzados son satisfactorios y equiparables con los existentes en la literatura. La baja incidencia de complicaciones y el resultado funcional excelente, hace que hoy en día, en manos experimentadas, se deba elegir como técnica de elección en un amplio espectro de pacientes.
Palabras clave: Nefrectomía parcial abierta.
ABSTRACT
Introduction: Radical nephrectomy has traditionally been considered as the standard treatment for renal tumors. Nephron-sparing surgery was introduced two decades ago. Its excellent oncological and functional results have led to widespread use of this procedure. This procedure was first performed at our institution in 1991. Our experience with open partial nephrectomy is reported.
Materials and methods: Our series of 83 open partial nephrectomies performed from 1991 to date for oncological purposes is analyzed. The demographic, intraoperative, postoperative, oncological, and functional results are reported. A survival analysis and renal function evaluation is also provided.
Results: Thirty-four of the 83 open partial nephrectomies (42%) were non-elective. Mean tumor size was 36 mm (12-120). Fifty-two percent of tumors were exophytic and 38% endophytic. The most relevant intraoperative variables included a median surgery time of 160 min, an ischemia time of 15 min, a blood loss of 500 mL, and a 9-day hospital stay. Twenty-four percent of patients experienced complications, of which fistula was the most common, occurring in 6 patients (8.8%). The pathological study revealed clear renal cell carcinoma in 57% of patients and benign tumors in 25%. Stage at diagnosis was pT1A in 61% of patients, pT1B in 27%, pT2 in 3%, and pT3 in 9%. Grade 2 of Furham classification was most common (40%). Positive surgical margins were seen in 4% of patients. Cancer-specific survival rates were 94% at 5 years and 85% at 10 years. A slight increase was seen in median creatinine levels when preoperative and postoperative values were compared: 0.04, 0.11, 0.08, and 0.03 at 6, 12, 24, and 36 months respectively. A minimum, statistically significant increase was found in mean creatinine levels 6, 12, 24, and 36 months after surgery as compared to preoperative values.
Conclusions: Open partial nephrectomy is a feasible procedure routinely used in our standard practice. Its oncological results are satisfactory and consistent with those reported in the literature. The procedure also has a low complication rate and an excellent functional outcome, and is therefore the procedure of choice for a wide spectrum of patients when performed by experienced surgeons.
Key words: Open partial nephrectomy.
A pesar de que Vermooten en 1950 describió la cirugía conservadora como tratamiento para seleccionados casos de tumor renal (TR); la nefrectomía radical (NR, descrita por Robson en 1963, se ha considerado históricamente como el tratamiento estándar del carcinoma renal (CR)1.
Con el paso del tiempo se ha experimentado un auge en la realización de nefrectomía parcial (NP) como tratamiento de neoplasias renales, hasta ser considerado como tratamiento de elección en tumores menores de 4 cm.
Este cambio de tendencia se justifica desde parámetros histológicos, epidemiológicos, de respuesta clínica y funcionales.
Los TR son una amplia familia de neoplasias en las que se incluyen entidades de muy distinta agresividad. Es de destacar que únicamente un 54% de los casos son carcinomas renales de células claras, que representan el 90% de los tumores que metastatizan. El 46% restante se reparte en 25% de tumores benignos (oncocitomas, adenomas y angiomiolipomas) y un 21% en tumores malignos, generalmente indolentes (tumor papilar y cromófobo)2. Por otro lado se ha evidenciado al igual que en el cáncer de próstata una migración epidemiológica, auspiciada por la realización masiva de ecografías, que permite que actualmente el 70% de los tumores diagnosticados tengan un diámetro <4 cm, y con menor incidencia de afectación linfática y adrenal3. De manera añadida, multitud de estudios han demostrado que NP y NR consiguen el mismo control oncológico a medio y largo plazo para neoplasias ≤4cm. Las guías de la Asociación Europea de Urología ratifican estos datos4. La última razón que justifica este cambio de tendencia es que el 26% de los enfermos previo a cirugía por tumor renal presentan una filtración glomerular estimada ≤60 ml/min/1,73m2. Está ampliamente documentado que la insuficiencia renal (IR) es un factor independiente de cardiopatía, hospitalización y muerte5.
El presente trabajo analiza retrospectivamente la serie de nefrectomías parciales de nuestra institución, iniciada en 1991.
Material y métodos
Estudio de la serie de NPA realizadas en nuestro centro por causa tumoral, desde 1991-actualidad. De las 83 NPA realizamos un estudio descriptivo de las siguientes variables: edad (años); sexo (hombre o mujer); índice de masa corporal (IMC) peso(Kg)/m2; creatinina (Cr) pre-cirugía (mg/dl); clasificación pre-anestésica según la sociedad americana de anestesia (ASA); tamaño de la neoplasia en la prueba de imagen pre-cirugía (mm); localización de la misma (riñón izquierdo o derecho); relación neoplasia con la superficie renal (exofítica= protruye >50%, mesofítica si protruye 25-50% y endofítica si protruye <25%); motivo de NP (absoluta, relativa, electiva) (Tabla 1).

Las variables quirúrgicas evaluadas son: tiempo quirúrgico (min), tiempo de isquemia (min), sangrado(ml), biopsia intraoperatorias (si/no) y resultado de la misma (positiva/negativa), apertura de cáliz (si/no), colocación de catéter (si/no), empleo de adhesivos o selladores quirúrgicos, complicaciones quirúrgicas (clasificadas como mayores y menores; según si requirió intervención en el postoperatorio), complicaciones médicas relacionadas con el procedimiento y tiempo de hospitalización (días).
Las variables anatomopatológicas estudiadas fueron: tipo histológico de la pieza, margen quirúrgico (positivo o negativo), tamaño tumoral de la pieza (mm), estadio (TNM), grado tumoral (clasificación de Furham).
Se registró el estado del enfermo como: asintomático, recidiva local, metástasis a distancia y situación al finalizar el estudio como: vivo, fallecido por tumor, fallecido por otra causa. El cálculo de supervivencia se realizó mediante método de Kaplan Meier.
La evolución de la función renal fue valorada en primer lugar calculando la mediana de creatinina en sangre a los 6, 12, 24 y 36 meses postcirugía. A continuación se realizó un T-test para comparar el valor medio de creatinina pre y postcirugía a los 6, 12, 24 y 36 meses, para el total de NPA y para el subgrupo de NPA no electivas. Todos los análisis con un IC del 95%.
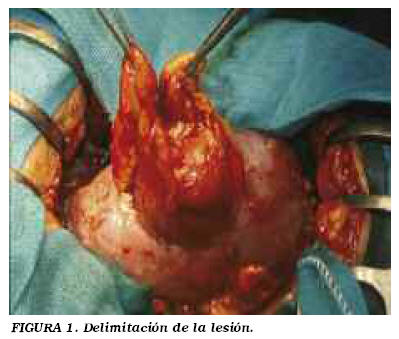
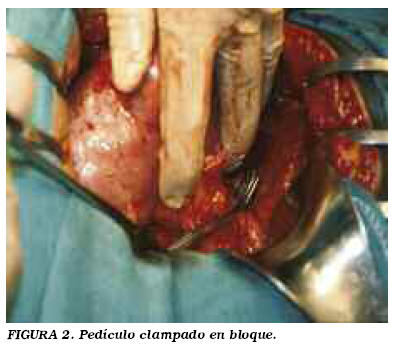
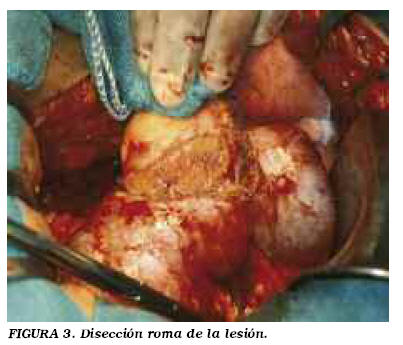
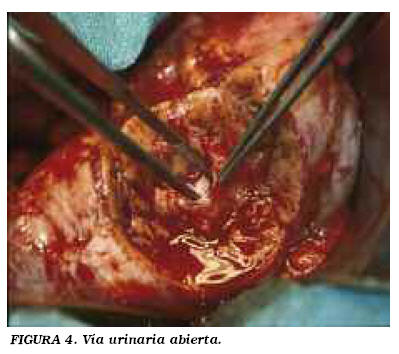
Descripción de la técnica: incisión de lumbotomía clásica. Se incide la fascia de Gerota y se moviliza la unidad renal. Localizamos la tumoración y tendemos a no liberar más que la grasa renal adyacente (no la del propio tumor) (Fig. 1). En caso de dudas de la existencia de otras lesiones, se libera la grasa renal para visualizar y palpar toda la superficie renal. Liberación del pedículo. El clampaje se realiza generalmente en bloque (Fig. 2), dependiendo de las expectativas de sangrado en función de tamaño, localización y morfología tumoral. En casos muy seleccionados de lesiones pequeñas y periféricas se puede no clampar o hacer una compresión manual del parénquima. Delimitación peri-tumoral con bisturí eléctrico, procurando dejar un margen de al menos 0,5 cm de tejido sano. Disección a tijera del tumor (Fig. 3). Únicamente tomamos biopsia del lecho si tenemos dudas del margen de resección. Hemostasia y cierre de la vía en el lecho (Fig. 4). Excepcionalmente colocamos un catéter doble J, sólo ante apertura masiva. Damos puntos en u que se apoyan en un cilindro de surgicel® para no comprimir directamente el tejido. Ocasionalmente, con la llegada de otros adhesivos quirúrgicos (tissucol®, floseal® y otros), se están empleando con fines hemostáticos. Siempre dejamos drenaje, por lo general tubo de silicona.
Resultados
La edad media de los pacientes ha sido 61 años; 34 son mujeres y 49 hombres; el IMC de 29 kg/m2 (21-40); la creatinina precirugía de 1,1mg/dl. La clasificación anestésica prequirúrgica ha resultado en un 68% ASA-II, 26% ASA-III.
El diámetro medio de la lesión, en la prueba de imagen precirugía, ha sido de 36 mm (12-120), el 52% de los tumores han sido exofíticos, el 38% endofíticos y 10% mesofíticos.
Resultados quirúrgicos
Del total de 83 NPA, 34 (42%) han sido no electivas: 20 monorrenos; 10 insuficiencia renal; 3 enfermedad renal bilateral y 1 síndrome genético.
Las variables quirúrgicas más importantes están recogidas en la Tabla 2.
El 56% de los casos hubo apertura de vía, requirió colocación de catéter doble J en el 21%.
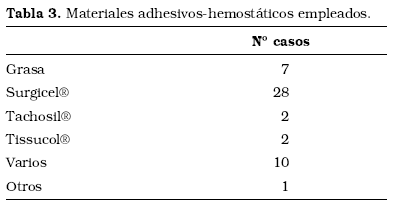
En la Tabla 3 presentamos los materiales adhesivos-selladores que se han empleado con fines hemostáticos.
El 20% de los enfermos han presentado alguna complicación (Tabla 4), la más frecuente ha sido fístula en 6 (8,8%) (Tabla 4).

Estudio anatomopatológico
Ha mostrado 57% de carcinomas renales de células claras (CCR) y destaca la presencia de 25% de lesiones benignas: 11% de oncocitomas, 7% angiomiolipomas, 6% quistes y 1% adenomas (Tabla 5).

Resultados oncológicos
En 26 (32%) de los casos realizamos biopsia intraoperatoria, 2 fueron positivas. En ambas se amplió el margen de resección y con la confirmación patológica de borde libre se completó la NPA. Ambos casos eran pacientes jóvenes y monorrenos. Han evolucionado satisfactoriamente y actualmente se encuentran asintomáticos.
En 3 (4%) de los enfermos se ha constatado un margen positivo. En ninguno de los tres se realizó biopsia intraoperatoria.
El estadio patológico más frecuente ha sido 61% de los casos pT1A, 27% pT1B, 3% pT2 y 9% pT3. El grado de Furham más habitual han sido 2 en 62% y 1 21% de las neoplasias.
El resultado final del procedimiento ha sido 77% asintomático, 4% recidiva local, 7% metástasis y 11% perdidos para el seguimiento.
El análisis de supervivencia indica una supervivencia media de 175 meses (IC al 95%: 160-189). La supervivencia cáncer específica a los 5 años es del 94% y del 85% al evaluarla a los 10 años (Fig. 5).

Resultados funcionales
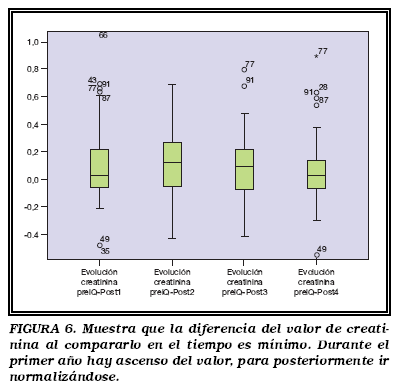
La mediana de creatinina muestra un leve incremento a los 6 meses de 0,04 mg/dl, que se acentúa a los 12 meses 0,11 mg/dl, para posteriormente comenzar un descenso, sin llegar nunca al nivel previo 0,08 y 0,03 mg/dl evaluada a los 24 y 36 meses postcirugía (Fig. 6).
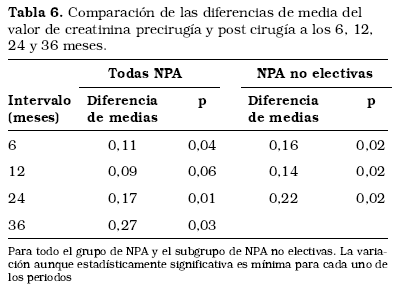
Al comparar la diferencia de medias de creatininemia precirugía y post cirugía para el total de NPA a los 6, 12, 24 y 36 meses se ha evidenciado un empeoramiento en cada uno de los periodos. Al realizar el mismo análisis para el subgrupo de enfermos en los que se realizó la NPA de forma no electiva se acentúan dichas diferencias. Todas alcanzan significación estadística (Tabla 6).
Discusión
Pese a estar establecido por las guías de la Asociación Europea de Urología como un tratamiento curativo para tumores renales <4 cm y en casos seleccionados para masas <7 cm, la NP es realizada solamente en un 9,6% de los enfermos tratados quirúrgicamente de un tumor renal6.
En nuestra institución comenzamos este tipo de cirugía en el año 1991. Desde el año 2003 convive con la NPL. La finalidad de este escrito es comunicar la experiencia de un centro nacional y evaluarlo con la literatura existente. Este estudio presenta las limitaciones atribuibles a un estudio retrospectivo. Creemos que presenta algunos sesgos importantes, pues al recoger toda nuestra experiencia desde 1991, la serie arrastra en los resultados prácticas del inicio de la experiencia. En este sentido nuestra serie presentó un 42% de NPA no electivas, hoy en día nos inclinamos por esta técnica siempre que el tumor es asequible.
Es sabido que el tiempo de isquemia caliente se relaciona con el grado de daño renal. La isquemia causa daño hipóxico en los túbulos renales medulares7. Está constatado que se realiza clampaje del pedículo en el 50-99% de las NP publicadas en la literatura y que el tiempo de isquemia varía de 14-20,1 min8. En nuestra serie se sitúa en 14 min.
Cuando se realiza NP en riñones únicos, suelen ser T de mayor tamaño, lo que lleva a un tiempo de clampaje alrededor de 40 min. Cuando se prevee que el tiempo de clampaje vaya a ser superior a 30 min, deberían realizarse medidas de hipotermia. El metabolismo renal se suspende casi por completo entre 5-20Cº, así hay protección celular y permite hasta 3 horas de isquemia sin daño renal9,10. En nuestra serie hay 10 enfermos que padecieron una isquemia fría superior a 30 min. El enfermo que mayor tiempo sufrió fue 40 min. En ninguno de los casos empleamos medidas hipotérmicas.
Al evaluar la frecuencia con la que aparecen complicaciones intraoperatorias en NP, vemos que no difiere mucho de las que derivan de la NR. Van Popple et al11 presentan un estudio prospectivo en el que comparan 268 NP vs 273 NR (en tumores £5 cm) y concluyen que la NP es un procedimiento seguro que presenta una frecuencia de complicaciones ligeramente superior a la de NR. La complicación más frecuente es el daño pleural 11,5% NP vs 9,3% NR; hemorragia severa: 3,1% NP vs 1,2% NR; fístula 4,4% vs 0% NR y reintervención 4,4% NP vs 2,4% NR. Por su parte Gill et al sitúan al comparar 1800 enfermos en los que se realiza NP las complicaciones intraoperatorias12 en 1,8% NPL vs 1,0% NPA. Otros datos de complicaciones (Tabla 7).
El 23% de nuestros enfermos han presentado complicaciones relacionadas directamente con la cirugía. Nuestra complicación más frecuente ha sido la fístula urinaria (8,8%), probablemente porque se consideró como fístula toda salida de orina por el drenaje, sin restringir en función de la cantidad de orina o del número de días. Hoy lo definimos como la salida mayor a 50 cc de orina por el drenaje, por un periodo de 7 o más días. Ante ella nuestra actitud es vigilancia y en escasas ocasiones, si no cede, colocación de doble J. No hemos realizado ninguna reintervención ni nefrectomía por este motivo.
El porcentaje de pacientes en los que se presentó daño de algún órgano adyacente es de 6,5%. Podía parecer superior a otras experiencias, pero hemos incluido daño pleural, que en otras series está considerado aparte.
Al evaluar los resultados oncológicos y compararnos con otras series, vemos que existe suficiente sustento en la literatura para afirmar que los resultados oncológicos y tasas de supervivencia cáncer específica para masas6,18. En los casos de masas pequeñas bien seleccionadas la recurrencia local se aproxima al 0%. Este porcentaje va ascendiendo hasta el 12% en casos de incremento del tamaño tumoral, enfermedad localmente avanzada, enfermedad multifocal o resección incompleta19,20. La recurrencia local ipsilateral está documentada 1,5-4%21. Un estudio multinstitucional francés donde incluyeron 579 NP, de las cuales el 20% eran mayores de 4 cm, situó a los 3 años de evolución la recurrencia local en 3,5% y la mortalidad cáncer específica 4,5%22 (Tabla 8). Los resultados oncológicos obtenidos en nuestra institución son superponibles a estos, pues hemos sufrido 4% de recidivas locales y 7% de metástasis a distancia.
El margen de tejido circundante sano que se debe respetar es un tema controvertido y no aclarado. Está documentado que hasta un 30% de las neoplasias25, o incluso aún de más26. En nuestro centro tendemos a respetar un margen de 0,5 cm, pero hemos sufrido tres márgenes positivos (3,6%). Es de destacar que todos ellos eran tumores avanzados (pT3) y en ninguno se realizó biopsia del lecho. En los centros con mayor experiencia12 reportan 2,85% para NPL y 1,26% en NPA. La significación clínica de un margen positivo en esta cirugía es incierta, y así viene a corroborarlo el hecho de que dos de nuestros enfermos están vivos y asintomáticos, el tercero perdido para el seguimiento. Existen estrategias empleadas para intentar evitar posibles células remanentes que pudiesen quedar, como coagular el lecho quirúrgico para eliminarlas. A pesar de que grupos emplean ecografía intra-operatoria para delimitar mejor el tejido a resecar y descartar existencia de enfermedad multifocal7, nosotros no lo practicamos.
La realización de biopsia del lecho es un tema en debate. Nosotros realizamos en el 32% de los procedimientos biopsia del lecho, solamente 2 fueron positivas. Hoy en día las reservamos para aquellos casos de duda en el momento de la resección. El alto porcentaje responde sobre todo al primer periodo en el que se realizaba rutinariamente.
La evaluación de la función renal en nuestro estudio es limitada. Está basada en niveles de creatinina en sangre. Huang et al reportan el 26% de los pacientes precirug presentan valor de Cr normal y filtrado glomerular muy disminuido5. En nuestros resultados se ha objetivado una tendencia inicial al leve aumento del nivel de creatinina en sangre, que se recupera a los 12 meses postcirugía. Al valorar la creatinina media pre y postcirugía en cualquiera de los cuatroperiodos encontramos un aumento, que aunque estadísticamente significativo, es tan suave que no tiene relevancia clínica. Es de destacar que al evaluar dichas diferencias para el subgrupo de enfermos en los que se realizó una NPA no electiva, aunque presentan ascensos algo mayores que el primer grupo, también son clínicamente insignificantes, lo cual apoya la bondad del procedimiento.
En el momento actual está aceptado por todos que la NP debe ser el procedimiento de elección en casos bien seleccionados, pero se abre el debate de si el abordaje debe ser abierto o laparoscópico. Para el grupo de Cleveland Clinic la introducción de procedimientos mínimamente invasivos, NPL, crioterapia y radio-frecuencia, no han desplazado a la NPA13. Al comparar su serie histórica, en la que solamente disponían de NPA, con la era actual, en la que conviven procedimientos mínimamente invasivos y NPA; concluyen que la NPA se emplea para tumores de mayor tamaño y/o de localización central, sin evidenciar un descenso en el número de NPA realizadas.
La NPL está empezando a introducirse en nuestro medio, así vemos que en un estudio multi-institucional para evaluar la NP en Francia, tan sólo el 12% de las mismas eran NPL22.
La mayor serie reportada en la bibliografía comparando 1.800 NPA vs NPL, concluye que la NPL presenta menor sangrado, tiempo quirúrgico y estancia hospitalaria que la NPA. Sin embargo el tiempo de isquemia caliente, las complicaciones postoperatorias y el número de reintervenciones fueron mayores para la NPL, siendo todas estadísticamente significativas12.
En nuestro centro realizamos ambos. Desde el año 2003 la NPL va sustituyendo a NPA siempre que el caso nos parece asumible con esta vía. Creemos que lo más importante es la experiencia personal del cirujano.
Conclusiones
La NPA es una técnica factible e integrada en nuestro medio. Los resultados oncológicos alcanzados son buenos y consistentes con los conocidos previamente en la literatura. La baja incidencia de complicaciones y el resultado funcional excelente, hace que hoy en día, en manos experimentadas se deba elegir como técnica de elección para casos seleccionados.
Referencias
1. Herr HW. A history of partial nephrectomy for renal tumors. J Urol. 2005;173(3):705-708. [ Links ]
2. Russo P. Open partial nephrectomy: an essential operation with an expanding role. Curr Opin Urol 2007;17(5):309-315. [ Links ]
3. Russo P. Functional preservation in patients with renal cortical tumors: the rationale for partial nephrectomy. Curr Urol Rep. 2008;9(1):15-21. [ Links ]
4. Ljungberg B, Hanbury DC, Kuczyk MA, Merseburger AS, Mulders PF, Patard JJ, et al. Renal cell carcinoma guideline. Eur Urol. 2007;51(6):1502-1510. [ Links ]
5. Huang WC, Levey AS, Serio AM, Snyder M, Vickers AJ, Raj GV, et al. Chronic kidney disease after nephrectomy in patients with renal cortical tumours: a retrospective cohort study. Lancet Oncol. 2006;7(9):735-740. [ Links ]
6. Miller DC, Hollingsworth JM, Hafez KS, Daignault S, Hollenbeck BK. Partial nephrectomy for small renal masses: an emerging quality of care concern?. J Urol. 2006;175(3 Pt 1):853-857; discussion 858. [ Links ]
7. Derweesh IH, Novick AC. Mechanisms of renal ischaemic injury and their clinical impact. BJU Int. 2005;95(7):948-950. [ Links ]
8. Porpiglia F, Renard J, Billia M, Musso F, Volpe A, Burruni R, et al. Is renal warm ischemia over 30 minutes during laparoscopic partial nephrectomy possible?. One-year results of a prospective study. Eur Urol. 2007;52(4):1170-1178. [ Links ]
9. Harvey RB. Vascular resistance changes produced by hyperosmotic solutions. Am J Physiol. 1960;199:31-34. [ Links ]
10. Novick AC. Renal hypothermia: in vivo and ex vivo. Urol Clin North Am.1983;10(4):637-644. [ Links ]
11. Van Poppel H, Da Pozzo L, Albrecht W, Matveev V, Bono A, Borkowski A, et al. A prospective randomized EORTC intergroup phase 3 study comparing the complications of elective nephron-sparing surgery and radical nephrectomy for low-stage renal cell carcinoma. Eur Urol. 2007; 51(6):1606-1615. [ Links ]
12. Gill IS, Kavoussi LR, Lane BR, Blute ML, Babineau D, Colombo JR Jr, et al. Comparison of 1,800 laparoscopic and open partial nephrectomies for single renal tumors. J Urol. 2007;178(1): 41-46. [ Links ]
13. Weight CJ, Fergany AF, Gunn PW, Lane BR, Novick AC. The impact of minimally invasive techniques on open partial nephrectomy: a 10-year single institutional experience. J Urol. 2008;180(1): 84-88. [ Links ]
14. Patard JJ, Pantuck AJ, Crepel M, Lam JS, Bellec L, Albouy B, et al. Morbidity and clinical outcome of nephron-sparing surgery in relation to tumour size and indication. Eur Urol. 2007;52(1):148-154. [ Links ]
15. Campbell SC, Novick AC. Management of local recurrence following radical nephrectomy or partial nephrectomy. Urol Clin North Am. 1994;21(4):593-599. [ Links ]
16. Belldegrun A, Tsui KH, deKernion JB, Smith RB. Efficacy of nephron-sparing surgery for renal cell carcinoma: analysis based on the new 1997 tumor-node-metastasis staging system. J Clin Oncol. 1999;17(9):2868-2875. [ Links ]
17. Moll V, Becht E, Ziegler M. Kidney preserving surgery in renal cell tumors: indications, techniques and results in 152 patients. J Urol. 1993;150(2 Pt 1):319-323. [ Links ]
18. Fergany AF, Saad IR, Woo L, Novick AC. Open partial nephrectomy for tumor in a solitary kidney: experience with 400 cases. J Urol 2006;175(5):1630-1633; discussion 1633. [ Links ]
19. Porpiglia F, Fiori C, Terrone C, Bollito E, Fontana D, Scarpa RM. Assessment of surgical margins in renal cell carcinoma after nephron sparing: a comparative study: laparoscopy vs open surgery. J Urol. 2005;173(4):1098-1101. [ Links ]
20. Van Poppel H. The optimal margins in nephron-sparing surgery. Curr Opin Urol. 2004;14(4):227-228. [ Links ]
21. Hafez KS, Novick AC, Butler BP. Management of small solitary unilateral renal cell carcinomas: impact of central versus peripheral tumor location. J Urol. 1998;159(4):1156-1160. [ Links ]
22. Bernhard JC, Ferriere JM, Crepel M, Wallerand H, Bellec L, Lacroix B, et al. What is the clinical practice of partial nephrectomy in France?. Prog Urol. 2008;18(7):428-434. [ Links ]
23. Becker F, Siemer S, Humke U, Hack M, Ziegler M, Stöckle M. Elective nephron sparing surgery should become standard treatment for small unilateral renal cell carcinoma: Long-term survival data of 216 patients. Eur Urol. 2006;49(2):308-13. [ Links ]
24. Lerner SE, Hawkins CA, Blute ML, Grabner A, Wollan PC, Eickholt JT et al. Disease outcome in patients with low stage renal cell carcinoma treated with nephron sparing or radical surgery. J Urol. 1996;155(6):1868-1873. [ Links ]
25. Bhayani SB, Allaf ME, Link RE, Rao P, Varkarakis JM, Jarrett TW, et al. Laparoscopic partial nephrectomy in patients with neoplasia in a solitary kidney. Urology. 2004;64(1):35-37. [ Links ]
26. Gill IS, Ramani AP, Spaliviero M, Xu M, Finelli A, Kaouk JH, et al. Improved hemostasis during laparoscopic partial nephrectomy using gelatin matrix thrombin sealant. Urology. 2005;65 (3):463-436. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Dr. Alfredo Rodríguez Antolín
Servicio de Urología
Hospital Universitario 12 de Octubre
Avda. de Córdoba, s/n - 28041 Madrid
Tel.: 913 908 121
E-mail autor: arantolin@yahoo.es
Trabajo recibido: marzo 2009
Trabajo aceptado: abril 2009














