Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Actas Urológicas Españolas
versión impresa ISSN 0210-4806
Actas Urol Esp vol.34 no.5 may. 2010
Ultrasonidos extracorpóreos de alta intensidad: alternativa terapéutica del tumor renal
Extracorporeal high-intensity focused ultrasound: Therapeutic alternative for renal tumors
J.M. Caballeroa, P. Borrata, M. Parairab, L. Martía y J. Ristola
aServicio de Urología, Hospital Mútua Terrassa, Terrassa, Barcelona, España
bServicio de Radiología, Hospital Mútua Terrassa, Terrassa, Barcelona, España
Dirección para correspondencia
RESUMEN
Objetivos: Es conocida la aplicación de los ultrasonidos focalizados de alta intensidad (HIFU) en el tratamiento de los tumores sólidos dentro de las terapias mínimamente invasivas, habiéndose desarrollado en los últimos años transductores que permiten la aplicación de ultrasonidos desde un foco extracorpóreo. Presentamos una revisión del desarrollo, los principios físicos, el estado actual y la experiencia inicial propia de esta terapia en el tratamiento de los tumores renales.
Material y métodos: Actualmente el HIFU extracorpóreo está siendo utilizado en el tratamiento de tumores, principalmente hepáticos, ginecológicos y óseos, y se ha iniciado su uso en la terapia para las neoplasias renales con buenos resultados. Presentamos una revisión bibliográfica (búsqueda estructurada en la base electrónica MEDLINE online) de los principios físicos de este tratamiento y su acción biológica. Describimos la metodología de tratamiento de los primeros casos de carcinoma renal tratados en nuestro hospital con éxito mediante HIFU.
Resultados: Esta terapia ha sido empleada con éxito para tratar tumores sólidos en varios centros de Europa, América y Asia. En nuestro centro tenemos una amplia experiencia en el tratamiento mediante HIFU extracorpóreo de tumores ginecológicos, y ya hemos tratado tumores renales sin complicaciones, si bien el seguimiento es todavía corto.
Conclusiones: El uso de esta energía de forma extracorpórea aparece como una nueva opción dentro de las terapias no invasivas del cáncer renal en casos seleccionados, con un escaso índice de complicaciones, aunque hace falta mucho más tiempo de seguimiento para valorar sus resultados desde el punto de vista oncológico.
Palabras clave: Ultrasonidos de alta intensidad. Ablación tumoral. Ultrasonidos terapéuticos.
ABSTRACT
Objectives: High intensity focused ultrasound (HIFU) is known to be used for the treatment of solid tumors in minimally invasive procedures. Transducers allowing for application of ultrasound from an extracorporeal focus have recently been developed. A review is provided of the development, physical principles, and current status of this therapy, and our early experience with it for the treatment of renal tumors is reported.
Materials and methods: Extracorporeal HIFU is currently being used for the treatment of tumors (mainly hepatic, gynecological, and bone tumors), and has been started to be used for renal tumors with good results. A literature review (structured search in the online MEDLINE electronic base) of the physical principles of this treatment and its biological action is provided. The therapeutic procedure used in the first few patients with renal carcinoma successfully treated with HIFU at our hospital is reported.
Results: This therapy has been successfully used to treat solid tumors at several centers in Europe, America, and Asia. Our center has a wide experience in treatment of gynecological tumors using extracorporeal HIFU, and has already treated renal tumors with no complications, although follow-up is still short.
Conclusions: Extracorporeal use of this energy appears as a new option among non-invasive therapies for renal cancer in selected cases. A low complication rate has been noted, but much longer follow-up times are required for assessment of oncological results.
Key words: High-intensity focused ultrasound. Tumor ablation. Therapeutic ultrasound.
Introducción
El uso de los ultrasonidos clásicamente se ha limitado al diagnóstico por imagen o como guía en la práctica de procesos percutáneos, tales como drenajes o biopsias. El desarrollo tecnológico permite hoy en día la utilización de la energía del ultrasonido para propósitos terapéuticos. Los ultrasonidos focalizados de alta intensidad (HIFU) se han mostrado como un método eficaz no invasivo para tratar ciertos tumores primarios sólidos o enfermedad metastásica, ablación de focos ectópicos de actividad eléctrica en el corazón o conseguir la hemostasia en traumatismos de las extremidades o de los órganos viscerales.
En la medicina actual, en la que priman las técnicas lo menos invasivas posible, los HIFU aparecen como una nueva fuente de posibilidades terapéuticas, especialmente en el tratamiento de tumores sólidos. Otras técnicas, como la radiofrecuencia o la crioablación, pueden ser también utilizadas para tratar tumores pero, a diferencia de éstas, el HIFU puede actuar de forma extracorpórea, siendo posible aplicarlo para alcanzar áreas de hemorragia o tumores que están en profundidad a través de una ventana acústica que permita la transmisión de la energía del ultrasonido, con unos niveles de toxicidad reducida en comparación con otros procedimientos.
En 1954, Lindstrom y Fry et al investigaron la posibilidad de utilizar los HIFU para tratar trastornos neurológicos en humanos. Fry et al fueron los primeros en obtener la acreditación para la primera aplicación del HIFU en humanos, logrando focalizar la intensidad acústica en vivo de manera similar a la que se concentra un haz de luz mediante la utilización de un prisma. A principios de la década 1970 se inició la investigación sobre el uso del ultrasonido de baja intensidad en el tratamiento de tumores. El concepto se basaba en inducir hipertemia con una elevación de la temperatura tisular en torno a 43oC y mantener en todo el volumen tumoral la temperatura durante un tiempo prolongado (alrededor de una hora). Desafortunadamente, este método no tuvo buenos resultados debido a la dificultad de medir la temperatura en el tejido para el control del tratamiento, lo que suponía un inconveniente para mantener el calor uniformemente y en la totalidad del volumen tumoral a la temperatura deseada1,2.
La siguiente innovación tiene lugar en la década de 1980, con el desarrollo de la litotricia extracorpórea. Su uso como método para tratar las litiasis renales fue aprobado en 1984 por la FDA. Fue la primera aplicación terapéutica de los HIFU (pulsátiles). El redescubrimiento del HIFU para el tratamiento de los tumores tiene lugar diez años más tarde, con la evolución de la moderna tecnología de imagen, en particular con la termometría mediante resonancia magnética (RM). Finalmente, no sólo el tratamiento de los tumores se planteó como objetivo del HIFU, sino que también podría ser utilizado como sistema para lograr la hemostasia, tal y como se ha demostrado en animales de experimentación3,4.
Comparando las diferencias de intensidad entre el HIFU y el ultrasonido diagnóstico convencional, el primero obtiene intensidades focales extremadamente más altas en el objetivo. El transductor de ultrasonido diagnóstico clásico obtiene intensidades de aproximadamente 0,1-100mW/cm2, en contraste con los transductores de HIFU, que desarrollan intensidades del orden de 100-10.000W/cm2, o presiones de 0,001-0,003MPa frente a niveles de 30MP. La repercusión del HIFU sobre el organismo es consecuencia de los diferentes fenómenos físicos (térmicos y mecánicos) que provocan una serie de efectos biológicos.
El objetivo de este artículo es mostrar las diferentes repercusiones que puede tener la aplicación de esta energía sobre los tejidos y sus posibilidades terapéuticas en el tratamiento de los tumores sólidos. Por esto, desarrollaremos los diferentes efectos físicos y sus repercusiones biológicas sobre el tejido vivo, aspectos que permiten comprender el porqué de la utilidad del HIFU extracorpóreo en la patología neoplásica.
Material y métodos
Hemos realizado una revisión bibliográfica de los principios físicos y de la acción biológica del HIFU, realizando una búsqueda estructurada en la base electrónica MEDLINE (en línea).
Formas de actuación del ultrasonido focalizado de alta intensidad
1. Efectos térmicos del HIFU
El mayor efecto del HIFU en el organismo es la generación del calor debido a la absorción de la energía acústica por parte de los tejidos. Los sistemas actuales permiten obtener rápidamente temperaturas de 60oC o más, causando necrosis por coagulación a los pocos segundos. La capacidad de focalización es muy alta, pudiéndose concentrar el foco terapéutico en volúmenes muy pequeños, del orden de milímetros cúbicos. Esta capacidad de focalización minimiza el potencial efecto del daño térmico del tejido localizado entre el transductor y el punto focal y el circundante al tumor tratado, ya que las intensidades energéticas son mucho más bajas fuera de la zona diana.
2. Efectos mecánicos del HIFU
Los fenómenos mecánicos se suman a los térmicos, se producen en el caso de HIFU, pero no se dan si las intensidades son bajas, como en el caso de los ultrasonidos diagnósticos. Los efectos mecánicos son los siguientes:
• Cavitación: se define como la creación de una cavidad de gas en un campo acústico y se debe al movimiento oscilatorio de la materia de un medio líquido expuesto a ondas sónicas. La cavitación se produce debido a la alternancia de la compresión y de la expansión del tejido a través del cual el ultrasonido se propaga. Este proceso puede lograr, si es de suficiente magnitud, concentrar el gas de un tejido, formando burbujas. Estas burbujas, además, pueden interaccionar con el campo de ultrasonidos, produciéndose fenómenos de expansión y de contracción de éstas. Hay dos formas de cavitación para considerar. La primera, denominada cavitación estable, en la cual la burbuja se expone a un campo acústico de baja presión, resultando una oscilación del tamaño de la burbuja. La otra es una cavitación por inercia, en la cual la exposición de la burbuja a un campo acústico de mayor intensidad produce violentas oscilaciones del tamaño de la burbuja y un rápido crecimiento de ésta que puede llegar a alcanzar el colapso y la destrucción violenta de ésta. Este fenómeno de colapso brusco puede crear unas corrientes líquidas de alta velocidad del líquido circundante, que pueden tener la fuerza suficiente como para romper las membranas celulares.
• Microflujos: la cavitación estable también puede producir un fenómeno de microflujos (movimiento rápido del fluido cerca de la burbuja debida a oscilaciones de su tamaño) y, asimismo, generar fuerzas de corte que provoquen lesión celular.
• Fuerzas de radiación: tienen lugar cuando la onda es absorbida o reflejada. La completa reflexión produce el doble de energía que la completa absorción. Si el medio de reflexión o de absorción es tejido u otro material sólido, la energía produce un efecto de aumento de la presión. Si el medio es líquido, puede provocar la existencia de microcorrientes5.
3. Efectos biológicos y mecanismos térmicos
El ultrasonido diagnóstico tiene un alto índice de seguridad, no habiéndose detectado efectos biológicos con los equipos que se utilizan en la práctica clínica. Por el contrario, a altas intensidades el ultrasonido provoca alteraciones en los tejidos sobre los que incide, causando necrosis, apoptosis y lisis celular. Estos efectos que provoca el HIFU en los tejidos son causados por el efecto térmico y los mecanismos de cavitación discutidos previamente:
• Necrosis por coagulación: se produce en el tejido expuesto a HIFU cuando el nivel de temperatura alcanza ciertos niveles durante un tiempo determinado. La temperatura requerida para inducir la necrosis por coagulación es tiempo dependiente. Si aplicamos 60oC durante un segundo genera la muerte por necrosis por coagulación en la mayoría de los tejidos, siendo éste el mecanismo principal de destrucción celular en la terapia por HIFU. En los estudios practicados por Wu en pacientes afectos de diversos tumores tratados inicialmente con HIFU y posteriormente resección quirúrgica, el tejido evaluado de 1-7 días después de la terapia con HIFU muestra áreas homogéneas de necrosis por coagulación sin evidencia de células tumorales viables. De 7-14 días después del tratamiento se observa tejido de granulación que reemplaza tejido necrótico, y la zona limítrofe entre el área tratada y la no tratada está reemplazada por fibrosis6.
• Apoptosis: aunque la mayoría de la muerte celular inicial en el tratamiento con HIFU está causada por la necrosis celular por efecto térmico, también puede inducir la apoptosis. En las células apoptóticas el núcleo se autodestruye por la rápida degradación del ADN por endonucleasas. La apoptosis también ha sido demostrada en células leucémicas expuestas a ultrasonidos de baja intensidad o expuestas a cavitación inducida por ultrasonidos. La apoptosis puede ser un efecto añadido en el tejido expuesto a HIFU, especialmente en tipos celulares con baja capacidad de regeneración, como las neuronas. Por tanto, hay un área más extensa de muerte celular más allá del área sobre el cual se focaliza el tratamiento. Esto puede suponer una limitación de la técnica, porque la muerte celular debida a la apoptosis ocurre en los más bajos niveles de exposición de energía, y puede suceder en el tejido sano adyacente al foco de tratamiento o el existente entre el transductor y el foco. Actualmente no existen estudios concluyentes que hayan determinado la destrucción celular por apoptosis inducida por HIFU6.
4. Efectos no lineales del HIFU
Este fenómeno se observa a altas intensidades acústicas. Cuando una onda acústica de alta intensidad se propaga a través del agua o de un tejido, la onda puede transformarse de una onda sinusoidal inicial armónica en una onda de forma aserrada más irregular, debido a la cantidad de energía que es rápidamente absorbida y altera la onda sinusoidal original. Eso es debido a la absorción de energía de la frecuencia fundamental de la onda. Este proceso produce un calentamiento del tejido superior al teóricamente calculado y puede distorsionar la distribución del calor. Este efecto puede suponer un inconveniente a la hora de delimitar la zona por tratar con HIFU.
No está determinado el grado de importancia de cada uno de los procesos que causan la muerte celular en la aplicación del HIFU, se requieren más estudios para determinar el papel de cada uno de ellos, si bien el resultado final es una combinación de todos.
Limitaciones del ultrasonido focalizado de alta intensidad
Aunque se plantea un gran potencial para la terapia no invasiva de neoplasias, particularmente aquellas que están diseminadas o no son operables, el uso del HIFU tiene limitaciones en cuanto a la curación del tumor y a la posibilidad de crear efectos adversos.
Dado que el HIFU es esencialmente un ultrasonido, los artefactos que sufre este fenómeno físico también se producen en el tratamiento, tales como la sombra acústica, la reverberación y la refracción. Las lesiones que están en profundidad con relación a los huesos, como los tumores hepáticos adyacentes a la costilla, pueden ser difíciles de tratar. El gas en el intestino puede no ser penetrado por el HIFU, tal y como puede suceder en el diagnóstico por ultrasonidos, siendo estas ondas reflejadas hacia el transductor de nuevo. Con el diagnóstico sonográfico estas ondas reflejadas son de tal baja energía que no provocan efectos adversos. Sin embargo, con el HIFU éstas son de muy alta energía y pueden producir quemaduras en los tejidos que existen entre el transductor y el objetivo. Los acúmulos de gas intestinal pueden producir lesiones térmicas en la pared anterior del intestino y en la musculatura de la pared abdominal. La refracción, producida al cambiar de medio a través del cual se propaga el ultrasonido, puede provocar acúmulos de energía en el tejido blando adyacente al área del objetivo.
La cantidad de energía que se estima que es absorbida por el tejido se basa en la suposición de que la atenuación de las sondas sónicas en los tejidos blandos entre el transductor y el objetivo es lineal. Este presupuesto no es siempre verdadero; el tejido fibroso, el graso y el altamente vascularizado atenúan la onda sónica de manera diferente. La diferente capacidad de absorción de energía por los diferentes tejidos resulta en una distribución de la muerte celular hasta cierto punto impredecible. Por consiguiente, el fijar el objetivo es de extrema importancia, siendo la RM el sistema de guía que actualmente se acepta como el más preciso.
Se ha barajado como un potencial efecto adverso del HIFU la posible diseminación de células malignas por las fuerzas de corte generadas por el procedimiento. No obstante, esta complicación no ha sido demostrada ni en vivo ni in vitro7.
Guía por imagen y monitorización de la terapia
La guía y la monitorización de la terapia acústica es fundamental para garantizar el tratamiento en la región deseada y minimizar el daño a las estructuras adyacentes. La monitorización en tiempo real, tal y como se hace con ecografía, permite que el haz de ultrasonidos se mantenga en la situación deseada durante todo el procedimiento. Tanto la RM como los ultrasonidos están siendo utilizados actualmente como guía y monitorización de la terapia con HIFU. Ambos métodos tienen sus ventajas e inconvenientes. La RM puede proporcionar datos de temperatura tisular pocos segundos después de la exposición al HIFU; no obstante, la guía por RM es cara, más laboriosa y tiene baja resolución espacial en algunos casos, aunque tiene mejor rendimiento que los ultrasonidos en pacientes obesos. La ecografía como método de guía proporciona el beneficio de ser un sistema de imagen de la misma naturaleza de la que se está utilizando para la terapia, por tanto, la ventana acústica de la imagen se corresponderá con mayor precisión con la ventana acústica terapéutica. Si el objetivo no puede ser bien visualizado por ultrasonidos, consecuentemente es poco probable que la terapia con HIFU sea efectiva y puede potencialmente causar daño térmico en el tejido sano. La monitorización de temperatura usando ultrasonidos todavía no es posible, si bien actualmente se está investigando en el desarrollo de sistemas de termometría mediante ultrasonidos. Los sistemas para valorar el éxito del tratamiento con HIFU son similares a los utilizados con otros métodos de ablación como la radiofrecuencia o la crioterapia, esto es, mediante tomografía axial computarizada o RM. El uso de microburbujas como contraste ecográfico está siendo desarrollado como método para evaluar los efectos del tratamiento con HIFU. El objetivo de todos estos sistemas consiste en valorar el cambio en la vascularización del volumen tratado. Otro método que está siendo examinado es el uso de PET para analizar los cambios en la actividad metabólica después del tratamiento con HIFU8.
Aplicaciones clínicas
Los estudios clínicos que se llevan a cabo sobre la terapia con HIFU amplían progresivamente sus indicaciones. La indicación principal es el tratamiento de los tumores benignos y malignos sólidos. Otros posibles usos terapéuticos potenciales del HIFU están en desarrollo, tales como la trombolisis, las oclusiones arteriales para el tratamiento de tumores, los sangrados de neoplasias o la hemostasia de vasos sangrantes en traumatismos. Hasta la fecha han sido publicados estudios de tratamiento en animales y en humanos para el tratamiento del carcinoma hepático, el cáncer pancreático, los sarcomas, el cáncer de vejiga urinaria, el carcinoma de próstata y el carcinoma renal. Gracias a modelos animales ha sido posible determinar la capacidad de delimitar con máxima precisión el foco de ablación. Para localizar grandes cantidades de energía en profundidad en el cuerpo, sin causar daño al tejido prefocal o posfocal, es necesario usar un sistema de ancha apertura que emite energía con un amplio ángulo de convergencia. Un aspecto crítico del HIFU es, al igual que en el diagnóstico por imagen, la capacidad de obtener una ventana acústica adecuada que permita la propagación de la energía hacia el objetivo. Una ventana acústica es el área de la cual se puede obtener un sonograma de las estructuras que atraviesa. Existen determinadas estructuras, tales como el hueso, el aire y el gas, que interfieren con la propagación de los rayos de ultrasonido dentro del cuerpo, esto hace que se oscurezcan los objetivos más allá de estas superficies, es por esto que la vejiga, por ejemplo, es una excelente ventana acústica al ser un medio líquido homogéneo, y ya se han publicado resultados en el tratamiento de tumores de vejiga; sin embargo, los pulmones son órganos en los cuales no es factible el tratamiento.
La sonografía tridimensional puede proporcionar información que puede ser valiosa en el tratamiento con HIFU. Esto permite delinear el volumen de tejido para tratar con más datos que únicamente utilizando un solo plano. Ésta es probablemente un área de aplicación en el futuro para el tratamiento y para la monitorización del HIFU.
La principal ventaja del HIFU es su capacidad de depositar altas cantidades de energía en profundidad en el cuerpo, con una precisión milimétrica y con escaso daño del tejido circundante. En algunas situaciones es posible la aplicación del HIFU sin sedación ni anestesia.
Metodología propia del tratamiento
En nuestro hospital se dispone de un dispositivo de tratamiento con ultrasonidos extracorpóreo de la compañía Chongquing Haifu Technology Co., modelo JC (figura 1), que desde hace un año ha sido utilizado principalmente en el tratamiento de tumores ginecológicos y hepáticos. También se han llevado a cabo ablación de un número limitado de neoplasias renales en pacientes con indicaciones muy específicas. Este equipo trabaja mediante un sistema de visualización por ultrasonidos, por lo que se trata el tumor en tiempo real. El rango de intensidad acústica en el campo focal es de 500 a 25.000W/cm2. Posee volumen focal de actuación y tiene forma elipsoidal con unas dimensiones de 1,1×3,3×5,6mm (figura 2). Su software permite la planificación por conformación tridimensional (figura 3). El dispositivo generador de ultrasonidos consiste en seis transductores dispuestos en círculo con un sistema de lentes acústicas que permite una precisa focalización y variar la profundidad del foco, con longitud focal entre 90-169mm. En el centro de este dispositivo se encuentra el transductor de ultrasonidos con el que podremos capturar imágenes simultáneamente al tratamiento (figura 4). Cuando se aplica el ultrasonido se aprecia en la zona tratada a los pocos minutos un aumento de ecogenicidad que nos permite diferenciar la zona ya tratada.

Figura 1. Dispositivo de tratamiento con ultrasonidos
de alta intensidad HAIFU® modelo JC.

Figura 2. Esquema de la lesión producida por HIFU extracorpóreo
(High-intensity focused ultrasound treatment of solid tumour deposit-final report.
British Standard EN ISO 14155-1:2003. Illing RO, Kennedy JE).

Figura 3. El software permite la localización tridimensional
del foco de tratamiento.

Figura 4. Transductor terapéutico, de forma cóncava con seis emisores
de ultrasonodos dispuestos de forma circular que convergen en el foco.
En el centro se aprecia el transductor de ultrasonidos para la obtención de imágenes.
La correcta transmisión de la onda se realiza a través de medio líquido, por lo que se dispone de un circuito de agua con sistema de refrigeración para minimizar el daño térmico en la piel y un sistema desgasificador para una mejor transmisión sónica.
El tratamiento se aplica con anestesia general o raquídea con el paciente colocado sobre un colchón de agua en decúbito lateral, siendo la duración del proceso variable en función del volumen tumoral, pudiéndose realizar de forma ambulatoria (hospital de día) o con 24h de ingreso (figura 5).

Figura 5. Posición del paciente para tratar un tumor renal,
contactando la zona lumbar con el colchón de agua.
Todos los casos deben ser evaluados individualmente, siendo candidatos de primer orden aquéllos en los que no es recomendable el tratamiento quirúrgico. Es necesaria la confirmación histológica del tumor que vamos a tratar. Los tumores que se tratan con más facilidad son aquéllos de pequeño tamaño, más periféricos y en los que exista un margen de seguridad respecto a estructuras vasculares o el intestino, ya que existen casos de perforación intestinal secundaria al tratamiento de tumores hepáticos (figura 6A y B). En casos óptimos la incidencia de complicaciones es mínima, registrándose tan sólo lesiones cutáneas leves como quemaduras, que son leves si se aplica un correcto tratamiento de la piel, pequeños hematomas y dolor lumbar. También es posible en casos seleccionados y en manos de un terapeuta con experiencia para tratar tumores de tamaño considerable (figura 7A y B).
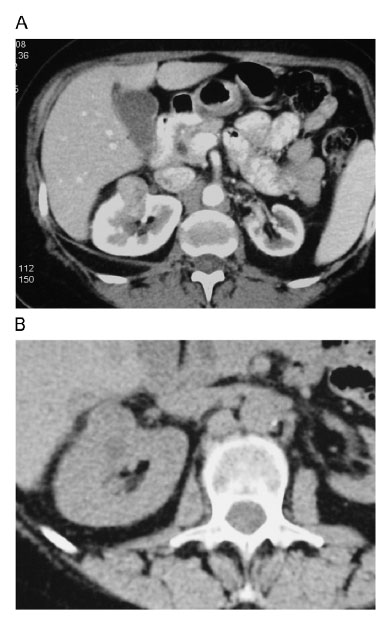
Figura 6. A) Hipernefroma en región medio-anterior de riñón derecho.
B) Control post tratamiento, la zona nodular persiste formada
por tejido necrótico en primer tiempo y cicatricial después.

Figura 7. A) Tumor renal derecho de gran tamaño pre-tratamiento.
B) Tras tratamiento mediante RMN se puede valorar la disminución
de la vascularización.
Resultados
El HIFU está viendo incrementadas sus aplicaciones paulatinamente; no obstante, las diferentes líneas de desarrollo están, en cierto modo, en sus estadios iniciales y será necesario seguir investigando para ver las situaciones clínicas en las que el HIFU puede estar indicado. Con los avances en las técnicas de imagen y la tecnología de los transductores y una mejor comprensión de los bioefectos del HIFU, éste probablemente ganará aceptación clínica como técnica no invasiva8-11.
Tumores hepáticos
Se han publicado diversos estudios para el tratamiento del hepatocarcinoma o para tumores secundarios metastásicos en el hígado. Wu et al han utilizado el HIFU extracorpóreo para tratar a 68 pacientes con neoplasias hepáticas. En los 30 casos en los que el tratamiento quirúrgico se practicó tras el HIFU, el tumor fue totalmente eliminado. También ha sido utilizado como tratamiento paliativo en pacientes con cáncer hepático en estadio avanzado de forma que, después del tratamiento, el 87% de los pacientes refiere una mejoría sintomática, mostrándose incluso que sobre una muestra de 120 pacientes la morbilidad fue más baja al compararla con tratamientos de cirugía abierta12.
En otro estudio del mismo autor se randomizaron pacientes entre quimioembolización transarterial más HIFU frente a quimiembolización únicamente. La supervivencia media fue de 11,3 meses en la terapia combinada HIFU-quimioembolización con respecto a 4 meses en el grupo de quimioembolización sola. Hasta la fecha tanto estudios experimentales en animales como en humanos muestran una significativa esperanza en el tratamiento de las neoplasias hepáticas malignas primarias con HIFU13.
Cáncer de páncreas
El HIFU está siendo utilizado para tratamiento paliativo del cáncer pancreático, permitiendo mejorar la sintomatología mediante el control local del tumor. Un estudio con 251 pacientes con cáncer pancreático avanzado sugiere que el HIFU puede reducir el tamaño del tumor sin causar pancreatitis y puede prolongar la supervivencia. El 84% de los pacientes con dolor debido al cáncer pancreático puede obtener una mejoría significativa de su dolor con este tratamiento. Aunque el HIFU es una técnica no invasiva que tiene la capacidad de reducir significativamente el dolor asociado con el cáncer pancreático, no han sido efectuados estudios rigurosos prospectivos y randomizados dirigidos a determinar si el tratamiento del tumor pancreático con HIFU produce una respuesta local del tumor o beneficios clínicos en aspectos como el estatus funcional, la calidad de vida o la supervivencia14.
Carcinoma de próstata
El HIFU fue utilizado como tratamiento de la hiperplasia benigna de próstata en algunos centros médicos durante la pasada década. Cerca del 50% de los pacientes con hipertrofia benigna de próstata necesitó posteriormente resección transuretral. Por tanto, el HIFU no ha sido recomendado para el tratamiento de esta patología15,16. Han sido utilizados procedimientos transperineales y transrectales, tanto en estudios animales como en humanos, dado que la terapia extracorpórea no es posible por la sombra acústica que genera el pubis17. En cuanto al carcinoma de próstata sigue siendo, con sus limitaciones, una técnica vigente. Los criterios de inclusión para el tratamiento del cáncer de próstata con HIFU son específicos, incluyendo antígeno prostático específico (PSA) inferior a 15ng/ml, Gleason menor de 7, estadio local T1 o T2, sin evidencia de metástasis ganglionar, peso prostático menor de 30-40g y expectativa de vida superior a los 5 años. Estas series utilizaban para controlar los resultados el decrecimiento del PSA y las biopsias repetidas negativas. El seguimiento de estos pacientes ha sido de entre unos meses a 5 años. En algunas series el HIFU se ha demostrado como un método efectivo de terapia de rescate de pacientes incompletamente tratados con radiación externa. Las tasas de éxito del tratamiento de la próstata oscilan según las series entre el 60-80% al repetir la biopsia o al mostrar reducción del PSA por debajo de 4ng/ml. El fallo de la terapia se define generalmente por biopsias positivas o tres aumentos consecutivos del PSA con biopsias negativas. Las tasas de éxito del tratamiento se correlacionan con los niveles de PSA previos, con más del 90% de pacientes libres de enfermedad en los que tenían PSA de menos de 4ng/ml previo al tratamiento, comparándolo con el 57% libres de enfermedad de aquellos que tenían PSA superiores a 4ng/ml. En casi un 90% de los pacientes que no estaban libres de enfermedad tras la terapia se han evidenciado disminuciones del PSA. Las complicaciones del HIFU para el tratamiento de la próstata ocurren con una frecuencia entre el 0-50%. Se describen como tales la retención urinaria, la incontinencia, la infección urinaria, la impotencia, el dolor crónico, rectal y anal, y las fístulas. La repetición del tratamiento con HIFU se asocia con un incremento muy alto de tasas de complicación frente a los tratamientos únicos. Para intentar evitar la retención urinaria asociada con el tratamiento prostático con HIFU se ha llegado a efectuar resección transuretral previa al tratamiento. No obstante, el seguimiento a largo plazo en estos pacientes todavía no se ha realizado y, dado que el número de pacientes es bajo, muchos autores han concluido que todavía no hay suficientes datos para justificar el HIFU como sustituto de las terapias convencionales. El tratamiento de próstata con HIFU parece ser más apropiado en hombres mayores de 65 años que presentan contraindicación quirúrgica18-27.
Tumores renales
El carcinoma de células renales está incrementando su frecuencia en los últimos años, con tasas de supervivencia en estadios avanzados de sólo el 25-30% a los 5 años. Por tal hecho, las terapias no invasivas, tales como la radiofrecuencia, la inyección con etanol y el HIFU, han generado un interés creciente como alternativa o como tratamiento adyuvante de la cirugía en casos seleccionados.
Tal como sucede en las neoplasias hepáticas, el principal tratamiento para los tumores renales es la cirugía, con tasas de supervivencia a los 5 años superiores al 80% con resecciones completas. Dado que muchas lesiones renales diagnosticadas actualmente son de pequeño tamaño, el disponer de un tratamiento no invasivo resulta atractivo, por lo que han sido diseñados diversos modelos de experimentación animal para evaluar el uso del HIFU en el tratamiento de la neoplasia renal, existiendo ya datos para valorar los resultados del tratamiento del tumor renal con HIFU en humanos. Estudios en los que se ha practicado HIFU y posteriormente nefrectomía muestran una evidencia de destrucción de la lesión, presentando como principal complicación quemaduras en la piel en un 10% de los casos. En los casos en que se presente un tumor renal no excesivamente grande en un paciente añoso o con contraindicación quirúrgica, el HIFU se presenta como una buena alternativa28-34.
Resultados en nuestra experiencia
Conclusiones
Es evidente que el tratamiento de elección del cáncer renal es la exéresis quirúrgica en cualquiera de sus modalidades (nefrectomía radical, parcial o laparoscópica), pero han surgido otras opciones terapéuticas (crioablación, radiofrecuencia, etc.) que en casos seleccionados pueden tener su papel, y que tal vez en un futuro no muy lejano, junto con las nuevas terapias farmacológicas, estas técnicas u otras que vayan apareciendo desplacen progresivamente a la cirugía.
Está demostrado que la aplicación de HIFU de forma extracorpórea provoca una serie de efectos biológicos que pueden ser aplicados en el tratamiento de las neoplasias.
Existe experiencia en el uso del HIFU en el tratamiento de neoplasias prostáticas y son discutibles sus indicaciones, pero el HIFU extracorpóreo es una técnica muy novedosa que abre un gran campo de posibilidades terapéuticas entre la que está el tratamiento del cáncer renal; sin embargo, es obvio que se requieren muchos más estudios para poder establecer sus posibilidades reales.
En el tratamiento de otras patologías, como la ginecológica, nuestra unidad de HIFU ya dispone de la experiencia suficiente como para extraer conclusiones, habiéndose podido demostrar un bajo índice de complicaciones inmediatas y una buena evolución a más largo plazo de la patología tratada.
En el caso de cáncer renal, dada su menor tasa de incidencia y, en concreto, de casos en los que haya una indicación clara, y lo reciente de la técnica, todavía no tenemos el seguimiento y la casuística requerida para poder disponer de los datos suficientes para obtener determinadas conclusiones. Es por esto que la finalidad de este artículo es el dar a conocer una nueva técnica que puede hacerse un lugar dentro de los recursos terapéuticos del tratamiento de los tumores renales.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Agradecimientos
Agradecemos su colaboración para la realización de este artículo a Marta Caballero Ávila.
Bibliografía
1. Lindstrom P.A. Prefrontal ultrasonic irradiation: A substitute for lobotomy. Arch Neurol Psych. 1954; 72:399-425. [ Links ]
2. Fry W., Barnard J., Fry , Krumins R., Brennan J. Ultrasonic lesions in the mammalian central nervous system with ultrasound. Science. 1955; 122:517-8. [ Links ]
3. Ter Haar G., Roberston D. Tissue destruction with focused ultrasound in vivo. Eur Urol. 1993; 23:8-11. [ Links ]
4. Sibille A., Prat F., Chapelon J.Y., Abou el Fadil F., Henri L., Theillère , Ponchon T., et al. Extracorporeal ablation of liver tissue by high intensity focused ultrasound. Oncology. 1993; 50:375-9. [ Links ]
5. Marmottant P., Hilgenfeldt S. Controled vesicle deformation and lysis by single oscillating bubbles. Nature. 2003; 423:153-6. [ Links ]
6. Wu F., Cheng W.Z., Bai J., Zou J.Z., Wang Z.L., Zhu H., et al. Pathological changes in human malignant carcinoma treated with high-intensity focused ultrasound. Ultrosound med Biol. 2001; 27:1099-110. [ Links ]
7. Kennedy J.E. High-intensity focused ultrasound in the treatment of solid tumours. Nature Reviews: Cancer. 2005; 5:321-7. [ Links ]
8. Dubinsky J., Cuevas C., Dighe M.K. High-intensity focused ultrasound: Current potential and oncologic applications. AJR. 2008; 190:191-9. [ Links ]
9. Unger E.C., Matsunaga T.O., McCreery T., Schumann P., Sweitzer R., Quigley R., et al. Therapeutic applications of microbubbles. Eur J Radiol. 2002; 42:160-8. [ Links ]
10. Aus G. Current status of HIFU and cryotherapy in prostate cancer: A review. Eur Urol. 2006; 50:927-34. [ Links ]
11. Chartier-Kastler E., Chopin D., Vallencien G. The effects of focused extracorporeal pyrotherapy on a human badder tumor cell line (647V). J Urol. 1993; 149:643-64. [ Links ]
12. Li C.X., Xu G.L., Jiang Z.Y., Li J.J., Luo G.Y., Shan H.B., et al. Analysis of clinical effect of high-intensity focused ultrasound on liver cancer. World J Gastroenterol. 2004; 10:2201-4. [ Links ]
13. Illing R.O., Kennedy J.E., Wu F., ter Haar G.R., Protheroe A.S., Friend P.J., et al. The safety and feasibility of extracorporeal high intensity focused ultradoun (HIFU) for the treatment of liver and kidney tumours in a Westwer population. Br J Cancer. 2005; 93:890-5. [ Links ]
14. Wu F., Wang Z.B., Zhu H., Chen W.Z., Zou J.Z., Bai J., et al. Feasibility of US-guided high intensity focused ultrasound treatment in patients with advanced pancreatic cancer: Initial experience. Radiology. 2005; 236:1034-40. [ Links ]
15. Madersbacher S., Schatzl G., Djavan B., Stulnig T., Marberger M. Long-term outcome of transrectal high-intensity focused ultrasound therapy for benign prostatic hyperplasia. Eur Urol. 2000; 37:687-94. [ Links ]
16. Rouvière O., Mège-Lechevallier F., Chapelon J.Y., Gelet A., Bouvier R., Boutitie F., et al. Evaluation of color Doppler in guiding prostate biopsy after HIFU ablation. Eur Urol. 2006; 50:490-7. [ Links ]
17. Häcker A., Köhrmann K.U., Back W., Kraut O., Marlinghaus E., Alken P., et al. Extracorporeal application of high-intensity focused ultrasound for prostatic tissue ablation. BJU int. 2005; 96:71-6. [ Links ]
18. Chaussy C., Thuroff S. Results and side effects of high-intensity focused ultrasound in localized prostate cancer. J Endourol. 2001; 15:437-40. [ Links ]
19. Ficarra V., Antoniolli S.Z., Novara G., Parisi A., Fracalanza S., Martignoni G., et al. Short-term outcome after high-intensity focused ultrasound in treatment of patients with high-risk prostate cancer. BJU Int. 2006; 98:1193-8. [ Links ]
20. Blana A., Walter B., Rogenhofer S., Wieland W.F. High-intensity focused ultrasound for the treatment of localized prostate cancer: 5-year experience. Urology. 2004; 63:297-300. [ Links ]
21. Uchida T., Sanghvi N.T., Gardner T.A., Koch M.O., Ishii D., Minei S., et al. Transrectal high-intensity focused ultrasound for treatment of patients with stage Tlb-2N0M0 localized prostate cancer: A preliminary report. Urology. 2002; 59:394-8. [ Links ]
22. Schatzl G., Madersbacher S., Djavan B., Lang T., Margberger M. Two-year results of transurethral resection of the prostate versus four "less invasive" treatments options. Eur Urol. 2000; 37:695-701. [ Links ]
23. Gelet A., Chapelon J.Y., Poissonnier L., Bouvier R., Rouvière O., Curiel L., et al. Local recurrence of prostate cancer after external beam radiotherapy: Early experience of salvage therapy using high-intensity focused ultrasonography. Urology. 2004; 63:625-9. [ Links ]
24. Lledo García E., Jara Rascon J., Subira Ros D., Herranz Amo F., Martinez-Salamanca J.I., Henández Fernández C. Evidencia científica actual sobre la utilidad del ultrasonido de alta intensidad (HIFU) en el tratamiento del adenocarcinoma prostático. Actas Urol Esp. 2005; 29:131-7. [ Links ]
25. Gelet A., Chapelon J.Y., Bouvier R., Rouvire O., Lyonnet D., Dubernard J.M. Transrectal high intensity focused ultrasound for the treatment of localized prostate cancer: Factors influencing the outcome. Eur Urol. 2001; 40:124-9. [ Links ]
26. Vallancien G., Prapotnich D., Cathelineau X., Baumert H., Rozet F. Transrectal focused ultrasound combined with transurethral resection of the prostate cancer: Feasibility study. J Urol. 2004; 171:2265-7. [ Links ]
27. Lledó García E., Jara Rascón J., Herranz Amo F., Hernández Fernández C. Estado actual del ultrasonido de alta frecuencia (HIFU) en el tratamiento del adenocarcinoma prostático. Actas Urol Esp. 2007; 31:642-50. [ Links ]
28. Henández Fernández C., Lledó García E., Subirá Ríos D., Bueno Chomón G. Tratamiento conservador del cáncer renal mediante HIFU. Técnica, indicaciones y resultados. Actas Urol Esp. 2009; 33:522-5. [ Links ]
29. Chapelton J.Y., Margonari J., Theillere Y., Gorry F., Vernier F., Blanc E., et al. Effects of high-energy focused ultrasound on kidney tissue in the rat and the dog. Eur Urol. 1992; 22:558-62. [ Links ]
30. Adams J.B., Moore R.G., Anderson J.H., Strandberg J.D., Marshall F.F., Davoussi L.R., et al. High intensity focused ultrasound ablation of rabbit kidney tumors. J Endourol. 1996; 10:71-5. [ Links ]
31. Vallancien G., Chartier-Kastler E., Chopin D., Veillon B., Brisset J.M., André-Bougaran J., et al. Focused extracorporeal pyrotherapy: Experimental results. Eur Urol. 1991; 20:211-9. [ Links ]
32. Roberts W.W., Hall T.L., Ives K., Wolf JS, Fowlkes J.B., Cain C.A. Pulsed cavitational ultrasound: A noninvasive technology for controlled tissue ablation (histotripsy) in the rabbit kidney. J Urol. 2006; 175:734-8. [ Links ]
33. Marberger M., Schaltz G., Cranston D., Kennedy J.E. Extracorporeal ablation of renal tumours with high intensity focused ultrasound. Br J Urol. 2005; 95:52-5. [ Links ]
34. Wu F., Wang Z.B., Chen W.Z., Bai J., ZHu H., Quiao T.Y. Preliminary experience using high intensity focused ultrasound for the treatment of patients with advanced stage renal malignancy. J Urol. 2003; 170:2237-40. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
25138jcg@comb.cat
(J.M. Caballero)
Recibido 6 Octubre 2009
Aceptado 13 Enero 2010














