Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Actas Urológicas Españolas
versión impresa ISSN 0210-4806
Actas Urol Esp vol.34 no.5 may. 2010
Relación de la velocidad preoperatoria de PSA con los hallazgos histopatológicos de la pieza quirúrgica y la supervivencia tras prostatectomía radical
Relationship of preoperative PSA velocity to histopathological findings in the surgical specimen and survival after radical prostatectomy
A. Rodríguez-Alonsoa, A. González-Blancoa, S. Pita-Fernándezb, C. Bonelli-Martína, S. Pértega-Díazb y M. Cuerpo-Péreza
aServicio de Urología, Hospital Arquitecto Marcide, Ferrol, A Coruña, España
bUnidad de Epidemiología Clínica y Bioestadística, Hospital Juan Canalejo, A Coruña, España
Dirección para correspondencia
RESUMEN
Objetivo: Determinar si la velocidad de antígeno prostático específico (PSAV) se relaciona con los hallazgos histopatológicos de la pieza, la supervivencia libre de recidiva bioquímica (SLRB), la supervivencia cáncer-relacionada (SCR) y la supervivencia global (SG).
Material y métodos: Estudio observacional de cohorte retrospectivo y prospectivo formado por 265 pacientes con cáncer de próstata a los que se practicó prostatectomía radical (PR) entre 2000-2008. La PSAV fue calculada de forma aritmética y mediante regresión lineal, utilizando valores de antígeno prostático específico del año previo al diagnóstico. Se realizó un análisis multivariado de regresión logística para detectar variables asociadas a enfermedad extracapsular (EEC). Las variables asociadas a SLRB, SCR y SG fueron estudiadas mediante análisis de Kaplan-Meier (PSAV<3 vs. >3ng/ml/año) y multivariado de regresión de Cox. La capacidad de PSAV para predecir SLRB, SCR y SG fue determinada mediante c-index.
Resultados: La mediana de seguimiento fue 56,16 meses (9,14-106,75). La mediana de PSAV fue 0,65 y 0,63ng/ml/año con los métodos aritmético y de regresión, respectivamente. Se detectó EEC en 74 casos (27,92%) y recidiva bioquímica en 50 (18,87%). Se observó mortalidad cáncer-relacionada en 4 pacientes (1,52%) y mortalidad global en 16 (6,08%). En el análisis multivariado, la PSAV no se relacionó con EEC, asociándose de forma independiente con la SLRB (RR: 1,06; IC 95%: 1,02-1,13; p:=0,008), SCR (RR: 1,22; IC 95%: 1,00-1,50; p=0,048) y SG (RR: 1,35; IC 95%: 1,18-1,55; p<0,001).
Conclusiones: La PSAV es una variable preoperatoria que predice SLRB, SCR y SG en los pacientes tratados mediante PR. No se observa asociación entre PSAV y la presencia de EEC.
Palabras clave: Cáncer de próstata. Prostatectomía radical. Velocidad de antígeno prostático específico. Recidiva bioquímica. Enfermedad extracapsular. Supervivencia.
ABSTRACT
Objective: To assess whether PSA velocity (PSV) is related to pathological findings in surgical specimen, biochemical recurrence-free survival (BRFS), cancer-related survival (CRS), and overall survival (OS).
Materials and methods: A retrospective and prospective observational cohort study on 265 patients with prostate cancer (PCa) who underwent radical prostatectomy (RP) from 2000 to 2008. PSAV was calculated arithmetically and by linear regression analysis, using PSA values in the year prior to diagnosis. A multivariate logistic regression analysis was performed to detect variables associated to extracapsular disease (ECD). Variables related to BRFS, CRS, and OS were analyzed using Kaplan-Meier methodology (PSAV <3 vs. >3ng/mL/year) and a multivariate Cox regression analysis. The ability of PSA velociy to predict BRFS, CRS, and OS was evaluated by c-index.
Results: Median follow-up was 56.16 months (9.14-106.75). Median PSAV was 0.65 and 0.63ng/ml/year using the arithmetic and regression methods respectively. ECD was detected in 74 specimens (27.92%), and biochemical recurrence in 50 patients (18.87%). Cancer-related mortality was seen in 4 patients (1.52%) and overall mortality in 16 (6.08%). In the multivariate analysis, PSAV was not related to ECD. PSAV was an independent predictor for BRFS (RR: 1.06, 95% CI: 1.02-1.13, p=0.008), CRS (RR: 1.22, 95% CI: 1.00-1.50, p=0.048), and OS (RR: 1.35, 95% CI: 1.18-1.55, p<0.001) in the multivariate Cox regression analysis.
Conclusions: PSAV is a preoperative parameter that predicts for BFRS, CRS, and OS in patients undergoing RP. No association was found between PSA velocity and presence of ECD.
Key words: Prostatic neoplasms. Radical prostatectomy. PSA velocity. Biochemical recurrence. Extracapsular disease. Survival.
Introducción
La generalización del uso del antígeno prostático específico (PSA) ha producido un cambio drástico en la epidemiología, el diagnóstico y el manejo terapéutico del cáncer de próstata (CaP).
La difusión del screening poblacional y del screening oportunístico, así como de las biopsias extendidas y de saturación, ha transformado el perfil clínico del paciente con CaP y en la actualidad aproximadamente el 25% de estos pacientes tienen un PSA <4ng/ml1. El hecho de que los tumores detectados en la actualidad suelan ser no palpables, de pequeño tamaño y bajo PSA, ha reducido considerablemente la importancia del estadio clínico en el pronóstico y la utilidad del PSA para establecer discriminaciones diagnósticas y pronósticas, hasta el punto de que algunos autores creen que en la actualidad el PSA puede reflejar predominantemente el volumen prostático, más que el tipo de patología subyacente2. Es necesario por tanto, buscar herramientas que nos permitan predecir el diagnóstico y el pronóstico el CaP con niveles bajos de PSA.
La cinética del PSA y en concreto la velocidad de PSA (PSAV) han sido analizadas en diversos estudios para determinar su capacidad en la predicción del diagnóstico de CaP y de diferenciar entre hiperplasia benigna y CaP, considerándose clásicamente que una PSAV superior a 0,75ng/ml/año se asocia a una elevada probabilidad de CaP en la biopsia3.
La investigación de las aplicaciones de la PSAV en la estimación del pronóstico del CaP tras tratamiento curativo, tiene una trayectoria más corta, aunque existen varios estudios en los que se observa su asociación con la supervivencia libre de recidiva bioquímica (SLRB), la supervivencia cáncer-relacionada (SCR) y la supervivencia global (SG)4,5.
El método de cálculo de la PSAV ha sido motivo de controversia, ya que frente a los sencillos modelos aritméticos, fácilmente aplicables en la clínica, existen modelos de regresión lineal que utilizan fórmulas complejas, desconocidas para la generalidad de urólogos6.
El estudio que hemos realizado pretende determinar si la PSAV en el año previo a la prostatectomía radical (PR) se relaciona con los hallazgos histopatológicos de la pieza quirúrgica, la SLRB, la SCR y la SG. Asimismo dos métodos de cálculo de PSAV son comparados.
Material y métodos
Se realizó un estudio observacional de cohorte retrospectivo y prospectivo, formado por pacientes con CaP clínicamente localizado, a los que se practicó PR en el Servicio de Urología del Hospital Arquitecto Marcide, Ferrol, A Coruña, España, entre 2000-2008.
De todos los pacientes tratados mediante PR durante el periodo de estudio, se seleccionaron 265 pacientes de los que disponía al menos de 2 determinaciones de PSA en el año previo al diagnóstico de CaP.
Ningún paciente recibió hormonoterapia neoadyuvante, ni tratamiento adyuvante inmediato, con radioterapia u hormonoterapia.
Se realizó PR retropúbica en 181 casos (68,30%) y laparoscópica en 84 pacientes (31,70%).
La clasificación TNM empleada fue la AJCC/UICC de 19977. Se utilizó asimismo la clasificación de grupos de riesgo de D´Amico, para determinar su capacidad para predecir eventos8.
La determinación del PSA se efectuó mediante el ensayo ADVIA Centaur® (Bayer Diagnostics, Tarrytown, New York).
Se definió recidiva bioquímica como la existencia de 2 incrementos consecutivos de la cifra de PSA por encima de 0,2ng/ml. Se consideró como fecha de recidiva bioquímica aquella en la que la cifra de PSA superó por primera vez 0,2ng/ml.
Se consideró como fecha de último contacto la fecha en la que el paciente fue visto en la consulta por última vez o bien la fecha de fallecimiento.
Se consideró como muerte cáncer-relacionada aquella que se produjo en un contexto de CaP hormonorrefractario metastático y con PSA en aumento progresivo. El resto de las muertes no fueron consideradas como cáncer-relacionadas.
El cálculo de la PSAV se realizó mediante 2 metodologías previamente descritas6. La primera de ellas utilizando un método aritmético simple restringido al año previo al diagnóstico, utilizando 2 mediciones de PSA: el PSA más próximo al año previo al diagnóstico, sin sobrepasarlo y el PSA previo a la biopsia prostática.
La PSAV fue también calculada mediante un método de regresión lineal, utilizando todos los valores de PSA disponibles en el año previo al diagnóstico de CaP, y seleccionando solo aquellos casos en los que se disponía de 3 o más determinaciones de PSA (n=114). Se calculó el intervalo en días entre cada una de las determinaciones de PSA y el PSA inicial. Con las variables PSA y tiempo y utilizando la ecuación y=ax+b se calculó una recta de regresión para cada paciente, correspondiendo la pendiente de la recta (a) con la PSAV. Para obtener la PSAV anual, que es la cifra habitualmente empleada en la práctica clínica, se multiplicó la pendiente por 365 días.
Se analizaron diversos puntos de corte de PSAV, comprobando que el que permitía obtener las mayores diferencias en cuanto a la predicción de enfermedad extracapsular (EEC), SLRB, SCR y SG era de 3ng/ml/año, por ello se empleó este punto de corte para el análisis.
Análisis estadístico: se realizó un análisis descriptivo de todas las variables del estudio. Las variables cuantitativas fueron expresadas como media±desviación típica y/o mediana y las cualitativas como valor absoluto y porcentaje, con su IC 95%. La variable PSAV fue estudiada de forma continua, o bien categorizada en dos grupos (<3ng/ml/año y >3ng/ml/año). Las diferencias relativas a EEC fueron analizadas mediante test c2 en variables cualitativas y test t de Student y U de Mann-Whitney, en variables cuantitativas. El análisis univarido de SLRB, SCR y SG se efectuó mediante la metodología de Kaplan-Meier en variables cualitativas y mediante regresión de Cox en variables cuantitativas. Se realizó análisis multivariado de regresión logística para identificar variables asociadas a EEC. Se desarrollaron modelos multivariados de regresión de Cox para identificar variables asociadas a SLRB, SCR y SG. Se determinó asimismo la capacidad del PSA y PSAV para predecir recidiva bioquímica, muerte global y muerte cáncer-relacionada, mediante c-index. Se consideró como significativo un valor de p<0,05. El análisis estadístico fue realizado con el programa SPSS 13.0 para Windows.
Resultados
La media de edad de los pacientes del estudio fue 64,64±5,54 años (rango: 52-74).
Se observó organoconfinación tumoral en 191 casos (72,08%) y EEC en 74 pacientes (27,92%). Se detectaron márgenes quirúrgicos positivos en 34 casos (12,83%). En la tabla 1 se pueden observar estas y otras características clínicas de los pacientes e histopatológicas de la pieza de PR.
El seguimiento medio de los pacientes fue de 62,68±20,34 meses (9,14-106,75), con una mediana de 56,16 meses.
Se produjo recidiva bioquímica en 50 pacientes (18,87%), siendo el seguimiento medio hasta la recidiva bioquímica de 16,84±13,80 meses (1,41-48,85), con una mediana de 12,13 meses.
La mortalidad relacionada con el CaP fue del 1,52%. La mortalidad global observada al final del periodo de seguimiento fue del 6,08%.
La sensibilidad, especificidad y valores predictivos positivo y negativo de diversos puntos de corte de PSAV fueron analizados en relación con la probabilidad de EEC, SLRB, SCR y SG (tabla 2).
Los métodos de cálculo de PSAV (aritmético y regresión lineal) fueron comparados en los 114 casos en los que fue posible calcularlo mediante regresión lineal, observando que la estimación de PSAV era prácticamente igual con ambos métodos. La media de PSAV con el método aritmético era 1,73±3,31ng/ml/año (mediana: 0,65), y la media de PSAV con el método de regresión era 1,72±3,35ng/ml/año (mediana: 0,63).
En la tabla 3 se exponen la sensibilidad, especificidad, y valores predictivos positivo y negativo de PSAV obtenidos con ambos métodos, para un punto de corte de 3ng/ml/año. Los resultados fueron analizados utilizando la PSAV obtenida mediante ambos métodos, pero debido a la equivalencia de los mismos, las tablas muestran solo los datos relativos a la PSAV calculada aritméticamente.
Predicción de EEC
Entre los pacientes con tumor confinado a la próstata y aquellos con EEC se observaron diferencias en relación con el % cilindros positivos (p=0,008) y con el Gleason combinado (p=0,016). El resto de las variables clínicas analizadas no mostraron capacidad para predecir la existencia de EEC (tabla 4).
Se realizó un análisis multivariado de regresión logística, ajustando por edad, PSA, PSAV, % cilindros positivos, Gleason combinado de la biopsia y categoría T, observando que el % cilindros positivos y la presencia de un Gleason >7 tenían capacidad para predecir de forma independiente la presencia de EEC en la pieza quirúrgica (tabla 4).
Predicción de SLRB
La SLRB al cabo de 1, 2, 5 y 9 años en los pacientes con una PSAV<3ng/ml/año fue de 93,80; 89,30; 81,30 y 81,30%, respectivamente. En el grupo con PSAV >3ng/ml/año, la SLRB al cabo de 1, 2, 5 y 9 años fue de 72,20; 60,60; 60,60 y 60,60%, respectivamente (p<0,001) (figura 1).
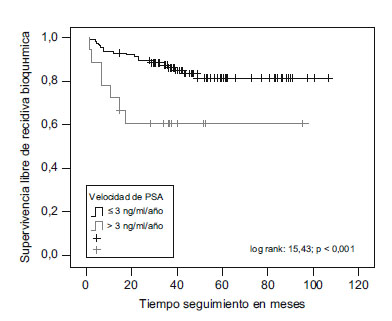
Figura 1. Diferencias entre pacientes con PSA velocidad <3ng/ml/año
y pacientes con PSA velocidad >3ng/ml/año, en relación con supervivencia
libre de recidiva bioquímica (log rank=15,43; p<0,001).
La probabilidad de desarrollar recidiva bioquímica en los pacientes con PSAV <3ng/ml/año fue del 16,00 vs. 38,88% en pacientes con PSAV >3ng/ml/año (OR: 3,34; IC 95%: 1,56-7,13) (p=0,001).
Las variables que modificaron de forma significativa la probabilidad de recidiva bioquímica fueron la cifra de PSA (p=0,002), PSA densidad (p<0,001), PSAV (p<0,001). % cilindros positivos (p=0,001), grupo de riesgo de D´Amico (p=0,008), categoría T (p=0,033), categoría pT (p<0,001), la existencia de EEC (p=0,002) y la presencia de márgenes quirúrgicos (p<0,001). La relación de estas y otras variables con la recidiva bioquímica se puede observar en las tabla 5 y tabla 6.
Se realizó un análisis de regresión de Cox, ajustando por edad, PSA, PSAV, Gleason combinado de la pieza, estado de márgenes quirúrgicos y categoría pT. Se comprobó que las variables que permitían predecir de forma independiente la SLRB eran PSA, PSAV, la presencia de márgenes quirúrgicos positivos y la infiltración de las vesículas seminales (tabla 7).
El c-index de PSAV para predecir SLRB fue 0,685.
Predicción de SCR
La SCR al cabo de 1, 2, 5 y 9 años fue de 100, 100, 98,70 y 98,70%, respectivamente, en los pacientes con PSAV <3ng/ml/año, y de 100; 94,10; 94,10 y 94,10%, respectivamente, en los pacientes con PSAV >3ng/ml/año (p=0,019) (figura 2).
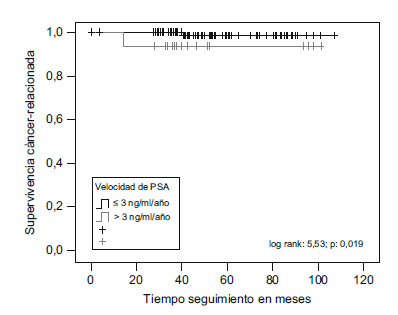
Figura 2. Diferencias entre pacientes con PSA velocidad <3ng/ml/año
y pacientes con PSA velocidad >3ng/ml/año, en relación con Supervivencia
cáncer-relacionada (log rank=5,53; p=0,019).
La mortalidad cáncer-relacionada de los pacientes con PSAV<3ng/ml/año (0,89%) fue significativamente menor que la de los casos con PSAV >3ng/ml/año (5,00%) (OR: 5,86; IC 95%: 1,00-42,92) (p=0,048).
La SCR se asoció de forma significativa con PSA (p=0,046), %PSA libre/total (p=0,007), PSA densidad (p=0,048), PSAV (p=0,004), grupo de riesgo de D´Amico (p=0,015), categoría pT (<0,001) y existencia de márgenes quirúrgicos (p=0,001) (tabla 5 y tabla 6).
Ajustando por edad, PSA, PSAV, Gleason combinado de pieza, estado de márgenes quirúrgicos y existencia de EEC, en un modelo multivariado de regresión de Cox, se evidenció que las variables significativamente asociadas a SCR eran PSA y PSAV (tabla 7).
El c-index de PSAV para predecir SCR fue 0,794.
Predicción de SG
La SG al cabo de 1, 2, 5 y 9 años, en los pacientes con PSAV<3ng/ml/año fue de 100, 100, 97,50 y 90,30%, respectivamente. En los pacientes con PSAV >3ng/ml/año, la SG observada fue de 90,00; 80,00; 70,00 y 70,00%, respectivamente (p<0,001) (figura 3).
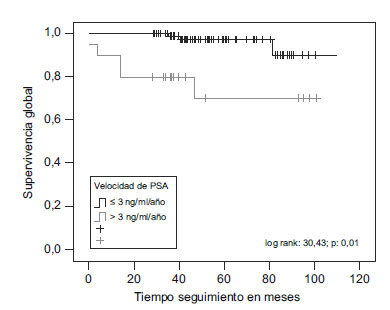
Figura 3. Diferencias entre pacientes con PSA velocidad <3ng/ml/año
y pacientes con PSA velocidad >3ng/ml/año, en relación con supervivencia
global (log rank=30,43; p<0,001).
La mortalidad global en los pacientes con PSAV<3ng/ml/año fue del 2,67 vs. 25,00% en los pacientes con PSAV >3ng/ml/año, siendo las diferencias estadísticamente significativas (OR: 12,16; IC 95%: 4,12-35,88) (p<0,001).
Las variables que modificaron de forma significativa la SG en el análisis univariado fueron PSA (p=0,006), %PSA libre/total (0,025), PSA densidad (0,006) y PSAV (p<0,001) (tabla 5 y tabla 6).
Se desarrolló un modelo multivariado de regresión de Cox, para predecir SG, ajustando por edad, PSA, PSAV, Gleason combinado de pieza, márgenes quirúrgicos y existencia de EEC, observando que las variables con capacidad para predecir la SG de forma independiente eran edad y PSAV (tabla 7).
Se realizó asimismo un segundo modelo de regresión de Cox, ajustando por las mismas variables que el anterior, pero dicotomizando PSAV en < y >3ng/ml/año. Se observó que las variables con capacidad para predecir SG de forma independiente eran edad (RR: 1,29; IC 95%: 1,06-1,58) (p=0,010) y PSAV (RR: 22,81; IC 95%: 4,71-90,46) (p<0,001), de modo que los pacientes con PSAV >3ng/ml/año tenían una probabilidad de muerte 22,81 veces superior que aquellos con PSAV <3ng/ml/año.
El c-index de PSAV para predecir SG fue 0,803.
Discusión
Stamey TA et al sugirieron que en la actualidad la cifra de PSA total es un reflejo más fiel del tamaño prostático que de la existencia de CaP2. Parece no ocurrir lo mismo con la variación anual de PSA, que podría ayudarnos a distinguir entre benignidad y malignidad, independientemente del tamaño prostático, así Loeb S et al, en un estudio con un seguimiento medio de más de 4 años, observan que en pacientes sin CaP la PSAV era <0,1ng/ml/año en la mayoría de los casos, a pesar de la existencia de tasas de crecimiento prostático de hasta 10cc/año9.
La variación de la cifra de PSA en el tiempo podría ser útil para identificar enfermos con CaP y valores bajos de PSA. Sin embargo, el CaP suele tener una dilatada historia natural, por lo que la transcendencia de los cambios biológicos y bioquímicos que pueda experimentar en el corto plazo son desconocidos.
El concepto de PSAV fue inicialmente utilizado por Carter HB et al3, quienes demostraron su utilidad para distinguir entre pacientes con y sin CaP y atribuyeron las diferencias encontradas a una hipotética mayor velocidad proliferativa del epitelio tumoral, con respecto al epitelio benigno.
La PSAV ha sido empleada para predecir la presencia de CaP en la pieza de RTU o adenomectomía10, así como para diferenciar entre recidiva local y sistémica tras PR11 y postulada como indicador pronóstico en pacientes tratados con intención curativa4,5.
La PSAV ha sido considerada como un reflejo bioquímico del incremento del volumen tumoral con el tiempo12, de forma que una elevada PSAV preoperatoria en un tumor clínicamente órganoconfinado podría asociarse al hallazgo de EEC en la pieza de PR o bien a la diseminación linfática y/o hematógena de células neoplásicas, al alcanzar el tumor un volumen crítico con capacidad metastásica.
La cuantificación de PSAV puede verse afectada por múltiples factores, que dificultan la comparación de los resultados de diferentes estudios. La determinación de PSA en distintos laboratorios puede ocasionar diferencias medias del 37% en la cifra de PSA, por la utilización de distintos ensayos13. La variabilidad biológica inherente en la cifra de PSA puede alcanzar el 20% en dos determinaciones realizadas a un paciente en el mismo día14. Existen diversos procesos inflamatorios e infecciosos que pueden interferir en la cifra de PSA, al tratarse de una molécula órgano-específica y no cáncer-específica. Existen otros factores que pueden afectar a la estimación de PSAV, como la utilización de diferentes métodos matemáticos de cálculo, el número de determinaciones de PSA empleadas y la variabilidad del intervalo de tiempo considerado para el cálculo.
No existe un método estándar de cálculo de PSAV, resultando por ello difícil cuantificar la verdadera importancia y reproductibilidad de los estudios que analizan las aplicaciones de PSAV. Existen estudios que comparan diversos métodos aritméticos y de regresión lineal para calcular la PSAV, obteniendo una elevada correlación en los resultados obtenidos con ambos métodos de cálculo6,15,16. En nuestro estudio, la media de PSAV fue de 1,73ng/ml/año utilizando un método aritmético y de 1,72ng/ml/año, cuando se empleó un método de regresión lineal, confirmando estos resultados los hallazgos de los estudios anteriormente citados, ya que ambos métodos tienen una capacidad prácticamente igual para predecir los eventos analizados en el estudio (tabla 3).
La PSAV ha sido empleada para determinar la existencia de hallazgos histopatológicos adversos en la pieza de PR, con resultados discordantes5,17-21. Sengupta S et al16 observaron en un análisis univariado, que una PSAV >3,4ng/ml/año se asociaba de forma significativa con una categoría pT más elevada, un Gleason combinado más indiferenciado y una mayor proporción de márgenes quirúrgicos infiltrados.
En la misma línea, Patel DA et al comprobaron en un análisis univariado, que aquellos pacientes con una PSAV >2ng/ml/año tenían una probabilidad significativamente mayor de presentar tumores pT3, con márgenes positivos, y volúmenes tumorales >1ml18.
D´Amico AV et al observaron asimismo, como una PSAV >2ng/ml/año incrementaba la probabilidad de metástasis ganglionares, categoría pT3 y Gleason score >75.
Por el contrario, otros estudios como los de Thiel R y Freedland SJ20,21, efectuando ambos un análisis multivariado, no encuentran relación entre la cinética del PSA y las características de la pieza, con la limitación del reducido número de pacientes que analizan.
En nuestro estudio se observó que el % cilindros positivos y un Gleason combinado >6 eran variables independientes en la predicción de EEC. No se observó relación significativa entre PSAV y la presencia de EEC. Una posible explicación para entender la discrepancia entre los resultados de nuestro estudio y el de aquellos en los que PSAV se relaciona con los hallazgos histopatológicos de la pieza, es que estos últimos están basados en un análisis univariado, con sus limitaciones inherentes como la ausencia de control del posible efecto confusor de otras covariables.
Se ha analizado en diversos estudios la utilidad de PSAV en la predicción del resultado de diversos tratamientos curativos del CaP, como braquiterapia, radioterapia externa4 y PR.
La recidiva bioquímica tras PR representa el fallo de la cirugía como tratamiento definitivo. Bien es cierto que no todos los pacientes con recidiva bioquímica experimentan progresión clínica a los 10 años, solo un 21-37% según Stephenson AJ et al22, y que de estos, un 57% no morirán a consecuencia del CaP23. Sin embargo resulta evidente que todos los pacientes que fallecen a consecuencia de un CaP, tras someterse a una PR, han experimentado fallo de PSA. Es por esto que la SLRB se ha utilizado en múltiples estudios como un criterio indirecto de valoración (surrogate endpoint) ya que su análisis requiere un periodo de seguimiento menos prolongado que la SG o SCR18,21,24.
El estudio de Berger AP et al analiza una cohorte de 102 pacientes y comprueba como la PSAV en el año previo a la cirugía es un factor independiente en la predicción de recidiva bioquímica a los 5 años tras PR24. Los autores observan que la mediana de PSAV en los pacientes sin recidiva bioquímica era significativamente inferior a la de los pacientes con recidiva bioquímica (1,05 vs. 1,98ng/ml/año).
Resultados similares fueron obtenidos por Patel DA et al, quienes observaron que PSAV era una variable independiente de recidiva bioquímica tras PR, cuando era categorizada en torno a 2ng/ml/año. Los autores comprobaron que los pacientes con PSAV >2ng/ml/año tenían un riesgo tres veces superior de presentar recidiva bioquímica tras PR18.
Sengupta et al realizan un estudio con 2.290 pacientes sometidos a PR, con un seguimiento medio de 7,1 años, poniendo de manifiesto que tanto una PSAV >3,4ng/ml/año, como un tiempo de duplicación de PSA <18 meses, predicen de forma independiente la recidiva bioquímica, la progresión clínica y la mortalidad cáncer-relacionada. Cuando PSAV y el tiempo de duplicación de PSA son incluidos en el mismo modelo multivariado, solo el tiempo de duplicación de PSA predice de forma independiente la probabilidad de progresión clínica y la SCR17.
La relación de PSAV y el resultado de la PR fue estudiada también por D´Amico AV et al, en una cohorte de 1.095 pacientes seguidos una media de 5,1 años. Los pacientes fueron categorizados en dos grupos, en función de PSAV (< y >2ng/ml/año), observando que los pacientes con PSAV >2ng/ml/año tenían una probabilidad significativamente superior de presentar hallazgos patológicos adversos, recidiva bioquímica, mortalidad cáncer-relacionada y mortalidad global. La mortalidad global de la serie fue del 7,67%, siendo la mortalidad cáncer-relacionada del 2,46%5.
El seguimiento medio en nuestro estudio fue de algo más de 5 años, detectándose recidiva bioquímica en el 18,87% de los pacientes, mortalidad cáncer-relacionada en el 1,52% y mortalidad de cualquier causa en el 6,08%. Estos datos son comparables a los encontrados en estudios con periodos de seguimiento similares5,17,25. Observamos asimismo que tras 9 años de seguimiento, los pacientes con PSAV >3ng/ml mostraban una probabilidad significativamente superior de recidiva bioquímica, mortalidad cáncer-relacionada y mortalidad de cualquier causa (p<0,001) (figura 1).
La cifra de corte adoptada por los estudios revisados es variable y probablemente depende de las características de la muestra estudiada. El punto de corte utilizado por D´Amico et al es 2ng/ml/año, en una cohorte de pacientes con una mediana de PSA de 4,30ng/ml y una proporción de pacientes con PSA<4ng/ml del 43%5. En nuestro estudio la mediana de PSA era 7,60ng/ml y solo un 5,28% de los pacientes tenían un PSA<4ng/ml. Estos datos podrían justificar las diferencias en el punto de corte de PSAV considerado como óptimo, ya que la PSAV varía de forma proporcional a la cifra de PSA total, según demuestran Yu X et al26.
La mediana de PSA en el estudio de Sengupta et al17 es 6,70ng/ml, y el punto de corte empleado de 3,4ng/ml/año. Este elevado punto de corte no es fácil de explicar, salvo porque su porcentaje de márgenes positivos es del 33,10%, cifra muy superior al 12,83% de nuestra serie.
Los resultados de nuestro análisis multivariado de regresión de Cox confirman los encontrados en estudios similares5,17,18,24, demostrando que la PSAV en el año previo a la cirugía es una variable independiente en la predicción de SLRB, SCR y SG. Otras variables independientes son PSA, estado de los márgenes quirúrgicos y categoría pT, en la predicción de SLRB, el PSA en la predicción de SCR y la edad en la predicción de SG.
Cuando en el análisis multivariado se introduce PSAV como una variable continua, se observa que por cada incremento de una unidad de PSAV, el riesgo relativo de recidiva bioquímica, muerte cáncer-relacionada y muerte por cualquier causa se incrementa un 6, un 22 y un 35%, respectivamente. Asimismo, cuando PSAV es dicotomizada en torno a 3ng/ml/año, se observa que los pacientes con PSAV >3ng/ml/año tienen un riesgo 22,81 veces superior de muerte por cualquier causa, que los pacientes cuyo PSAV es <3ng/ml/año.
Resulta evidente que la naturaleza retrospectiva de nuestro estudio supone una limitación, ya que no se puede controlar por un eventual sesgo de seleccionar para el estudio solo aquellos pacientes a los que se solicitaron varias determinaciones de PSA en el año previo a la cirugía, que podrían tener características poblacionales diferentes a aquellos con una sola determinación de PSA. Sin embargo, hay que tener en cuenta que solo se excluyeron del análisis por este motivo un 17,44% de los pacientes sometidos a PR. Esta carencia solamente podría ser evitada mediante un estudio prospectivo.
El seguimiento mediano de los pacientes de nuestro estudio fue de 56 meses y la mortalidad observada del 6%. La realización de un seguimiento más prolongado se asociaría a una mayor mortalidad, e indudablemente los resultados de supervivencia serían más consistentes.
Conclusiones
La PSAV preoperatoria permite predecir la SLRB, la SCR y la SG de los pacientes con CaP tratados mediante PR.
Un punto de corte de 3ng/ml/año permite en nuestro estudio obtener la mayor capacidad discriminatoria de PSAV para predecir eventos relacionados con la supervivencia.
Las implicaciones de estos resultados en el tratamiento del CaP parecen importantes, desde nuestro punto de vista, ya que los pacientes con PSAV elevada no deberían ser candidatos a modalidades terapéuticas basadas en la monitorización activa. Es posible también que los pacientes con una PSAV preoperatoria elevada deban ser considerados como pacientes de alto riesgo de recidiva bioquímica y muerte tras la realización de PR, por lo que debería ser valorada la aplicación de tratamiento adyuvante. No obstante, estas consideraciones solo podrían ser tenidas en cuenta en el seno de estudios prospectivos y aleatorizados.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Bibliografía
1. Horninger W., Cheli C.D., Babaian R.J., Fritsche H.A., Lepor H., Taneja S.S., et al. Complexed prostate-specific antigen for early detection of prostate cancer in men with serum prostate-specific antigen levels of 2 to 4 nanograms per milliliter. Urology. 2002; 60(4 suppl 1):31-5. [ Links ]
2. Stamey T.A., Caldwell M., McNeal J.E., Nolley R., Hemenez M., Downs J. The prostate specific antigen era in the United Status is over for prostate cancer: what happened in the last 20 years?. J Urol. 2004; 172:1297-301. [ Links ]
3. Carter H.B., Pearson J.D., Metter M.D., Brant L.J., Chan D.W., Andres R., et al. Longitudinal evaluation of prostate-specific antigen levels in men with and without prostate disease. JAMA. 1992; 267:2215-20. [ Links ]
4. Eggener S.E., Roehl K.A., Yossepowitch O., Catalona W.J. Prediagnosis prostate specific antigen velocity is associated with risk of prostate cancer progression following brachytherapy and external beam radiation therapy. J Urol. 2006; 176:1399-403. [ Links ]
5. D´Amico A.V., Chen M.H., Roehl K.A., Catalona W.J. Preoperative PSA velocity and the risk of death from prostate cancer after radical prostatectomy. N Eng J Med. 2004; 351:125-35. [ Links ]
6. Yu X., Han M., Loeb S., Gashti S.N., Yeh J.T., Roehl K.A., et al. Comparison of methods for calculating prostate specific antigen velocity. J Urol. 2006; 176:2427-31. [ Links ]
7. Sobin L.H., Wittekind C.H., editors. International Union Against Cancer (UICC): TNM Classification of malignant tumours. 5th edition. New York: John Wiley-Liss; 1997. 170-3. [ Links ]
8. D´Amico A.V., Whittington R., Malkowicz S.B., Schultz D., Blank K., Broderick G.A., et al. Biochemical outcome after radical prostatectomy, external beam radiation therapy, or interstitial radiation therapy for localized prostate cancer. JAMA. 1998; 280:969-74. [ Links ]
9. Loeb S., Kettermann A., Carter H.B., Ferrucci L., Metter E.J., Walsh P.C. Does prostate growth confound prostate specific antigen velocity? Data from the Baltimore longitudinal study of aging. J Urol. 2008; 180:1314-7. [ Links ]
10. Rodríguez-Alonso A., González-Blanco A., Barbagelata-López A., Pita-Fernández S., Suárez-Pascual G., Bonelli-Martín C., et al. Importancia de la velocidad y la densidad de PSA en la predicción de cáncer de próstata en la pieza de RTU o adenomectomía de pacientes con biopsia prostática previa negativa. Actas Urol Esp. 2008; 32:779-86. [ Links ]
11. Partin A.W., Pearson J.D., Landis P.K., Carter H.B., Pound C.R., Clemens J.Q., et al. Evaluation of serum prostate-specific antigen velocity after radical prostatectomy to distinguís local recurrente from distant metastases. Urology. 1994; 43:649-59. [ Links ]
12. Sengupta S., Amling C., D´Amico A.V., Blute M.L. Prostate specific antigen kinetics in the management of prostate cancer. J Urol. 2008; 179:821-6. [ Links ]
13. Loeb S., Chan D.W., Sokoll L., Kan D., Maggiore J., Mikolajczyk S.D., et al. Prostate specific antigen assay standardization bias could affect clinical decision making. J Urol. 2008; 180:1959-63. [ Links ]
14. Sölétormos G., Semjonow A., Sibley P.E.C., Lamerz R., Petersen P.H., Albrecht W., et al. Biological variation of total prostate-specific antigen: a survey of Publisher estimates and consequences for clinical practice. Clin Chem. 2005; 51:1342-51. [ Links ]
15. Connolly D., Black A., Murray L.J., Napolitano G., Gavin A., Keane P.F. Methods of calculating prostate-specific antigen velocity. Eur Urol. 2007; 52:1044-51. [ Links ]
16. King C.R., Freeland S.J., Terris M.K., Aronson W.J., Kane C.J., Amling C.L., et al. Optimal timing, cutoff, and method of calculation of preoperative prostate-specific antigen velocity to predict relapse after prostatectomy: A report from SEARCH. Urology. 2007; 69:732-7. [ Links ]
17. Sengupta S., Myers R.P., Slezak J.M., Bergstralh E.J., Zincke H., Blute M.L. Preoperative prostate specific antigen doubling time and velocity are stong and independent predictors of outcomes following radical prostatectomy. J Urol. 2005; 174:2191-6. [ Links ]
18. Patel D.A., Presti J.C., McNeal J.E., Gill H., Brooks J.D., King C.R. Preoperative PSA velocity is an independent prognostic factor for relapse alter radical prostatectomy. J Clin Oncol. 2005; 23:6157-62. [ Links ]
19. Berger A.P., Deibl M., Strasak A., Bektic J., Pelzer A.E., Klocker H., et al. Large-scale study of clinical impact of PSA velocity: long-term PSA kinetics as method of differentiating men with from those without prostate cancer. Urology. 2007; 69:134-8. [ Links ]
20. Thiel R., Pearson J.D., Epstein J.I., Walsh P.C., Carter H.B. Role of prostate-specific antigen velocity in prediction of final pathologic stage in men with localizad prostate cancer. Urology. 1997; 49:716-20. [ Links ]
21. Freeland S.J., Dorey F., Aronson W.J. Preoperative PSA velocity and doubling time do not predict adverse pathologic features or biochemical recurrence after radical prostatectomy. Urology. 2001; 57:476-80. [ Links ]
22. Stephenson A.I., Kattan M.W., Eastham J.A., Dotan Z.A., Bianco F.J., Lilja H., et al. Defining biochemical recurrente of prostate cancer after radical prostatectomy: a proposal for a standardized definition. J Clin Oncol. 2006; 24:3973-8. [ Links ]
23. Pound C.R., Partin A.W., Eisenberger M.A., Chan D.W., Pearson J.D., Walsh P.C. Natural history of progression after PSA elevation following radical prostatectomy. JAMA. 1999; 281:1591-7. [ Links ]
24. Berger A.P., Deibl M., Strasak A., Bektic J., Pelzer A., Steiner H., et al. Relapse after radical prostatectomy correlates with preoperative PSA velocity and tumor volume: results from a screening population. Urology. 2006; 68:1067-71. [ Links ]
25. Hull G.W., Rabbani F., Abbas F., Wheeler T.M., Kattan M.W., Scardino P.T. Cancer control with radical prostatectomy alone in 1000 consecutive patients. J Urol. 2002; 167:528-34. [ Links ]
26. Yu X., Loeb S., Roehl K.A., Han M., Catalona W.J. The association between total specific antigen concentration and prostate specific antigen velocity. J Urol. 2007; 177:1298-302. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
arodri68@gmail.com
(A. Rodríguez-Alonso)
Recibido 28 Octubre 2009
Aceptado 5 Enero 2010














