My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Actas Urológicas Españolas
Print version ISSN 0210-4806
Actas Urol Esp vol.34 n.10 Nov./Dec. 2010
Tumor neuroendocrino primario del riñón
Primary neuroendocrine tumor of the kidney
Dirección para correspondencia
Sr. Director:
Presentamos el caso de un paciente con pérdida de peso y una masa en el flanco izquierdo con varios meses de evolución. En la TAC abdominal se podía ver un quiste complejo del riñón de 16cm y un nódulo hepático solitario (figura 1). Los análisis de sangre y los marcadores tumorales estaban dentro de la normalidad.
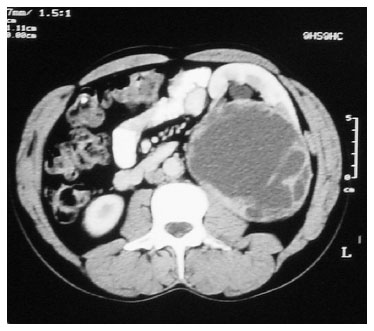
Figura 1. TAC abdominal. Quiste grado iv de Bosniak en riñón izquierdo.
La nefrectomía radical izquierda reveló una neoplasia de 16cm con necrosis y hemorragia central, delimitada por un tejido de 2cm de aspecto blanquecino. La histología reveló un carcinoma de patrón cordonal sin atipias celulares o pleomorfismo celular y el índice mitótico mínimo. La neoplasia, confinada por la cápsula renal, tenía infiltración venosa microscópica y un nódulo linfático hilar metastatizado, pero ninguna invasión vascular mayor. La marcación inmunohistoquímica fue positiva para CD57/Leu7, NSE, sinaptofisina y cromogranina, demostrando que se trataba de un tumor neuroendocrino bien diferenciado (figura 2).

Figura 2. HE200×. Carcinoma de patrón cordonal sin atipias celulares
o pleomorfismo celular y el índice mitótico mínimo. Positividad para
NSE y sinaptofisina-caja (StreptABC-peroxidase).
En el postoperatorio se realizaron examen endoscópico gastrointestinal, TAC torácica y marcadores neuroendocrinos (5-HIAA y gastrina), que resultaron normales. En la hepatectomía parcial se extirparon 4 lesiones metastásicas con las mismas características histológicas. En los 6 meses siguientes se realizó un ciclo de quimioterapia adyuvante con etopósido y cisplatino.
El paciente recuperó peso, no manifestó clínica alguna y permaneció sin evidencia de enfermedad hasta transcurridos 2 años cuando la TAC de control se detectó múltiples metástasis hepáticas pequeñas. El octreoscan fue positivo, confirmando las metástasis con receptores de somatostatina. Empezó terapéutica con octreotido con estabilización de la enfermedad hepática. La terapia con octreotido tuvo que ser suspendida por desenvolvimiento de diabetes mellitus a los 5 años. Se cambió a una pauta con doxorrubicina que tuvo que suspender seis meses después por progresión marcada de la enfermedad hepática. Se empezó una nueva línea de quimioterapia paliativa con estreptozocina y 5FU, pero la enfermedad progresó lentamente, con desenvolvimiento de nuevas metástasis óseas y ganglionares que condicionaron su fallecimiento a los 85 meses del diagnóstico.
Aunque la mayoría de los tumores neuroendocrinos afectan a los sistemas gastrointestinal y respiratorio, pueden ocurrir en cualquier localización y están entre los tumores renales más raros. En la ausencia de células neuroendocrinas en el riñón, se opina que derivan de la diferenciación neuroendocrina de células multipotenciales, de las células metaplásticas del urotelio o en la asociación con teratomas1,2.
Histológicamente, los tumores carcinoides renales se presentan como áreas sólidas de células dispuestas en trabéculas glandulares (como rosetas) o cordones. Esto los diferencia de los tumores indiferenciados y altamente proliferativos de pequeñas células neuroendocrinas (carcinoma neuroendocrino y PNET). Las técnicas de coloración (Grimelius, Fontana-Masson), los marcadores ultraestructurales (cromogranina A, NSE, sinaptofisina, Leu7 o citoqueratina) o la microscopía electrónica ayudan en el diagnóstico diferencial1,3. Al contrario del carcinoide renal y del carcinoma neuroendocrino de pequeñas células, el PNET es positivo para CD99, CD117 y vimentina3.
Desde el primer trabajo en 1966 se han publicado 56 casos de carcinoide renal primario4. La edad media al diagnóstico es de 49 años, sin predilección de sexo. Lo más habitual es que se presenten con síntomas que son el resultado de una masa abdominal expansiva grande (dolor, masa, hematuria o pérdida de peso). Los síntomas productivos (síndrome carcinoide) son raros. Uno de entre cuatro eran tumores incidentales.
La mayoría de los carcinoides renales son de débil captación de contraste o masas quísticas, a veces con calcificación en la TAC5,6.
Casi el 20% ocurrió en riñones en herradura, que representa la malformación renal con riesgo más alto de desarrollar un carcinoide renal. Aunque Krishnan declaró un comportamiento más benigno del tumor neuroendocrino en riñones en herradura, por lo menos 4 casos desarrollaron enfermedad metastásica5,6. La mitad de los pacientes tenían enfermedad avanzada en el momento del diagnóstico, localmente o con metástasis en nódulos linfáticos, hígado y hueso. Las recidivas pueden ocurrir después de varios años. En una revisión reciente, el 30% de los pacientes tenía enfermedad progresiva en el informe final, pero solamente el 7% había fallecido en los 34 meses de seguimiento mediano4.
El carcinoide genitourinario es tan raro que para hacer un diagnóstico de carcinoide renal primario hay que excluir otros orígenes más comunes a través de un estudio clínico, serológico, gastrointestinal y de imagen. Como la mayoría de los carcinoides expresan receptores de somatostatina, el estudio con octreoscan es muy sensible y fundamental para diagnosticar tumores primarios, así como para hacer el seguimiento de la enfermedad7.
El pronóstico del carcinoide renal depende de la fase clínica y patológica (tamaño del tumor, extensión local y metástasis), edad e índice mitótico del tumor1,4. La extirpación quirúrgica ampliada es el tratamiento de elección1. Como la mayoría de los tumores crece lentamente, con la supervivencia prolongada, la extirpación quirúrgica de las metástasis debe hacerse persiguiendo un mayor beneficio. La citorreducción con escleroterapia percutánea, radiofrecuencia y embolización hepática son tratamientos alternativos2,7. Recientemente, el uso de análogos de la somatostatina con estabilización del tumor en al menos 2/3 de los pacientes ha surgido como la terapia alternativa de la enfermedad avanzada6,8.
J. Cabral Ribeiro, L. Sousa y A. Ribeiro Santos
Department of Urology, Hospital de São Marcos, Braga, Portugal
Bibliografía
1. Raslan W.F., Ro J.Y., Ordonez N.G., Amin M.B., Troncoso P., Sella A., et al. Primary carcinoid of the kidney. Immunohistochemical and ultrastructural studies of five patients. Cancer. 1993; 72:2660-6. [ Links ]
2. Krishnan B., Truong L.D., Saleh G., Sirbasku D.M., Slavin K.M. Horseshoe kidney is associated with an increased relative risk of primary renal carcinoid tumor. J Urol. 1997; 157:2059-66. [ Links ]
3. Gross M.I., Berger I. Primary metastatic renal carcinoid in a young male patient: A contribution to the differential diagnosis of neuroendocrine tumors. Pathologue. 2007; 28:285-90. [ Links ]
4. Romero F.R., Rais-Baharami S., Permpongkosol S., Fine S.W., Kohanin S., Jarrett T.W. Primary carcinoid tumors of the kidney. J Urol. 2006. 176-2359-66. [ Links ]
5. Quinchon J.F., Aubert S., Biserte J., Lemaitre L., Gosselin B., Leroy X. Primary atypical carcinoid of the kidney: A classification is needed. Pathology. 2003; 35:353-5. [ Links ]
6. Motta L., Candiano G., Pepe P., Panella P., Galia A., Aragona A. Neuroendocrine tumor in a horseshoe kidney. Case report and updated follow-up of cases reported in the literature. Urol Int. 2004; 73:361-4. [ Links ]
7. McCaffrey J.A., Reuter V., Herr H.W., Macapinlac H.A. Carcinoid tumor of the kidney: The use of somatostatin receptor scintigraphy in diagnosis and management. Urol Oncol. 2000; 5:108-11. [ Links ]
8. Arnold R., Simon B., Wied M. Treatment of neuroendocrine GEP tumours with somatostatin analogues. Digestion. 2000; 62:84-91. [ Links ]
 Dirección para correspondencia:
Dirección para correspondencia:
jcabral@hsmbraga.min-saude.pt
(J. Cabral Ribeiro)














