Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Actas Urológicas Españolas
versión impresa ISSN 0210-4806
Actas Urol Esp vol.35 no.1 ene. 2011
Experiencia con sunitinib en cáncer de próstata metastásico hormonorresistente sin respuesta a docetaxel
Experience with sunitinib in hormone-resistant metastatic prostate cancer that is unresponsive to docetaxel
J.M. Gasenta, E. Grandeb, J. Casinelloc, M. Provenciod, J.B. Laforgae y V. Alberolaf
aServicio de Oncología Médica, Hospital de Denia, Alicante, España
bServicio de Oncología Médica, Hospital Universitario Ramón y Cajal, Madrid, España
cServicio de Oncología Médica, Hospital Universitario de Guadalajara, Guadalajara, España
dServicio de Oncología Médica, Hospital Universitario Puerta de Hierro, Madrid, España
eServicio de Anatomía Patológica, Hospital de Denia, Alicante, España
fServicio de Oncología Médica, Hospital Arnau de Vilanova, Valencia, España
Dirección para correspondencia
RESUMEN
Introducción: Las opciones de tratamiento sistémico para los pacientes con cáncer de próstata hormonorrefractario (CPHR) que progresan a pesar del uso de docetaxel son muy limitadas. Una de las opciones de uso compasivo disponibles en la actualidad es el empleo de sunitinib. Presentamos una experiencia preliminar conjunta con el uso de sunitinib en esta circunstancia clínica.
Pacientes y métodos: Se presenta una serie de 8 casos que refleja una experiencia multicéntrica prospectiva con sunitinib en pacientes con cáncer de próstata metastático, hormonorrefractario y en progresión, previamente tratados con al menos un régimen quimioterápico a base de docetaxel. En algunos pacientes ya se habían ensayado otros regímenes quimioterápicos alternativos. El objetivo primario de nuestro estudio fue la tasa de respuesta de PSA, y el objetivo secundario el tiempo libre de progresión. Se administró una dosis de 50mg/ día durante ciclos de 4 semanas, seguidos de 2 semanas de descanso por ciclo, hasta alcanzar un total de 8 ciclos o hasta la progresión clínica o toxicidad intolerable.
Resultados: En 4 casos el PSA descendió por debajo del 50% del nivel basal al inicio del tratamiento, y 5 pacientes presentaron algún descenso del PSA. El tiempo libre de progresión fue de 16,4 semanas. La toxicidad derivada del tratamiento fue moderada y manejable.
Conclusiones: A pesar de lo limitado de esta experiencia, podemos decir que sunitinib parece una opción activa y segura en pacientes con cáncer de próstata hormonorrefractario y resistente a quimioterapia con docetaxel.
Palabras clave: Sunitinib. Próstata. Cáncer hormonorrefractario. Resistencia a quimioterapia.
ABSTRACT
Introduction: Systemic treatment options for patients with hormone-refractory prostate cancer (HRPC) that progress despite the use of Docetaxel are very limited. One of the options of compassionate use currently available is the use of Sunitinib. We present a joint preliminary experience with the use of Sunitinib in this clinical case.
Patients and methods: A series of eight cases is presented, which sets forth a prospective multicentre experience with Sunitinib in patients with hormone-refractory metastatic and progressive prostate cancer, previously treated with at least a regime of Docetaxel-based chemotherapy. Other alternative chemotherapy regimes had already been tried in some patients. The primary objective of our study was the PSA response rate and our secondary objective was the progression-free period. We administered a dosage of 50mg/day for four-week cycles, followed by a two-week rest per cycle, until we reached a total of eight cycles or up to clinical progression or intolerable toxicity.
Results: In four cases, the PSA dropped to below 50% of the baseline level at the beginning of the treatment, and five patients presented some decrease in PSA. The progression-free time was 16.4 weeks. Toxicity arising from the treatment was moderate and manageable.
Conclusions: Despite the limits of this experience, we can say that Sunitinib appears to be an active and safe option in patients with hormone-refractory prostate cancer that is resistant to chemotherapy with Docetaxel.
Key words: Sunitinib. Prostate. Hormone-refractory Cancer. Resistance to chemotherapy.
Problema clínico
Las opciones de tratamiento sistémico para los pacientes con cáncer de próstata hormonorrefractario (CPHR) que progresan a pesar del uso de docetaxel son muy limitadas. Una de las opciones de uso compasivo disponibles en la actualidad es el empleo de sunitinib. Presentamos una experiencia preliminar conjunta, multicéntrica y prospectiva, no aleatorizada, ni financiada por empresa farmacéutica alguna, de carácter observacional, que evalúa el uso compasivo de sunitinib en cáncer de próstata hormonorrefractario y quimiorresistente en progresión a propósito de 8 pacientes.
Diseño del estudio
Todos los pacientes estaban afectos de cáncer metastático y habían progresado a pesar del tratamiento hormonal y de al menos un régimen quimioterápico a base de docetaxel (Taxotere®; Sanofi-Aventis, Bridgewater, New Jersey). En algunos pacientes ya se habían ensayado otros regímenes quimioterápicos alternativos. En todos los pacientes se instauró el tratamiento con sunitinib por necesidad clínica y como uso compasivo. El objetivo primario de nuestro estudio fue la tasa de respuesta del PSA y el objetivo secundario el tiempo libre de progresión.
Todos presentaron un incremento sobre el PSA basal en controles seriados de al menos 2 semanas de intervalo entre los mismos, y su último PSA era en todos los casos mayor de 10 ng/ ml. El Eastern Cooperative Oncology Group (ECOG) performance status se encontraba entre 0 y 2. Así mismo, todos tuvieron buena función cardíaca, sin presencia de arritmias o hipertensión no controlada. Ninguno de los pacientes había recibido tratamiento previo con radionúclidos que afectasen a más del 50% de la médula ósea. La función renal y hematopoyética era así mismo normal en todos los casos. Ninguno de los pacientes había presentado episodio de sangrado en las 4 semanas previas o morbilidad cardiovascular en los 6 meses previos. Adicionalmente, no se llevaron a cabo tampoco tratamientos radioterápicos en las 4 semanas previas al inicio del tratamiento.
Los pacientes recibieron inicialmente sunitinib 50mg diarios los días 1-28 cada 6 semanas, hasta algunas de las siguientes circunstancias: alcanzar un total de 8 ciclos, presentar progresión tumoral, sufrir toxicidad inaceptable o retirada del consentimiento por parte del paciente. En el diseño del estudio se consideró que para ser incluidos en el análisis se permitiría únicamente un total de 2 reducciones de dosis de sunitinib por toxicidad, inicialmente hasta 37,5mg diarios y posteriormente a 25mg diarios. En los casos con toxicidad grado 3 o 4, el tratamiento se suspendería hasta la recuperación completa del paciente o la mejora de la toxicidad hasta grado 1, continuando con el siguiente nivel de dosis reducida correspondiente. Los pacientes que interrumpieron su tratamiento durante más de 3 semanas no fueron incluidos en el análisis.
Resultados alcanzados
Se incluyeron un total de 8 pacientes, con una edad media de 71 años. El PSA medio al inicio del tratamiento fue de 584 ng/ ml (Tabla 1). Todos los pacientes habían recibido al menos una línea de quimioterapia que incluía docetaxel y 6 (75%) habían recibido además una segunda línea de quimioterapia con oxaliplatino y capecitabina. Ninguno de los pacientes incluidos presentaba otro lugar de metástasis que el hueso.
Cinco de nuestros pacientes presentaron una reducción de PSA de al menos 6 semanas de duración; cuatro de los pacientes alcanzaron una reducción de al menos el 50%; tres pacientes incrementaron su nivel de PSA a pesar de seguir tratamiento con sunitinib (Figura 1); en los pacientes con respuesta/ estabilización el intervalo libre de progresión fue de 16,4 semanas (12-18 semanas). No encontramos correlación entre la respuesta a quimioterapia previa y la respuesta a sunitinib en nuestra cohorte.
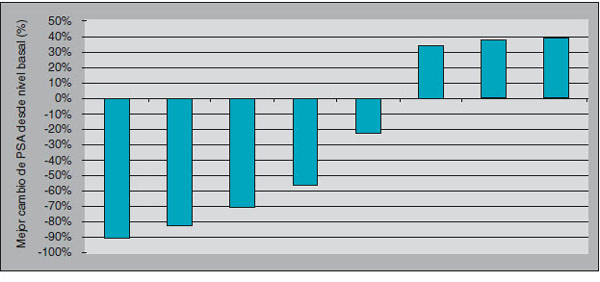
Figura 1. Cambio relativo del PSA para cada paciente sobre el valor basal conseguido
por el tratamiento con sunitinib.
Astenia, diarrea, anemia y trombopenia fueron las toxicidades registradas más relevantes. Los efectos secundarios considerados como graves (grado 3 o 4) fueron muy poco frecuentes en nuestra serie, puesto que solamente un paciente presentó toxicidad grado 3, de carácter digestivo en forma de diarrea. El resto fueron de carácter menor. Cinco pacientes (62,5%) presentaron astenia (uno grado 1, 4 grado 2), un paciente (12,5%) presentó anemia (grado 1) y 4 pacientes (50%) presentaron diarrea (uno grado 1, 2 grado 2 y uno grado 3). No se produjeron muertes atribuidas al tratamiento con sunitinib. Ninguno de nuestros pacientes presentó una interrupción del tratamiento más de 3 semanas.
Comentario
Sunitinib (Sutent®, Pfizer, New Jersey, USA) es un inhibidor oral multiselectivo de varios receptores de membrana de tirosina quinasa, entre los que se encuentran todos los receptores conocidos del VEGFR (-1, -2, y -3) y PDGFR (-α, y -β), así como el RET, KIT y FLT-3. Sunitinib se encuentra actualmente aprobado para el tratamiento de primera línea de pacientes con cáncer de células renales y para el tratamiento de pacientes con tumores del estroma gastrointestinal (GIST) que hayan fracasado, o que sean intolerantes al tratamiento con imatinib. Sunitinib, a través de la inhibición de VEGFR y PDGFR, cuenta con un mecanismo de acción antiangiogénico y actúa contra la proliferación de las células tumorales de manera directa a través de su acción sobre los otros receptores de membrana de tipo tirosina quinasa1.
Recientemente se ha comunicado un estudio preclínico en el que sunitinib, tanto como agente único como en combinación con docetaxel, inhibe de manera significativa el crecimiento y aumenta los marcadores de apoptosis de las líneas celulares PC3 de cáncer de próstata implantadas en xenoinjertos murinos2. Basado en estos esperanzadores resultados de preclínica, en el congreso americano de ASCO 2007 se comunicaron los primeros resultados de un estudio fase I/II de sunitinib como agente único durante un ciclo (4 semanas on / 2 semanas off), seguido de la combinación estándar de docetaxel y prednisona más sunitinib. El tratamiento se administró a pacientes con cáncer de próstata metastático hormonorrefractario en primera línea de tratamiento tras la progresión al bloqueo hormonal completo3.
Evaluamos la seguridad y actividad de sunitinib en monoterapia, en pacientes con cáncer de próstata hormonorrefractario, altamente pretratados y en progresión con docetaxel. El 50% de los pacientes alcanzó una reducción de PSA de más del 50% sobre el nivel basal. Dos pacientes (25%) presentaron un incremento del PSA tras el primer ciclo de tratamiento para, posteriormente, experimentar una reducción de su nivel de PSA de hasta el 70% en uno de los dos casos. Este fenómeno poco descrito se conoce como flare, y ejemplifica cómo probablemente no deba suspenderse un tratamiento con sunitinib tras el primer ciclo, a pesar de que se determine un incremento de PSA en el primer control.
Esta casuística es muy limitada, pero el intervalo libre de progresión en los pacientes que responden es similar al publicado por Sonpavde et al4. Este grupo encontró una supervivencia libre de enfermedad de 19,4 semanas. La toxicidad registrada en estos pacientes ha sido fácilmente manejable, siendo necesario reducir la dosis a 37,5mg en 3 pacientes (37,5%). Pensamos que la incorporación de sunitinib al tratamiento habitual de estos pacientes con prednisona (el cual puede ayudar a superar algunos de los efectos secundarios de sunitinib como astenia, vómitos o anorexia) puede controlar mejor la sintomatología de la enfermedad, consiguiendo así mismo una mejoría en la calidad de vida de los pacientes y una mayor supervivencia libre de progresión.
Conclusiones
Sunitinib demuestra actividad en el contexto del cáncer de próstata hormonorresistente en pacientes altamente pretratados, presentando un perfil de toxicidad muy manejable y con unos datos de supervivencia libre de progresión muy interesantes, por lo que consideramos justificado continuar con el estudio de este fármaco en este difícil contexto clínico.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Bibliografía
1. Faivre S., Delbaldo C., Vera K., Robert C., Lozahic S., Lassau N., Bello C., Deprimo S., Brega N., Massimini G., Armand J.P., Scigalla P., Raymond E. Safety, pharmacokinetic, and antitumor activity of SU11248, a novel oral multitarget tyrosine kinase inhibitor, in patients with cancer. J Clin Oncol. 2006; 24:25-35. [ Links ]
2. Guérin O., Formento P., Lo Nigro C., Hofman P., Fischel J.L., Etienne-Grimaldi M.C., Merlano M., Ferrero J.M., Milano G. Supra-additive antitumor effect of sunitinib malate (SU11248) combined with docetaxel. A new Therapeutic perspective in hormone refractory prostate cancer. J Cancer Res Clin Oncol. 2008; 134:51-7. [ Links ]
3. Zurita AJ, Shore ND, Kozloff MF. Distinct patterns of PSA modulation by single-agent sunitinib before combination with docetaxel and prednisone in patients with metastatic castrate-resistant prostate cancer. Presented at the ASCO 2007 meeting. Abstract number 5134. [ Links ]
4. Sonpavde G., Periman P.O., Bernold D., Weckstein D., Fleming M.T., Galsky M.D., Berry W.R., Zhan F., Boehm K.A., Asmar L., Hutson T.E. Sunitinib malate for metastatic castration resistant prostate cancer following docetaxel-based chemotherapy. Ann Oncol. 2010; 21:319-24. [ Links ]
 Dirección para correspondencia:
Dirección para correspondencia:
JOANMAGASENT@telefonica.net
(J.M. Gasent)
Recibido 17 Noviembre 2009
Aceptado 19 Septiembre 2010















