My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Medicina Intensiva
Print version ISSN 0210-5691
Med. Intensiva vol.32 n.8 Nov. 2008
Nuevos modos de ventilación: NAVA
New modes of ventilation: NAVA
Fernando Suarez-Sipmann, Manuel Pérez Márquez y Paloma González Arenas
Servicio de Medicina Intensiva. Fundación Jiménez Díaz-UTE. Madrid. España.
Dirección para correspondencia
RESUMEN
La ventilación asistida ajustada neuronalmente (NAVA) es un nuevo modo de ventilación mecánica asistida basado en la utilización de la señal obtenida de actividad eléctrica diafragmática (Edi) para el control del ventilador. La Edi representa directamente el impulso ventilatorio central y refleja la duración y la intensidad con que el paciente desea ventilar. Durante la NAVA la asistencia inspiratoria mecánica se inicia en el momento en que el centro respiratorio lo demanda, y el disparo es independiente de cualquier componente neumático. Durante la inspiración, la presión suministrada es proporcional a la Edi y la presurización inspiratoria cesa cuando la activación neural del diafragma comienza a disminuir tras alcanzar un valor máximo. Por sus características, el modo NAVA ofrece un nuevo enfoque conceptual a la ventilación mecánica que puede mejorar significativamente la interacción entre paciente y ventilador y puede optimizar la descarga muscular efectiva durante la ventilación asistida.
Palabras clave: Ventilación mecánica. Actividad eléctrica del diafragma. Interacción paciente-ventilador. Descarga muscular respiratoria. Ventilación no invasiva.
ABSTRACT
Neurally adjusted ventilatory assist (NAVA) is a new mode of assisted mechanical ventilation that uses the signal obtained from diaphragmatic electrical activity (Edi) to control the mechanical ventilator. Edi directly represents the central respiratory drive and reflects the length and intensity of the patient's neural effort. During NAVA, mechanical inspiratory assist starts when the respiratory center initiates the breath and is therefore independent of any pneumatic component. During inspiration, the pressure delivered is proportional to the Edi and the inspiratory pressure assist ceases when the neural activation of the diaphragm starts to decline after reaching the inspiratory maximum value. NAVA is a new conceptual approach to mechanical ventilation that can significantly improve patient-ventilator interaction and optimize the level of effective respiratory muscle unloading during assisted mechanical ventilation.
Key words: Mechanical ventilation. Diaphragm electric activity. Patient-ventilator interaction. Respiratory muscle unloading. Noninvasive mechanical ventilation.
Introducción
La ventilación mecánica tiene como principales objetivos reducir el trabajo respiratorio y mantener un adecuado intercambio gaseoso durante la fase inicial de cualquier proceso crítico1. Cuando la situación clínica mejora, se pasa de una ventilación controlada, sin participación del paciente, a una asistida en la que los esfuerzos inspiratorios espontáneos tienen el apoyo del respirador, y es esencial que haya una adecuada interacción entre la actividad respiratoria del paciente y la actividad mecánica del ventilador. En las últimas dos décadas han surgido nuevos modos de ventilación asistida, como la ventilación proporcional asistida (PAV)2, dirigidos a mejorar la interacción paciente-ventilador proporcionando un grado de asistencia no prefijado, sino proporcional a los requerimientos del paciente.
La NAVA es un nuevo modo de ventilación mecánica asistida que utiliza la actividad eléctrica del diafragma (Edi) para el control del ventilador3, tanto del ciclo inspiratorio (disparo) y espiratorio como de la magnitud y el perfil de la asistencia inspiratoria mecánica. Esto lo diferencia de cualquier otro modo ventilatorio previo, ya que el paciente pasa a controlar de modo más directo -esto es, «neuronalmente»- la asistencia ventilatoria mecánica que recibe del ventilador.
En esta revisión se describen los fundamentos teóricos en los que se basa la NAVA y se destaca algunas de sus potenciales ventajas clínicas. Dado que en la actualidad el sistema sólo está disponible en los ventiladores Servo-i (Maquet Critical Care, Solna, Suecia), su descripción se limita a su aplicación en dichos ventiladores.
Disparo «neuronal» y disparo neumático
El ciclo respiratorio se origina en el centro respiratorio regulado por la compleja interacción de diferentes aferencias neuronales, químicas y mecánicas. El impulso eferente respiratorio viaja por las motoneuronas del nervio frénico que inician la activación eléctrica del diafragma y originan su contracción mecánica. La actividad eléctrica del diafragma (Edi) refleja el grado de reclutamiento de motoneuronas y su intensidad/frecuencia de disparo y guarda una relación directa con la intensidad del impulso respiratorio4. Esta posibilidad de utilizar la señal Edi para el control del ventilador proporciona un modo «neuronal» de disparo y permite al centro respiratorio modular la asistencia ventilatoria mecánica de modo mucho más directo (fig. 1). Los modos convencionales de disparo, llamados neumáticos porque utilizan la señal de presión y/o de flujo en la vía aérea, requieren que el impulso neuronal se traduzca primero en una contracción diafragmática efectiva y, por lo tanto, dependen de un adecuado acoplamiento neuromecánico. Después, esa contracción debe ser capaz de producir los cambios de presión o flujo intratorácicos efectivos que a su vez deben ser transmitidos de modo eficiente por el circuito respiratorio del ventilador para su correcta detección en el ventilador3 (fig. 1).
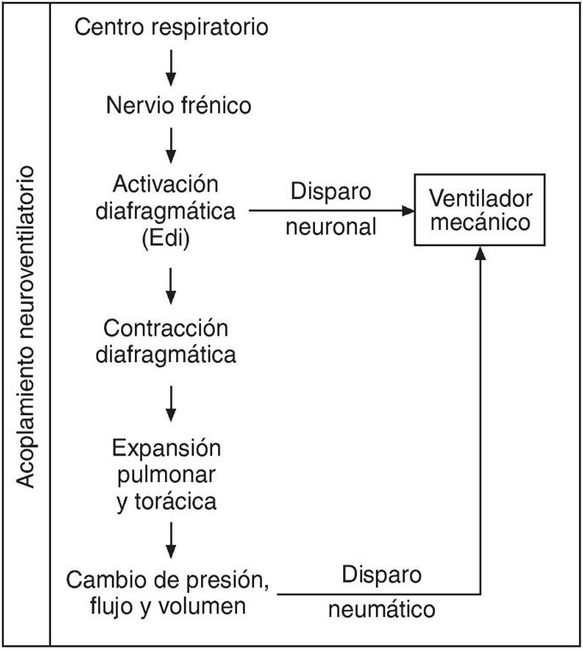
Figura 1. Trayecto del impulso ventilatorio central. La actividad elétrica diafragmática (Edi)
utilizada por el sistema NAVA es la señal más próxima a la génesis del impulso respiratorio central
que la tecnología actual nos permite utilizar para el control del ventilador. Modificado de Sinderby et al3.
La señal eléctrica diafragmática
El sistema NAVA requiere la existencia de un adecuado impulso respiratorio, su transmisión eferente y la activación eléctrica del diafragma. Para el registro de la Edi, el sistema utiliza una configuración de diez electrodos esofágicos incorporados en serie en la parte distal de una sonda nasogástrica convencional (fig. 2). Se reducen así los problemas debidos al bajo voltaje de la Edi (medida en microvoltios) y al «ruido» eléctrico existente en el entorno del diafragma (musculatura abdominal, actividad cardíaca, etc.). Es esencial posicionar los electrodos correctamente a ambos lados del diafragma utilizando como referencia la señal electrocardiográfica esofágica, registrada mediante los propios electrodos del sistema. Una vez en posición, se obtiene el registro de la actividad eléctrica de la porción crural del diafragma, que se ha demostrado es representativa de su activación general y homogénea5,6. Varios trabajos clínicos y experimentales han comprobado que hay buena correlación entre la Edi crural y la presión transdiafragmática (Pdi). Esta correlación se ha mostrado constante en individuos sanos en respuesta a diferentes maniobras ventilatorias, en situaciones patológicas y en respuesta a diferentes grados de soporte en pacientes en ventilación mecánica7.
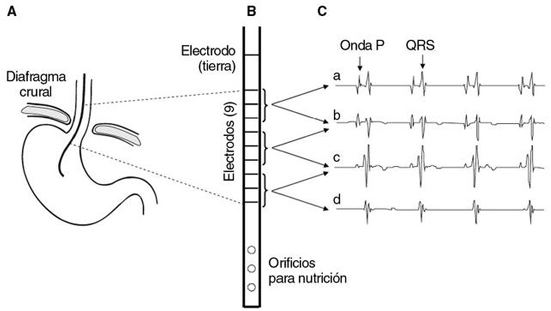
Figura 2. Sistema NAVA: posicionamiento del catéter. A: posicionamiento anatómico.
La región de los electrodos (delimitada por la línea de puntos) debe quedar a ambos lados del
diafragma para un correcto registro. B: el catéter Edi es una sonda nasogástrica convencional
modificada a la que se han añadido diez electrodos en serie incluidos de forma concéntrica en
la pared de la sonda. C: con el registro electrocardiográfico esofágico mediante los propios electrodos
del sistema, se puede comprobar el posicionamiento correcto; las derivaciones superiores (a y b)
registran la actividad de los electrodos proximales, más cercanos a la región cardíaca, y la onda P
es más prominente; las derivaciones inferiores (c y d) registran la actividad de los electrodos distales,
que muestran una disminución progresiva de la onda P. El ventilador dispone de una herramienta de
posicionamiento que muestra el registro electrocardiográfico y facilita su posicionamiento.
La Edi permite al ventilador medir directamente el tiempo neural inspiratorio (TIn) y espiratorio (TEn), a diferencia de los modos convencionales en los que éstos sólo pueden ser estimados de modo indirecto mediante el registro de los cambios de presión y flujo en la vía aérea8,9. En la figura 3 se muestran las características de la señal Edi obtenida por el sistema NAVA. El TIn se inicia con el aumento de la Edi sobre el valor espiratorio y termina al alcanzar su valor máximo o pico inspiratorio, momento en el que comienza el TEn. La Edi espiratoria (actividad diafragmática tónica), en condiciones normales, es mínima, pero puede aumentar en situaciones patológicas. No existe un valor estándar de la Edi debido a las diferencias interindividuales, que dependen de factores como la masa muscular diafragmática, la afección del paciente y el grado de sedación, entre otros.
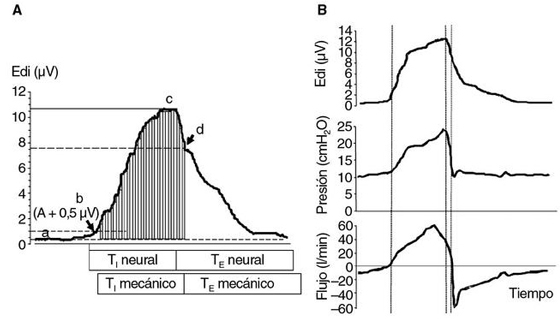
Figura 3. La señal eléctrica diafragmática. A: registro de la actividad eléctrica diafragmática (Edi) en un paciente.
a: Edi mínima (espiratoria o tónica); b: inicio de la fase inspiratoria a nivel central (tiempo inspiratorio [TI] neural)
tras alcanzar el umbral de sensibilidad prefijado para el disparo, en este caso 0,5 μ V > la Edi mínima (las barras
representan de modo esquemático los ajustes de presión instantáneos cada 0,2 ms proporcionales a los cambios de Edi
y cuya magnitud está determinada por el nivel NAVA ajustado, que en el ejemplo es 1); c: Edi máxima, final de TI neural;
d: ciclo espiratorio, descenso de la Edi a un valor umbral del 70% de la Edi máxima. B: registro simultáneo de Edi, presión
en la vía aérea y flujo; el estímulo central y la respuesta mecánica ocurren de forma sincronizada, como muestra el inicio
del flujo inspiratorio inmediatamente tras el inicio del aumento de la Edi (primera línea de puntos) y el mínimo retraso entre
disminución de la Edi y el ciclo espiratorio mecánico (segunda y tercera líneas de puntos, respectivamente). Nótese que
el perfil de presurización sigue la morfología de la Edi.
Características del funcionamiento del modo de ventilación NAVA
Ciclo inspiratorio
A diferencia de los modos de disparo neumáticos, la Edi es una señal mucho más precoz, no se afecta por fugas y no depende de la generación de una presión o un flujo determinados ni del acoplamiento neuromecánico del diafragma o la mecánica del sistema respiratorio. El umbral de detección de la señal se fija en microvoltios, con un valor que oscila entre 0,1 y 2 μV por encima de la Edi tónica espiratoria detectada. Durante el modo NAVA, el disparo neumático sigue activado, de tal forma que la inspiración se inicia por el primer estímulo detectado por el ventilador, ya sea la Edi, la presión o el flujo prefijados, con lo que se evita fallos en el disparo en caso de una Edi irregular.
Asistencia inspiratoria
Durante la NAVA, no se prefija un nivel de presión, sino que es el paciente quien determina la magnitud de la asistencia inspiratoria que recibe mediante su patrón de activación diafragmático. Ésta resulta de multiplicar la Edi instantánea (cada 0,2 ms) por una constante de proporcionalidad llamada nivel NAVA, ajustada por el usuario, cuyas unidades son cmH2O/ μV. La presión inspiratoria finalmente alcanzada se obtiene de la siguiente relación:
Presión inspiratoria máxima estimada = nivel NAVA × (Edi máxima - Edi mínima) + PEEP
De este modo, la asistencia ventilatoria se ajusta automáticamente en proporción a la activación diafragmática o, dicho de otro modo, de la intensidad con que el paciente desea respirar.
Ciclo espiratorio
El cese en la activación diafragmática corresponde al final de la fase inspiratoria neuronal y está marcada por la disminución de la Edi tras alcanzar el máximo inspiratorio. El criterio de ciclo espiratorio empleado en la NAVA es la reducción de la Edi a un valor < 70% de la Edi máxima o < 40% cuando la Edi máxima es muy baja (< 1,5 μV). Se consigue así suprimir la asistencia inspiratoria en el mismo momento en que el centro respiratorio cesa la activación del diafragma (fig. 3).
Aplicaciones clínicas
Si bien todavía no se ha introducido en la práctica clínica, los principios en los que se basa su funcionamiento, así como estudios clínicos y experimentales, indican potenciales ventajas del sistema NAVA (tabla 1). A continuación se describen algunas de las más importantes.
Mejora en la sincronía paciente-ventilador
La asincronía paciente-ventilador es un problema clínico de gran relevancia por su frecuencia, su difícil manejo y sus consecuencias1,10,11. En general resulta del desfase entre el ciclo ventilatorio del paciente definido por el TIn y el TEn y el ciclo ventilatorio mecánico definido por los tiempos inspiratorio y ventilatorio mecánicos12. Esto se traduce en la imposibilidad para el paciente de disparar el ventilador (respiraciones fallidas13, retrasos en el disparo mecánico, especialmente durante situaciones patológicas en que aun haya aumento de resistencia al flujo espiratorio con hiperinsuflación dinámica (PEEP intrínseca) -p. ej., en los pacientes con enfermedad pulmonar obstructiva crónica14- o en un ciclo espiratorio a destiempo que altere la duración de la fase inspiratoria9 y haga que el paciente active la musculatura espiratoria15.
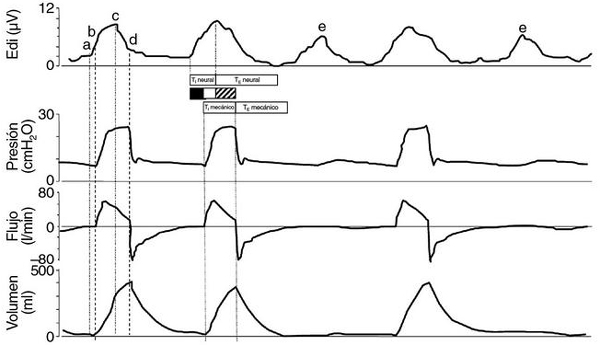
Otro motivo de asincronía se produciría en situaciones en que el flujo inspiratorio proporcionado por el ventilador no se ajusta a las necesidades del paciente16. En la figura 4 se muestra el registro Edi, la presión, el flujo y el volumen en un paciente en asincronía con el ventilador.
Figura 4. Asincronía entre paciente y ventilador, monitorizada por la actividad eléctrica diafragmática (Edi).
Registro simultáneo de Edi, presión, flujo y volumen en un paciente con enfermedad pulmonar obstructiva
crónica durante presión de soporte. Hay un significativo retraso entre el comienzo del tiempo inspiratorio neural (a)
y el tiempo inspiratorio mecánico (b). Al alcanzar el final del tiempo inspiratorio mecánico (c), el paciente inicia
la espiración neural, pero ésta ocurre a mitad de la inspiración mecánica cuando todavía la presurización es máxima
y hay un considerable flujo inspiratorio. Al final del tiempo inspiratorio mecánico (d), el diafragma ya ha vuelto a su
actividad espiratoria. Barra negra: asincronía inspiratoria motivada por el retraso en el disparo mecánico; barra
con rayas diagonales: asincronía inspiratoria y espiratoria por el retraso en el ciclo espiratorio mecánico.
El uso de la señal Edi puede mejorar de forma significativa la correspondencia entre el tiempo neural y el mecánico y, por lo tanto, la sincronía paciente-ventilador, siempre y cuando el paciente tenga un adecuado impulso respiratorio central y su transmisión eferente esté intacta. Beck et al8 mostraron una reducción significativa en el tiempo de activación del disparo inspiratorio y en el ciclo espiratorio en animales con lesión pulmonar aguda ventilados con NAVA, en comparación con la presión de soporte. Esta reducción fue más marcada con mayor asistencia. Además, con NAVA no se detectaron respiraciones fallidas, que son frecuentes durante la ventilación con presión soporte.
Descarga muscular efectiva
Uno de los objetivos de la asistencia ventilatoria es proporcionar una adecuada descarga del trabajo muscular que evite, por un lado, el agotamiento y, por otro, la excesiva inactividad para poder progresar en el proceso de desconexión de la ventilación. Nuevos modos como la PAV han mejorado el modo de asistencia permitiendo un ajuste intracíclico proporcional a la exigencia inspiratoria estimada por el flujo y el volumen generados por el paciente. Este modo, sin embargo, depende de medidas indirectas de la mecánica respiratoria y de un adecuado acoplamiento neuromecánico del diafragma, que está sujeto a variaciones intercíclicas y frecuentes alteraciones en los pacientes críticos6. Ello, unido a su complejidad conceptual, ha limitado el uso de este modo de ventilación17. El modo NAVA utiliza una medida directa y no estimada, la Edi, que además es fiel reflejo del impulso respiratorio y, por lo tanto, de las necesidades del paciente. La magnitud de la asistencia ventilatoria depende del nivel NAVA ajustado, y los cambios resultantes en la Edi determinan la presión inspiratoria alcanzada. A su vez, los cambios en la presión obtenidos controlan el propio centro respiratorio por la modulación que recibe a través de las aferencias respiratorias. Sinderby et al18 mostraron que aumentos en el nivel NAVA consiguieron una disminución de la amplitud de la Edi incluso durante inspiraciones máximas (con gran aumento de la Edi) en individuos sanos (fig. 4). Por otro lado, Beck et al8 mostraron en un modelo experimental de lesión pulmonar que aumentos progresivos en el nivel NAVA originaban reducci ones de la amplitud de la Edi y en la presión transdiafragmática manteniendo estable la presión inspiratoria máxima sin cambios en el volumen corriente suministrado. Igualmente, Allo et al19 pudieron mostrar una descarga muscular efectiva mediante NAVA manteniendo volúmenes corrientes bajos en un modelo similar.
Este mecanismo de control, por lo tanto, tiene varias ventajas: a) evita que se alcancen presiones inspiratorias excesivas cuando se incrementa la asistencia; b) permite estimar la descarga muscular óptima que se obtendría cuando un incremento adicional en el nivel NAVA no resultase en aumento de la presión inspiratoria, y c) asegura que la musculatura respiratoria esté activa tanto en el inicio como durante toda la fase inspiratoria incluso con niveles altos de soporte18. Se evita así la inactividad muscular durante la ventilación asistida20 y la sobreasistencia, ambas relacionadas con la disfunción diafragmática inducida por la ventilación mecánica21.
Edi como herramienta de monitorización
Poder visualizar la Edi de forma continua, en cada ciclo respiratorio y sincronizada con el resto de las curvas respiratorias, ofrece nuevas posibilidades para la siempre precaria monitorización respiratoria. Como hemos visto, permite detectar de forma inmediata la existencia de asincronía paciente-ventilador y monitorizar la respuesta a las intervenciones emprendidas para corregirla. Además permite integrar la información funcional de la musculatura respiratoria en la evaluación y las decisiones clínicas habituales. Teniendo en cuenta la frecuencia con que se produce la disfunción de la musculatura respiratoria en los pacientes en UCI22, disponer de esta información adicional puede ser de gran utilidad.
NAVA y ventilación no invasiva
El modo de asistencia ventilatoria, la posibilidad de monitorizar la Edi y que las fugas en el disparo no influyan hacen del NAVA un modo muy atractivo para su aplicación en ventilación no invasiva. Beck et al23 mostraron recientemente que la NAVA es capaz de proporcionar una asistencia ventilatoria sincronizada y proporcional a la Edi mediante una interfaz abierta (cánula nasal) en un modelo experimental de lesión pulmonar aguda. Incluso con la gran fuga existente, el sistema fue capaz de mantener una presión intratraqueal proporcional a la programada.
Ventilación en neonatos
Tres características del modo NAVA -el ciclo inspiratorio independiente de cualquier componente neumático o de mecánica respiratoria y que no se afecta por fugas, la mejor sincronía paciente-ventilador y el modo de asistencia, que por su mecanismo de control central evita incrementos excesivos en la presión transpulmonar (fig. 5)- suponen ventajas evidentes de este sistema para la ventilación mecánica en neonatos.
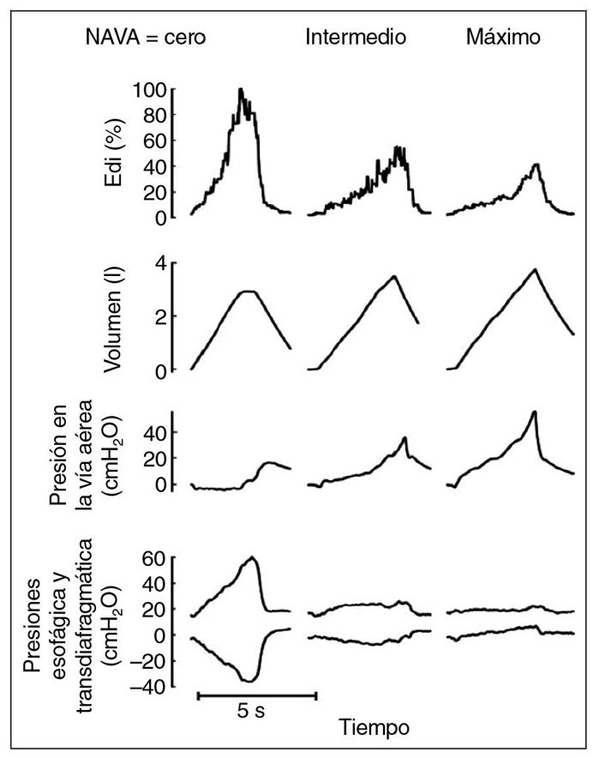
Figura 5. Características de la descarga muscular con NAVA. Registro simultáneo de la actividad
eléctrica diafragmática (Edi), el volumen corriente, la presión en la vía aérea, la presión transdiafragmática
y la presión esofágica en un voluntario sano realizando una maniobra de inspiración máxima a niveles
progresivos de soporte NAVA. Sin soporte NAVA (cero), la Edi es alta, lo que resulta en moderados valores
de presión en la vía aérea y grandes oscilaciones en la transdiafragmática y la esofágica, debido al mayor
esfuerzo inspiratorio. A medida que se aumenta NAVA (intermedio) se reduce la Edi y las oscilaciones en
las presiones transdiafragmática y esofágica, mientras se incrementa la presión en la vía aérea y, escasamente,
el volumen corriente. Con nivel NAVA máximo, la presión en la vía aérea aumenta menos de lo previsto debido
a la disminución de la Edi, sin que además aumente la presión transpulmonar (vía aérea - esofágica) gracias
a la disminución de oscilación en la presión esofágica, que deja de ser negativa. Tomado de Sinderby et al18.
Conclusiones
NAVA es un nuevo modo de ventilación mecánica asistida basado en la utilización de la señal de activación eléctrica diafragmática para el control del ventilador. Ofrece un nuevo enfoque conceptual a la ventilación mecánica que introduce mejoras en el control y el modo de soporte de la ventilación asistida, con el potencial para aportar soluciones a problemas clínicos de gran relevancia. Sus ventajas teóricas frente a otros modos de ventilación podrán ser evaluados cuando se introduzca en la práctica clínica de modo más generalizado.
Bibliografía
1. Tobin MJ. Advances in mechanical ventilation. N Engl J Med. 2001;344:1986-96. [ Links ]
2. Younes M. Proportional assist ventilation, a new approach to ventilatory support. Theory. Am Rev Respir Dis. 1992;145: 114-20. [ Links ]
3. Sinderby C, Navalesi P, Beck J, et al. Neural control of mechanical ventilation in respiratory failure. Nat Med. 1999;5: 1433-6. [ Links ]
4. Lourenco RV, Cherniack NS, Malm JR, Fishman AP. Nervous output from the respiratory center during obstructed breathing. J Appl Physiol. 1966;21:527-33. [ Links ]
5. Beck J, Sinderby C, Lindstrom L, Grassino A. Crural diaphragm activation during dynamic contractions at various inspiratory flow rates. J Appl Physiol. 1998;85:451-8. [ Links ]
6. Beck J, Sinderby C, Lindstrom L, Grassino A. Effects of lung volume on diaphragm EMG signal strength during voluntary contractions. J Appl Physiol. 1998;85:1123-34. [ Links ]
7. Beck J, Gottfried SB, Navalesi P, et al. Electrical activity of the diaphragm during pressure support ventilation in acute respiratory failure. Am J Respir Crit Care Med. 2001;164:419-24. [ Links ]
8. Beck J, Campoccia F, Allo JC, et al. Improved synchrony and respiratory unloading by neurally adjusted ventilatory assist (NAVA) in lung-injured rabbits. Pediatr Res. 2007;61:289-94. [ Links ]
9. Parthasarathy S, Jubran A, Tobin MJ. Assessment of neural inspiratory time in ventilator-supported patients. Am J Respir Crit Care Med. 2000;162:546-52. [ Links ]
10. Tobin MJ, Jubran A, Laghi F. Patient-ventilator interaction. Am J Respir Crit Care Med. 2001;163:1059-63. [ Links ]
11. Thille AW, Rodriguez P, Cabello B, et al. Patient-ventilator asynchrony during assisted mechanical ventilation. Intensive Care Med. 2006;32:1515-22. [ Links ]
12. Sassoon CS, Foster GT. Patient-ventilator asynchrony. Curr Opin Crit Care. 2001;7:28-33. [ Links ]
13. Leung P, Jubran A, Tobin MJ. Comparison of assisted ventilator modes on triggering, patient effort, and dyspnea. Am J Respir Crit Care Med. 1997;155:1940-8. [ Links ]
14. Nava S, Bruschi C, Rubini F, et al. Respiratory response and inspiratory effort during pressure support ventilation in COPD patients. Intensive Care Med. 1995;21:871-9. [ Links ]
15. Jubran A, Van de Graaff WB, Tobin MJ. Variability of patient-ventilator interaction with pressure support ventilation in patients with chronic obstructive pulmonary disease. Am J Respir Crit Care Med. 1995;152:129-36. [ Links ]
16. MacIntyre NR, McConnell R, Cheng KC, Sane A. Patient-ventilator flow dyssynchrony: flow-limited versus pressure-limited breaths. Crit Care Med. 1997;25:1671-7. [ Links ]
17. Navalesi P, Costa R. New modes of mechanical ventilation: proportional assist ventilation, neurally adjusted ventilatory assist, and fractal ventilation. Curr Opin Crit Care. 2003;9:51-8. [ Links ]
18. Sinderby C, Beck J, Spahija J, et al. Inspiratory muscle unloading by neurally adjusted ventilatory assist during maximal inspiratory efforts in healthy subjects. Chest. 2007;131:711-7. [ Links ]
19. Allo JC, Beck JC, Brander L, et al. Influence of neurally adjusted ventilatory assist and positive end-expiratory pressure on breathing pattern in rabbits with acute lung injury. Crit Care Med. 2006;34:2997-3004. [ Links ]
20. Kimura T, Takezawa J, Nishiwaki K, Shimada Y. Determination of the optimal pressure support level evaluated by measuring transdiaphragmatic pressure. Chest. 1991;100:112-7. [ Links ]
21. Vassilakopoulos T, Petrof BJ. Ventilator-induced diaphragmatic dysfunction. Am J Respir Crit Care Med. 2004;169:336-41. [ Links ]
22. Tobin MJ, Laghi F, Jubran A. Respiratory muscle dysfunction in mechanically-ventilated patients. Mol Cell Biochem. 1998; 179:87-98. [ Links ]
23. Beck J, Brander L, Slutsky A, et al. Non-invasive neurally adjusted ventilatory assisst in rabbits with acute lung injury. Intensive Care Med. 2007; DOI:10.1007/s00134-007-0882-x [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Dr. F. Suarez Sipmann.
Servicio de Medicina Intensiva.
Fundación Jiménez Díaz-UTE.
Avda. de los Reyes Católicos, 2.
28040 Madrid. España.
Correo electrónico: fsuarez@fjd.es
Manuscrito aceptado el 21-4-2008.