Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Medicina Intensiva
versión impresa ISSN 0210-5691
Med. Intensiva vol.33 no.1 ene./feb. 2009
Tendencias en resucitación cardiopulmonar
Trends in cardiopulmonary resuscitation
Raúl-Jaime Gazmuri a y Jesús-Andrés Álvarez-Fernández b
a Section of Critical Care Medicine. North Chicago VA Medical Center and Medical Service. Chicago. Illinois. Estados Unidos.
b Departamento de Fisiología. Universidad de La Laguna. Unidad de Neurosonología y Hemodinámica Cerebral. Hospital Hospiten-Rambla. Santa Cruz de Tenerife. Santa Cruz. España.
Dirección para correspondencia
RESUMEN
Menos del 10% de las personas que sufren una parada cardíaca son resucitados con éxito y regresan a sus hogares para vivir vidas productivas. Nuevos enfoques de la resucitación podrían modificar de forma sustancial este resultado tan triste. Cuatro tendencias en resucitación cardiopulmonar (RCP) parecen tener el mayor potencial para mejorar el pronóstico: los sistemas para la prevención de la parada cardíaca mediante reconocimiento precoz de los signos de alarma e intervención oportuna; el cambio hacia una resucitación orientada hacia el flujo sanguíneo, enfatizando la realización ininterrumpida de una RCP de alta calidad con un papel limitado de la ventilación; la importancia creciente de la tecnología guiando las intervenciones en resucitación, mejorando el proceso humano de toma de decisiones, y el empleo de la hipotermia.
Palabras clave: Resucitación. Cuidados de emergencias. Parada cardíaca.
ABSTRACT
Less than 10% of those individuals who suffer an episode of sudden cardiac arrest are successfully resuscitated and return home to live productive lives. New approaches to cardiac resuscitation could substantially improve such dismal outcome. Four current trends in cardiopulmonary resuscitation (CPR) have the greatest potential for improving outcome: the development of systems that can prevent cardiac arrests through recognition of early warning signs and timely intervention; a shift towards a flow-based resuscitation emphasizing the delivery of high-quality uninterrupted CPR limiting the role of ventilation; the growing role of technology in driving resuscitation interventions, incrementally enhancing the human decision-making process, and the use of hypothermia.
Key words: Resuscitation. Emergency cardiovascular care. Cardiac arrest.
Introducción
La resucitación tras una parada cardíaca continúa siendo un desafío formidable. En Estados Unidos, entre 400.000 y 460.000 personas sufren cada año un episodio de parada cardíaca1, superando el millón de afectados si se suman las ocurridas en los países de la Unión Europea2; en España la incidencia de paradas cardíacas extrahospitalarias de todas las causas supera los 50.000 casos anuales3,4. Sin embargo, menos del 10% de estos individuos son resucitados con éxito y regresan a sus hogares para vivir vidas productivas5-7. Por consiguiente, hay una urgente necesidad de nuevos enfoques de la resucitación que puedan modificar de forma sustancial este resultado tan triste.
Actualmente pueden ser reconocidas muchas tendencias en resucitación cardiopulmonar (RCP). Sin embargo, hay cuatro que en nuestra opinión tienen el mayor potencial para mejorar el pronóstico: los sistemas para la prevención de la parada cardíaca mediante reconocimiento precoz de los signos de alarma e intervención oportuna; el cambio hacia una resucitación orientada hacia el flujo sanguíneo enfatizando la realización ininterrumpida de una RCP de alta calidad con un papel limitado de la ventilación; la importancia creciente de la tecnología guiando las intervenciones en resucitación y mejorando el proceso humano de toma de decisiones, y el empleo de la hipotermia.
Prevención de la parada cardíaca
La prevención de la parada cardíaca afrontando los procesos de los que se conoce su alto riesgo de producirla tiene el mayor potencial para reducir su incidencia. Un ejemplo excelente es el de la enfermedad coronaria, en la que la modificación del estilo de vida y el empleo de tratamientos que alteran la evolución de los procesos patológicos pueden tener un profundo impacto pronóstico. Sin embargo, la prevención a la que hacemos referencia en este artículo es la relacionada con el reconocimiento precoz por la población general y los profesionales sanitarios de un evento que compromete la vida, la que permite evitar la parada cardíaca o iniciar sin demoras las maniobras de RCP.
Prevención de la parada cardíaca extrahospitalaria
En la población adulta la mayoría de los episodios de parada cardíaca extrahospitalaria no traumática ocurren en más del 90% de los casos como resultado de eventos cardíacos primarios productores de fibrilación ventricular (FV), actividad eléctrica sin pulso (AESP) o asistolia. El mecanismo precipitante a menudo es un evento coronario agudo con trombosis coronaria en cerca del 50% de quienes la sufren8. El reconocimiento precoz de los síntomas y signos del evento coronario agudo puede servir para activar el sistema de emergencias médicas (SEM), lo que permite acciones para evitar o tratar precozmente la parada cardíaca y llevar a la víctima al hospital para completar su manejo. Los síntomas de un posible síndrome coronario agudo que deben ser conocidos son, entre otros: a) malestar torácico que dura más de unos pocos minutos (y puede recurrir) y es percibido como sensación de presión, estrujamiento, plenitud o dolor; b) malestar en otra localización como brazos, espalda, cuello, mandíbula o epigastrio; c) limitación de la ventilación precediendo, acompañando o siguiendo al malestar torácico, y d) otros síntomas como sudor frío, náuseas, aturdimiento o mareo. Los esfuerzos para educar a la población en el reconocimiento de estos síntomas y en la activación precoz del sistema de emergencias (p. ej., llamando al número 911 en Estados Unidos o al 112 en Europa), junto con la promoción del conocimiento de la RCP, pueden tener un impacto favorable cuantificable en el pronóstico de la parada cardíaca9-12.
Prevención de la parada cardíaca hospitalaria
Las áreas de hospitalización se pueden clasificar en dos grupos: con capacidad para monitorización electrocardiográfica, como las unidades de cuidados intensivos, las salas de telemetría o los quirófanos, y sin esta capacidad. La decisión de dónde ingresar al paciente está basada inicialmente en el proceso que motivó la consulta hospitalaria y puede tener un profundo impacto en la supervivencia a una parada cardíaca hospitalaria, que oscila entre el 15 y el 20%. La mayoría de quienes sobreviven a la parada se observan en áreas de monitorización, y a menudo son FV en el seno de eventos isquémicos cardíacos primarios. En estas circunstancias las intervenciones diagnósticas y terapéuticas pueden ser iniciadas con mínima demora. Por el contrario, en los pacientes admitidos en áreas sin monitorización surgen paradas cardíacas típicamente como consecuencia de reducciones progresivas en la oxigenación o el flujo sanguíneo a órganos vitales tras deterioros en la función respiratoria, circulatoria o del sistema nervioso central. Cuando ocurren estas paradas cardíacas, el diagnóstico frecuentemente lo realiza personal que encuentra al paciente inconsciente y sin ventilación. Se pierde así un tiempo precioso y la RCP a menudo se inicia con mayores demoras que en las áreas monitorizadas, lo que explica un mayor daño cardíaco y cerebral que hace imposible una supervivencia significativa, incluso aunque se recupere inicialmente la actividad cardíaca.
Estudios recientes han demostrado que los problemas respiratorios y circulatorios que llevan a parada cardíaca en pacientes hospitalizados no son reconocidos a tiempo y, de serlo, no son tratados adecuadamente13. Los estudios han demostrado también que los médicos y las enfermeras que trabajan en las salas de hospitalización convencional no están bien entrenados para reconocer los deterioros en la funciones fisiológicas ventilatoria, circulatoria y neurológica ni para intervenir adecuadamente o pedir ayuda a personal competente de forma oportuna y efectiva13.
En respuesta a este problema tan extendido, muchos hospitales han comenzado a desarrollar sistemas para el reconocimiento y el tratamiento precoces de los deterioros fisiológicos que preceden a la parada cardíaca13-16. Estos sistemas pueden tener diferentes características en cada institución, pero pueden identificarse dos componentes básicos comunes a todos ellos, uno orientado a la detección precoz de las situaciones de riesgo vital y otro a la intervención oportuna y efectiva. El primero adopta habitualmente la forma de un sistema de alarma estandarizado que los profesionales sanitarios a cargo de la monitorización de los signos vitales del paciente pueden aplicar. Un enfoque es asignar puntos a los signos vitales habituales y actuar según la puntuación total, lo que puede ir desde aumentar la frecuencia de las determinaciones hasta la inmediata llamada de petición de ayuda. Otro enfoque es asignar un umbral de valores a las variables fisiológicas que lleva a la inmediata petición de ayuda en caso de que se supere. La tabla 1 muestra un ejemplo de un sistema de alarma precoz desarrollado según valores umbral. Debe mencionarse que este sistema no está basado en la evidencia científica, pero refleja el juicio clínico colectivo dirigido por la fisiopatología de la enfermedad crítica.
Una vez que se reconoce la situación de riesgo vital, deben iniciarse sin demora las actuaciones terapéuticas apropiadas. Los hospitales han mantenido tradicionalmente equipos a los que se llamaba después de producirse la parada cardíaca. Sin embargo, para intervenir antes de que se produzca, algunos hospitales han comenzado a implantar «equipos de emergencias» cuya responsabilidad primaria es responder a los signos de riesgo previamente mencionados. Estos equipos varían en su composición y finalidad, y pueden ser similares a los equipos de parada o ser de hecho el mismo equipo de parada con responsabilidades ampliadas. Una información más detallada sobre los diversos sistemas disponibles excede los objetivos de este artículo, pero está disponible en varias publicaciones recientes13-18. Este esquema basado en signos de alarma y equipos de intervención oportuna están siendo adaptados por un número creciente de servicios hospitalarios en diferentes partes del mundo occidental, con la esperanza de que su implementación sistemática resulte en un disminución generalizada de la parada cardíaca intrahospitalaria17,18.
Resucitación orientada hacia el flujo sanguíneo
Fundamentos
Cuando fallan los esfuerzos para evitar la parada cardíaca, los reanimadores se enfrentan al formidable reto de intentar restaurar la vida. En las paradas cardíacas presenciadas un tratamiento rápido de la causa desencadenante (p. ej., desfibrilación eléctrica de la FV o ventilación de la asfixia) puede ser absolutamente efectivo y restablecer con éxito la actividad cardíaca necesitando mínima o ninguna intervención adicional. Sin embargo, en los casos en que la resucitación se inicia tras intervalos prolongados de parada cardíaca no tratada, la capacidad de restablecer la actividad cardíaca depende de la generación, con medios artificiales, de flujos sanguíneos coronarios por encima de un umbral crítico de resucitación.
Las compresiones torácicas manuales son el primer medio para generar flujos sanguíneos anterógrados y, por lo tanto, coronarios durante la parada cardíaca. Sin embargo, los reanimadores tienen a menudo otras prioridades y los esfuerzos para conseguir flujo sanguíneo anterógrado pueden entrar en conflicto con los de asegurar la vía aérea, promover la ventilación o restablecer la actividad eléctrica cardíaca.
Hay actualmente un creciente reconocimiento de la importancia crucial de la generación de flujo sanguíneo para el éxito de la resucitación19-23. El mensaje marco de las nuevas recomendaciones para RCP y cuidados cardíacos de emergencia24,25 es que los reanimadores deben centrar sus esfuerzos en proporcionar RCP de calidad reduciendo al mínimo las interrupciones relacionadas con la ventilación, la desfibrilación, la administración de fármacos o la valoración del pulso.
El análisis detallado de la hemodinámica de la RCP revela que una clave determinante de la resucitación inicial es la presión de perfusión coronaria. Esta presión se define como el gradiente establecido entre la aorta y la aurícula derecha durante la fase de relajación de la compresión torácica. Ya que la isquemia induce máxima vasodilatación coronaria, el aumento de la presión de perfusión se sigue de aumentos proporcionales en el flujo sanguíneo. En modelos animales y en seres humanos que tuvieron paradas cardíacas se han observado umbrales críticos de esta presión de perfusión coronaria para una resucitación con éxito. Tales umbrales se corresponden con > 10 mmHg en cerdos26, > 20 mmHg en ratas27 y perros28 y > 15 mmHg en humanos29. Por lo tanto, los esfuerzos para aumentar la presión de perfusión coronaria por encima del umbral de resucitabilidad son esenciales para el éxito de la maniobra (fig. 1). Una vez que se ha superado ese umbral, dichas presiones deben ser mantenidas durante varios minutos para promover las condiciones metabólicas miocárdicas necesarias para el éxito de la resucitación22, y las interrupciones pueden ser muy perjudiciales en la RCP19,30.
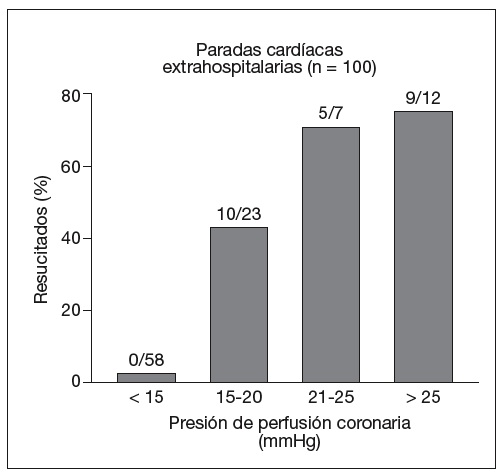
Figura 1. Relación entre la presión de perfusión coronaria y la recuperación de
la circulación espontánea en adultos que sufrieron paradas cardíacas
extrahospitalarias (n = 100). La presión de perfusión coronaria se midió a
la llegada al servicio de urgencias de los pacientes en que habían
fracasado los esfuerzos iniciales de resucitación. Adaptado de Paradis et al29.
El principal determinante de la perfusión coronaria es la presión «diastólica» aórtica, que refleja el efecto combinado del flujo sanguíneo anterógrado y la resistencia vascular periférica. La presión diastólica auricular derecha se mantiene sin cambios durante la resucitación a tórax cerrado y es mínimamente susceptible de manipulación terapéutica. Por lo tanto, pueden conseguirse incrementos en la presión de perfusión coronaria aumentando el flujo sanguíneo anterógrado, la resistencia vascular periférica o ambos. El primero se aumenta mediante intervención mecánica y la otra, mediante administración de agentes vasopresores.
Aumento del flujo sanguíneo anterógrado
La compresión torácica manual es enseñada en el mundo entero a la población general y a los reanimadores profesionales, y es la técnica básica habitual para generación de flujo sanguíneo durante la RCP estándar. El mecanismo por el que la compresión torácica manual genera flujo incluye predominantemente una función de bomba cardíaca en la que el flujo sanguíneo anterógrado es en parte o completamente el resultado de la compresión directa del corazón entre el esternón y la columna vertebral31-34.
Desde esta perspectiva, la profundidad de la compresión torácica es un determinante crítico del flujo sanguíneo anterógrado. Se ha demostrado en estudios con modelos animales que debe excederse un umbral de compresión antes de que el flujo sanguíneo anterógrado pueda generarse y que, tras superarse ese umbral, el flujo aumenta en proporción a la profundidad de la compresión35,36. Sin embargo, una vez alcanzada una profundidad de compresión máxima no se obtienen mayores beneficios hemodinámicos, pero aumenta el riesgo de lesionar la pared torácica o las vísceras abdominales37-39. Por lo tanto, la compresión torácica manual actúa dentro de una estrecha relación profundidad-flujo, de modo que debe prestarse gran atención a la calidad de la técnica para maximizar su efectividad hemodinámica (fig. 2).
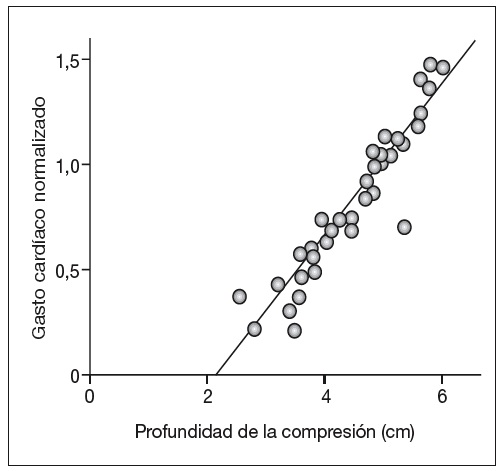
Figura 2. Relación entre la profundidad de las compresiones torácicas
y el flujo sanguíneo anterógrado generado. Las mediciones se tomaron
en un modelo canino de parada cardíaca. Modificado de Babbs et al35.
Desafortunadamente, estudios recientes han mostrado que la calidad con que se realiza la compresión torácica -incluso por reanimadores entrenados y experimentados- es sorprendentemente pobre y se desvía considerablemente de la profundidad, la frecuencia y la relación compresión-ventilación recomendadas40-42. Una pobre RCP se verá empeorada por interrupciones frecuentes que harán que un elevado número de compresiones sean menos profundas de lo recomendado20,43. Se cree que una RCP de baja calidad es la causa del fracaso en la resucitación de un considerable número de pacientes con parada cardíaca, aunque la magnitud exacta del problema es difícil de determinar. Por ello se ha emprendido una intensa campaña para alertar a los reanimadores sobre su realidad y promover esfuerzos para mejorar la calidad de la RCP.
Se requieren soluciones creativas. Como se discute más adelante, los sistemas de monitorización que ofrecen una retroalimentación en tiempo real están siendo desarrollados e incorporados a desfibriladores externos semiautomáticos (DESA) en un intento por guiar a los reanimadores en obtener compresiones torácicas manuales de acuerdo con las recomendaciones. Además, los reanimadores pueden guiar sus compresiones torácicas conociendo estimaciones del flujo sanguíneo anterógrado. Una de estas medidas es la presión de CO2 telespiratoria, que ha mostrado una estrecha relación con el flujo sanguíneo anterógrado y la presión de perfusión coronaria generada y es un predictor del pronóstico inicial de la resucitación44-48. La monitorización continua de la pCO2 telespiratoria, mediante el empleo de los dispositivos ya comercializados o de sensores incluidos en los desfibriladores manuales, permite a los reanimadores ajustar la técnica de compresión torácica para obtener la mayor pCO2 telespiratoria posible, por lo que sería deseable un mayor empleo de estos dispositivos en resucitación.
Retorno venoso
Como el corazón latiendo normalmente, el flujo sanguíneo anterógrado generado por la compresión torácica también produce un retorno venoso y una precarga adecuados. El retorno venoso hacia el tórax lo origina el gradiente de presión establecido entre las estructuras vasculares extratorácicas e intratorácicas, pues son esos cambios en la presión intratorácica lo que influye en el retorno venoso. Este concepto relativamente simple (aunque todavía no ampliamente reconocido) está adquiriendo relevancia práctica gracias a recientes estudios que han demostrado que el retorno venoso (y el ulterior flujo sanguíneo anterógrado) pueden ser reducidos por la hiperventilación49,50 y aumentados por los dispositivos que generan vacío intratorácico51-53.
En un estudio realizado en 13 víctimas de parada cardíaca extrahospitalaria, una ventilación meticulosa realizada por reanimadores profesionales implicó una media de 30 ± 3 (intervalo, 15-49) ventilaciones/min. La duración de cada ventilación fue de aproximadamente 1 s, de forma que el tiempo en que se registró una presión positiva en los pulmones fue el 47% ± 4%. Ningún paciente sobrevivió en ese estudio49. Los investigadores examinaron entonces este fenómeno en un modelo animal de parada cardíaca y encontraron que un incremento de 12 a 20 y a 30 en el número de ventilaciones por minuto se acompañó de aumentos en la presión intratraqueal media de 7 ± 1 a 12 ± 1 y a 18 ± 1 mmHg, y descensos en la presión de perfusión coronaria de 23 ± 1 a 20 ± 2 y a 17 ± 2 mmHg. En otra serie de experimentos la supervivencia se vio gravemente comprometida por ventilación a 30/min comparada con 12/min49. Este efecto no se explicó por hipocapnia, pues la adición de CO2 al 5% al gas respirado no mejoró el pronóstico.
Por lo tanto, evitar frecuencias superiores a las 12 ventilaciones/min actualmente recomendadas para reanimadores sanitarios podría tener un efecto favorable inmediato en el pronóstico de las resucitaciones. Sin embargo, se requiere un trabajo adicional para definir de forma más precisa los requerimientos ventilatorios durante la RCP. Los estudios han demostrado que no están justificados los esfuerzos para eliminar CO2 mediante ventilación con volúmenes minuto fisiológicos. El estado de muy bajo flujo existente durante la RCP excluye numerosos lechos vasculares y limita la cantidad de CO2 transportado hacia los pulmones54. Incluso si ocurriera retención de CO2, la resucitabilidad sólo estaría comprometida a muy altos niveles de pCO2, habitualmente por encima de 100 mmHg55. Además, en condiciones de privación de oxígeno las células aprecian más un medio ácido que uno alcalino56-58. Por lo tanto, no existen argumentos para ventilar agresivamente durante la RCP.
Aplicando el mismo razonamiento, los descensos en la presión torácica podrían usarse para aumentar el retorno venoso. Estudios de laboratorio y clínicos demostraron precozmente que el retorno venoso se puede aumentar mediante descompresión activa de la cavidad torácica59 empleando un dispositivo de copa de succión que permite la elevación manual de la pared anterior del tórax60,61. Se esperaba que el vacío intratorácico generado aumentase el retorno venoso. Sin embargo, pronto se vio que tal vacío podía disiparse fácilmente si la vía aérea estaba permeable y permitía la entrada de aire en lugar de sangre a la cavidad torácica. Entonces Keith Lurie desarrolló un dispositivo de válvula para permitir la entrada de aire a los pulmones sólo cuando se superaba un determinado umbral de presión62,63. El llamado «dispositivo de umbral de impedancia» se ha mostrado capaz de aumentar el retorno venoso tanto en la RCP como en otros estados de bajo flujo como el shock hemorrágico (fig. 3)64-67. Las Recomendaciones 2005 para RCP y cuidado cardiovascular de emergencia concluyeron que este dispositivo probablemente sea efectivo y le asignaron una clase IIa para su recomendación de uso durante la RCP24,25.
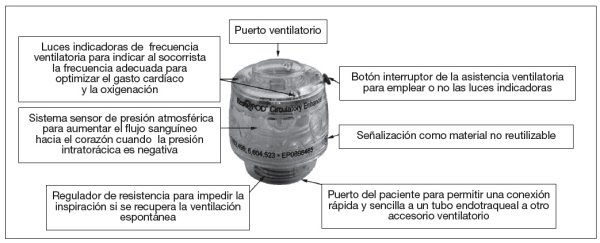
Figura 3. Ejemplo de Dispositivo comercializado de umbral de impedancia para crear un vacío intratorácico
entre compresiones. Incluye también un temporizador para guiar a los socorristas
en la aplicación de un número adecuado de ventilaciones
Nuevas técnicas de resucitación
La búsqueda de técnicas más potentes de resucitación ha dado frutos en el pasado que todavía no se han materializado en técnicas de amplia aceptación, a pesar de demostrarse capaces de aumentar el flujo sanguíneo anterógrado. Ése es el caso de la RCP con compresión abdominal interpuesta («contrapulsación abdominal»), que consiste en la compresión del abdomen durante la fase de relajación de las compresiones torácicas68-70. El propósito es aumentar el retorno venoso inmediatamente antes de la compresión torácica y limitar el flujo aórtico distal para aumentar la presión de perfusión aórtica central. En una reciente revisión bibliográfica, Babbs71 encontró que la mayoría de los estudios en animales y clínicos respaldaban la efectividad de la compresión abdominal interpuesta.
Recientemente se ha desarrollado un vendaje para compresión automática que genera flujo anterógrado constriñendo circunferencialmente la pared anterior del tórax contra un tablero rígido (AutoPulseTM)72,73 (fig. 4). El concepto proviene de estudios previos que emplearon chalecos circunferenciales parecidos a un gran manguito de presión arterial y enrollados alrededor del tórax que cuando se inflan y desinflan pueden generar presiones durante la RCP superiores a las generadas por la RCP convencional72,74. Los efectos hemodinámicos del AutoPulseTM fueron estudiados recientemente en 31 sujetos que habían sufrido una parada cardíaca hospitalaria y en los que habían fracasado 10 min de soporte vital avanzado estándar. Se avanzaron catéteres hasta la aorta torácica y hasta la aurícula derecha para calcular la presión de perfusión coronaria. Se practicó a los sujetos periodos de RCP estándar a 100 compresiones por minuto alternando con periodos de AutoPulseTM aplicados a 60 compresiones por minuto. Todos los sujetos fueron intubados y ventilados a 12 insuflaciones por minuto mediante una bola con válvula unidireccional. Se administró adrenalina (1 mg en bolo) a intervalos de 3-5 min. AutoPulseTM produjo mayores presiones aórticas máximas (153 ± 28 frente a 115 ± 42 mmHg; p < 0,0001) y mayores presiones de perfusión coronarias (20 ± 12 frente a 15 ± 11 mmHg; p < 0,015). Aunque el beneficio hemodinámico parece modesto, los pequeños incrementos en la presión de perfusión coronaria pueden tener un impacto crucial en la resucitabilidad. Sin embargo, dos ensayos clínicos amplios han dado resultados contradictorios; en el que los pacientes fueron asignados de forma aleatoria a RCP estándar o a AutoPulseTM, los autores no encontraron diferencias en el pronóstico75,76. Por lo tanto, el asunto está todavía siendo evaluado y se requerirán más estudios para determinar el papel de AutoPulseTM en la resucitación.

Figura 4. Dispositivos AutopulseTM (izquierda) y LUCASTM (derecha)
para la compresión automática del tórax.
Otro dispositivo mecánico para RCP es el dispositivo Lund University Cardiac Assist System (LUCASTM)77,78 (fig. 4). Este dispositivo utiliza un pistón desplazado por aire comprimido que actúa comprimiendo el tórax en forma similar a la compresión manual. El pistón también tiene adherida una copa de succión, también por aire comprimido, que permite activamente elevar la pared anterior del tórax, con lo que se expande la cavidad torácica antes de la compresión siguiente. El dispositivo LUCASTM ha demostrado ser hemodinámicamente superior a la técnica manual de RCP. La compresión está programada para deprimir el tórax 5 cm a una frecuencia de 100 compresiones por minuto, con una relación proporcional entre compresión y descompresión.
Otras técnicas más potentes para generar flujo anterógrado incluyen el masaje cardiaco directo (manual) a tórax abierto79-82 y la circulación extracorpórea a través de un acceso venoso periférico83-87. Estas técnicas son capaces de producir flujos sanguíneos a niveles próximos al gasto cardíaco normal con el masaje cardíaco directo o incluso superiores con la circulación extracorpórea88. El uso de estas técnicas requiere, sin embargo, una formidable dedicación de personal entrenado y equipamiento. Sin embargo, todavía no hay pruebas definitivas de que puedan mejorar el pronóstico final de los pacientes. Para que estas técnicas tengan éxito, tienen que ser aplicadas muy precozmente tras el inicio de la parada cardíaca. Sin embargo, frecuentemente estas técnicas se emplean como un último recurso, cuando la RCP convencional ha fracasado y, por lo tanto, en situaciones en que los órganos vitales han sufrido ya lesiones graves de isquemia y reperfusión.
Avances tecnológicos en monitorización
La tecnología probablemente tenga un papel cada vez más prominente durante la resucitación cardíaca, no sólo por la posibilidad de nuevos y más efectivos dispositivos, sino también por incorporar datos en tiempo real capaces de mejorar el proceso de toma de decisiones. Por ejemplo, los DESA no son sólo cajas de desfibrilación. Además de sus capacidades iniciales de reconocer arritmias desfibrilables e indicar a los socorristas el momento de la descarga mediante señales acústicas, los DESA actuales también indican a los socorristas cuándo deben realizar RCP. De hecho, se ha argumentado que algunos de los efectos favorables de la implantación de programas de acceso de la población a la desfibrilación89 son resultado de promover entre la población la RCP, independientemente de su capacidad para la desfibrilación precoz.
Por otra parte, las compañías están desarrollando algoritmos para el análisis en tiempo real de la morfología de las FV, lo que permitiría no sólo distinguir entre los ritmos desfibrilables y los no desfibrilables, sino también determinar la probabilidad de éxito de una descarga para recuperar una actividad eléctrica cardíaca organizada. Esta capacidad añadida facilitaría una mejor sincronización de las descargas eléctricas, minimizando los efectos perjudiciales para la resucitación derivados de la interrupción en las compresiones torácicas30 y el excesivo número de descargas eléctricas90.
Las empresas líderes en la fabricación de desfibriladores están desarrollando también tecnologías para la monitorización de la frecuencia y la profundidad de las compresiones. Una de estas tecnologías consiste en un acelerómetro introducido en un dispositivo que se coloca en la pared anterior del tórax y permite una monitorización continua de los desplazamientos del esternón, lo que proporciona al socorrista una información retroalimentada para asegurar una frecuencia y la profundidad apropiadas en las compresiones (fig. 5). Estos nuevos dispositivos también pueden monitorizar la ventilación y emitir señales para asegurar frecuencias adecuadas de ventilación y compresión, junto con información retroalimentada para corregir errores.
Figura 5. Electrodo comercializado para desfibrilación externa semiautomatizada
con acelerómetro para monitorización continua de los desplazamientos del esternón.
Otra muestra interesante de la tecnología que se está desarrollando es la alarma implantable de parada cardíaca. Un prototipo experimental está siendo probado en humanos tras haberse desarrollado en modelos animales. Este dispositivo se coloca subcutáneamente en la región precordial y su contenido electrónico le permite monitorizar de forma continua el electrocardiograma. Su señal se transmite a una estación remota en la que el electrocardiograma puede ser monitorizado. En caso de un ritmo cardíaco que comprometa la vida, puede activarse un sistema de respuesta que incluya al servicio de emergencias junto con una alarma local que atraiga a personas próximas a la víctima para que respondan rápidamente de forma apropiada hasta la llegada del personal de emergencias.
Hipotermia
La hipotermia es una forma altamente efectiva de reducir los requerimientos metabólicos y se emplea comúnmente en los quirófanos durante la cirugía cardíaca con circulación extracorpórea y otras intervenciones que requieren interrupción del flujo sanguíneo. La hipotermia permite a los tejidos resistir mayores intervalos sin oxígeno o flujo sanguíneo mediante la disminución de los requerimientos energéticos. Cuando una parada cardíaca ocurre en hipotermia, son posibles buenos resultados incluso tras largos periodos sin flujo y prolongados esfuerzos de resucitación91,92. Por estas razones los investigadores han sido tentados durante décadas por la idea de inducir hipotermia durante la parada cardíaca. Diversos estudios experimentales realizados en modelos animales de parada cardíaca respaldaron el concepto de que la hipotermia durante la parada cardíaca es efectiva para minimizar el daño, pues promueve un mejor funcionamiento miocárdico y cerebral tras la resucitación93,94. Sin embargo, existen importantes dificultades logísticas que limitan la aplicación de la hipotermia durante la parada cardíaca, aunque se han considerado factibles soluciones sencillas como la administración rápida de suero salino frío.
Se han realizado también estudios para investigar el papel de la inducción de hipotermia tras la resucitación de una parada cardíaca. Aunque inicialmente su empleo es contrario a la intuición, pues el daño isquémico ya se ha producido, los estudios han mostrado que este enfoque es efectivo. Dos ensayos clínicos aleatorizados han demostrado que los pacientes que persisten comatosos tras la resucitación de la parada cardíaca se benefician de un periodo de 12-24 h de hipotermia a una temperatura interna entre 32 y 34 oC95,96. Estos estudios, junto con datos preclínicos sólidos y muchos otros ensayos clínicos más pequeños, han aportado la evidencia requerida por muchas autoridades, como las redactoras de las más recientes pautas en RCP y cuidados cardiovasculares de emergencia, para recomendar el empleo clínico de la hipotermia tras la resucitación97,98. Aunque los dos ensayos clínicos antes mencionados realizaron intensos esfuerzos para el enfriamiento de superficie (incluidos la circulación de aire frío o el uso de bolsas de hielo), la evidencia de su utilidad ha estimulado el interés por desarrollar enfoques tecnológicos más convenientes no sólo para el enfriamiento externo, sino también para el enfriamiento interno mediante dispositivos intravasculares. Actualmente hay una fuerte tendencia hacia un más amplio uso de la hipotermia tras la resucitación con esfuerzos por iniciarla lo antes posible, idealmente durante la propia parada cardíaca. Se cree que la hipotermia tiene además otros efectos favorables, y posiblemente favorezca respuestas tisulares adaptativas que pueden implicar la activación de vías de supervivencia y la modulación de la inflamación99.
Conclusiones
La aplicación de la evidencia científica disponible en resucitación podría modificar de forma sustancial los tristes resultados que se obtienen actualmente en tratamiento de la parada cardíaca tanto extrahospitalaria como hospitalaria100. Sin embargo, la mayoría de los procedimientos que han conseguido reducir la mortalidad por parada cardíaca no se emplean suficientemente en nuestro medio. Junto con el establecimiento de estrategias realmente enérgicas para la desfibrilación precoz, se han repasado los cuatro aspectos de la resucitación que tienen el mayor potencial para mejorar el pronóstico: la prevención de la parada cardíaca mediante el reconocimiento precoz de los signos de alarma e intervención oportuna, la resucitación orientada hacia el flujo sanguíneo, con un papel limitado de la ventilación, la aplicación de la tecnología para guiar las intervenciones en resucitación y el empleo de hipotermia.
Bibliografía
1. Zheng ZJ, Croft JB, Giles WH, Mensah GA. Sudden cardiac death in the United States, 1989 to 1998. Circulation. 2001;104:2158-63. [ Links ]
2. Eisenberg MS, Mengert TJ. Cardiac resuscitation. N Engl J Med. 2001;344:1304-13. [ Links ]
3. Álvarez-Fernández JA, Álvarez-Mon M, Rodríguez-Zapata M. Supervivencia en España de las paradas cardíacas extrahospitalarias. Med Intensiva. 2001;25:236-43. [ Links ]
4. Álvarez-Fernández JA. Pobre evolución de la mortalidad por parada cardíaca en España. Rev Clin Esp. 2003;203:513-6. [ Links ]
5. Nichol G, Stiell IG, Laupacis A, Pham B, De Maio VJ, Wells GA. A cumulative meta-analysis of the effectiveness of defibrillator-capable emergency medical services for victims of out-of-hospital cardiac arrest. Ann Emerg Med. 1999;34:517-25. [ Links ]
6. Fredriksson M, Herlitz J, Nichol G. Variation in outcome in studies of out-of-hospital cardiac arrest: a review of studies conforming to the Utstein guidelines. Am J Emerg Med. 2003;21:276-81. [ Links ]
7. Rea TD, Eisenberg MS, Sinibaldi G, White RD. Incidence of EMS-treated out-of-hospital cardiac arrest in the United States. Resuscitation. 2004;63:17-24. [ Links ]
8. Spaulding CM, Joly LM, Rosenberg A, Monchi M, Weber SN, Dhainaut JF, Carli P. Immediate coronary angiography in survivors of out-of-hospital cardiac arrest. N Engl J Med. 1997;336:1629-33. [ Links ]
9. Herlitz J, Ekstrom L, Wennerblom B, Axelsson A, Bang A, Holmberg S. Effect of bystander initiated cardiopulmonary resuscitation on ventricular fibrillation and survival after witnessed cardiac arrest outside hospital. Br Heart J. 1994;72:408-12. [ Links ]
10. Gallagher EJ, Lombardi G, Gennis P. Effectiveness of bystander cardiopulmonary resuscitation and survival following outof-hospital cardiac arrest. JAMA. 1995;274:1922-5. [ Links ]
11. Spearpoint KG, McLean CP, Zideman DA. Early defibrillation and the chain of survival in «in-hospital» adult cardiac arrest; minutes count. Resuscitation. 2000;44:165-9. [ Links ]
12. Zafari AM, Zarter SK, Heggen V, Wilson P, Taylor RA, Reddy K, et al. A program encouraging early defibrillation results in improved in-hospital resuscitation efficacy. J Am Coll Cardiol. 2004;44:846-52. [ Links ]
13. Kause J, Smith G, Prytherch D, Parr M, Flabouris A, Hillman K. A comparison of antecedents to cardiac arrests, deaths and emergency intensive care admissions in Australia and New Zealand, and the United Kingdom-the ACADEMIA study. Resuscitation. 2004;62:275-82. [ Links ]
14. Bristow PJ, Hillman KM, Chey T, Daffurn K, Jacques TC, Norman SL, et al. Rates of in-hospital arrests, deaths and intensive care admissions: the effect of a medical emergency team. Med J Aust. 2000;173:236-40. [ Links ]
15. Bellomo R, Goldsmith D, Uchino S, Buckmaster J, Hart G, Opdam H, et al. Prospective controlled trial of effect of medical emergency team on postoperative morbidity and mortality rates. Crit Care Med. 2004;32:916-21. [ Links ]
16. DeVita MA, Braithwaite RS, Mahidhara R, Stuart S, Foraida M, Simmons RL. Use of medical emergency team responses to reduce hospital cardiopulmonary arrests. Qual Saf Health Care. 2004;13:251-4. [ Links ]
17. Hillman K, Chen J, Cretikos M, Bellomo R, Brown D, Doig G, et al. Introduction of the medical emergency team (MET) system: a cluster-randomised controlled trial. Lancet. 2005;365:2091-7. [ Links ]
18. Piquette D, Fowler RA. Do medical emergency teams improve the outcomes of in-hospital patients? CMAJ. 2005;173:599-600. [ Links ]
19. Berg RA, Sanders AB, Kern KB, Hilwig RW, Heidenreich JW, Porter ME, et al. Adverse hemodynamic effects of interrupting chest compressions for rescue breathing during cardiopulmonary resuscitation for ventricular fibrillation cardiac arrest. Circulation. 2001;104:2465-70. [ Links ]
20. Kern KB, Hilwig RW, Berg RA, Sanders AB, Ewy GA. Importance of continuous chest compressions during cardiopulmonary resuscitation: improved outcome during a simulated single lay-rescuer scenario. Circulation. 2002;105:645-9. [ Links ]
21. Berg RA, Hilwig RW, Kern KB, Sanders AB, Xavier LC, Ewy GA. Automated external defibrillation versus manual defibrillation for prolonged ventricular fibrillation: lethal delays of chest compressions before and after countershocks. Ann Emerg Med. 2003;42:458-67. [ Links ]
22. Kolarova J, Ayoub IM, Yi Z, Gazmuri RJ. Optimal timing for electrical defibrillation after prolonged untreated ventricular fibrillation. Crit Care Med. 2003;31:2022-8. [ Links ]
23. Wik L, Hansen TB, Fylling F, Steen T, Vaagenes P, Auestad BH, et al. Delaying defibrillation to give basic cardiopulmonary resuscitation to patients with out-of-hospital ventricular fibrillation: a randomized trial. JAMA. 2003;289:1389-95. [ Links ]
24. 2005 American Heart Association Guidelines for Cardiopulmonary Resuscitation and Emergency Cardiovascular Care. Circulation. 2005;112:IV1-211. [ Links ]
25. Consejo Español de Resucitación. Recomendaciones 2005 en Resucitación Cardiopulmonar del European Resuscitation Council. Traducción oficial autorizada [citado 27 Ago 2007]. Disponible en: http://www.semicyuc.org/files/NR_RCP.pdf [ Links ]
26. Gazmuri RJ, Von Planta M, Weil MH, Rackow EC. Cardiac effects of carbon dioxide-consuming and carbon dioxide-generating buffers during cardiopulmonary resuscitation. J Am Coll Cardiol. 1990;15:482-90. [ Links ]
27. Von Planta I, Weil MH, Von Planta M, Bisera J, Bruno S, Gazmuri RJ, et al. Cardiopulmonary resuscitation in the rat. J Appl Physiol. 1988;65:2641-7. [ Links ]
28. Niemann JT, Criley JM, Rosborough JP, Niskanen RA, Alferness C. Predictive indices of successful cardiac resuscitation after prolonged arrest and experimental cardiopulmonary resuscitation. Ann Emerg Med. 1985;14:521-8. [ Links ]
29. Paradis NA, Martin GB, Rivers EP, Goetting MG, Appleton TJ, Feingold M, et al. Coronary perfusion pressure and the return of spontaneous circulation in human cardiopulmonary resuscitation. JAMA. 1990;263:1106-13. [ Links ]
30. Yu T, Weil MH, Tang W, Sun S, Klouche K, Povoas H, et al. Adverse outcomes of interrupted precordial compression during automated defibrillation. Circulation. 2002;106:368-72. [ Links ]
31. Deshmukh HG, Weil MH, Gudipati CV, Trevino RP, Bisera J, Rackow EC. Mechanism of blood flow generated by precordial compression during CPR. I. Studies on closed chest precordial compression. Chest. 1989;95:1092-9. [ Links ]
32. Porter TR, Ornato JP, Guard CS, Roy VG, Burns CA, Nixon JV. Transesophageal echocardiography to assess mitral valve function and flow during cardiopulmonary resuscitation. Am J Cardiol. 1992;70:1056-60. [ Links ]
33. Redberg RF, Tucker KJ, Cohen TJ, Dutton JP, Callaham ML, Schiller NB. Physiology of blood flow during cardiopulmo-nary resuscitation. A transesophageal echocardiographic study. Circulation. 1993;88:534-42. [ Links ]
34. Ma MH, Hwang JJ, Lai LP, Wang SM, Huang GT, Shyu KG, et al. Transesophageal echocardiographic assessment of mitral valve position and pulmonary venous flow during cardiopulmonary resuscitation in humans. Circulation. 1995;92:854-61. [ Links ]
35. Babbs CF, Voorhees WD, Fitzgerald KR, Holmes HR, Geddes LA. Relation of blood pressure and flow during CPR to chest compression amplitude: Evidence for an effective compression threshold. Ann Emerg Med. 1983;12:527-32. [ Links ]
36. Bellamy RF, DeGuzman LR, Pedersen DC. Coronary blood flow during cardiopulmonary resuscitation in swine. Circulation. 1984;69:174-80. [ Links ]
37. Krischer JP, Fine EG, Davis JH, Nagel EL. Complications of cardiac resuscitation. Chest. 1987;92:287-91. [ Links ]
38. Rabl W, Baubin M, Broinger G, Scheithauer R. Serious complications from active compression-decompression cardiopulmonary resuscitation. Int J Legal Med. 1996;109:84-9. [ Links ]
39. Lederer W, Mair D, Rabl W, Baubin M. Frequency of rib and sternum fractures associated with out-of-hospital cardiopulmonary resuscitation is underestimated by conventional chest X-ray. Resuscitation. 2004;60:157-62. [ Links ]
40. Abella BS, Alvarado JP, Myklebust H, Edelson DP, Barry A, O'Hearn N, et al. Quality of cardiopulmonary resuscitation during in-hospital cardiac arrest. JAMA. 2005;293:305-10. [ Links ]
41. Abella BS, Sandbo N, Vassilatos P, Alvarado JP, O'Hearn N, Wigder HN, et al. Chest compression rates during cardiopulmonary resuscitation are suboptimal: a prospective study during in-hospital cardiac arrest. Circulation. 2005;111:428-34. [ Links ]
42. Wik L, Kramer-Johansen J, Myklebust H, Sorebo H, Svensson L, Fellows B, et al. Quality of cardiopulmonary resuscitation during out-of-hospital cardiac arrest. JAMA. 2005;293:299-304. [ Links ]
43. Eftestol T, Sunde K, Steen PA. Effects of interrupting pre-cordial compressions on the calculated probability of defibrillation success during out-of-hospital cardiac arrest. Circulation. 2002;105:2270-3. [ Links ]
44. Sanders AB, Atlas M, Ewy GA, Kern KB, Bragg S. Expired PCO2 as an index of coronary perfusion pressure. Am J Emerg Med. 1985;3:147-9. [ Links ]
45. Falk JL, Rackow EC, Weil MH. End-tidal carbon dioxide concentration during cardiopulmonary resuscitation. N Engl J Med. 1988;318:607-11. [ Links ]
46. Gudipati CV, Weil MH, Bisera J, Deshmukh HG, Rackow EC. Expired carbon dioxide: A noninvasive monitor of cardiopulmonary resuscitation. Circulation. 1988;77:234-9. [ Links ]
47. Sanders AB, Kern KB, Otto CW, Milander MM, Ewy GA. End-tidal carbon dioxide monitoring during cardiopulmonary resuscitation. JAMA. 1989;262:1347-51. [ Links ]
48. Gazmuri RJ, Weil MH, Bisera J, Rackow EC. End-tidal carbon dioxide tension as a monitor of native blood flow during resuscitation by extracorporeal circulation. J Thorac Cardiovasc Surg. 1991;101:984-8. [ Links ]
49. Aufderheide TP, Lurie KG. Death by hyperventilation: a common and life-threatening problem during cardiopulmonary resuscitation. Crit Care Med. 2004;32:S345-51. [ Links ]
50. Aufderheide TP, Sigurdsson G, Pirrallo RG, Yannopoulos D, McKnite S, Von Briesen C, et al. Hyperventilation-induced hypotension during cardiopulmonary resuscitation. Circulation. 2004;109:1960-5. [ Links ]
51. Wolcke BB, Mauer DK, Schoefmann MF, Teichmann H, Provo TA, Lindner KH, et al. Comparison of standard cardiopulmonary resuscitation versus the combination of active compression-decompression cardiopulmonary resuscitation and an inspira-tory impedance threshold device for out-of-hospital cardiac arrest. Circulation. 2003;108:2201-5. [ Links ]
52. Aufderheide TP, Pirrallo RG, Provo TA, Lurie KG. Clinical evaluation of an inspiratory impedance threshold device during standard cardiopulmonary resuscitation in patients with out-of-hospital cardiac arrest. Crit Care Med. 2005;33:734-40. [ Links ]
53. Plaisance P, Soleil C, Lurie KG, Vicaut E, Ducros L, Payen D. Use of an inspiratory impedance threshold device on a facemask and endotracheal tube to reduce intrathoracic pressures during the decompression phase of active compression-decompression cardiopulmonary resuscitation. Crit Care Med. 2005;33:990-4. [ Links ]
54. Gazmuri RJ, Von Planta M, Weil MH, Rackow EC. Arterial PCO2 as an indicator of systemic perfusion during cardiopulmonary resuscitation. Crit Care Med. 1989;17:237-40. [ Links ]
55. Von Planta I, Weil MH, Von Planta M, Gazmuri RJ, Duggal C. Hypercarbic acidosis reduces cardiac resuscitability. Crit Care Med. 1991;19:1177-82. [ Links ]
56. Bing OH, Brooks WW, Messer JV. Heart muscle viability following hypoxia: Protective effect of acidosis. Science. 1973;180:1297-8. [ Links ]
57. Kitakaze M, Weisfeldt ML, Marban E. Acidosis during early reperfusion prevents myocardial stunning in perfused ferret hearts. J Clin Invest. 1988;82:920-7. [ Links ]
58. Hata K, Takasago T, Saeki A, Nishioka T, Goto Y. Stunned myocardium after rapid correction of acidosis: Increased oxygen cost of contractility and the role of the Na+-H+ exchange system. Circ Res. 1994;74:794-805. [ Links ]
59. Cohen TJ, Tucker KJ, Redberg RF, Lurie KG, Chin MC, Dutton JP, et al. Active compression-decompression resuscitation: a novel method of cardiopulmonary resuscitation. Am Heart J. 1992;124:1145-50. [ Links ]
60. Tucker KJ, Redberg RF, Schiller NB, Cohen TJ. Active compression-decompression resuscitation: Analysis of transmitral flow and left ventricular volume by transesophageal echocardiography in humans. J Am Coll Cardiol. 1993;22:1485-93. [ Links ]
61. Luiz T, Ellinger K, Denz C. Active compression-decompression cardiopulmonary resuscitation does not improve survival in patients with prehospital cardiac arrest in a physician-manned emergency medical system. J Cardiothorac Vasc Anesth. 1996;10:178-86. [ Links ]
62. Lurie KG. Recent advances in mechanical methods of cardiopulmonary resuscitation. Acta Anaesthesiol Scand Suppl. 1997;111:49-52. [ Links ]
63. Langhelle A, Stromme T, Sunde K, Wik L, Nicolaysen G, Steen PA. Inspiratory impedance threshold valve during CPR. Resuscitation. 2002;52:39-48. [ Links ]
64. Lurie KG, Zielinski T, Voelckel W, McKnite S, Plaisance P. Augmentation of ventricular preload during treatment of cardiovascular collapse and cardiac arrest. Crit Care Med. 2002;30: S162-5. [ Links ]
65. Sigurdsson G, Yannopoulos D, McKnite SH, Lurie KG. Cardiorespiratory interactions and blood flow generation during cardiac arrest and other states of low blood flow. Curr Opin Crit Care. 2003;9:183-8. [ Links ]
66. Lurie KG, Zielinski TM, McKnite SH, Idris AH, Yannopoulos D, Raedler CM, et al. Treatment of hypotension in pigs with an inspiratory impedance threshold device: a feasibility study. Crit Care Med. 2004;32:1555-62. [ Links ]
67. Marino BS, Yannopoulos D, Sigurdsson G, Lai L, Cho C, Redington A, et al. Spontaneous breathing through an inspiratory impedance threshold device augments cardiac index and stroke volume index in a pediatric porcine model of hemorrhagic hypovolemia. Crit Care Med. 2004;32:S398-405. [ Links ]
68. Mateer JR, Stueven HA, Thompson BM, Aprahamian C, Darin JC. Interposed abdominal compression CPR versus standard CPR in prehospital cardiopulmonary arrest: Preliminary results. Ann Emerg Med 1984;13:764-6. [ Links ]
69. Sack JB, Kesselbrenner MB, Bregman D. Survival from inhospital cardiac arrest with interposed abdominal counterpulsation during cardiopulmonary resuscitation. JAMA. 1992;267:379-85. [ Links ]
70. Adams CP, Martin GB, Rivers EP, Ward KR, Smithline HA, Rady MY. Hemodynamics of interposed abdominal compression during human cardiopulmonary resuscitation. Acad Emerg Med. 1994;1:498-502. [ Links ]
71. Babbs CF. Interposed abdominal compression CPR: a comprehensive evidence based review. Resuscitation. 2003;59:71-82. [ Links ]
72. Halperin H, Berger R, Chandra N, Ireland M, Leng C, Lardo A, et al. Cardiopulmonary resuscitation with a hydraulic-pneumatic band. Crit Care Med. 2000;28:N203-6. [ Links ]
73. Timerman S, Cardoso LF, Ramires JA, Halperin H. Improved hemodynamic performance with a novel chest compression device during treatment of in-hospital cardiac arrest. Resuscitation. 2004;61:273-80. [ Links ]
74. Halperin HR, Tsitlik JE, Gelfand M, Weisfeldt ML, Gruben KG, Levin HR, et al. A preliminary study of cardiopulmonary resuscitation by circumferential compression of the chest with use of a pneumatic vest. N Engl J Med. 1993;329:762-8. [ Links ]
75. Hallstrom A, Rea TD, Sayre MR, Christenson J, Anton AR, Mosesso VN Jr, et al. Manual chest compression vs use of an automated chest compression device during resuscitation following out-of-hospital cardiac arrest: a randomized trial. JAMA. 2006;295:2620-8. [ Links ]
76. Ong ME, Ornato JP, Edwards DP, Dhindsa HS, Best AM, Ines CS, et al. Use of an automated, load-distributing band chest compression device for out-of-hospital cardiac arrest resuscitation. JAMA. 2006;295:2629-37. [ Links ]
77. Steen S, Liao Q, Pierre L, Paskevicius A, Sjöberg T. Evaluation of LUCAS, a new device for automatic mechanical compression and active decompression resuscitation. Resuscitation. 2002;55:285-99. [ Links ]
78. Steen S, Sjöberg T, Olsson P, Young M. Treatment of out-of-hospital cardiac arrest with LUCAS, a new device for automatic mechanical compression and active decompression resuscitation. Resuscitation. 2005;67:25-30. [ Links ]
79. Takino M, Okada Y. Firm myocardium in cardiopulmonary resuscitation. Resuscitation. 1996;33:101-6. [ Links ]
80. Durham LA 3rd, Richardson RJ, Wall MJ Jr, Pepe PE, Mattox KL. Emergency center thoracotomy: impact of prehospital resuscitation. J Trauma. 1992;32:775-9. [ Links ]
81. Paradis NA, Martin GB, Rivers EP. Use of open chest cardiopulmonary resuscitation after failure of standard closed chest CPR: illustrative cases. Resuscitation. 1992;24:61-71. [ Links ]
82. Geerh EC, Lewis FR, Auerbach PS. Failure of open-heart massage to improve survival after prehospital nontraumatic cardiac arrest. N Engl J Med. 1986;314:1189-90. [ Links ]
83. Gazmuri RJ, Weil MH, Von Planta M, Gazmuri RR, Shah DM, Rackow EC. Cardiac resuscitation by extracorporeal circulation after failure of conventional CPR. J Lab Clin Med. 1991;118:65-73. [ Links ]
84. Dembitsky WP, Moreno-Cabral RJ, Adamson RM, Daily PO. Emergency resuscitation using portable extracorporeal membrane oxygenation. Ann Thorac Surg. 1993;55:304-9. [ Links ]
85. Lee G, Antognini JF, Gronert GA. Complete recovery after prolonged resuscitation and cardiopulmonary bypass for hyperkalemic cardiac arrest. Anesth Analg. 1994;79:172-4. [ Links ]
86. Monties JR, Caus T, Mesana T, Pomane C, Mouly-Bandini A, Guez P. Clinical situations and results of cardiopulmonary support by peripheral access for resuscitation and recovery. Artif Organs. 1995;19:750-5. [ Links ]
87. Duncan BW, Ibrahim AE, Hraska V, Del Nido PJ, Laussen PC, Wessel DL, et al. Use of rapid-deployment extracorporeal membrane oxygenation for the resuscitation of pediatric patients with heart disease after cardiac arrest. J Thorac Cardiovasc Surg. 1998;116:305-11. [ Links ]
88. Gazmuri RJ, Weil MH, Terwilliger K, Shah DM, Duggal C, Tang W. Extracorporeal circulation as an alternative to open-chest cardiac compression for cardiac resuscitation. Chest. 1992;102:1846-52. [ Links ]
89. Hallstrom AP, Ornato JP, Weisfeldt M, Travers A, Christenson J, McBurnie MA, et al. Public-access defibrillation and survival after out-of-hospital cardiac arrest. N Engl J Med. 2004;351:637-46. [ Links ]
90. Gazmuri RJ. Effects of repetitive electrical shocks on postresuscitation myocardial function. Crit Care Med. 2000;28:N228-32. [ Links ]
91. Siebke H, Rod T, Breivik H, Link B. Survival after 40 minutes; submersion without cerebral sequelae. Lancet. 1975;1:1275-7. [ Links ]
92. Southwick FS, Dalglish PH Jr. Recovery after prolonged asystolic cardiac arrest in profound hypothermia. A case report and literature review. JAMA. 1980;243:1250-3. [ Links ]
93. Safar P, Xiao F, Radovsky A, Tanigawa K, Ebmeyer U, Bircher N, et al. Improved cerebral resuscitation from cardiac arrest in dogs with mild hypothermia plus blood flow promotion. Acta Anaesthesiol Scand Suppl. 1996;27:105-13. [ Links ]
94. Miki T, Liu GS, Cohen MV, Downey JM. Mild hypothermia reduces infarct size in the beating rabbit heart: a practical intervention for acute myocardial infarction? Basic Res Cardiol. 1998;93:372-83. [ Links ]
95. Bernard SA, Gray TW, Buist MD, Jones BM, Silvester W, Gutteridge G, et al. Treatment of comatose survivors of out-of-hospital cardiac arrest with induced hypothermia. N Engl J Med. 2002;346:557-63. [ Links ]
96. Hypothermia after Cardiac Arrest Study Group. Mild therapeutic hypothermia to improve the neurologic outcome after cardiac arrest. N Engl J Med. 2002;346:549-56. [ Links ]
97. 2005 American Heart Association Guidelines for Cardiopulmonary Resuscitation and Emergency Cardiovascular Care. Hypothermia. Circulation. 2005;112:IV136-8. [ Links ]
98. Nolan JP, Deakin CD, Soar J, Böttiger BW, Smith G. European Resuscitation Council guidelines for resuscitation 2005; section 4. Adult Advanced Life Support. Resuscitation. 2005;67 Suppl 1:S39-86. [ Links ]
99. Gazmuri RJ, Gopalakrishnan P. Hypothermia: cooling down inflammation. Crit Care Med. 2003;31:2811-2. [ Links ]
100. Álvarez-Fernández JA, Gazmuri RJ. Mortalidad evitable por parada cardíaca extrahospitalaria. Med Clin (Barc). 2008;130:710-4. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Dr. R.J. Gazmuri.
Medical Service (111F). North Chicago VA Medical Center.
3001 Green Bay Road. North Chicago. Illinois, 60064. Estados Unidos.
Correo electrónico: raul.gazmuri@rosalindfranklin.edu
Aceptado:19-10-2007.















