Meu SciELO
Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Medicina Intensiva
versão impressa ISSN 0210-5691
Med. Intensiva vol.35 no.2 Mar. 2011
Desarrollo de un modelo experimental de shock séptico orientado a la formación. Aplicación en el entrenamiento de técnicas de depuración en el manejo de la sepsis grave
Development of a septic shock experimental model oriented at training. Application in the training of depuration techniques in the management of severe sepsis
M.E. Herrera-Gutiérreza, G. Seller-Péreza, G. Quesada Garcíaa, M.M. Granadosb, J.M. Domínguezb y R.J. Gómez-Villamandosb
a Cuidados Críticos y urgencias, Hospital Universitario Carlos Haya, Málaga, España
b Departamento de Medicina y Cirugía Animal, Universidad de Córdoba, Córdoba, España
Esta investigación ha sido financiada mediante una beca sin restricciones de Hospal/Gambro®.
Dirección para correspondencia
RESUMEN
Objetivo: Definir un modelo experimental de shock séptico que pueda aplicarse al entrenamiento en el manejo inicial del shock séptico, de forma concreta mediante el uso de técnicas de depuración extrarrenal (TDE).
Diseño: Estudio experimental de casos-control.
Ámbito: Hospital veterinario universitario.
Sujetos: Diez perros Beagle (peso 12-15kg).
Intervenciones: Se provocó shock infundiendo 1mg/kg de lipopolisacárido de Escherichia coli (LPS) en 20ml salino en 10min, con un seguimiento posterior de 6h. Cinco animales no recibieron intervención para definir el curso del shock y 5 fueron tratados con hemofiltración de alto volumen (HVHF, 100ml/kg/h) para valorar la rapidez de respuesta.
Variables de interés: Se monitorizaron presiones (arterial y pulmonar), parámetros hemodinámicos, tonometría gástrica y función respiratoria.
Resultados: A los 2 min el efecto de la infusión de LPS era apreciable y al final de la infusión los 10 animales mostraban shock severo. A las 2h se apreciaban diferencias en gasto cardíaco, variabilidad de volumen sistólico y CO2 mucoso entre tratados y no tratados. En 4h la diferencia era evidente también en presión arterial media. Ningún control y todos los tratados sobrevivieron las 6h del experimento. Posteriormente, hemos desarrollado un taller docente basado en este protocolo que se ha aplicado en cinco cursos de formación (www.ccmijesususon.com; www.crrtcordoba.com.es/), obteniendo los resultados previstos.
Conclusiones: Este modelo de shock muestra una respuesta predecible en el tiempo, una latencia muy corta y una mejoría en animales tratados suficientemente rápida como para aplicarlo en talleres de formación. Es útil para el entrenamiento en HVHF y, asimismo, podría aplicarse en otros escenarios de manejo precoz del shock séptico.
Palabras clave: Shock séptico, Depuración extracorpórea, Experimentación animal.
ABSTRACT
Objective: To define a septic shock experimental model that can be used in for training in the early management of septic shock, specifically by extracorporeal depuration (ECD).
Design: A case-control experimental study.
Setting: Veterinary university hospital.
Subjects: Ten Beagle dogs (weight 12-15kg).
Interventions: Shock was induced using 1mg/kg Escherichia coli lipopolysaccharide (LPS) diluted in 20mL saline infused in 10minutes, with a subsequent follow-up at 6hours. There was no intervention in 5 animals in order to define the natural course of the shock and 5 underwent high volume hemofiltration (HVHF, 100mL/kg/h) to define delay in response to treatment.
Variables: Pressures (arterial and pulmonary), hemodynamic parameters, gastric tonometry and respiratory function were recorded.
Results: The LPS effect was evidenced at 2minutes of the infusion and the 10 animals showed severe shock at the end of the infusion. At 2-hours, changes between treated and non-treated animals were seen in cardiac output, systolic volume variability and mucous CO2. Mean arterial pressure was significantly different at four hours. All non-treated subjects died during the 6-hour follow-up and all the treated animals survived for this period. Based on these results, we developed a workshop that has been used in five courses (www.ccmijesususon.com - www.crrtcordoba.com.es/), obtaining the previous results.
Conclusions: Our shock model shows a predictable behavior, very short latency and a sufficiently rapid improvement in the treated animals for it to be applied in training workshops. It is useful for training in the high-volume hemofilitration (HVHF) and can be used for training in the early management of septic shock.
Key words: Septic shock, Extracorporeal depuration, Animal research.
Introducción
La infección grave es la principal causa de disfunción orgánica múltiple y muerte en las unidades de cuidados intensivos1,2. Diferentes autores han propuesto el uso de las técnicas de depuración extracorpórea (TDE) para controlar o atenuar la respuesta a la sepsis y la evolución a disfunción multiorgánica (SDMO) e inicialmente se aplicó la hemofiltración continua (HFC), que posteriormente derivó a modalidades más agresivas (HFC de alto volumen HVHF) y que actualmente se complementan con nuevas modalidades, como las basadas en adsorción3-5 o la difusión realizada sobre membranas de muy alto poro6. Estos cambios suponen un reto para el intensivista al aplicarse a pacientes en situación de extrema gravedad y en los que un manejo inadecuado podría derivarse en serias consecuencias para ellos, por lo tanto, es importante conocer la interacción entre las TDE y los sistemas vitales del paciente (circulación, respiración, etc.) y es necesario disponer de un adecuado entrenamiento antes de su aplicación. Sin embargo, la curva de aprendizaje para estas técnicas se ve dificultada ante todo por el reducido número de pacientes a los que se aplica en este escenario específico, aun cuando su uso en el manejo del paciente con disfunción renal esté muy extendido7-9.
Por último, aunque las TDE en general se consideran seguras y con un perfil de riesgo bajo, los cambios progresivos que se han producido en su modo de aplicación condicionan que el número de complicaciones derivadas de su uso haya aumentado y este riesgo potencial es significativamente más alto al elevar la dosis de tratamiento10, lo que hace más importante, de cara a la seguridad del paciente, contar con mecanismos eficaces de entrenamiento en estas variantes de alta complejidad y baja frecuencia de aplicación. Esta preocupación se ve reflejada en la creciente demanda, por parte de los profesionales, de cursos dirigidos al entrenamiento teórico-práctico en el manejo de las TDE.
Creemos que contar con un modelo docente que simule las características del paciente inestable podría cumplir una doble función: por una parte, capacitar al intensivista para el manejo seguro de las TDE en pacientes críticos y, por otra, hacerlo en el uso de técnicas dirigidas específicamente al paciente séptico y todo esto basado en el manejo de sujetos realmente en situación crítica pero sin riesgo para nuestros pacientes. Nosotros presentamos un modelo de shock séptico que, por sus características, podría ser adecuado para la formación práctica en la aplicación de TDE al paciente inestable.
Material y métodos
Se trata de un estudio experimental realizado en dos fases, una primera sobre todos los animales incluidos en el estudio, a los que se desencadenó un cuadro de shock séptico para definir las características de la provocación del shock (duración, 10min), y una segunda fase (una vez provocado el shock; duración, 6h) en que se separó a los sujetos en dos grupos, uno sin intervención (grupo sepsis), para definir la evolución natural del shock, y otro al que se aplicó HVHF (grupo HVHF) para analizar la rapidez de aparición de la respuesta al tratamiento. El estudio se realizó en un quirófano experimental del Hospital Veterinario de la Universidad de Córdoba y fue controlado por el equipo de anestesia de este centro, e incluía 10 perros Beagle (10 sujetos en la fase de provocación y 5 sujetos en cada grupo en la fase de seguimiento) de entre 12 y 15kg de peso.
Protocolo anestésico: se realizó a los sujetos el procedimiento anestésico habitual en este centro, mediante anestesia con gases, relajación con atracurio y ventilación mecánica dirigida a obtener normocarbia. La única administración de volumen admitida fue una reposición, en los 10 animales, de cloruro sódico a 10ml/kg/h independientemente de la situación clínica de los sujetos y no se aplicó ningún otro tratamiento durante todo el estudio.
Monitorización: se monitorizó a todos los animales con un catéter Picco® insertado en arteria femoral, un catéter de arteria pulmonar insertado en vena yugular, una sonda de tonometría gástrica, una sonda para medición de CO2 espirado, una computadora de cálculo del consumo de O2 y un catéter vesical. A los animales del grupo HVHF se les insertó un catéter de alto flujo (Hospal®) de 12 Fr y 20cm de longitud en la otra vena yugular. En todos los sujetos se registraron cada 15min: presión arterial (PAM), presión venosa (PVC), presión pulmonar (PAP), presión enclavada (PCP), gasto cardíaco continuo (GC), variabilidad del volumen sistólico (VVS) e índice de contractilidad del ventrículo izquierdo (dPMax), y se calcularon las resistencias sistémica (RVS) y pulmonar (RVP); también se monitorizó el consumo de oxígeno (VO2), CO2 end-tidal (CO2-et) y CO2 intramucoso (CO2-i). Se registraron FiO2, volumen tidal (Vol-T), peep y compliance pulmonar. Hemos realizado un total de 256 medidas para cada una de las variables analizadas.
Determinaciones analíticas: en basal, al finalizar la inducción de la sepsis y cada 30min se extrajo sangre para determinar hemograma y gasometría arterial (con cálculo de PaO2/FiO2).
Inducción de la sepsis: con el sujeto anestesiado, monitorizado y en situación estable, se infundía a través de la luz pulmonar del catéter de arteria pulmonar una dosis de 1mg/kg de peso de un preparado de lipopolisacárido ultrapuro de Escherichia coli (cepa 0111:B4) (InvivoGen®) (LPS) en una dilución fija, para todos los animales, de 20ml y a una velocidad de 2ml/min, con una duración total de la infusión de 10min. Todos los sujetos recibieron la dosis completa en el tiempo predeterminado. Tras la inducción, se mantenía un seguimiento de 6h para todos los sujetos (ambos grupos), finalizado el cual se sacrificó a los supervivientes siguiendo las normas del Hospital Veterinario.
El grupo sepsis se siguió sin intervención y en el grupo HVHF se inició el tratamiento tras 15min de finalizar la infusión de LPS.
Protocolo de HVHF: membrana de AN69 de 0,9 m2 en un monitor Prisma®, con flujo de sangre de 130ml/min, dosis de hemofiltración 100ml/kg/h, extracción 0, anticoagulación con heparina no fraccionada a 15 U/kg/h y fluidos con bicarbonato. Para mantener la temperatura se aplicó un calentador externo mediante baño de agua y se aplicaron fuentes de calor al sujeto. El tratamiento se iniciaba tras 15min de finalizar la inducción de la sepsis y en el momento de la conexión se administraba simultáneamente 1ml/kg de hidroxietilalmidón (Voluven®) para compensar la pérdida ocasionada por el volumen del circuito (volumen de cebado aproximado, 80ml).
Aspectos éticos: este trabajo ha sido aprobado por el Comité de Ética e Investigación Clínica del Hospital Veterinario de la Universidad de Córdoba.
Análisis estadístico: el análisis se ha realizado mediante el paquete estadístico SPSS para Windows versión 11. Los datos se muestran como media±error estándar de la media o como porcentaje. Para las comparaciones hemos empleado la U de Mann-Whitney para variables dicotómicas y el test de Kruskal-Wallis cuando las variables tenían más de dos valores posibles, con un nivel de significación para todos los tests de 0,05.
Resultados
En todos los sujetos se provocó un estado de shock severo (caracterizado por un descenso rápido de la PAM y del CG y elevación de la VVS) (Tabla 1) antes de finalizar la infusión de LPS, sin que ninguno falleciera en esta etapa del experimento y siendo evidente el shock en la mayoría de los sujetos entre los 2 y los 5min de iniciada la infusión (Figura 1).
La técnica de HVHF se realizó sin problemas, salvo por coagulación precoz de un único filtro que supuso una pérdida de 15 min de ese tratamiento.
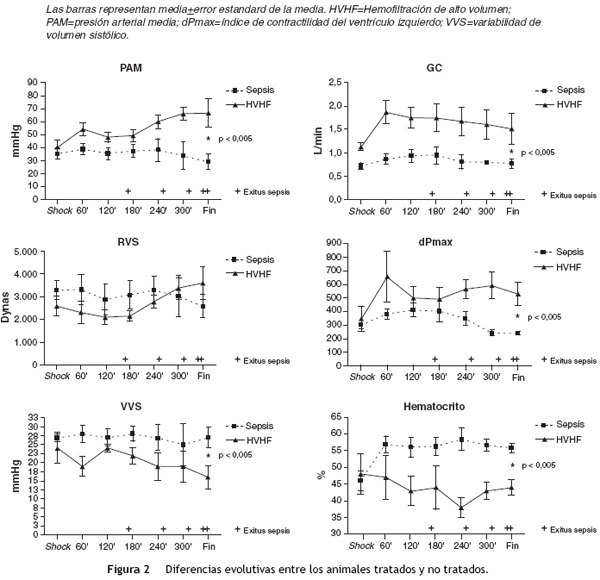
La evolución posterior fue similar durante las primeras 2 h de seguimiento, con mantenimiento de la situación de hipoperfusión (PAM crítica, bajo GC, elevada VVS y descenso del VO2 y CO2-i) (Tabla 2), y a partir de este momento, se evidencia un efecto positivo en la evolución del grupo HVHF, con una mejoría moderada pero progresiva de la TA, el GC, la VVS y las RVS, que se mantiene hasta el final del protocolo; en tanto que en el grupo sepsis la situación de shock severo se mantiene hasta finalizar el seguimiento (Figura 2).
Respecto de la supervivencia, todos los animales del grupo sepsis fallecieron durante el tiempo de seguimiento (uno a los 150min, otro a los 250, un tercero a los 315 y los dos restantes antes de los 360min), con una media de supervivencia de 288±39,5min y todos los del grupo HVHF sobrevivieron este periodo.
Discusión
Presentamos un modelo experimental de shock muy adecuado para su aplicación en talleres de formación en el manejo de las TDE. Se trata de un modelo reproducible, con respuesta muy rápida y bien definida y que permite la supervivencia del animal el tiempo suficiente como para poder detectar cambios secundarios al tratamiento y, por lo tanto, a priori, adecuado para la adquisición de competencias en el manejo del paciente crítico mediante TDE. Aunque el trabajo que presentamos se realizó en condiciones experimentales, era necesario posteriormente probar su aplicabilidad y, por lo tanto, según los resultados presentados, hemos diseñado un modelo de taller basado en el uso de sistemas multimedia para que todos los asistentes puedan seguir de forma continua los cambios evolutivos durante la inducción del shock y, más tarde, en diferentes grupos y ya de presencia física, aplicar la HVHF en un escenario real y seguir su efecto en el tiempo. Este modelo ha sido introducido hasta el momento en cinco ediciones de cursos teórico-prácticos de formación en técnicas de depuración renal (http://www.ccmijesususon.com; www.crrtcordoba.com.es/) y en todos ha mostrado el comportamiento previsto permitiendo alcanzar los objetivos propuestos de forma adecuada. Creemos, además, que este modelo podría ser de utilidad en otros escenarios, como puede ser el entrenamiento en la aplicación de los paquetes de manejo inicial del shock séptico o en la formación en interpretación de monitorización avanzada.
El uso de modelos animales aplicados a la formación en TDE es, de hecho, una realidad en nuestro país tras que, en 1999, apareciera un curso teórico-práctico realizado en el CCMI de Cáceres y basado en talleres en los que se aplican diferentes modalidades de TDE a animales de experimentación. La creciente demanda de asistencia a este tipo de cursos es una prueba de que se consideran necesarios para mantener el entrenamiento de los especialistas que realizan estas técnicas. La posibilidad de simular en estos talleres el manejo de un "paciente" real se verá reforzada al poder enfrentar al intensivista con un sujeto en situación de shock severo que requiere tratamiento de depuración.
Los modelos de experimentación animal han estado ligados de forma íntima al desarrollo de las TDE y de forma más estrecha aún con su aplicación en el proceso séptico, y ya desde el inicio de su uso aparecieron estudios en modelos de sepsis animal que apuntaban a un posible beneficio a corto plazo sobre la hemodinámica y la oxigenación tras el tratamiento con HFC. En 1990, Stein et al11 publicaron un estudio realizado en cerdos de 28 a 32kg a los que provocaron el shock mediante el uso de lipopolisacárido de E. coli (LPS) en infusión continua; iniciaron con 2µg/kg/h y aumentaron la dosis cada 10min hasta conseguir un efecto hemodinámico y respiratorio apreciable (que se demoró casi 2h), momento en que bajaban la dosis a la mitad y la mantenían hasta finalizar el experimento. Simultáneamente habían iniciado un tratamiento de HFC con un recambio de 600ml/h mantenido durante 6h; en ese tiempo encontraron un efecto positivo de la depuración en la hemodinámica de los animales. Sin embargo, este trabajo adolecía de algunos problemas; el más importante fue que el tratamiento se iniciara antes de comenzar la infusión de LPS, con lo que parte de los resultados podían estar artefactados. Por otra parte, el efecto positivo era lento de alcanzar y el shock, no muy pronunciado.
En un corto plazo de tiempo se publicó un nuevo artículo con una novedosa forma de aplicación de la HFC, nos referimos al trabajo publicado por Grootendorst et al12 en 1992. Esos autores provocaron shock en 18 cerdos de 36 a 39kg mediante la infusión de LPS en dosis de 0,5mg/kg en 30min, tras lo que aleatorizaron a los animales para recibir HFAV a dosis de 6 l/h frente a no recibir tratamiento. El shock fue clínicamente evidente en 30min tras el final de la infusión y el efecto positivo del tratamiento se hizo evidente a partir de la segunda hora de experimento. El aspecto más relevante de este trabajo es que sirvió de base para desarrollar el alto volumen tal como se aplica en la actualidad, concretamente la aplicación mediante pulsos de alta dosis y corta duración diseñada por Honore et al13.
El uso de LPS ha sido descrito por otros autores, como Bellomo et al14, en perros de aproximadamente 20kg a los que inyectaban 0,5mg/kg en 5min. Aunque los autores no describen con detalle la provocación de la sepsis, sí detectan un efecto positivo de la HFC a dosis de 1.750ml/h en el grupo tratado, que comenzaba a evidenciarse en unos 30min. Sin embargo, este protocolo presentaba el problema de iniciar el tratamiento antes de infundir el LPS, lo que dificulta la estandarización y comparación del efecto y, por otra parte, este se mantenía tan solo 3h. Resultados similares arrojan otros protocolos basados en dosis similares de HFC y de LPS; de nuevo se observa un inicio relativamente lento del shock, pero un efecto positivo precoz del tratamiento15.
Otra alternativa muy usada en modelos de sepsis y TDE son las bacterias vivas. Concretamente, la infusión de unidades formadoras de colonias de E. coli ha sido el modelo elegido por diferentes autores16,17 pero, aunque más próximo a lo que ocurre en humanos, presenta la importante desventaja de tener un inicio más lento (entre 1 y 6h) y, por lo tanto, ser menos predecible, lo que lo hace menos adecuado para su aplicación en docencia, donde necesitamos una programación más exacta del inicio del efecto.
Probablemente los modelos más adecuados para estudiar los efectos de la sepsis o su tratamiento sean los basados en la provocación de peritonitis, al ser los más parecidos a la enfermedad en humanos. Sin embargo, los múltiples trabajos publicados con este modelo18-20 muestran un inicio de efecto excesivamente retardado, lo que lo hace completamente inoperante en este escenario.
En el escenario de la docencia, existen claras limitaciones de tiempo y horario que exigen poder definir de forma exacta el momento de aparición de la sintomatología (que debe hacerse coincidir con el inicio de la jornada) y, por supuesto, la aparición de cambios importantes debe poder apreciarse en el intervalo de duración de estos, requisitos que no se pueden lograr con los modelos basados en gérmenes vivos (que se han mostrado inoperantes en este contexto), por lo que los modelos basados en el uso de LPS se perfilan como los más adecuados para su aplicación en talleres de adquisición de competencias, aunque en general los trabajos publicados hasta ahora adolecen (aunque no tanto como los basados en gérmenes vivos) de un inicio algo lento. En este aspecto, el modelo publicado por Grootendorst12 es el que más se acercaba a las necesidades que a priori nos habíamos fijado y, finalmente, ha servido de base para el nuestro, con modificaciones orientadas a hacerlo más intenso y precoz.
La inyección de LPS produce un ascenso brusco pero transitorio de citocinas, en tanto que la infección bacteriana produce un ascenso lento pero sostenido, dando lugar a menores elevaciones de proinflamatorios. De hecho, como muestran nuestros datos, el shock en el primer supuesto es hipodinámico y en el segundo (más próximo al humano), hiperdinámico21. Como dato interesante, nosotros encontramos un descenso muy precoz y severo del fluido intravascular con hipovolemia acentuada desde las fases iniciales del shock y, posiblemente, reforzado por la ausencia de reanimación en nuestros sujetos, lo que (con las importantes salvedades descritas) lo hace más próximo al modelo humano.
De cualquier modo, nuestro énfasis estaba no en dibujar un cuadro séptico completamente igual al humano, sino unas alteraciones hemodinámicas definidas y en las que pudiéramos evaluar de forma evidente la repercusión (positiva o negativa) de las TDE sobre estos parámetros alterados y, por otra parte, todo modelo animal de sepsis presentará diferencias en cuanto a tipo de alteración, duración o respuesta intrínseca de la especie animal seleccionada como para permitir considerarlos representativos del proceso de sepsis en humanos22. Contando con esta consideración, no obstante, debemos admitir que es cierto que los modelos basados en el uso de LPS se asemejan menos a lo que ocurre en humanos que los basados en gérmenes, pero las alteraciones hemodinámicas producidas por el LPS son reproducibles y previsibles, permiten seguir la respuesta a los tratamientos y, sobre todo, presentan un tiempo de latencia lo suficientemente corto como para hacerlos útiles en el terreno de la docencia.
Bibliografía
1. Blanco J, Muriel-Bombín A, Sagredo V, Taboada F, Gandía F, Tamayo L, for the Grupo de Estudios y Análisis en Cuidados Intensivos (G.R.E.C.I.A.). Incidence, organ dysfunction and mortality in severe sepsis: a Spanish multicenter study. Critical Care. 2008; 12:R158. [ Links ]
2. Rivers E, Nguyen B, Havstad S, Ressler J, Muzzin A, Knoblich B, et al. Early goal-directed therapy in the treatment of severe sepsis and septic shock. N Engl J Med. 2001; 345:1368-77. [ Links ]
3. Tetta C, Cavaillon JM, Schulze M, Ronco C, Ghezzi PM, Camussi G, et al. Removal of cytokines and activated complement components in an experimental model of continuous plasmafiltration coupled with sorbent adsorption. Nephrol Dial Transplant. 1988; 13:1458-64. [ Links ]
4. Rimmel T, Assadi A, Cattenoz M, Desebbe O, Lambert C, Boselli E, et al. High-volume haemofiltration with a new haemofiltration membrane having enhanced adsorption properties in septic pigs. Nephrol Dial Transplant. 2009; 24:421-7. [ Links ]
5. Haase M, Silvester W, Uchino S, Goldsmith D, Davenport P, Tipping P, et al. A pilot study of high-adsorption hemofiltration in human septic shock. Int J Artif Organs. 2007; 30:108-17. [ Links ]
6. Lonnemann G, Bechstein M, Linnenweber S, Burg M, Koch KM. Tumor necrosis factor-alpha during continuous highflux hemodialysis in sepsis with acute renal failure. Kidney Int. 1999; 72:S84-7. [ Links ]
7. Herrera ME, Seller G, Maynar J, Sánchez-Izquierdo JA, Grupo FRAMI. Epidemiología del FRA en las UCI españolas: Estudio prospectivo multicéntrico FRAMI. Med Intensiva. 2006; 30:260-7. [ Links ]
8. Brivet FG, Kleinknnecht DJ, Loirat P, Landais PJ, the French Study Group on Acute Renal Failure. Acute renal failure in intensive care units. Causes, outcome, and pronostic factors of hospital mortality: A prospective, multicenter study. Crit Care Med. 1996; 24:192-8. [ Links ]
9. Uchino S, Doig G, Bellomo R, Motimatsu H, Morgera S, Schetz M, et al, the Beginning and Ending Supportive Therapy for the Kidney (BEST Kidney) investigators. Diuretics and mortality in acute renal failure. Crit Care Med. 2004; 32:1669-77. [ Links ]
10. Maynar-Moliner J, Sánchez-Izquierdo-Riera JA, Herrera-Gutiérrez M. Renal support in critically ill patients with acute kidney injury. N Engl J Med. 2008; 359:1960. [ Links ]
11. Stein B, Pfenninger E, Griinert A, Schmitz JE, Hudde M. Influence of continuous haemofiltration on haemodynamics and central blood volume in experimental endotoxic shock. Intensive Care Med. 1990; 16:494-9. [ Links ]
12. Grootendorst AF, Van Bommel EEH, Van der Hoven B, Van Leengoed LAMG, Van Osta ALM. High volume hemofiltration improves right ventricular function in endotoxin-induced shock in the pig. Intensive Care Med. 1992; 18:235-40. [ Links ]
13. Honore PM, Jamez J, Wauthier M, Lee PA, Dugernier T, Pirenne B, et al. Prospective evaluation of short-term, high-volume isovolemic hemofiltration on the hemodynamic course and outcome in patients with intractable circulatory failure resulting from septic shock. Crit Care Med. 2000; 28:3581-7. [ Links ]
14. Bellomo R, Kellum JA, Gandhi J, Pinsky MR. The effect of intensive plasma water exchange by hemofiltration on hemodynamics and soluble mediators in canine endotoxemia. Am J Respir Crit Care Med. 2000; 161:1429-36. [ Links ]
15. Ullrich R, Roeder G, Lorber C, Quezado Z, Kneifel W. Continuous venovenous hemofiltration improves arterial oxygenation in endotoxin-induced lung injury in pigs. Anesthesiology. 2001; 95:428-36. [ Links ]
16. Mink SN, Jha P, Wang R, Yang J, Bose D, Jacobs H, et al. Effect of continuous arteriovenous hemofiltration combined with systemic vasopressor therapy on depressed left ventricular contractility and tissue oxygen delivery in canine Escherichia coli sepsis. Anesthesiology. 1995; 83:178-90. [ Links ]
17. Lee P, Weger G, Pryor RW, Matson JR. Effects of filter pore size on efficacy of continuous arteriovenous hemofiltration therapy for Staphylococcus aureus-induced septicemia in immature swine. Crit Care Med. 1998; 26:730-7. [ Links ]
18. Yekebas EF, Eisenberger CF, Ohnesorge H, Saalmüller A, Elsner HA, Engelhardt M, et al. Attenuation of sepsis-related immunoparalysis by continuous venovenous hemofiltration in experimental porcine pancreatitis. Crit Care Med. 2001; 29:1423-30. [ Links ]
19. Rogiers P, Sun Q, Dimopoulos G, Tu Z, Pauwels D. Blood warming during hemofiltration can improve hemodynamics and outcome in ovine septic shock. Anesthesiology. 2006; 104:1216-22. [ Links ]
20. Sykora R, Chvojka J, Krouzecky A, Radej J, Karvunidis T, Varnerova V. High versus standard-volume haemofiltration in hyperdynamic porcine peritonitis: effects beyond haemodynamics?. Intensive Care Med. 2009; 35:371-80. [ Links ]
21. Buras JA, Holzmann B, Sitkovsky M. Animal models of sepsis: Setting the stage. Nat Rev Drug Discov. 2005; 4:854-65. [ Links ]
22. Dyson A, Singer M. Animal models of sepsis: Why does preclinical efficacy fail to translate to the clinical setting?. Crit Care Med. 2009; 37(Suppl):S30-7. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
mehguci@gmail.com
(M.E. Herrera-Gutiérrez)
Recibido 3 Junio 2010
Aceptado 18 Diciembre 2010