My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Medicina Intensiva
Print version ISSN 0210-5691
Med. Intensiva vol.36 n.5 Jun./Jul. 2012
Estudio ECAIS: eventos cardiovasculares adversos inadvertidos en sepsis
Ecais study: inadvertent cardiovascular adverse events in sepsis
M. Gómez Duquea, C. Enciso Oliverab, E. Peña Torresc, O.D. Segura Duránd y V.H. Nieto Estradae
aComité de Ética en Investigación, CEISH, Hospital Universitario de San José, Bogotá, Colombia
bUnidad de Cuidados Intensivos, Hospital Universitario Infantil de San José, Bogotá, Colombia
cDivisión en Investigaciones, Fundación Universitaria de Ciencias de la Salud, Bogotá, Colombia
dFundación Universitaria de Ciencias de la Salud, Bogotá, Colombia
eUnidad de Medicina Crítica y Cuidados Intensivos, Hospital Universitario de San José, Bogotá, Colombia
Dirección para correspondencia
RESUMEN
Objetivo: Describir la incidencia de eventos cardiovasculares adversos en pacientes con diagnóstico de sepsis en sus diferentes estadios.
Diseño: Estudio observacional, descriptivo, longitudinal.
Ámbito: Unidades de cuidados intensivos de tipo mixto de dos hospitales universitarios en la ciudad de Bogotá.
Participantes: Se incluyeron una serie de pacientes mayores de edad, que ingresan a UCI con diagnostico de sepsis, sin evidencia de lesión miocárdica isquémica previa.
Intervenciones: Registros electrocardiográficos continuos de 12 derivaciones durante 48 horas con monitoría Holter
Variables de interés: Isquemia, arritmia cardiaca, variabilidad de la frecuencia cardiaca.
Resultados: Se analizaron 100 pacientes, 62% de los cuales se estadificó como choque séptico. El 3% presentó evento cardiovascular adverso de tipo isquémico detectado por Holter y desapercibido por monitoreo convencional. El 46% presentaron un evento de tipo arrítmico por Holter, comparado con solo un 6% detectado por monitoreo convencional. La mortalidad cruda fue de 40%. El 100% presentó pérdida de la variabilidad de la frecuencia cardiaca.
Conclusión: La sepsis en esta experiencia mostró una baja incidencia de eventos cardiovasculares isquémicos. Los eventos arrítmicos, sin embargo, mostraron una incidencia alta. El monitoreo convencional falló en detectar la totalidad de los eventos isquémicos y en mayor proporción los eventos arrítmicos. En esta serie, los eventos cardiovasculares generados por descarga adrenérgica no impactan en la mortalidad.
Palabras clave: Isquemia miocárdica. Electrocardiografía ambulatoria. Sepsis. Choque séptico.
ABSTRACT
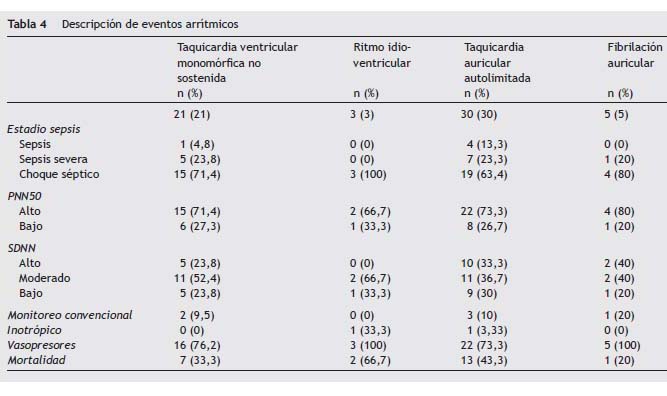
Objective: To describe the incidence of cardiovascular adverse events in patients with sepsis in its various stages. Key words: Myocardial ischemia. Ambulatory electrocardiography. Sepsis. Septic shock. Introducción La incidencia de la sepsis ha aumentado en los últimos años como consecuencia de diferentes factores1. Es la principal causa de mortalidad en pacientes críticamente enfermos no coronarios con una tasa entre 19,6 y 59%2,3. La mortalidad es atribuida a la falla de diferentes órganos, entre los cuales el sistema cardiovascular es objeto de interés4. La patogénesis de la disfunción miocárdica por sepsis es multifactorial, en donde se incluye la isquemia5,6. Se describe un aumento en el flujo coronario, pero algunas áreas presentan déficit regional de oxígeno, describiendo un fenómeno similar al de la hibernación miocárdica7. La alteración en el flujo capilar y en la homeostasis de la coagulación son consideradas como las bases de este proceso8,9. Por tanto, la disfunción miocárdica no puede atribuirse a un fenómeno de isquemia miocárdica generalizada10,11. Otros elementos alteran la función ventricular en la sepsis, entre los cuales se destacan las interleuquinas12, el factor de necrosis tumoral y un factor humoral circulante específico, probablemente de origen pancreático13. El comportamiento clínico inicial se relaciona con la pérdida del tono vascular, una fase hiperdinámica con elevación del gasto cardiaco. Posteriormente hay depresión del miocardio con alteraciones de la contractilidad14, trastornos en la relajación, taquicardia15 y dilatación de las cavidades cardiacas16. No hay un perfil arritmogénico típico, sin embargo, la respuesta inflamatoria sistémica, independiente de su etiología, es arritmogénica17. Se altera el equilibrio en el control autonómico de la función cardiaca, desarrollando un estado de cronotropismo incompetente que reduce la variabilidad de la frecuencia cardiaca18. Al control parasimpático se le atribuye un efecto antiinflamatorio mediado por la atenuación de la producción de factor de necrosis tumoral-α esplácnico18. Finalmente la frecuencia cardiaca elevada aumenta el stress miocárdico y la demanda de oxígeno19. Dentro de la práctica clínica, el monitoreo cardiovascular constituye la base para la toma de gran parte de las decisiones clínicas20. Hasta el momento ningún elemento técnico cumple todos los requisitos que describen a un monitor ideal21. En el caso específico de la isquemia miocárdica, el monitoreo básico no cumple con las características operativas para el diagnóstico de un evento agudo22. Considerando una alta probabilidad de isquemia desapercibida en el miocardio del paciente séptico planteamos un seguimiento estrecho de la electrocardiografía en estos pacientes. Materiales y métodos Se diseñó un estudio observacional, longitudinal, descriptivo, la información fue recolectada a partir del registro Holter de 48 horas como fuente primaria. Población y muestra Se incluyeron pacientes mayores de 18 años con diagnóstico de sepsis, que ingresaron a la unidad de cuidados intensivos dentro de las primeras 24 horas de inicio de las manifestaciones clínicas. En un período de 18 meses comprendido entre julio del 2009 y octubre de 2010, que requirieron soporte cardiovascular o ventilatorio. Como criterios de exclusión se definieron las características clínicas o electrocardiográficas que dificultaran la interpretación del Holter o hicieran diagnóstico de enfermedad coronaria. El registro Holter se realizó con un equipo Cardiovex MMC10L de 3 canales de electrocardiografía, iniciando en las primeras 6 horas del ingreso y hasta completar 48 horas. La interpretación de los trazados se realizó por 1 de 2 cardiólogos de acuerdo a una asignación aleatoria y bajo los parámetros de los consensos actuales23,24. Se consideraba como evento cardiovascular adverso a la isquemia miocárdica las arritmias y la pérdida de variabilidad de la frecuencia cardiaca. La detección de la isquemia se basó en el análisis del segmento ST. Para la evaluación de la variabilidad de la frecuencia cardiaca se utilizaron los índices estadísticos desviación estándar de los intervalos RR (SDNN) y porcentaje de intervalos, que difieren por más de 50ms del intervalo precedente (PNN50) por la relación con la actividad simpática y parasimpática, respectivamente25,26 Estos índices han sido utilizados para la predicción del riesgo de mortalidad post infarto, un SDNN menor de 50ms y un PNN50 menor de 3% identifican a pacientes con una disminución severa de la variabilidad de la frecuencia cardiaca26, en la Tabla 1 se muestra esta categorización. El monitoreo cardiaco convencional se llevó a cabo por medio del visoscopio obteniendo registro de 1 a 2 canales. Análisis estadístico Se utilizó el programa estadístico STATA SE V. 10.1, se realizó un análisis descriptivo de los datos a través de frecuencias absolutas y porcentajes para las variables categóricas y medidas de tendencia central y de dispersión para las variables cuantitativas. Se realizó un análisis de correspondencias múltiples con SPAD 7.0, la variable ilustrativa fue el estadio de la sepsis y las variables activas, los eventos cardiovasculares adversos. Aspectos éticos Este estudio fue aprobado por el Comité de Ética de las instituciones participantes y valorado como de riesgo mínimo bajo la normatividad vigente27. Se solicitó consentimiento informado a la totalidad de pacientes participantes. Resultados Ciento treinta pacientes adultos elegibles ingresaron desde el mes de julio del 2009 hasta el mes de octubre de 2010 con diagnóstico de sepsis y requerimiento de soporte cardiovascular y/o ventilatorio, que cumplían criterios de selección, de los cuales fueron excluidos 30 pacientes por mala calidad del dato. Se caracterizó la población general y agrupada por estadificación de la sepsis. El 10% de los pacientes ingresó con diagnóstico de sepsis, el 28% con diagnóstico de sepsis severa y el 62% con choque séptico, definiendo esta categoría no solo por el uso de vasopresores, sino también por presencia de manifestaciones clínicas de hipoperfusión tisular. La edad mediana general fue 55±26 años con un rango de 18 a 88 años. La relación hombre: mujer fue 1,38: 1. La admisión por causa médica fue ligeramente superior en la población general con un 53%. Esta tendencia se mantuvo en el grupo de pacientes con sepsis y sepsis severa, pero en el grupo de choque séptico predominaron los pacientes quirúrgicos (56,5%). En los factores de riesgo cardiovasculares encontrados predominó la hipertensión arterial con un 33%, seguida de edad mayor de 65 años con un 24%, obesidad 18% y diabetes mellitus 12%. La mediana del puntaje de gravedad APACHE fue 16,5±10 en el análisis de todos los pacientes y en el grupo de choque séptico fue de 18±9. El foco séptico más frecuente fue el pulmonar con un 38%, en el subgrupo de pacientes con choque séptico las infecciones de la cavidad abdominal predominaron con un 41,9% (Tabla 2). El 72% de los pacientes requirió vasopresores, el 7% inotrópicos y el 45% requirió monitorización del gasto cardiaco, el cual se llevó a cabo mediante tecnología Vigileo®, se encontró un perfil hipodinámico con un valor promedio de índice de volumen sistólico (IVS) de 32cc por latido y variabilidad del volumen sistólico (VVS) promedio de 10%. El monitoreo convencional no detectó ningún evento de isquemia y las arritmias se detectaron en un 6%. El análisis del Holter determinó la presencia de isquemia en 3 pacientes (Tabla 3). Los eventos arrítmicos se detectaron por Holter en el 46% de la población, clasificándolos de acuerdo a su origen en: taquicardia ventricular monomórfica (21%), ritmo idioventricular (3%), taquicardia auricular (30%) y fibrilación auricular (5%), encontrando una mayor frecuencia de arritmias en los pacientes con choque séptico y en los pacientes con mayor pérdida de la variabilidad de la frecuencia cardiaca (Tabla 4). La mortalidad general fue del 40%, 1 de los 3 pacientes con diagnóstico de isquemia falleció, en los pacientes con eventos arrítmicos la mortalidad fue de 40,1%. La pérdida de la variabilidad de la frecuencia cardiaca fue menor en la categoría sepsis con medianas para SDNN de 81,5ms y PNN50 de 1,5% frente a un valor de SDNN de 68ms y PNN50 de 0% en la categoría choque séptico (Tabla 5). En los pacientes que recibieron vasopresores el SDNN tuvo una mediana de 68±46,5 y en los que recibieron inotrópicos de 61±87, la mediana del SDNN en los pacientes en quienes no se administró inotrópicos ni vasopresores fue mayor. En el grupo de sobrevivientes, la mediana de SDNN fue de 72,5±42 en comparación con los que fallecieron con 61±45. Se aplicó la categorización de riesgo de mortalidad usada en pacientes coronarios a esta población, encontrando en la categoría de alto riesgo por PNN50 una proporción del 76%, entre los cuales la mortalidad fue del 44,7%. Según el SDNN la población se distribuye en un 78% en los grupos de riesgo moderado y alto, con mortalidad del 51,9% en el grupo de alto riesgo (Tabla 6). En el análisis de correspondencias múltiples, tomando como variable ilustrativa la clasificación del estadio de la sepsis y como variables activas, la presencia de eventos isquémicos, los eventos arrítmicos, la variabilidad de la frecuencia cardiaca, la mortalidad y el uso de vasoactivos, se encontró que el choque séptico se relaciona con mayor pérdida de la variabilidad de la frecuencia cardiaca, más arritmias y mayor mortalidad. Los eventos isquémicos no se relacionan con la variable ilustrativa (Figura 1). Discusión Se evaluó la incidencia de eventos isquémicos al obtener un registro de 4.800 horas de monitoreo por tecnología Holter, observando un valor poco significativo y que no parece ser el evento cardiovascular primario inducido por la sepsis28. La activación de la respuesta inflamatoria sistémica es la causa de las principales manifestaciones de la sepsis29,30, la evidencia acumulada sugiere que la inflamación no controlada puede desencadenar isquemia miocárdica en coronarias previamente enfermas31-33 y puede deprimir la función ventricular desde el comienzo de la sepsis34. Durante la observación no se demostró que la isquemia corresponda al principal evento fisiopatológico relacionado con la disfunción ventricular, pero la presencia de eventos arrítmicos y la pérdida de la variabilidad de la frecuencia cardiaca aparecen como elementos importantes, al considerarlos eventos cardiovasculares inadvertidos y que se relacionan con el disbalance entre la actividad simpática y parasimpática35. Reconocemos como desventajas del estudio la naturaleza descriptiva del diseño que se planteó, debido al escaso piso teórico sobre el cual sustentar un estudio analítico. Los pacientes que sufrieron eventos isquémicos pasaron inadvertidos al monitoreo convencional y el diagnóstico se realizó por monitoreo Holter, los eventos fueron transitorios y ninguno ameritó estratificación invasiva. Esta baja incidencia de eventos isquémicos concuerda con los reportes de Cunnion y Schaer10, quienes describieron un flujo coronario normal o aumentado en 4 de 7 pacientes sépticos con depresión miocárdica y con Dhainaut y Huyghebaert, quienes reportan isquemia miocárdica en 6 de 40 pacientes sépticos por producción miocárdica de lactato, pero aclaran que el lactato es un mal indicador de isquemia miocárdica11. Las arritmias estuvieron presentes en cerca del 50% de pacientes, con mayor número de casos en la estadificación de choque, diagnosticadas casi en su totalidad durante el monitoreo Holter y caracterizada como taquicardia auricular, fibrilación auricular, taquicardia ventricular y ritmo idioventricular. Ninguno de estos eventos fue sostenido. La variabilidad de la frecuencia cardiaca (VFC) revela el equilibrio en el control del sistema nervioso autónomo en la función del corazón18, se han descrito muchos usos de esta medición26. En sepsis, esta descrito que hay pérdida de la variabilidad de la frecuencia cardiaca y este fenómeno se asocia a desenlaces desfavorables36. Esta es la primera serie con 100 pacientes, donde se demuestra pérdida de la variabilidad de la frecuencia cardiaca (VFC) evaluada por los índices estadísticos, SDNN y PNN50, los cuales se asocian a hiperactividad simpática y a pérdida del control parasimpático, respectivamente, fenómeno encontrado en la cardiomiopatía séptica35. No existe validación para el uso de la escala de estratificación de riesgo postinfarto con VFC en pacientes sépticos. Se utilizó con la intención de agrupar los datos de estos índices en la población. Encontrando una mayor distribución en las categorías de alto riesgo. Las medianas más altas de SDNN y PNN50 en la categoría de sepsis sugieren menor pérdida de la VFC. Los pacientes fallecidos mostraron mayor pérdida de la variabilidad, este hallazgo concuerda con Chen y Kuo37, quienes demostraron la capacidad predictiva de la VFC en la mortalidad hospitalaria en pacientes con sepsis37. El uso de inotrópicos y vasopresores obedeció a protocolos de reanimación actuales38, estos pacientes mostraron mayor pérdida de la VFC. La utilización de inotrópicos fue baja, aun reconociendo que en fases avanzadas la cardiomiopatía séptica es un estado de depresión miocárdica. Con esta consideración en mente, se analizó el perfil hemodinámico en 26 pacientes a quienes se les realizó monitoreo del gasto cardiaco paralelo al registro Holter. La técnica empleada fue análisis del contorno de la onda de pulso por sistema Vigileo®, acumularon 100 horas de monitoreo, se reveló unos valores promedios para IVS de 32 y VVS de 10, esto concuerda con el fenómeno de depresión miocárdica, descrito y confirmado desde la descripción de Parrillo39. Observamos que en nuestro grupo de pacientes el comportamiento cardiovascular relacionado con la sepsis no es diferente de las descripciones previas, descartando que la isquemia del miocardio sea significativa dentro de la cardiomiopatía séptica, lo que hace más factible el efecto de los factores humorales depresores del miocardio. De otro lado, la incidencia de eventos arrítmicos y la pérdida de la variabilidad de la frecuencia cardiaca ameritan toda la atención representando los verdaderos eventos cardiovasculares inadvertidos en sepsis, abriendo un nuevo campo de investigación para establecer el beneficio de diferentes terapias, para intervenir sobre la actividad simpática. Se hace necesaria la realización de nuevos estudios con grupos de control para comparar el fenómeno de pérdida de variabilidad de la frecuencia cardiaca que hemos encontrado en el paciente séptico con otras patologías prevalentes en la unidad de cuidados intensivos. Se hace necesario mejorar las técnicas de monitoreo continuo y considerar en pacientes de riesgo modificaciones de las técnicas de electrocardiografía convencional o monitorear la contractilidad de manera más estrecha, ante la limitación del monitoreo cardiaco convencional para diagnosticar eventos cardiovasculares en el paciente séptico. Conflicto de intereses Los autores declaran no tener ningún conflicto de intereses. Bibliografía 1. Dombrovskiy VY, Martin AA, Sunderram J, Paz HL. Rapid increase in hospitalization and mortality rates for severe sepsis in the United States: a trend analysis from 1993 to 2003. Crit Care Med. 2007; 35:1244-50. [ Links ] 2. Angus DC. Epidemiology of severe sepsis in the United States: Analysis of incidence, outcome, and associated costs of care. Crit Care Med. 2001; 29:1303-10. [ Links ] 3. Kauss IA, Grion CM, Cardoso LT. The epidemiology of sepsis in a Brazilian teaching hospital. Braz J Infect Dis. 2010; 14:264-70. [ Links ] 4. Sharma AC. Sepsis-induced myocardial dysfunction. Shock. 2007; 28:265-9. [ Links ] 5. Rudiger A, Singer M. Mechanisms of sepsis-induced cardiac dysfunction. Crit Care Med. 2007; 36:1599-608. [ Links ] 6. Zanotti-Cavazzoni S. Cardiac dysfunction in severe sepsis and septic shock. Curr Opin Crit Care. 2009; 15:392-7. [ Links ] 7. Levy RJ, Piel DA, Acton PD, Zhou R, Ferrari VA, Karp JS, et al. Evidence of myocardial hibernation in the septic heart. Crit Care Med. 2005; 33:2752-6. [ Links ] 8. Schlag G, Redl H. Mediators of injury and inflammation. World J Surg. 1996; 20:406-10. [ Links ] 9. Levi M, Van der Poll T. Inflammation and coagulation. Cri. Care Med. 2010; 38(Suppl):S26-34. [ Links ] 10. Cunnion R, Schaer G. The coronary circulation in human septic shock. Circulation. 1986; 73:637-44. [ Links ] 11. Dhainaut J, Huyghebaert M. Coronary hemodynamics and myocardial metabolism of lactate, free fatty acids, glucose and ketons in patients with septic shock. Circulation. 1987; 75:533-41. [ Links ] 12. Flynn A, Chokkalingam B. Sepsis-induced cardiomyopathy: A review of pathophysiologic mechanisms. Heart Fail Rev. 2010; 15:605-11. [ Links ] 13. Fernández CJ, Akamine N, Knobel E. Myocardial depression in sepsis. Shock. 2008; 30(Suppl 1):14-7. [ Links ] 14. Cohen RI. Sepsis-induced left ventricular dysfunction: Little time to relax. Crit Care Med. 2008; 36:999-1000. [ Links ] 15. Werdan K, Oelke A. Myocardial depression or septic cardiomyopathy. En: Vincent JL, editor. Intensive care medicine. Annual update 2009. Heidelberg: Springer; 2009; cap. 5. p. 183-218. [ Links ] 16. Bouhemad B, Nicolas-Robin A, Arbelot C, Arthaud M, Féger F. Acute left ventricular dilatation and shock-induced myocardial dysfunction. Crit Care Med. 2009; 37:441-7. [ Links ] 17. Muller-Werdan U, Buenke M. Septic cardiomyopathy- a not yet discovered cardiomyopathy?. Exp Clin Cardiol. 2006; 11:226-36. [ Links ] 18. Werdan K, Schmidt H. Impaired regulation of cardiac function in sepsis, SIRS, and MODS. Can J Physiol Pharmacol. 2009; 87:266-74. [ Links ] 19. Merx MW, Weber C. Sepsis and the heart. Circulation. 2007; 116:793-802. [ Links ] 20. Boldt J. Hemodynamic monitoring in the intensive care unit. Crit Care. 2002; 6:52-9. [ Links ] 21. Chanoy JC, Derdak S. Minimally invasive hemodynamic monitoring for the intensivist, current and emerging technology. Crit Care Med. 2002; 30:2338-45. [ Links ] 22. Devereaux PJ, Goldman L, Cook DJ, Gilbert K, Leslie K, Guyatt GH. Perioperative cardiac events in patients undergoing noncardiac surgery: a review of the magnitude of the problem, the pathophysiology of the events and methods to estimate and communicate risk. CMAJ. 2005; 173:627-34. [ Links ] 23. Goodman S, Menon V, Cannon CP. Acute ST-segment elevation myocardial infraction: Physicians Evidence-Based Clinical Practice, 8th edition. Chest. 2008;133:708S-75S. [ Links ] 24. ACC/AHA 2007 guidelines for the management of patients with unstable angina/non ST- elevation myocardial infraction. Circulation. 2007;116:e148-e304. [ Links ] 25. American Heart Association Inc. European Society of Cardiology. guidelines. Heart rate variability Standards of measurement, physiological interpretation, and clinical use. Eur Heart J. 1996; 17:354-81. [ Links ] 26. De la Cruz B, López C, Naranjo J. Analysis of heart rate at rest and during exercise: A study in healthy people and cardiac patients. Br J Sports Med. 2008; 42:715-20. [ Links ] 27. Resolución No 008430 de 1993 - Ministerio de Salud [actualizado Nov 2010]. Disponible en: http://www.ins.gov.co/index.php?idcategoria=1395#. [ Links ] 28. Abraham E, Singer M. Mechanisms of sepsis-induced organ dysfunction. Crit Care Med. 2007; 10:2408-16. [ Links ] 29. Schouten M, Joost W, Levi M, Van der Poll T. Inflammation, endothelium, and coagulation in sepsis. J Leukoc Biol. 2008; 83:536-46. [ Links ] 30. Cinel I, Opal S. Molecular biology of inflammation and sepsis: A primer. Crit Care Med. 2009; 37:291-304. [ Links ] 31. Madjid M. Acute infections, vaccination and prevention of cardiovascular disease. CMAJ. 2008; 179:749-50. [ Links ] 32. Smeeth L, Thomas S, Hall A, Hubbard R, Farrington P, Vallance P. Risk of Myocardial Infarction and Stroke after Acute Infection or vaccination. N Engl J Med. 2004; 361:2611-8. [ Links ] 33. Musher D, Rueda A, Kaka A, Mapara S. The Association between Pneumococcal Pneumonia and Acute Cardiac Events. CID. 2007; 45:158-66. [ Links ] 34. Poelaert J, Declerck C, Vogelaers D. Left ventricular systolic and diastolic function in septic shock. Intensive Care Med. 1997; 23:553-60. [ Links ] 35. Annane D, Trabold F, Sharshar T. Inappropriate Sympathetic Activation at Onset of Septic Shock A Spectral Analysis Approach. Am J Respir Crit Care Med. 1999; 160:458-65. [ Links ] 36. Chen WL, Kuo C. Characteristics of Heart Rate Variability Can Predict Impending Septic Shock in Emergency Department Patients with Sepsis. Acad Emerg Med. 2007; 14:392-7. [ Links ] 37. Chen W, Chen J, Huang C, Kuo C. Heart rate variability measures as predictors of in-hospital mortality in ED patients with sepsis. Am J Emerg Med. 2008; 26:395-401. [ Links ] 38. Rivers E, Nguyen B, Havstad S, Ressler J, Muzzin A, Knoblich B, et al. Early goal-directed therapy in the treatment of severe sepsis and septic shock. N Engl J Med. 2001; 345:1368-78. [ Links ] 39. Court O, Kumar A, Parrillo J. Myocardial depression in sepsis and septic shock. Crit Care. 2002; 6:500-8. [ Links ] Recibido 31 Mayo 2011
Design: A longitudinal, descriptive, observational study was carried out.
Setting: Intensive care units of two university hospitals in Bogotá (Colombia).
Patients: A number of patients consecutively admitted to the adult ICU with a diagnosis of sepsis, and no evidence of previous ischemic myocardial injury.
Interventions: Forty-eight hours of electrocardiographic record using Holter technology.
Main variables: Ischemia, cardiac arrhythmia, heart rate variability.
Results: A total of 100 patients were analyzed, 62% being staged as presenting septic shock. Three percent suffered ischemic events detected by Holter and unnoticed through conventional monitoring. Forty-six percent suffered an arrhythmic event detected by Holter, compared with only 6% as detected by conventional monitoring. Mortality was 40%. All patients showed loss of heart rate variability.
Conclusion: In this study patients with sepsis showed a low incidence of cardiovascular ischemic events. In contrast, arrhythmic events showed a high incidence. Conventional monitoring failed to detect any of the ischemic events and most arrhythmic events. In this study, cardiovascular events generated by adrenergic discharge had no impact upon mortality.

Figura 1. Plano factorial de caracterización de la sepsis y eventos cardiovasculares.![]() Dirección para correspondencia:
Dirección para correspondencia:
victorhugonieto@aol.com
(V.H. Nieto Estrada).
Aceptado 10 Noviembre 2011