My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Medicina Intensiva
Print version ISSN 0210-5691
Med. Intensiva vol.36 n.5 Jun./Jul. 2012
PUESTA AL DÍA EN MEDICINA INTENSIVA. MONITORIZACIÓN HEMODINÁMICA EN EL PACIENTE CRÍTICO
Evaluación de la contractilidad y la poscarga en la unidad de cuidados intensivos
Evaluation of contractility and postloading in the intensive care unit
A. Ochagavíaa, L. Zapatab, A. Carrilloc, A. Rodríguezc, M. Guerrerod y J.M. Ayuelae
aServicio de Medicina Intensiva, Hospital de Sabadell, CIBER Enfermedades Respiratorias, Institut Universitari Parc Tauli, UAB, Sabadell, Barcelona, España
bServicio de Medicina Intensiva, Hospital de la Santa Creu i Sant Pau, Barcelona, España
cServicio de Medicina Intensiva, Unidad Coronaria, Hospital Universitario Son Espases, Palma de Mallorca, España
dServicio de Medicina Intensiva, Hospital de Valme, Sevilla, España
eServicio de Medicina Intensiva, Hospital General Yagüe, Burgos, España
Dirección para correspondencia
RESUMEN
La inestabilidad hemodinámica y la insuficiencia cardíaca son causas frecuentes de ingreso en la unidad de cuidados intensivos. El estudio de los determinantes de la función cardiovascular, fundamentalmente precarga, poscarga y contractilidad adquieren una importancia crucial en estas situaciones.
En este capítulo, se revisarán los conceptos de contractilidad y poscarga, así como sus métodos de evaluación. La tecnología disponible nos permite la combinación de varias técnicas diferentes de monitorización hemodinámica que aportan una información o un enfoque distinto sobre el mismo problema y nos ayudan a evaluar de una manera más precisa las alteraciones de la contractilidad y la poscarga. Esta información es útil para tomar decisiones diagnósticas y terapéuticas que ayuden a mejorar el pronóstico de los pacientes críticos.
Palabras clave: Contractilidad. Poscarga. Paciente crítico.
ABSTRACT
Cardiovascular failure is a common disorder in critical care medicine. When admitted to the ICU, patients with hemodynamic deterioration should be examined rapidly to correctly assess the main determinants of cardiovascular function (preload, afterload and contractility).
This review examines the assessment of contractility and afterload involving the combined use of several hemodynamic monitors, which allows different approaches to the same problem, with a view to improving the efficiency of management and treatment in critically ill patients.
Key words: Contractility. Afterload. Critically ill patient.
Introducción
La inestabilidad hemodinámica y la insuficiencia cardíaca son 2 causas frecuentes de ingreso en la unidad de cuidados intensivos (UCI). Por este motivo, el estudio de los determinantes de la función cardiovascular, fundamentalmente las condiciones de carga (precarga y poscarga) y la contractilidad, adquieren una importancia crucial para poder tomar decisiones diagnósticas y terapéuticas que ayuden a mejorar el pronóstico de nuestros pacientes. En este capítulo, se revisarán los conceptos de contractilidad y poscarga, así como sus métodos de evaluación en la UCI. La valoración de la precarga y la respuesta al aporte de volumen ha sido tratada en otro capítulo de esta serie de puesta al día en monitorización hemodinámica.
Los pacientes críticos pueden desarrollar disfunción cardíaca secundaria a numerosos procesos como son la cardiopatía isquémica o el shock séptico. Además, los tratamientos farmacológicos instaurados y las estrategias ventilatorias utilizadas en estos pacientes pueden desencadenar también insuficiencia cardíaca. Los índices de contractilidad deberían evaluar la capacidad del corazón para producir trabajo y deberían ser independientes de la precarga y la poscarga. Los parámetros tradicionales como el volumen sistólico, el gasto cardíaco y la fracción de eyección son útiles en la práctica clínica para la valoración hemodinámica global pero son muy dependientes de las condiciones de carga.
En los últimos años, se han propuesto diversos índices para evaluar la contractilidad miocárdica. Aunque la ecocardiografía 2D y Doppler puede sugerir un defecto de la función contráctil del corazón, su interpretación puede estar dificultada por la interferencia de las condiciones de pre o poscarga. La tecnología disponible actualmente nos permite la combinación de diferentes técnicas de monitorización hemodinámica que aportan una información o un enfoque distinto sobre el mismo problema y nos ayudan a evaluar de una manera más precisa las alteraciones de la contractilidad que pueden estar presentes en los pacientes críticos.
Por otro lado, un incremento de la poscarga puede producir inestabilidad hemodinámica en pacientes con valvulopatías o miocardiopatías y, por el contrario, un descenso de la poscarga en situaciones como la sepsis puede originar una situación de hipoperfusión tisular grave. La monitorización clásica, además de los nuevos sistemas de monitorización hemodinámica y la ecocardiografía, nos proporcionan información sobre la poscarga ventricular.
Contractilidad. Índices basados en la relación presión-volumen ventricular
La contractilidad puede ser definida como la capacidad del corazón para generar trabajo externo con independencia de la precarga y la poscarga. La disfunción cardíaca está principalmente originada por un fallo de bomba ventricular que no proporciona suficiente energía hidráulica para mantener una circulación efectiva1-3
Los cambios en la contractilidad ventricular están causados por mecanismos celulares intrínsecos que regulan la interacción entre actina y miosina independientemente de los cambios en la longitud del sarcómero. Por este motivo, un índice de contractilidad o inotropismo miocárdico debería evaluar la capacidad del corazón para producir trabajo y debería ser independiente de las condiciones de carga. La mayoría de los índices disponibles a nivel experimental o clínico son parcialmente dependientes de la precarga o de la poscarga, lo que puede ocasionar que la evaluación de la contractilidad sea difícil.
Índices basados en la relación presión-volumen ventricular: las curvas presión-volumen ventricular son generadas relacionando la presión ventricular con el volumen ventricular durante un ciclo cardíaco completo y constituyen una buena herramienta para analizar la función ventricular (Figura 1). La pendiente de la relación presión-volumen ventricular al final de la sístole, denominada elastancia telesistólica (Ees) es considerada como el índice de referencia de contractilidad debido a su relativa independencia de las condiciones de carga y su sensibilidad a los cambios de inotropismo. Otros parámetros derivados de la curva presión-volumen, como son la relación entre trabajo sistólico (stroke work, SW) - volumen telediastólico ventricular y la relación entre el máximo índice de cambio de presión ventricular (dP/dt max) - volumen telediastólico ventricular, también han demostrado ser buenos estimadores de la contractilidad4-7.
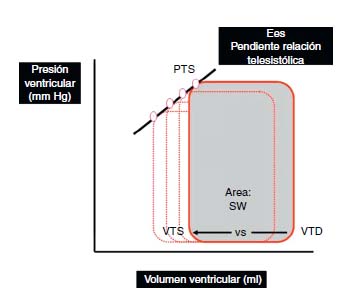
Figura 1. Bucle de presión volumen ventricular durante un ciclo cardíaco.
El VS es la diferencia entre el VTD y VTS. El área debajo de la curva representa el SW.
La Ees es la pendiente de la relación telesistólica de los diferentes bucles generados
en varios ciclos cardíacos. Ees: elastancia telesistólica; PTS: presión ventricular telesistólica;
SW: stroke work, trabajo sistólico; VS: volumen sistólico; VTD: volumen telediastólico;
VTS: volumen telesistólico.
La determinación de la Ees requiere generar diferentes bucles de la relación presión-volumen mediante reducción de precarga (oclusión de la vena cava inferior, tratamiento con nitroprusiato) o bien con incremento de poscarga (administración de vasopresores) (Figura 2). La generación de datos completos sistólicos y diastólicos precisa instrumentación invasiva del ventrículo izquierdo para estimación simultánea de medidas de presión y volumen lo que dificulta la determinación clínica de los índices derivados de la relación presión-volumen5,6.

Figura 2. Ejemplo de serie de bucles presión-volumen en
un modelo animal obtenido con oclusión progresiva de la vena cava inferior.
Ees: elastancia telesistólica.
La utilización de la ecocardiografía con detección automática de los bordes podría facilitar la determinación de la Ees puesto que permite la determinación semiautomática del área del ventrículo izquierdo. En consecuencia, los cambios de la presión arterial o presión ventricular invasiva junto a los cambios del área del ventrículo izquierdo podrían ser utilizados para generar bucles presión-área y así obtener la Ees casi on-line8,9 (Figura 3). Además, la reducción de la precarga con el uso de CPAP 5mm Hg, técnica rutinaria utilizada frecuentemente en la UCI, podría ser equivalente a la oclusión de la vena cava inferior según un estudio reciente de experimentación animal aunque no existe suficiente evidencia clínica para poder ser aplicada sistemáticamente10.
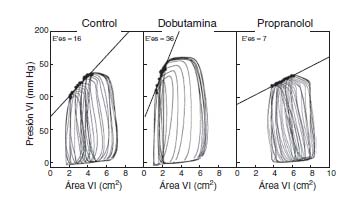
Figura 3. Ejemplos de diferentes bucles presión-área que demuestran
un incremento de la Ees con dobutamina y descenso con propranolol,
consistentes con cambios en la contractilidad. (Modificado de Mandarino et al., 20).
Es preciso tener en cuenta que aunque los parámetros derivados de la relación presión-volumen ventricular son los índices de referencia de contractilidad y las nuevas tecnologías facilitan parcialmente su determinación a pie de cama, su utilización no es posible en los pacientes inestables puesto que la alteración de las condiciones de carga mediante la oclusión de la vena cava inferior y la administración de drogas vasodilatadores o vasoactivas podría desencadenar una situación de riesgo vital en pacientes hemodinámicamente inestables.
Poscarga
La poscarga se define como la «carga» contra la que el corazón debe contraerse para expulsar la sangre. La poscarga es un determinante importante del gasto cardíaco para unas condiciones determinadas de contractilidad y precarga. La magnitud del acortamiento de la fibra miocárdica y, en consecuencia, el volumen sistólico correspondiente eyectado por el ventrículo están relacionados inversamente con la poscarga ventricular (Figura 4).

Figura 4. Efecto de los cambios de poscarga en las curvas de Frank-Starling.
Un incremento de la poscarga produce un descenso del volumen sistólico y un
aumento de la PTDVI (desplazamiento del punto A al C). Un descenso de la poscarga
produce un aumento del volumen sistólico y un descenso de la PTDVI (desplazamiento del punto A al B).
PTDVI: presión telediastólica de ventrículo izquierdo.
Aunque la presión aórtica constituye uno de los mayores componentes de la poscarga ventricular, todavía se debate qué parámetro es su estimador más correcto. Una forma de valoración de la poscarga ventricular podría ser mediante la estimación del estrés de la pared sistólica ventricular, la cual es proporcional a la presión intraventricular y al radio del ventrículo, dividido por el espesor de la pared (ecuación de Lapla estrés: P x r/2h). La utilización de la ecocardiografía puede facilitar la determinación de este parámetro11.
En la práctica clínica, la forma más habitual de valoración de la poscarga es a través del cálculo de la resistencia vascular (RV) sistémica o pulmonar que nos ofrece información sobre el tono arterial12. Es importante conocer que el valor de la RV arterial solo representa la oposición a un flujo constante, existente principalmente a nivel de las arteriolas donde los mecanismos compensatorios que controlan el tono vasomotor regulan la presión de perfusión dentro de un rango fisiológico. No ofrece una descripción completa de la impedancia arterial global debido al carácter oscilante del flujo sanguíneo y de la presión arterial.
El tono arterial y sus cambios en el tiempo o secundarios a un tratamiento con fármacos vasoactivos pueden ser determinados a pie de cama utilizando medidas de presión de perfusión relativa al flujo sanguíneo. La ratio resultante se denomina elastancia arterial (Ea), debido a que es la relación entre la presión desarrollada (presión de pulso, presión arterial sistólica) y el volumen sistólico más que el efecto sostenido de un flujo constante en un circuito de resistencia. Puesto que el flujo sanguíneo es fásico y no constante, la elastancia es una medida más precisa del tono arterial que la resistencia arterial. Asimismo, la evaluación del tono arterial requiere conocer no solo los valores absolutos de presión y flujo sino la relación entre los cambios en el flujo sanguíneo y la presión arterial. Por este motivo, pueden usarse los cambios en la presión de pulso y en el volumen sistólico en lugar de la presión de pulso/presión arterial sistólica y el volumen sistólico. La ratio entre la variación de presión de pulso (VPP) y la variación del volumen sistólico (VVS) (parámetros utilizados comúnmente en la valoración de la respuesta al aporte de volumen) durante un ciclo respiratorio se denomina elastancia arterial dinámica (Eadyn) y proporciona una evaluación funcional del tono arterial. El valor normal de la Eadyn es cercano a 1 (Figura 5). La presencia de un tono vasomotor disminuido o aumentado provocaría que el valor de Eadyn fuese menor o mayor que 1 respectivamente3,13,14.
Figura 5. Efecto de los cambios en el tono arterial en la relación entre la VPP y el VVS. La relación entre la Ees y la Ea, que representa el «acoplamiento» ventrículo-arterial, ha sido utilizado incluso en experimentación animal y en algún protocolo clínico para la evaluación de las propiedades mecanoenergéticas del ventrículo izquierdo15. Índices estimadores de contractilidad utilizados en la UCI Parámetros derivados de la hemodinámica clásica La introducción del catéter de arteria pulmonar por Swan y Ganz en 1970 revolucionó la monitorización de la Medicina Intensiva y ha sido la técnica de monitorización hemodinámica más ampliamente utilizada durante las últimas décadas. El catéter de Swan-Ganz ha proporcionado, de manera indiscutible, un incremento importante de nuestro conocimiento de la función cardiovascular al permitir la determinación de las presiones intravasculares (presión de la arteria pulmonar, presión de la aurícula derecha y presión de oclusión de la arteria pulmonar), el cálculo del gasto cardíaco por termodilución y el acceso a sangre venosa mezclada. Por otro lado, desde su introducción se han efectuado modificaciones que aún han ampliado más la información ofrecida por el mismo pudiendo obtenerse la fracción de eyección y los volúmenes del ventrículo derecho, la saturación venosa mixta de oxígeno (SvO2) y el gasto cardíaco continuos, además de que ofrece la posibilidad de incorporar electrocatéteres en la aurícula y el ventrículo derechos12. En la actualidad, la controversia acerca de la utilización del catéter de arteria pulmonar y los avances tecnológicos desarrollados en los últimos años han permitido la aparición de nuevos sistemas de monitorización hemodinámica que también nos proporcionan algunos de estos«viejos» parámetros y permiten obtener «nuevos» parámetros de funcionalismo cardiovascular (Tabla 1). El parámetro más utilizado tradicionalmente en la UCI para valorar la función ventricular es el gasto cardíaco (volumen sistólico x frecuencia cardíaca). Sin embargo, es importante recordar que el gasto cardíaco depende de la precarga (relación de Frank-Starling) y la poscarga además de la contractilidad, por lo que debería ser considerado más como un evaluador de la función cardíaca global que como un índice estimador de la contractilidad. Además, situaciones como el shock séptico pueden presentar un gasto cardíaco elevado a pesar de existir una alteración grave de la contractilidad, la cual se pone de manifiesto al incrementar el tono vascular que disminuye la fracción de eyección y el gasto cardíaco. La utilización conjunta del gasto cardíaco y las presiones de llenado (presión aurícula derecha, presión de oclusión de arteria pulmonar) permite obtener unos patrones hemodinámicos que pueden ser muy útiles en la práctica clínica y podrían mejorar la evaluación de la función contráctil. De esta manera, la insuficiencia cardíaca grave izquierda se caracterizaría por un gasto cardíaco bajo y una presión de oclusión de arteria pulmonar elevada. El ejemplo más característico de utilidad de los patrones hemodinámicos es la clasificación de Forrester16, la cual asigna a los pacientes con infarto agudo de miocardio a 4 categorías basándose en el valor de índice cardíaco (mayor o menor de 2,2 l/min/m2) y la presión de oclusión de arteria pulmonar (mayor o menor de 18mm Hg) y permite la instauración de estrategias terapeúticas en función de la clasificación establecida y proporciona además una estratificación pronóstica de los pacientes. A pesar de todo, un aumento en la presión de llenado ventricular no necesariamente indicaría una disminución de la contractilidad ventricular y podría reflejar más bien una alteración de la distensibilidad ventricular secundaria a diversos factores: enfermedad del pericardio, enfermedad restrictiva, disfunción diastólica, hipertrofia cardíaca o isquemia miocárdica. Por este motivo, los datos obtenidos mediante el estudio del gasto cardíaco y las presiones de llenado no nos proporcionarían información suficiente para conocer los mecanismos (alteración de la distensibilidad ventricular, disminución de contractilidad, incremento de poscarga...) responsables de los hallazgos clínicos y hemodinámicos del paciente. Otro parámetro utilizado clásicamente en la UCI para la evaluación de la contractilidad a pie de cama es el SW (aproximación del obtenido mediante las curvas presión-volumen ventricular) definido como el producto del volumen sistólico y la diferencia entre la presión arterial media y la presión de oclusión de arteria pulmonar. Este índice es también dependiente de la precarga pero es independiente de la poscarga por lo que el hallazgo de un SW bajo podría identificar una disminución de la función contráctil del corazón en situaciones en las que la reposición volémica haya sido adecuada. Numerosos estudios en el campo de la insuficiencia cardíaca, la cardiopatía isquémica y la sepsis han usado este parámetro como indicador de alteración de la contractilidad y se ha relacionado incluso con el pronóstico de los pacientes17,18. Potencia cardíaca «cardiac power» y reserva cardíaca El corazón puede ser considerado como una bomba mecánica capaz de generar energía hidráulica. En consecuencia, la capacidad de bomba puede expresarse como potencia cardíaca «cardiac power» (CP), definida como el producto del flujo y la presión generados por el corazón19. Por lo tanto, la CP es el producto del gasto cardíaco y la presión arterial media determinadas simultáneamente. Sus unidades de medida son julio/s o watio. La CP no está influida significativamente por la poscarga pero sí que puede variar directamente con la precarga por lo que debería asegurarse que el corazón del paciente no sea dependiente de precarga antes de afirmar que su CP y, por lo tanto, su función de bomba están disminuidas. Por otro lado, la CP o potencia ventricular máxima es un índice de la fase de eyección calculado como el producto instantáneo de flujo y presión en el momento de máximo flujo a través de la válvula aórtica y máxima presión aórtica. Se ha encontrado una buena correlación de este parámetro con la Ees20 (Figura 6). El desarrollo de técnicas ecocardiográficas para estimación del flujo aórtico y el registro de la presión aórtica han permitido la determinación semi-invasiva de la CP máxima en condiciones clínicas. La sensibilidad a la precarga puede ser corregida al dividir este parámetro por (volumen telediastólico2) o (área telediastólica 3/2). Sin embargo, en la práctica clínica se ha popularizado más el uso de la CP utilizando la presión arterial media y el gasto cardíaco debido a que estos son unos parámetros comúnmente utilizados en las UCI y la adquisición de la CP máxima requiere técnicas más sofisticadas. A pesar de que el concepto de CP tiene más de 100 años, los resultados de la investigación clínica y experimental, así como la revisión de conceptos fisiopatológicos recientes en el campo de la insuficiencia cardíaca, han reavivado el interés por este estimador de contractilidad19,21,22. Se ha propuesto incluso la utilización de los valores de CP y de resistencias vasculares sistémicas plasmadas en un gráfico bidimensional para el diagnóstico hemodinámico y seguimiento de los pacientes con insuficiencia cardíaca aguda22 (Figura 7). Por otro lado, la CP indexada (CPi) máxima o pico tras estimulación farmacológica o ejercicio se ha utilizado en los últimos años para evaluar a los pacientes con fallo cardíaco agudo y crónico. En este sentido, numerosos estudios han demostrado que la CPi pico alcanzada durante el ejercicio o al administrar dobutamina es un predictor más potente de la evolución de pacientes con insuficiencia cardíaca crónica que el consumo de oxígeno, el gasto cardíaco, la presión de oclusión de arteria pulmonar y la fracción de eyección determinada por ecocardiografía19. Estos resultados han sido confirmados en pacientes críticos en situación de shock cardiogénico. Tan et al.17 encontraron que la evaluación hemodinámica de la reserva cardíaca (diferencia entre CP pico y CP basal) mediante estimulación con dobutamina claramente separaba a los pacientes supervivientes de los no supervivientes. Los pacientes con CP pico menor de 1 w (valor normal basal para un adulto sano) o stroke work index de 0,25 j/m2 fallecieron mientras que todos aquellos con valores más elevados sobrevivieron durante un período superior a un año. Una confirmación posterior del valor pronóstico de la CP ha sido publicada recientemente23. En este estudio se determinaron la CP y otros parámetros hemodinámicos en 406 pacientes con shock cardiogénico incluidos en el registro SHOCK que estaban monitorizados con catéter de arteria pulmonar y encontraron que la CP fue el parámetro hemodinámico más fuertemente relacionado con la mortalidad de los pacientes con shock cardiogénico. Parámetros ecocardiográficos La ecocardiografía constituye una herramienta útil en la evaluación de la función cardiovascular del paciente crítico debido a que nos proporciona imágenes en tiempo real, a pie de cama y de una manera no invasiva (ecocardiografía transtorácica, ETT) o mínimamente invasiva (ecocardiografía transesofágica, ETE) y, por esta razón, se está incorporando de manera creciente en la UCI. El estudio de la función ventricular es una de las principales indicaciones de la ecocardiografía en el paciente crítico24-26. La ecocardiografía permite estimar el gasto cardíaco, la presión de arteria pulmonar, las presiones de llenado y distintos parámetros predictores de la respuesta a volumen. Además, nos permite obtener parámetros estimadores de contractilidad como son la fracción de acortamiento y la fracción de eyección del ventrículo izquierdo (FEVI), la velocidad máxima de la onda S del Doppler tisular a nivel del anillo mitral o tricuspídeo y el desplazamiento sistólico del anillo tricúspide (tricuspid annular plane systolic excursión, TAPSE) para valoración de la función ventricular derecha. La determinación y la utilidad de estos parámetros ecocardiográficos han sido comentados en el capítulo específico de ecocardiografía de esta serie de puesta al día27. La FEVI es el parámetro más frecuentemente utilizado para evaluar la contractilidad, aunque es también dependiente de la poscarga. Existen 2 situaciones clínicas comunes, la estenosis aórtica grave y la insuficiencia mitral crónica grave, en las que la FEVI no refleja el verdadero estado del ventrículo. En los casos de estenosis aórtica grave, la FEVI está frecuentemente deprimida pero aumenta al solucionar la obstrucción al flujo. Esta situación representa un caso de afectación importante de la poscarga que falsamente disminuye la función ventricular. Por otro lado, la insuficiencia mitral representa la situación de baja poscarga que falsamente aumenta la FEVI. En otros procesos que cursan con alteración importante de la poscarga podría encontrarse también que la FEVI no es buen estimador de la función contráctil. La ecocardiografía permite disponer de otros parámetros que son menos dependientes de las condiciones de carga como son el dP/dt max y el índice de Tei (Figura 8). El dP/dt max es uno de los índices estimadores de contractilidad utilizados clásicamente en laboratorios de experimentación animal por su independencia de la poscarga. Actualmente, las técnicas de ecografía nos permiten obtenerlo a pie de cama. El dP/dt obtiene su valor máximo antes de la apertura de la válvula aórtica, es decir, al final del período isovolumétrico por lo que se limita la influencia de la poscarga. La determinación del dP/dt requiere la presencia de insuficiencia mitral para medir el tiempo necesario del jet de regurgitación para incrementar su velocidad de 1 a 3m/s (N: 1.200mm Hg/s). Este índice es utilizado en la valoración pronóstica en la población de pacientes con insuficiencia cardíaca congestiva cuando su valor es menor de 600mm Hg/s. Otro estimador de contractilidad es el índice de Tei. Este índice es relativamente independiente de la precarga y la poscarga (tiempo contracción isovolumétrica+tiempo de relajación isovolumétrica/tiempo de eyección, N: 0,30-0,38) y precisa situar el volumen de muestra del ecógrafo en el ventrículo izquierdo entre la válvula mitral y aórtica (apical 5 cámaras) para obtener el flujo de eyección aórtico y el flujo de llenado mitral24,26. Índice de función cardíaca y fracción de eyección global (sistema PiCCO) El sistema de monitorización PiCCO (Pulsion Medical System) permite, mediante la termodilución transpulmonar, el cálculo del gasto cardíaco y del volumen sanguíneo contenido en las 4 cámaras cardíacas al final de la diástole, denominado volumen telediastólico global (VTDG). El cociente entre el GC y el VTDG es llamado índice de función cardíaca (IFC) y el cociente entre el VS y el VTDG/4 se denomina fracción de eyección global (FEG), los cuales son fácilmente obtenidos a pie de cama. Combes et al.28 encontraron una correlación significativa entre estos índices y la fracción de acortamiento del área del ventrículo izquierdo (FAC) determinada por ETE en una población de pacientes críticos. Además, estos autores observaron que un IFC>4 min-1 y una FEG>18% estimaba una FAC>40% (sensibilidad 86 y 88%, especificidad 88 y 79%, respectivamente). Este estudio excluyó los pacientes con disfunción ventricular derecha y, por otro lado, no fue diseñado para evaluar la respuesta del IFC y la FEG a la estimulación inotrópica. Recientemente, se ha publicado un estudio cuyo objetivo consistió en evaluar si los índices derivados de la termodilución eran buenos estimadores de contractilidad mediante el análisis de su respuesta a la estimulación inotrópica y al aporte de volumen29. Los resultados principales obtenidos fueron que el IFC no fue alterado por la expansión de volumen, mientras que la infusión de dobutamina incrementó significativamente en un 29±22% el valor basal del IFC, lo que indica que este parámetro puede ser un buen estimador de contractilidad. Se obtuvieron resultados similares con la FEG. Asimismo, se encontró una correlación significativa entre el IFC y la FEVI (r: 0,67, p<0,0001), así como entre la FEG y la FEVI (r: 0,63, p= 0,0001). Un valor de IFC<4,1 min-1 estimó una FEVI del 45% con una sensibilidad del 89% y una especificidad del 67%, mientras que un IFC<3,2 min-1 estimó una FEVI<35% con una sensibilidad del 81% y una especificidad del 88%. Los autores del estudio concluyeron que el IFC debería servir para alertar al clínico sobre la probable presencia de alteración de la contractilidad del ventrículo izquierdo y, en consecuencia, debería realizarse una ecocardiografía para evaluar la función ventricular. Además, el IFC podría ser una herramienta útil para evaluar los efectos hemodinámicos de la dobutamina. Por otro lado, en los pacientes con dilatación del ventrículo derecho, el IFC puede subestimar la FEVI y la ecocardiografía podría descartar la afectación del ventrículo derecho. Por último, un estudio experimental muy reciente también ha encontrado que el IFC y la FEG son buenos estimadores de la función contráctil cardíaca pero pueden ser dependientes de la precarga en situaciones de hipovolemia grave30. Utilidad de los péptidos natriuréticos Los cardiomiocitos del ventrículo, ante la sobrecarga tanto de volumen como de presión, secretan una prohormona proteica pro-Brain Natriuretic Peptide (pro-BNP) que se hidroliza a 2 péptidos: una forma activa el Brain Natriuretic Peptide (BNP) y otra inactiva el NT-proBNP (péptido aminoterminal del proBNP), cuyas vidas medias son de 20 y 120 minutos, respectivamente31. El BNP tiene un papel importante en la insuficiencia cardíaca al actuar como hormona contrarreguladora de la angiotensina II, norepinefrina y endotelina, inhibiendo su producción y actuando como hormona vasodilatadora y diurética31. La utilidad del BNP y del NT-proBNP como biomarcadores para la identificación de la disnea de origen cardiaco en urgencias ha sido ampliamente demostrada32,33. Niveles de BNP>100pg/mL o de NT-proBNP>450pg/mL han demostrado una alta sensibilidad y especificidad para el diagnóstico de insuficiencia cardíaca. Concentraciones plasmáticas elevadas de ambos péptidos han sido descritas en el fallo ventricular izquierdo, tanto diastólico como sistólico, así como en los estados de sobrecarga de presión derecha (tromboembolismo pulmonar, cor pulmonale e hipertensión pulmonar primaria)34. Su papel en otros escenarios como la UCI está menos definido. La utilización de los péptidos natriuréticos (PN) en pacientes críticos viene condicionada por la alta prevalencia de factores de confusión que pueden elevar los péptidos en ausencia de disfunción cardíaca: la edad, el sexo femenino, la disminución del filtrado glomerular, lesiones cerebrales como la hemorragia subaracnoidea, algunos fármacos como los betabloqueantes, el balance positivo de líquidos y la ventilación mecánica con PEEP34. En pacientes críticos los PN han demostrado ser una herramienta útil de screening para descartar la disfunción cardíaca, encontrando valores predictivos negativos de hasta 96% de un punto de corte que en los diferentes estudios se encuentra en 150pg/ml35,36. Los pacientes que presentan disfunción en la ecocardiografía tienen niveles significativamente más elevados de BNP que los pacientes sin disfunción: 330pg/mL (rango intercuartil [IQR]: 142-749) vs 115pg/mL (IQR: 50-197) (P<0,0001), siendo más elevados en aquellos pacientes con disfunción sistólica que en los que presentan cualquier grado de disfunción diastólica 1.100pg/mL (IQR: 275-1.240) vs 263 (IQR: 126-696) pg/mL (p<0,005). Las concentraciones plasmáticas de BNP en pacientes con disfunción ventricular izquierda e insuficiencia cardíaca se han correlacionado con éxito con las presiones de llenado del ventrículo izquierdo (r=0,72)37. Sin embargo, estudios en cohortes de pacientes críticos heterogéneas han demostrado una, aunque significativa, pobre correlación lineal entre las concentraciones de los PN y la presión capilar pulmonar enclavada (BNP r=0,40; NT-proBNP r=0,32)38. Tanto el BNP como el NT-proBNP pueden verse elevados en múltiples trastornos cardiacos, independientemente de las presiones de llenado del ventrículo izquierdo (fracción de eyección del ventrículo izquierdo deprimida, hipertrofia ventricular izquierda, función ventricular derecha deprimida, insuficiencia mitral significativa o estenosis aórtica grave). Ambos natriopéptidos poseen una alta sensibilidad pero baja especificidad para distinguir las presiones elevadas del ventrículo izquierdo38. A pesar de una clara necesidad clínica, los datos actualmente disponibles tan solo están comenzando a definir el papel potencial de los PN en la práctica clínica habitual en la UCI. Mientras tanto, es tiempo de aprovechar la opción que nos ofrecen como herramienta no invasiva de screening tanto en la disfunción ventricular como en la evaluación de las presiones de llenado del ventrículo izquierdo. Índices estimadores de la poscarga en la unidad de cuidados intensivos Parámetros derivados de la monitorización hemodinámica La estimación de la poscarga en la UCI se ha realizado tradicionalmente mediante la determinación de las RV sistémicas o pulmonares utilizando el catéter de arteria pulmonar. El desarrollo tecnológico actual nos permite disponer de otros dispositivos de monitorización hemodinámica que permiten obtener el gasto cardíaco y las RV sistémicas de manera menos invasiva. Por otro lado, existen sistemas de monitorización que permiten obtener la VPP así como la VVS de manera continua, lo que facilita la evaluación de la respuesta al aporte de volumen y ofrece la posibilidad de calcular la Eadyn (VPP/VVS), estimador del tono arterial. Esta información puede ser muy útil en la práctica clínica para el tratamiento de situaciones de inestabilidad hemodinámica. En este sentido, Pinsky3,13 ha propuesto un algoritmo de tratamiento en estas situaciones basado en una monitorización hemodinámica funcional que utiliza, por un lado, la VPP y la VVS (evaluación de la dependencia de precarga y respuesta a volumen) y, por otro lado, la Eadyn (valoración del tono vasomotor). El algoritmo permite la decisión de administración de volumen, vasopresores o inotrópicos en función de la información obtenida. Este algoritmo todavía no ha sido validado en la práctica clínica. Por último, Monge et al.14 han publicado recientemente un estudio en el que encuentran que la Eadyn predice la respuesta al aporte de volumen en pacientes dependientes de precarga y con fracaso circulatorio agudo. Un valor de Eadyn de 0,89 discrimina a los pacientes que incrementarán un 15% su presión arterial media tras la administración de volumen con una sensibilidad del 94% y una especificidad del 100%. Los autores concluyen que, desde un punto de vista práctico, los pacientes con una Eadyn <0,89 deberían recibir vasopresores junto a la administración de fluidos para incrementar su PAM, mientras que una Eadyn >0,89 indicaría que el volumen podría incrementar la presión arterial sin la necesidad de drogas vasopresoras. Parámetros ecocardiográficos La ecocardiografía permite estimar las resistencias vasculares sistémicas y pulmonares. En presencia de insuficiencia mitral, por ecocardiografía Doppler podemos identificar los pacientes con RSV>14 wood (> 1.120 dinas.s.cm-5), con una buena correlación con la estimación invasiva por catéter de Swan-Ganz (S= 70%, E= 70%), si el cociente entre la velocidad máxima detectada del flujo de insuficiencia mitral (Vmax IM) y la integral de la velocidad del tracto de salida del ventrículo izquierdo (ITVtsvi) es mayor de 0,27 (Vmax IM/ITVtsvi>0,27). Del mismo modo, en presencia de insuficiencia tricuspídea (IT), podemos cuantificar la RVP a través de la estimación de la velocidad máxima detectada del flujo de IT (Vmax IT) y la integral de la velocidad en el tracto de salida del ventrículo derecho (ITVtsvd), o bien, mediante la estimación del período preeyectivo pulmonar (PPE), tiempo de aceleración pulmonar (TAc) y tiempo sistólico total (TST)39,40. RVP=(Vmax IT/ITVtsvd) x 10+0,16 (un valor >0,175 identifica una RVP>2 wood, S=77%, E=81%) RVP= -0,156+1,154 x [(PPE/TAc)/TST] Por otro lado, se puede calcular el estrés de la pared ventricular como se ha mencionado anteriormente. Conclusiones La evaluación de la contractilidad y la poscarga, mediante la ecocardiografía y otros sistemas de monitorización hemodinámica, constituye un aspecto fundamental de la valoración de la función cardiovascular del paciente crítico. La combinación de diferentes técnicas probablemente nos permita obtener una información más completa que ayude a mejorar el pronóstico de los pacientes. Bibliografía 1. Poelaert J. Haemodynamic monitoring. Curr Opin Anaesthesiol. 2001; 14:27-32. [ Links ] 2. Poelaert J, Roosens C, Segers P. Monitoring left performance in the critically ill. En: Vincent J.L., editors. Yearbook of Intensive Care Med. Berlin: Springer-Verlag; 2002. 519-36. [ Links ] 3. Pinsky MR. Functional Hemodynamic monitoring: applied physiology at the bedside. En: Vincent J.L., editors. Yearbook of Intensive Care Med. Berlin: Springer-Verlag; 2002. 537-51. [ Links ] 4. Grossman W, Braunwald E, Mann T, McLaurin LP, Green LH. Contractile state of the left ventricle in man as evaluated from end-systolic pressure-volume relations. Circulation. 1977; 56:845-52. [ Links ] 5. Little WC, Cheng CP, Mumma M, Igarashi Y, Vinten-Johansen J, Johnston WE. Comparison of measures of left ventricular contractile performance derived from pressure-volume loops in conscious dogs. Circulation. 1989; 80:1378-87. [ Links ] 6. Kass DA, Maughan WL, Guo ZM, Kono A, Sunagawa K, Sagawa K. Comparative influence of load versus inotropic states on indexes of ventricular contractility: experimental and theoretical analysis based on pressure-volume relationships. Circulation. 1987; 76:1422-36. [ Links ] 7. Sagawa K. The left ventricular pressure-volume diagram revisited. Circ Res. 1978; 43:677-8. [ Links ] 8. Declerck C, Hillel Z, Shih H, Kuroda M, Connery C, Thys D. A comparison of left ventricular performance indices measured by transeophageal echocardiography with automated border detection. Anesthesiology. 1998; 89:341-9. [ Links ] 9. Gorcsan J, Denault A, Gasior TA, Mandarino WA, Kancel MJ, Deneault LG, et al. Rapid estimation of left ventricular contractility form end-systolic relations by echocardiographic automated border detection and femoral arterial pressure. Anesthesiology. 1994; 81:553-62. [ Links ] 10. Kim HK, Alhammouri MT, Mokhtar Y, Pinsky MR. Estimating left ventricular contractility using inspiratory-hold maneuvers. Intensive Care Med. 2007; 33:181-9. [ Links ] 11. Subramaniam B, Talmor D. Echocardiography for management of hypotension in the intensive care unit. Crit Care Med. 2007; 35(suppl.):S401-7. [ Links ] 12. Carrillo López A, Fiol Sala M, Rodríguez Salgado A. El papel del catéter de Swan-Ganz en la actualidad. Med Intensiva. 2010; 34:203-14. [ Links ] 13. Pinsky MR. Protocolized cardiovascular management based on ventricular-arterial coupling. En: Pinsky M.R., Payen D., editors. Functional Hemodynamic monitoring. Berlin: Springer-Verlag; 2005. 381-95. [ Links ] 14. Monge Garcia MI, Gil Cano A, Gracia Romero M. Dynamic arterial elastance to predict arterial pressure response to volume loading in preload-dependent patients. Crit Care. 2011; 15:R15. [ Links ] 15. Hayashi K, Shigemi K, Shishido T, Sugimachi M, Sunagawa K. Single-beat estimation of ventricular end-systolic elastance-effective arterial elastance as an index of ventricular mechanoenergetic performance. Anesthesiology. 2000; 92:1769-76. [ Links ] 16. Crexells C, Chatterjee K, Forrester JS, Dikshit Swan HJ. Optimal level of filling pressure in the left side of the heart in acute myocardial infaction. N Engl J Med. 1973; 289:1263-6. [ Links ] 17. Tan LB, Littler WA. Measurement of cardiac reserve in cardiogenic shock: implications for prognosis and management. Br Heart J. 1990; 64:121-8. [ Links ] 18. La Vechia L, Varotto L, Spadaro GL, Zanolla L, Fontanelli A. Left ventricular stroke work reserve as prognostic marker in severe heart failure. Minerva Cardioangiol. 2006; 54:249-55. [ Links ] 19. Cotter G, Williams SG, Vered Z, Tan LB. Role of cardiac power in heart failure. Curr Opin Cardiol. 2003; 18:215-22. [ Links ] 20. Mandarino WA, Pinsky MR, Gorcsan J3rd. Assessment of left ventricular contractile state by preload-adjusted maximal power using echocardiographic automated border detection. J Am Coll Cardiol. 1998; 31:861-8. [ Links ] 21. Cotter G, Moshkovitz Y, Milovanov O, Salah A, Blatt A, Krakover , et al. Acute heart failure: a novel approach to its pathogenesis and treatment. Eur J Heart Fail. 2002; 4:227-34. [ Links ] 22. Cotter G, Moshkovitz Y, Kaluski E, Milo O, Nobikov Y, Schneeweiss A, et al. The role of cardiac power and systemic vascular resistance in the pathophysiology and diagnosis of patients with acute congestive heart failure. Eur J Heart Fail. 2003; 5:443-51. [ Links ] 23. Fincke R, Hochman JS, Lowe AM, Menon V, Slater JN, Webb JG, et al. Cardiac power is the strongest hemodynamic correlate of mortality in cardiogenic shock: a report from the shock trial registry. J Am Coll Cardiol. 2004; 44:340-8. [ Links ] 24. Poelaert J, Schüpfer G. Hemodynamic monitoring utilizing transesophageal echocardiography. The relationships among pressure, flow, and function. Chest. 2005; 127:379-90. [ Links ] 25. Slama M, Maizel J. Echocardiographic measurement of ventricular function. Curr Opin Crit Care. 2006; 12:241-8. [ Links ] 26. Dittoe N, Stultz D, Schwartz BP, Hahn H. Quantitative left ventricular systolic function: from chamber to myocardium. Crit Care Med. 2007; 35(Suppl.):S330-9. [ Links ] 27. Ayuela Azcárate JM, Clau Terré F, Ochagavía A, Vicho Pereira R. Papel de la ecocardiografía en la monitorización hemodinámica de los pacientes críticos. Med Intensiva. 2012; 36:220-32. [ Links ] 28. Combes A, Berneau JB, Luyt CE, Trouillet JL. Estimation of left ventricular systolic function by single transpulmonary thermodilution. Intensive Care Med. 2004; 30:1377-83. [ Links ] 29. Jabot J, Monnet X, Lamia B, Chemla D, Richard C, Teboul JL. Cardiac function index provided by transpulmonary thermodilution behaves as an indicator of left ventricular systolic function. Crit Care Med. 2009; 37:2913-8. [ Links ] 30. Trepte CJ, Eichhorn V, Haas SA, Richter HP, Goepfert MS, Kubitz JC, et al. Thermodilution-derived indices for assessment of left and right ventricular cardiac function in normal and impaired cardiac function. Crit Care Med. 2011; 39:2106-12. [ Links ] 31. De Denus S, Pharand C, Williamson D. Brain Natriuretic Peptide in theManagement of Heart Failure. Chest. 2004; 125:652-68. [ Links ] 32. Maisel AS, Krishnaswamy P, Nowak RM, McCord J, Hollander JE, Duc P, et al. Rapid measurement of B-type natriuretic peptide in the emergency diagnosis of heart failure. N Engl J Med. 2002; 347:161-7. [ Links ] 33. Januzzi JL, Van Kimmenade R, Lainchbury J, Bayes-Genis A, Ordonez-Llanos J, Santalo-Bel M. NT-proBNP testing for diagnosis and short-term prognosis in acute destabilized heart failure: an international pooled analysis of 1256 patients: the International Collaborative of NT-proBNP Study. Eur Heart J. 2006; 27:330-7. [ Links ] 34. McLean AS, Huang SJ. The applications of B-type natriuretic peptide measurement in the intensive care unit. Curr Opin Crit Care. 2005; 11:406-12. [ Links ] 35. McLean AS, Tang B, Nalos M, Huang SJ, Stewart DE. Increased B-type natriuretic peptide (BNP) level is a strong predictor for cardiac dysfunction in intensive care unit patients. Anaesth Intensive Care. 2003; 31:21-7. [ Links ] 36. Zapata Ll Vera P, Baldirá J, Nuñez K, Ordoñez J, Betbesé AJ. Natriuretic peptide as a screening tool to detect left ventricular dysfunction in critically ill patients. Intensive Care Med. 2009; 35:S281. [ Links ] 37. Kazanegra R, Cheng V, Garcia A, Krishnaswamy P, Gardetto N, Clopton P, et al. A rapid test for B-type natriuretic peptide correlates with falling wedge pressures in patients treated for decompensated heart failure: a pilot study. J Card Fail. 2001; 7:21-9. [ Links ] 38. Forfia PR, Watkins SP, Rame JE, Stewart KJ, Shapiro EP. Relationship between B-type natriuretic peptides and pulmonary capillary wedge pressure in the intensive care unit. J Am Coll Cardiol. 2005; 45:1667-71. [ Links ] 39. Abbas AE, Fortuin FD, Patel B, Moreno CA, Schiller NB, Lester SJ. Noninvasive measurement of systemic vascular resistance using Doppler echocardiography. J Am Soc Echocardiogr. 2004; 17:834-8. [ Links ] 40. Abbas AE, Fortuin FD, Schiller NB, Appleton CP, Moreno CA, Lester SJ. A simple method for non-invasive estimation of pulmonary vascular resistance. J Am Coll Cardiol. 2003; 41:1021-7. [ Links ] 
Eadyn: elastancia arterial dinámica; VPP: variación de la presión de pulso; VVS: variación del volumen sistólico.
Figura 6. Efecto de un incremento de la poscarga, mediante oclusión
parcial de la aorta, en la potencia cardíaca «cardiac power». La presión
en el VI aumenta y el flujo aórtico disminuye secundario al aumento de poscarga,
pero la potencia cardíaca permanece constante (Modificado de Mandarino et al., 20).
VI: ventrículo izquierdo.
Figura 7. Gráfico que muestra la clasificación del estado hemodinámico
de los pacientes con diferentes síndromes de insuficiencia cardíaca aguda
en función de la CWi y las SVRi (modificado de Cotter et al., 22).
CWi: potencia cardíaca indexada, «cardiac power index»;
RVSi: índice de resistencias vasculares sistémicas.
Figura 8. a. Cálculo de dP/dt max. La figura muestra el registro de Doppler continuo a través
de la válvula mitral para estudio del jet de insuficiencia mitral y el esquema para la medición
del tiempo requerido para incrementar la velocidad de 1m/s a 3m/s.
dP/dt = incremento de presión tiempo = (4 x 32 - 1 x 12 / tiempo medido).
b. Indice de Tei. La figura muestra las velocidades del
flujo de llenado mitral y de eyección aórtica necesarios para el cálculo del índice.
Índice de Tei: (a- b)/b
a: tiempo desde el cierre a la apertura de la válvula mitral
b:TE
a-b: TRIV+TCIV
TCIV: tiempo de contracción isovolumétrica; TE: tiempo de eyección; TRIV: tiempo de relajación isovolumétrica.![]() Dirección para correspondencia:
Dirección para correspondencia:
AOchagavia@tauli.cat
(A. Ochagavía).















