Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Medicina Intensiva
versión impresa ISSN 0210-5691
Med. Intensiva vol.36 no.6 ago./sep. 2012
https://dx.doi.org/dx.doi.org/10.1016/j.medin.2012.05.003
PUESTA AL DÍA EN MEDICINA INTENSIVA. MONITORIZACIÓN HEMODINÁMICA EN EL PACIENTE CRÍTICO
Técnicas disponibles de monitorización hemodinámica. Ventajas y limitaciones
Techniques available for hemodynamic monitoring. Advantages and limitations
M.L. Mateu Camposa, A. Ferrándiz Sellésa, G. Gruartmoner de Verab, J. Mesquida Febrerb, C. Sabatier Cloarecb, Y. Poveda Hernándezc y X. García Nogalesb
aServicio de Medicina Intensiva, Hospital Universitario General de Castellón, Castellón, España
bÁrea de Críticos, Hospital de Sabadell, Institut Universitari Parc Taulí, Centro de Investigación Biomédica en Red (CIBER) en Enfermedades Respiratorias, Sabadell, Barcelona, España
cServicio de Medicina Intensiva, Hospital Santiago Apóstol, Vitoria, Álava, España
Dirección para correspondencia
RESUMEN
El catéter de la arteria pulmonar (CAP) ha constituido una herramienta fundamental para la monitorización hemodinámica en las unidades de cuidados intensivos durante los últimos 40 años. Durante este período de tiempo ha sido ampliamente usado en pacientes críticos para el diagnóstico y como guía del tratamiento, ayudando a los clínicos a entender la fisiopatología de muchos procesos hemodinámicos. Sin embargo, en los últimos años la utilidad del CAP ha sido sometida a un intenso debate. Paralelamente, los avances tecnológicos han permitido el desarrollo de nuevas técnicas, menos invasivas, para la monitorización cardiovascular. Esta puesta al día pretende dar a los clínicos una visión de los parámetros hemodinámicos que aportan los distintos métodos disponibles, considerando que es fundamental comprender tanto su potencial utilidad clínica como sus limitaciones para un uso eficaz de la información que proporcionan.
Palabras clave: Monitorización hemodinámica. Gasto cardiaco. Parámetros hemodinámicos.
ABSTRACT
The pulmonary artery catheter has been a key tool for monitoring hemodynamic status in the intensive care unit for nearly 40 years. During this period of time, it has been the hemodynamic monitoring technique most commonly used for the diagnosis of many clinical situations, allowing clinicians to understand the underlying cardiovascular physiopathology, and helping to guide treatment interventions. However, in recent years, the usefulness of pulmonary artery catheterization has been questioned. Technological advances have introduced new and less invasive hemodynamic monitoring techniques.
This review provides a systematic update on the hemodynamic variables offered by cardiac output monitoring devices, taking into consideration their clinical usefulness and their inherent limitations, with a view to using the supplied information in an efficient way.
Key words: Hemodynamic monitoring. Cardiac output. Hemodynamic variables.
Introducción
El catéter de la arteria pulmonar (CAP) ha constituido una herramienta fundamental para la monitorización hemodinámica en las unidades de cuidados intensivos (UCI) durante los últimos 40 años1. Durante este período de tiempo, el CAP ha sido ampliamente usado en pacientes críticos para el diagnóstico y como guía del tratamiento, ayudando a los clínicos a entender la fisiopatología de muchos procesos hemodinámicos. Sin embargo, en los últimos años la utilidad del CAP ha sido sometida a un intenso debate, debido fundamentalmente a la publicación de trabajos en los que su utilización no se asociaba a un beneficio en la supervivencia2-7. De hecho, en varios de estos estudios su uso se asociaba a mayor mortalidad2,3. Paralelamente, los avances tecnológicos han permitido el desarrollo de nuevas técnicas menos invasivas para la monitorización cardiovascular, reforzando la idea de que el uso sistemático del CAP podía haber llegado a su fin. A pesar de la controversia creada, no cabe duda de que mediante el CAP se pueden obtener variables hemodinámicas únicas, valiosas y útiles en la guía de la reanimación del paciente en estado crítico8,9.
A lo largo de los últimos años se han estudiado nuevos métodos que han llegado a reemplazar el uso del CAP para la determinación del gasto cardíaco (GC). Estas nuevas tecnologías varían ampliamente entre ellas, de muy invasivas a menos invasivas y hasta no invasivas, de intermitentes a continuas, y cada una de ellas con sus principios básicos, métodos y costes. Algunas proporcionan índices dinámicos de respuesta a los fluidos, que están siendo considerados como mejores predictores de respuesta al aporte de volumen, otras permiten valorar variables de precarga volumétrica y otras aportan medidas continuas de la saturación venosa central. Todas estas variables, junto con el GC, están destinadas a mejorar la monitorización hemodinámica de los pacientes críticos10. Hasta el momento, ninguna de ellas cumple todas las características necesarias para ser considerada como excelente: no invasiva, continua, fiable, reproducible, cómoda tanto para el paciente como para el profesional, exacta y con los mínimos efectos secundarios11,12. Por lo tanto, la utilización de cada una de ellas va a depender fundamentalmente de su disponibilidad y de los conocimientos o aptitudes del profesional.
Todas estas técnicas han sido valoradas y validadas mediante la comparación de sus resultados con el considerado gold standard, que aún a día de hoy sigue siendo la termodilución intermitente de la arteria pulmonar.
Esta puesta al día pretende dar a los clínicos una visión de los parámetros hemodinámicos que aportan los distintos métodos disponibles, considerando que es fundamental comprender tanto su potencial utilidad clínica como sus limitaciones para un uso eficaz de la información que proporcionan.
Métodos invasivos
Catéter de arteria pulmonar o de Swan-Ganz
Introducido en 1970 por J.C. Swan y W. Ganz. Se canaliza a través de una vena de gran calibre que a través del corazón derecho se introduce en la arteria pulmonar y deja alojado su extremo distal en una ramificación de esta arteria. El CAP nos proporciona información sobre 3 categorías de variables diferentes: medidas de flujo sanguíneo (GC), presiones intravasculares intratorácicas y parámetros oximétricos.
Mediciones del flujo sanguíneo
La medición del GC mediante este catéter se basa en la termodilución transcardíaca. Tras inyectar un volumen de líquido con una temperatura inferior a la sanguínea, el termistor detecta los cambios de temperatura a lo largo del tiempo, registrándose en forma de curva. El área bajo la curva registrada es el volumen minuto. Los detalles sobre la medición del GC, así como sus limitaciones técnicas (insuficiencia tricuspídea, etc.), se han desarrollado ampliamente en entregas previas de la «Puesta al día en monitorización hemodinámica»13.
Medición de presiones intravasculares intratorácicas
El CAP, debidamente posicionado, permite obtener presiones de 3 localizaciones diferentes: la aurícula derecha (presión venosa central, o PVC), la arteria pulmonar (PAP) y las venas pulmonares (también llamada presión de cuña, de oclusión o PAPO). Originariamente, el CAP se desarrolló para permitir la medición de la PAPO, que corresponde a la presión venosa pulmonar distal al lecho capilar pulmonar, y que representa una estimación aproximada de la presión de la aurícula izquierda (PAI). De hecho, aún hoy, la PAPO sigue siendo la mejor estimación a pie de cama de la presión venosa pulmonar de cara a evaluar tanto las resistencias pulmonares como la precarga del ventrículo izquierdo. Para este uso, la PAPO no tiene una alternativa práctica. Recientemente, se han propuesto una serie de mediciones del flujo venoso pulmonar por ecocardiografía Doppler para la estimación de la PAPO14, aunque las variables obtenidas mediante Doppler derivadas del flujo transmitral (TMF) y venoso pulmonar (PVF) son poco exactas, consumen tiempo, no se pueden obtener en todos los pacientes, y requieren un alto grado de experiencia, más allá de los principios básicos de ecocardiografía15. Pese a ello, en los últimos años se han desarrollado nuevos parámetros obtenidos con Doppler tisular que añaden más exactitud a la técnica. De todas formas, la utilidad de la PAPO en el paciente crítico necesita ser redefinida. Se ha demostrado, de forma reiterada y consistente, que la PAPO tiene bajo valor predictivo en la evaluación de la respuesta al volumen. Por lo cual, no se recomienda que el clínico utilice los valores absolutos de PAPO a pie de cama para predecir la respuesta a la administración de líquidos. En este aspecto, las variables obtenidas del análisis de la curva de presión arterial durante la ventilación con presión positiva, como la variación de la presión de pulso o la variación del volumen sistólico, predicen la respuesta a volumen de forma mucho más fiable16. Sin embrago, las mediciones de la PAPO siguen siendo de gran ayuda en el diagnóstico del origen de la hipertensión pulmonar, y en la diferenciación entre edema pulmonar primario (no cardiogénico) y secundario (cardiogénico).
Saturación venosa mixta y otras variables oximétricas
La saturación de oxígeno a nivel de arteria pulmonar distal o saturación venosa mezclada o mixta (SvO2) es probablemente el mejor indicador aislado de la adecuación del transporte global de oxígeno (DO2), puesto que representa la cantidad de oxígeno que queda en la circulación sistémica después de su paso por los tejidos. Se ha propuesto el uso de la saturación venosa central de O2 (SvcO2) como un método sencillo, en sustitución de la SvO2, para evaluar la idoneidad de la perfusión global en varios escenarios clínicos. Sin embargo, el hecho de que la SvcO2 sea reflejo de la SvO2ha sido muy discutido, especialmente en el paciente crítico. Además, con los valores obtenidos de GC y SvO2, junto con los valores arteriales de oxigenación, se puede calcular el transporte y el consumo global de oxígeno (DO2 y VO2, respectivamente), así como el shunt oximétrico pulmonar y el cálculo del gradiente oximétrico en la rotura aguda del tabique interventricular.
Ventajas e inconvenientes
El CAP parece ideal para identificar y monitorizar los diferentes patrones de shock circulatorio (hipovolémico, cardiogénico, obstructivo y distributivo), con la obtención de los componentes principales de cualquier patrón: GC, PAPO y oximetría. Usando estas 3 medidas, asociadas a medidas directas de presión arterial media, permiten definir la etiología del shock, así como monitorizar la respuesta al tratamiento17. Basado en estos argumentos, el CAP ha sido una de las piedras angulares para el manejo del paciente en nuestras UCI, utilizándose como sistema sistemático de monitorización. Sin embargo, sus datos han sido ignorados o simplemente usados para definir la estabilidad del paciente. Este uso poco específico e indiscriminado podría ser responsable, al menos en parte, de la falta de eficacia, en cuanto a la supervivencia, apuntada en diferentes trabajos18-20.
Otro factor contribuyente lo hallamos en la comprobación repetida del escaso conocimiento de los clínicos en la interpretación de la información obtenida mediante el CAP, como en el análisis de la morfología de la onda de PAPO y la falta de correcta comprensión de las variables fisiológicas obtenidas para su traslado al contexto clínico21. Obviamente, ningún sistema de monitorización hemodinámica será capaz de mejorar el pronóstico del paciente, excepto si la información obtenida mediante dicho sistema se asocia a la elección de un tratamiento que sí pueda mejorar la supervivencia del paciente.
Frente a lo que se acaba de exponer, varios estudios han demostrado que el uso del CAP en el tratamiento dirigido por objetivos mejora el pronóstico de los pacientes tratados. Cuando las estrategias de resucitación han sido dirigidas por variables hemodinámicas derivadas del CAP, como el DO2, el índice cardíaco (IC), o la SvO2, se han conseguido reducciones significativas en la estancia hospitalaria, así como una mayor supervivencia22-24. Por lo tanto, parece que el CAP es, de hecho, una herramienta útil, capaz de mejorar la supervivencia cuando se asocia a un algoritmo de tratamiento con objetivos fisiológicos específicos y se utiliza en los pacientes adecuados. No ha mostrado beneficio cuando se ha utilizado en poblaciones de bajo riesgo quirúrgico, o cuando se ha utilizado para guiar la reanimación en fases tardías de la enfermedad, una vez que el daño orgánico ya se ha desarrollado25. Tampoco ha demostrado efecto beneficioso, cuando se han comparado estrategias de manejo del aporte de volumen dirigidas por PAPO frente a PVC, como en el reciente estudio FACCT7, puesto que ninguna de las 2 variables usadas son medidas fiables de precarga o de respuesta a volumen.
Además del debate en lo referente al pronóstico de los pacientes, se ha hecho hincapié en las complicaciones potenciales del CAP para reforzar los argumentos en contra de su uso. Evidentemente, como cualquier técnica invasiva, no está exenta de riesgos y complicaciones. Numerosos estudios han demostrado que las complicaciones locales derivadas de la inserción del PAC no difieren de las derivadas de la inserción de cualquier otro catéter venoso central26. Sin embargo, sí se ha asociado a un incremento en el riesgo de infecciones (incidencia de bacteriemia del 0,7-1,3%)30 y a fenómenos trombóticos durante su uso prolongado (> 48 h), así como a un aumento del riesgo de arritmias durante su inserción (aunque con mínima incidencia de arritmias graves, y sin repercusión en el pronóstico). De todo esto se puede deducir que la asociación de CAP y mejoría o no del pronóstico va a depender de cómo, cuándo, dónde y en qué tipo de pacientes se utilice.
Métodos mínimamente invasivos
En los últimos años se han incorporado a distintos aparatos comerciales, nuevos métodos, menos invasivos, para cuantificar el GC. La mayor parte de ellos se han basado en el análisis del contorno de la onda de pulso arterial según un modelo clásico que permite la estimación del volumen latido a través de las variaciones en la morfología de esta onda de pulso (modelo de Windkessel descrito por Otto Frank en 1899)27. Difieren en los siguientes aspectos: la forma de transformar la información proporcionada por la morfología de la presión arterial en el volumen sistólico y en el GC latido a latido, en los algoritmos utilizados por cada uno de ellos, en la calibración, ya que algunos necesitan calibración manual y otros no precisan calibración externa, en el lugar de canulación arterial, en los parámetros analizados y en la exactitud con la que determinan el GC.
Los métodos y sistemas disponibles en el mercado para el análisis del contorno de la onda de pulso son: PiCCO® (Pulsion), PulseCO® (LiDCO), Modelflow (TNO/BMI), MostCare® (Vygon) y FloTrac®/Vigileo® (Edwards Lifesciences, Irvine CA). De ellos, el PiCCO se calibra por termodilución transpulmonar, el LiDCO por dilución con litio y el Modelflow mediante 3 o 4 mediciones convencionales por termodilución. Por el contrario, el sistema FloTrac®/Vigileo® y el MostCare® no necesitan de calibración externa.
Todos estos métodos están basados en la morfología de la curva de presión arterial, por lo que es importante la obtención de una curva con morfología exacta. La amortiguación de la curva arterial y el cero insuficiente, problemas comunes en la práctica clínica, deben de ser evitados para obtener una señal válida para el cálculo del GC. La presencia de arritmias severas y el uso del balón intraaórtico de contrapulsación reducen la precisión en la medición del GC. Además, el análisis de la presión de pulso tendrá una exactitud limitada durante períodos de inestabilidad hemodinámica, como los cambios rápidos en las resistencias vasculares que se producen en pacientes sépticos y en aquellos con disfunción hepática.
Sistema PiCCO®
El sistema PiCCO® (PiCCO System, PULSION Medical Systems AG, Munich, Alemania) es actualmente el único monitor disponible comercialmente que utiliza la termodilución transpulmonar (TDTP) para medir el GC. Requiere únicamente una línea arterial y otra venosa, las cuales son necesarias en la mayoría de pacientes críticos. Proporciona información sobre flujos sanguíneos y volúmenes intravasculares.
Mediciones del flujo sanguíneo
El GC es calculado por el análisis de la curva de TDTP usando la ecuación de Stewart-Hamilton. Para determinar el GC se precisa la inyección de un indicador en bolo, a distinta temperatura que la de la sangre, normalmente suero salino isotónico, a través de la luz del catéter venoso central en el que se encuentra el sensor de temperatura externo. Una vez en el torrente sanguíneo, el termistor situado en la punta del catéter arterial detecta las variaciones de la temperatura generando la curva de termodilución. Se recomiendan 3 mediciones para la calibración inicial del sistema. Además, se deben realizar calibraciones cada 8 h, y cada vez que la situación hemodinámica del paciente lo precise. Simultáneamente al proceso de termodilución, se realiza el análisis de la porción sistólica del contorno de la onda de pulso arterial, mediante la cual se determina la distensibilidad aórtica. Al utilizar el análisis de la onda de presión de pulso para el análisis del volumen sistólico (VS), se permite también el cálculo del porcentaje de variación en la presión de pulso (VPP) o en el área (VVS), utilizada para dirigir el aporte de fluidoterapia y analizar la respuesta a la misma.
Medición de volúmenes
Otra ventaja de esta técnica es la capacidad de calcular diferentes volúmenes de los compartimentos intravasculares (no presiones como hace el CAP), así como el líquido extravascular pulmonar. Estima la precarga cardíaca a través de 2 parámetros: a) la medición del volumen global al final de la diástole (GEDV), definido como la suma del volumen de sangre de las 4 cavidades cardíacas, y b) el índice de volumen sanguíneo intratorácico (ITBV) considerado como el volumen de sangre que hay en las 4 cavidades cardíacas y en el lecho vascular pulmonar. Ninguno de estos parámetros se altera con la ventilación mecánica. La medición del agua extravascular pulmonar (EVLW) supone una medida de cuantificación del edema pulmonar y permeabilidad vascular, índice de permeabilidad vascular pulmonar (PVPI). La VPP y la VVS aportan información sobre el estado de la volemia en pacientes ventilados. Se trata de parámetros muy sensibles de precarga y nos indican en qué punto de la curva de Frank-Starling se encuentra el paciente y si va a tener o no respuesta al aporte de fluidos.
Estudios realizados recientemente señalan que las medidas de PiCCO son más consistentes y no están influidas por el ciclo respiratorio en comparación con el CAP, aunque, para compensar las diferencias interindividuales que pueden darse en la distensibilidad y la resistencia del sistema vascular, motivadas por las diferentes situaciones clínicas, son necesarias las calibraciones manuales frecuentes, sobre todo en situaciones de inestabilidad hemodinámica, para obtener mayor precisión en los valores de GC28. Esta técnica ha sido validada en diferentes situaciones clínicas en los pacientes críticos, comparándola con la termodilución por catéter de arteria pulmonar, incluidos pacientes que han recibido cirugía de revascularización coronaria29,30. La TDTP puede dar medidas inexactas en pacientes con shunts intracardíacos, estenosis aórtica, aneurismas de aorta y tratamientos de circulación extracorpórea.
La medición de volúmenes con este sistema puede modificar la conducta terapéutica, permitiendo un manejo más preciso de la reanimación con fluidos y una optimización en el empleo de fármacos vasoactivos, así como una guía en las terapias depletivas con diuréticos o tratamientos dialíticos.
Al igual que el CAP y por su, aunque mínima, invasividad, las complicaciones que pueden presentar son todas aquellas relacionadas con el catéter, incluida infección, trombosis, sangrado y daño vascular por isquemia del miembro o seudoaneurisma.
Sistema LiDCO plus®
El sistema Lithium Dilution Cardiac Output (LiDCO plus®, London, Reino Unido), de forma similar al anterior, mide el GC a partir de una onda de dilución con cloruro de litio y un sensor periférico del indicador litio, creando una curva similar a la de la termodilución, la cual será utilizada para la calibración continua del GC, latido a latido, basado en el análisis de la fuerza de pulso. Para su calibración, se inyecta un bolo del trazador cloruro de litio (0,002-0,004M/kg) en una vía venosa, central o periférica. Un electrodo situado en una vía arterial, central o periférica, detecta la concentración de litio en sangre arterial y el tiempo transcurrido desde la administración, calculando el gasto cardíaco usando el área bajo la curva de concentración-tiempo. El volumen sistólico es calculado a partir de la potencia de pulso tras la calibración con la solución de litio. Del período medio de paso (MTt) del litio se obtiene el volumen sanguíneo intratorácico (ITBV), como indicador de precarga. Al utilizar el análisis de la onda de presión de pulso para el análisis del VS, como el sistema PiCCO, permite también el cálculo del porcentaje de variación en la presión (VPP) o en el área (VVS), para predecir la respuesta a la fluidoterapia. Con la introducción manual de determinadas variables obtenemos el índice o la resistencia vascular periférica (IRVS/RVS) y el índice de transporte de oxígeno (IDO2). Este último permitiría maximizar el aporte de oxígeno a los tejidos, consiguiendo optimizar la hemodinámica en pacientes de riesgo. En pacientes que presenten shunts intracardíacos, la curva de dilución puede verse alterada, al igual que ocurre con el PiCCO. El uso de relajantes musculares no despolarizantes y el tratamiento con sales de litio también determinarían errores en la determinación del GC.
La técnica del LiDCO muestra una exactitud aceptable si se recalibra de forma frecuente y es menos invasiva que el PiCCO, al no requerir de un acceso venoso central y siendo suficiente la cateterización de la arteria radial. Por otro lado, su calibración es rápida y con pocas complicaciones y ofrece información de forma continua sobre múltiples variables. La medida de GC obtenida mediante litiodilución ha sido validada en comparación con la termodilución por catéter de arteria pulmonar31. De igual forma, la medida de gasto cardíaco continuo obtenido mediante onda de pulso ha sido validada32,33, así como su estabilidad sin necesidad de recalibración hasta 24 h34. Aun así, se recomienda la recalibración siempre que se produzca un cambio sustancial en la situación hemodinámica del paciente, especialmente tras cambios en las medidas de soporte hemodinámico.
Para el más reciente LiDCO rapid®, la dilución de litio se ha sustituido por un normograma que deriva de los datos in vivo para estimar el GC de manera continua. Utiliza el mismo algoritmo de la presión de pulso que el LiDCO plus (PulseCO®). Este sistema cuenta con la simplicidad y la facilidad de uso. Fue diseñado para proporcionar parámetros que fueran fiables y útiles para la terapia con fluidos guiada por objetivos. Múltiples estudios están utilizando el LiDCO rapid como guía para la administración de líquidos y para medir la respuesta tensional a los mismos.
Sistema FloTrac®/Vigileo®
El sistema FloTrac®/Vigileo® (Edwards LifeSciences, Irvine, Estados Unidos) compuesto del sensor FloTrac® y el monitor Vigileo®, a diferencia de los 2 anteriores, analiza el contorno de pulso arterial sin necesidad de calibración externa. La calibración externa es reemplazada por factores de corrección que dependen de la presión arterial media (PAM) y de medidas antropométricas (edad, sexo, peso y altura del paciente). Se basa en el principio que la presión de pulso (diferencia entre la presión sistólica y la diastólica) es proporcional al VS e inversamente proporcional a la distensibilidad aórtica. No precisa de acceso venoso central o periférico, imprescindible para los métodos de dilución del indicador empleados en la calibración manual, ni de la canulación de una arteria de grueso calibre; solo requiere un catéter arterial radial.
Además del GC continuo, proporciona información sobre el VS, la VVS y la RVS. Con la implantación de un catéter venoso central con fibra óptica, tenemos la opción de monitorizar la SvcO2.
Diferentes estudios han demostrado una buena fiabilidad con el uso del FloTrac en diversas situaciones clínicas comparado con la termodilución por CAP35. Sin embargo, el porcentaje de error del FloTrac/Vigileo® comparado con el CAP en pacientes obesos (IMC > 30kg/m2) fue ligeramente más alto que en pacientes con peso normal, debido a la alteración en la distensibilidad arterial que presentan estos enfermos. De igual modo, la exactitud en el resultado es menor en pacientes con RVS disminuidas36. La precisión de este método se ha incrementado con versiones de software consecutivas, y con el último algoritmo actualizado se ha demostrado una aceptable correlación con la termodilución intermitente y la termodilución continua en pacientes post-operados de cirugía cardíaca37.
La determinación de la VVS mediante este sistema demostró exactitud similar a la obtenida con el PiCCO38, así como su uso durante la terapia de fluidos guiada por objetivos, presentando menor número de complicaciones y menor estancia hospitalaria39.
Recientemente se ha incorporado al mercado un nuevo sistema de monitorización hemodinámica, el sistema VolumeView® (Edwards LifeSciences, Irvine, Estados Unidos), que utiliza la termodilución transpulmonar para el cálculo del GC. Del mismo modo que el sistema PiCCO, el GC es calculado por el análisis de la curva de TDTP usando la ecuación de Stewart-Hamilton. Además del GC continuo, permite la obtención de VS, RVS y VVS. A través de la curva de dilución se obtienen parámetros volumétricos como EVLW, PVPI (para cuantificar el edema pulmonar), GEDV y GEF. Aunque se dispone de poca experiencia, los resultados obtenidos hasta el momento son comparables con el sistema PiCCO40.
Sistema MostCare® de Vygon (Vytech, Padova, Italy)
El sistema MostCare® de Vygon (Vytech, Padova, Italia) utiliza el pressure recording analytical method (PRAM), usando una versión modificada del algoritmo de Wesselings de análisis de la onda de pulso arterial. Requiere únicamente un catéter arterial que puede ser radial. El volumen sistólico (VS) es proporcional al área bajo la porción diastólica de la onda de presión arterial dividido por las características de la impedancia aórtica, que se obtiene a partir de los datos morfológicos de la curva de presión sin necesidad de calibración. La impedancia aórtica es estimada mediante una fórmula que utiliza los principios de la mecánica cuántica y de la dinámica de fluidos. Esta fórmula es totalmente diferente a todos los métodos conocidos. El VS se calcula para cada latido, y el GC se obtiene multiplicando el volumen sistólico por la frecuencia cardíaca. El GC se presenta como el valor medio de 12 latidos11. Hasta el momento ha sido validado en modelos animales en diferentes situaciones clínicas41. Estudios recientes han demostrado una correlación significativa entre los valores obtenidos con el método PRAM y los logrados con la termodilución en pacientes hemodinámicamente inestables42, así como en pacientes sépticos, donde la buena correlación con la TDTP no se vio afectada por los cambios en el tono vascular producidos por fármacos vasoactivos43. Presenta un parámetro de monitorización exclusivo, el Cardiac Cycle Efficency o índice de estrés cardíaco (CCE) que consiste en el trabajo realizado por el corazón, dividido por un ratio de gasto de energía. Refleja el gasto energético necesario para que el sistema cardiovascular mantenga un equilibrio hemodinámico. Requiere ser validado mediante nuevos estudios.
Sistema Modelflow-Nexfin®
El sistema Modelflow-Nexfin® (FMS, Amsterdam, Holanda) analiza de forma no invasiva la presión de pulso utilizando la pletismografía fotoeléctrica en combinación con un manguito inflable en el dedo. El GC se calcula mediante la monitorización continua de la presión arterial y el análisis del contorno de la onda de pulso, basado en el análisis del área de la onda de presión sistólica y en el modelo de los 3 elementos de Windkessel individualizado para cada paciente (método Modelflow). Las medidas obtenidas incluyen el GC continuo, el VS, RVS y un índice de contractilidad del VI. Algunos estudios, llevados a cabo en diferentes situaciones clínicas, sugieren una buena correlación con la termodilución44.
El sistema NICO®
El sistema NICO® (Novametrix Medical Systems, Wallingford, Estados Unidos) se basa en el principio de Fick, utilizando como indicador el CO2. Con este método el GC es proporcional al cambio en la producción de CO2 dividido por el end-tidal de CO2 resultante tras un breve período de reinhalación. Presenta diversos inconvenientes que limitan su utilización: pequeños errores de la medición dan lugar a cambios importantes en el cálculo del GC, debido a la escasa diferencia entre la PaCO2 y la PvCO2, no siendo válidos sus resultados en pacientes con PCO2 < 30mm Hg, y tanto en las alteraciones del espacio muerto como en las de la ventilación-perfusión provocan falsos cambios en el GC.
Los estudios de validación de esta técnica comparada con el CAP son limitados; sin embargo, señalan una correlación razonablemente buena. En el post-operatorio de pacientes que han recibido cirugía cardíaca, la medición del GC por reinhalación resulta infraestimado respecto al obtenido a través del CAP. En conclusión, cabe señalar que, por ahora, no constituye un reemplazo para el CAP, pero que es una técnica factible como alternativa, en determinados pacientes, como por ejemplo los sometidos a cirugía cardíaca45,46.
Métodos no Invasivos
Técnicas como la bioimpedancia transtorácica y el Doppler esofágico son técnicas desarrolladas en los últimos años para la valoración del GC y han llegado a tener gran aceptación en la práctica clínica, aunque con ciertas limitaciones.
Sistema NICOM® de biorreactancia eléctrica torácica
La bioimpedancia mide el GC, el VS y la contractilidad cardíaca a partir de medidas continuas de los cambios en la impedancia torácica causada por la fluctuación del volumen sanguíneo a través del ciclo cardíaco. La biorreactancia, método utilizado por el sistema NICOM® (Cheetah Medical Ltd., Maidenhead, Berkshire, Reino Unido), analiza los cambios de amplitud y frecuencia de los impulsos eléctricos a medida que pasan por el tórax. Su ventaja, en comparación con la bioimpedancia, radica en la reducción significativa de factores como la interferencia eléctrica, el movimiento o la posición del paciente, o el desplazamiento de electrodos que pueden resultar en la obtención de datos erróneos. Ofrece una mejor relación señal-ruido si se compara con la bioimpedancia. Dentro de sus limitaciones, debido a que el área bajo la onda de pulso de flujo es proporcional al producto del flujo pico y del tiempo de eyección del ventrículo, en condiciones de bajo flujo, la precisión de las determinaciones del GC puede estar reducida. Sus lecturas presentan una aceptable correlación con los resultados de las mediciones del GC obtenidas a través del CAP, tanto en animales como en humanos y en diferentes situaciones clínicas47-49.
Ultrasonografía Doppler (sistema USCOM®)
Se trata de una técnica no invasiva que utiliza la tecnología Doppler para obtener las medidas de volumen sistólico y sus derivados. Todos los dispositivos médicos que emplean el Doppler utilizan una sonda que emite ondas de sonidos a una frecuencia continua, que rebotan en los eritrocitos en continuo movimiento (o bien se acercan o bien se alejan del transductor), obteniendo así una medida de flujo. Cuando la onda y el eritrocito se encuentran, la onda de sonido que rebota hacia el transductor cambia su frecuencia original en función de la dirección del flujo sanguíneo. Cuando el transductor está alineado con el flujo sanguíneo, se obtiene una frecuencia o velocidad óptima máxima. En el caso del USCOM®, se coloca la sonda a nivel de la escotadura supraesternal, supraclavicular o paraesternal buscando los flujos sanguíneos máximos a nivel del tracto de salida de la válvula aórtica y pulmonar, respectivamente. Las áreas de los tractos de salida se estiman a partir de un algoritmo antropométrico. Con las velocidades y áreas podemos así obtener las medidas de volumen sistólico, gasto cardíaco, índice cardíaco y resistencias vasculares (Figura 1 y Figura 2).
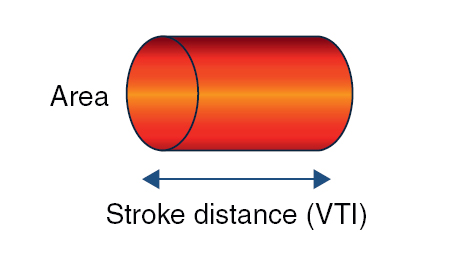
Figura 1. Área seccional de la aorta ascendente × distancia
columna sangre latido a latido (VTI) = volumen sistólico (VS).
Las principales ventajas de este método son las ya descritas para cualquier sistema ecográfico. Es un sistema totalmente no invasivo y que por su tamaño compacto permite mucha agilidad en su utilización a pie de cama. Su aprendizaje es rápido y no requiere calibración.
Por otro lado, hemos de tener en cuenta que se trata de un sistema observador dependiente y que no nos dará información de forma continua. La ventana acústica será también un limitante en su utilización, a pesar de que se dispone de varios accesos posibles (supraesternal, supraclavicular y paraesternal) minimizando esta limitación. Su uso todavía no está expandido por la falta de estudios de validación. La mayoría de los estudios se han realizado en pacientes quirúrgicos o poscirugía cardíaca, comparando el dispositivo USCOM® con el catéter de arteria pulmonar, obteniendo resultados muy dispares. Tom et al.50 compararon 250 medidas obtenidas simultáneamente en 89 pacientes, encontrando una escasa correlación entre los 2 sistemas. La media de las diferencias es 0,09 l/min, pero con unos límites del intervalo de confianza entre 2,83 y -3,01 l/min. Previamente, Chand et al.51 en el mismo tipo de pacientes (n = 50) habían encontrado una excelente correlación con una media de 0,03 l/min y con unos límites entre -0,19 y 0,13 m/min.m. Un estudio reciente, realizado por Horster et al.52 compara las mediciones del gasto cardiaco entre los sistemas PiCCO y USCOM en pacientes sépticos y observa una buena correlación entre el USCOM y la técnica de referencia basada en la termodilución (PiCCO). Setenta mediciones en 70 pacientes muestran una media de las diferencias de - 0,36 l/min con un intervalo de confianza de ± 0,99 l/min.
Serán necesarias investigaciones futuras para acabar de validar e implantar este sistema a pie de cama en las UCI.
Doppler esofágico
El Doppler esofágico es una técnica que empezó a utilizarse en la década de los 1990 en pacientes críticos, con el fin de permitir una monitorización hemodinámica precisa, rápida, continua y, sobre todo, mínimamente invasiva del GC y otros parámetros de demostrada utilidad clínica, proporcionando una visión suficientemente amplia del estado hemodinámico del paciente53. En síntesis, se trata de una sonda Doppler en forma de «D» que emite de forma continua ondas de ultrasonidos Doppler a una frecuencia fijada (generalmente 4-5 MHz), y que se coloca en el esófago (vía nasal u oral) con una inclinación de 45o del vaso sanguíneo explorado, en este caso, la aorta descendente. Dicha señal emitida es rebotada por los corpúsculos sanguíneos en movimiento y nuevamente detectada por la sonda. Esta información se distribuye a un monitor que analiza la señal recibida y muestra una gráfica de ondas de velocidad respecto al tiempo. El área de la onda de velocidad-tiempo es la distancia sistólica, es decir, la distancia recorrida por una columna de sangre por la aorta con cada contracción del ventrículo izquierdo. El producto de la distancia sistólica y del área de sección de la aorta en ese punto permite obtener el volumen sistólico.
Los diferentes monitores de Doppler esofágico disponibles en el mercado presentan distintas soluciones a este problema: por ejemplo, en el caso del CardioQ (Deltex Medical, Chichester, West Sussex, Reino Unido) incorpora un normograma derivado de la edad, peso y altura del paciente para estimar el volumen sistólico total del ventrículo izquierdo a partir del flujo medido en la aorta descendente.
Además del valor de volumen sistólico y GC que nos ofrece esta técnica, resulta especialmente interesante comentar la información sobre el estado cardiovascular (precarga, contractilidad y poscarga) que se puede extraer del análisis de las curvas velocidad-tiempo (Figura 3).
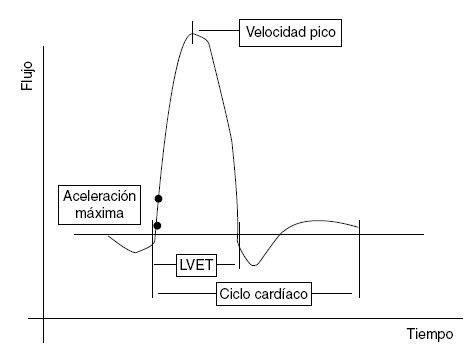
Figura 3. Componentes de una onda de flujo aórtico ideal.
LVET: tiempo de eyección de ventrículo izquierdo.
A pesar de los pocos estudios que existen al respecto, la evidencia disponible en la literatura médica demuestra una buena fiabilidad de las medidas de GC por Doppler esofágico comparado con las medidas clásicas por termodilución. Existe una amplia evidencia científica sustentada en múltiples estudios aleatorizados prospectivos que ha demostrado la utilidad del Doppler esofágico para la optimización peroperatoria de la volemia en el paciente quirúrgico de alto riesgo54-56, demostrando una clara mejoría en el pronóstico de estos pacientes (menos estancia hospitalaria y complicaciones post-operatorias). En el campo del paciente crítico, el Doppler esofágico se postula como una interesante herramienta de monitorización por las características ya comentadas: su aplicación ha sido descrita para la monitorización de pacientes durante las maniobras de reclutamiento pulmonar en el síndrome de dificultad pulmonar aguda57, para el manejo hemodinámico de potenciales donantes de órganos58 e, incluso, para la optimización del modo de estimulación de un marcapasos en pacientes en shock cardiogénico45. Más recientemente, se ha propuesto como herramienta para evaluar la respuesta al volumen en los cambios cíclicos inducidos por la ventilación mecánica y con la maniobra de elevación pasiva de las piernas59,60.
En la tabla 1 quedan reflejadas las diferentes técnicas disponibles y las más utilizadas en pacientes críticos para la estimación del GC, con las ventajas y limitaciones que presentan cada una de ellas. Se incluyen variables hemodinámicas adicionales que son proporcionadas por los diferentes sistemas.
¿Qué sistema o método elegir?
Como hemos visto, disponemos de diferentes herramientas de monitorización, que van a permitir al clínico hacer tanto una evaluación diagnóstica como servir de guía en las diferentes estrategias terapéuticas, especialmente para el manejo de fluidos y fármacos. A su vez, pueden ayudar a mejorar los resultados de los pacientes en términos de reducción de complicaciones, tiempo de duración de la ventilación mecánica, etc., y con ello la morbimortalidad y las estancias hospitalarias.
Cada sistema tiene unas ventajas y unos inconvenientes. La elección de una u otra técnica de monitorización va a estar influida por diversos factores, fundamentalmente, las características del sistema, los factores ligados al paciente y los ligados al clínico que lo utiliza. Las consideraciones que se deben tener en cuenta respecto al sistema serán: su disponibilidad, el ámbito donde va a ser utilizado y el coste del aparato. Con respecto al clínico serán: el conocimiento de la técnica, la experiencia del operador, la facilidad de uso e interpretación de los resultados y el que sea o no dependiente del operador. El factor tiempo llevará en muchas ocasiones a la elección de técnicas menos invasivas que puedan ser aplicadas de forma inmediata. Las condiciones generales, en relación con las características del paciente, se centran en que cuanto más enfermo esté el paciente, la necesidad de precisión de los parámetros hemodinámicos obtenidos es mayor, siendo las técnicas invasivas las que, por el momento, para una monitorización continua, cumplen esta premisa. Las técnicas que hemos denominado menos invasivas, sin necesidad de cateterización venosa central, podrían ser de mayor utilidad en los servicios de urgencias o en determinadas áreas hospitalarias para el tratamiento inicial del paciente, para valorar su evolución y decidir su ingreso o no en UCI, así como en aquellos pacientes en los que no se considera indicado su ingreso en el área de críticos, por su enfermedad subyacente, pero que necesitan ser tratados y estabilizados. En otras ocasiones, recurriremos a técnicas más invasivas, eligiendo unas u otras según la enfermedad del paciente.
Así pues, el CAP y las mediciones del PAPO parecen seguir siendo de mayor utilidad en pacientes con distintos tipos de insuficiencia cardíaca, en el shock cardiogénico o en pacientes con hipertensión pulmonar. La ecocardiografía y el Doppler esofágico se pueden considerar de elección siempre que la habilidad de los operadores esté garantizada durante la evolución de los pacientes, y en aquellos casos en los que exista una contraindicación para la implantación de un catéter intracardíaco.
Las técnicas de dilución transpulmonar que determinan los volúmenes intratorácicos (GED y el agua extravascular pulmonar (EVLW) se pueden considerar de elección para guiar el manejo de fluidos, mejorar la función pulmonar y disminuir el tiempo de ventilación mecánica en la insuficiencia respiratoria aguda y el SDRA.
En la sepsis grave y el shock séptico, parece más indicado optar por los sistemas que obtienen el GC mediante el análisis del contorno de la onda de pulso arterial. Proporcionan información acerca de la fase de shock en que se encuentra el paciente, aunque necesitan de frecuentes calibraciones en sus fases iniciales, debido a la afectación del tono vascular.
Los sistemas y parámetros empleados para la valoración de la respuesta a fluidos, incluyen: los volúmenes cardíacos derivados de la dilución transpulmonar (la VPP y VVS son los parámetros que pueden guiar la respuesta al aporte de volumen), la velocidad de flujo del Doppler esofágico y los índices ecocardiográficos, así como índices dinámicos obtenidos a partir de los métodos que utilizan el análisis del contorno de la onda de pulso. La mayor polémica suscitada en los últimos años hace referencia al aporte de volumen en las fases iniciales del shock. Aunque la PVC sigue siendo usada en la práctica diaria para el manejo de volumen, los parámetros volumétricos se consideran de mayor utilidad que las presiones de llenado, ya que no se ven alterados por el ciclo respiratorio. Del mismo modo, los índices dinámicos obtenidos a partir del análisis de la onda de pulso presentan unas limitaciones que conviene tener en cuenta a la hora de monitorizar al paciente, ya que solo son aplicables en ventilación mecánica controlada y con un ritmo cardíaco regular y normofrecuente61.
Independientemente del proceso, del dispositivo empleado y de las variables utilizadas para dirigir nuestra actuación, debemos tener presente que nuestro objetivo debe estar dirigido a mejorar la perfusión tisular, esto es, a restaurar los valores fisiológicos del transporte-consumo de oxígeno, a través de la valoración de los niveles de lactato y de la SvO2/SvcO262.
Conclusiones
La monitorización hemodinámica tiene como objetivo final disminuir la mortalidad de los pacientes en estado crítico. En el momento actual, disponemos de diferentes técnicas más o menos invasivas, que permiten la monitorización de diferentes parámetros hemodinámicos. La elección de uno u otro dispositivo va a estar determinada por los siguientes aspectos: la experiencia del operador en el manejo de la técnica, la facilidad de uso e interpretación de resultados, la precisión del sistema y el coste-efectividad de la misma.
El ámbito de utilización, la gravedad del paciente y los objetivos a perseguir tanto diagnósticos como terapéuticos contribuirán a la elección de uno de los sistemas y métodos citados en esta revisión. Para que el facultativo pueda utilizar de modo eficaz cualquiera de estos dispositivos, es necesario que comprenda su funcionamiento, sus ventajas e inconvenientes y los escenarios más propicios para cada uno de ellos y, por supuesto, saber interpretar los datos obtenidos.
Para terminar, podemos concluir que la monitorización del paciente crítico debe ser global; una monitorización multiparamétrica, que combine los parámetros hemodinámicos referidos en este capítulo y los datos metabólicos del transporte y consumo de oxígeno celular, complementándose entre sí con el objetivo de optimizar la perfusión tisular y aumentar la supervivencia de los enfermos críticos.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Bibliografía
1. Swan HJC, Ganz W, Forrester JS, Marcus H, Diamond G, Chonette D. Catheterization of the heart in man with the use of a flow-directed balloon tipped catheter. N Engl J Med. 1970; 283:447-51. [ Links ]
2. Connors AF, Speroff T, Dawson NV, Thomas C, Harrell FE, Wagner D, et al, for the SUPPORT Investigators. The effectiveness of right heart catheterization in the initial care of critically ill patients. JAMA. 1996; 276:889-97. [ Links ]
3. Polanczyk CA, Rohde LE, Goldman L, Cook EF, Thomas EJ, Marcantonio ER, et al. Right heart catheterization and cardiac complication in patients undergoing noncardiac surgery: an observational study. JAMA. 2001; 286:309-14. [ Links ]
4. Richard C, Warszawski J, Anguel N, Deye N, Combes A, Barnoud D, et al. Early use of the pulmonary artery catheter and outcomes in patients with shock and acute respiratory distress syndrome: a randomized controlled trial. JAMA. 2003; 290:2713-20. [ Links ]
5. Rhodes A, Cusack RJ, Newman PJ, Grounds RM, Benett ED. A randomized, controlled trial of the pulmonary artery catheter in critically ill patients. Intensive Care Med. 2002; 28:256-64. [ Links ]
6. Harvey S, Harrison DA, Singer M, Ashcroft J, Jones CM, Elbourne D, et al. Assessment of the clinical effectiveness of pulmonary artery catheters in management of patients in intensive care (PAC-Man): a randomized controlled trial. Lancet. 2005; 366:472-7. [ Links ]
7. The National Heart, Lung, Blood Institute Acute Respiratory Distress Syndrome (ARDS). Clinical trials Network. Pulmonary artery versus central venous catheter to guide treatment of acute lung injury. N Engl J Med. 2006; 354:2213-24. [ Links ]
8. Pinsky MR, Vincent JL. Let us use the pulmonary artery catheter correctly and only when we need it. Crit Care Med. 2005; 33:1119-22. [ Links ]
9. Vincent JL, Pinsky MR, Sprung C, Levy M, Marini JJ, Payen D, et al. The pulmonary artery catheter: in medio virtus. Crit Care Med. 2008; 36:3093-6. [ Links ]
10. Alhashemi JA, Cecconi M, Hofer C. Cardiac output monitoring: an integrative perspective. Crit Care. 2011; 15:214. [ Links ]
11. Geerts BF, Aarts LP, Jansen JR. Methods in pharmacology: measurement of cardiac output. Br J Clin Pharmacol. 2011; 71:316-30. [ Links ]
12. Lee AJ, Cohn JH, Ranasinghe JS. Cardiac output assessed by invasive and minimally. Anesthesiol Res Pract. 2011; 2011:151-475. [ Links ]
13. García X, Mateu L, Maynar J, Mercadal J, Ochagavía A, Ferrándiz A. Estimación del gasto cardíaco. Utilidad en la práctica clínica. Monitorización disponible invasiva y no invasiva. Med Intensiva. 2011; 35:552-61. [ Links ]
14. Boussuges A, Blanc P, Molenat F, Burnet H, Habib G, Sainty JM. Evaluation of left ventricular filling pressure by transthoracic Doppler echocardiography in the intensive care unit. Crit Care Med. 2002; 30:362-7. [ Links ]
15. Voga G. Pulmonary artery occlusion pressure estimation by transesophageal echocardiography: is simpler better?. Crit Care. 2008; 12:127. [ Links ]
16. Michard F, Teboul JL. Predicting fluid responsiveness in ICU patients: a critical analysis of the evidence. Chest. 2002; 121:2000-8. [ Links ]
17. Pinsky MR. Hemodynamic Profile, Interpretation. En: Tobin M.J., editors. Principles and Practice of Intensive Care Monitoring. New York: McGraw-Hill; 1998. p. 871-888. [ Links ]
18. Ospina-Tascon GA, Cordioli RL, Vincent JL. What type of monitoring has been shown to improve outcomes in acutely ill patients. Intensive Care Med. 2008; 34:800-20. [ Links ]
19. Vincent JL, Bihari D, Suter PM, Bruining HA, White J, Nicolas-Chanoin MH, et al. The prevalence of nosocomial infection in intensive care units in Europe, Results of the European Prevalence of Infection in Intensive Care (EPIC) study. EPIC International Advisory Committee. JAMA. 1995; 274:639-44. [ Links ]
20. Sakr Y, Vincent JL, Reinhart K, Payen D, Wiedermann CJ, Zandstra DF, et al. Use of the pulmonary artery catheter is not associated with worse outcome in the intensive care unit. Chest. 2005; 128:2722-31. [ Links ]
21. Iberti TJ, Daily EK, Leibowitz AB, Panacek EA, Silverstein JH, Albertson TE. A multicenter study of physicians knowledge of the pulmonary artery catheter, Pulmonary Artery Catheter Study Group. JAMA. 1990; 264:2928-32. [ Links ]
22. Polonen P, Ruokonen E, Hippelainen M, Poyhonen M, Takala J. A prospective, randomized study of goal oriented hemodynamic therapy in cardiac surgical patients. Anaesth Analg. 2000; 90:1052-9. [ Links ]
23. Tuchschmidt J, Fried J, Astiz M, Rackow E. Elevation of cardiac output and oxygen delivery improves outcome in septic shock. Chest. 1992; 102:216-20. [ Links ]
24. Lobo SMA, Salgado PF, Castillo VGT, Borim AA, Polachini CA, Palchetti JC, et al. Effects of maximizing oxygen delivery on morbidity and mortality in high risk surgical patients. Crit Care Med. 2000; 28:3396-404. [ Links ]
25. Kern JW, Shoemaker WC. Meta-analysis of hemodynamic optimization in high-risk patients. Crit Care Med. 2002; 30:1686-92. [ Links ]
26. Hadian M, Pinsky MR. Evidence-based review of the use of the pulmonary artery catheter: impact data and complications. Crit Care. 2006; 10(Suppl 3):S8. [ Links ]
27. Frank O. Die Gründform des arterielen Pulses erste Abhandlung: mathematische Analyse. Z Biol. 1899; 483-526. [ Links ]
28. Goedje O, Hoeke K, Lichtwarck-Aschoff M, Faltchauser A, Lamm P, Reichart B. Continuous cardiac output by femoral arterial thermodilution calibrated pulse contour análisis: comparison with pulmonary arterial thermodilution. Crit Care Med. 1999; 27:2407-12. [ Links ]
29. Chakravarthy M, Patil TA, Jayaprakash K, Kalligud P, Prabhakumar D, Jawali V. Comparison of simultaneous estimation of cardiac output by four techniques in patients undergoing off-pump coronary artery bypass surgery-aprospective observational study. Ann Cardiac Anaesth. 2007; 10:121-6. [ Links ]
30. Boyle M, Lawrence J, Belessis A, Murgo M, Shehabi Y. Comparison of dynamic measurements of pulse contour with pulsed heat cpontinuous cardiac output in postoperative cardiac surgical patients. Austr Crit Care. 2007; 20:27-32. [ Links ]
31. Garcia-Rodriguez C, Pittman J, Cassell CH, Sum-Ping J, El-Moalem H, Young C, et al. Lithium dilution cardiac output measurement: A Clinical assessment of central venous and peripheral venous indicator injection. Crit Care Med. 2002; 30:2199-204. [ Links ]
32. Hamilton TT, Huber LM, Jessen ME. PulseCOTM: a less-lnvasive method to monitor cardiac output from arterial pressure after cardiac surgery. Ann Thorac Surg. 2002; 74:S1408-12. [ Links ]
33. Pittman J, Bar Yosef S, Sum Ping J, Sherwood M, Mark J. Continuous cardiac output monitoring with pulse contour analysis: A comparison with lithium indicator dilution cardiac output measurement. Crit Care Med. 2005; 33:2015-21. [ Links ]
34. Smith J, Kirwan C, Lei K, Beale R. A comparison of two calibrated, continuous, arterial waveform based measurements of cardiac output over 24hours. Crit Care Med. 2005; 33(Suppl 12):. 207-S; A56. [ Links ]
35. McGee WT, Horswell JL, Calderon J, Janvier G, Van Severen T, Van den Berghe G, et al. Validation of a continuous, arterial pressure-based cardiac output measurement: a multicenter, prospective clinical trial. Crit Care. 2007; 11:R105. [ Links ]
36. Sakka SG, Kozieras J, Thuemer O, Van Hout N. Measurement of cardiac output: a comparison between transpulmonary thermodilution and uncalibrated pulse contour análisis. Br J Anaesth. 2007; 99:337-42. [ Links ]
37. Mayer J, Boldt J, Poland R, Peterson A, Manecke GR. Continuous arterial pressure waveform-based cardiac output using the FloTrac/Vigileo: a review and meta-analysis. Emerging technology review. J Cardiothor Vasc Anesth. 2009; 23:401-6. [ Links ]
38. Hofer CK, Senn A, Weibel L, Zollinger A. Assessment of stroke volumen variation for prediction of fluid responsiveness using the modified FloTracTM and PiCCO plusTM Critical Care. 2008; 12:R82. [ Links ]
39. Mayer J, Boldt J, Mengistu AM, Röhm D, Suttner S. Goal directed intraoperative therapy base on autocalibrated arterial pressure reduces hospital stay in high-risk surgical patients: a randomized, controlled trial. Crit Care. 2010; 14:R18. [ Links ]
40. Bendjelid K, Giraud R, Siegenthaler N, Michard F. Validation of a new transpulmonary thermodilution system to assess global end-diastolic volume and extravascular lung water. Crit Care. 2010; 14:R209. [ Links ]
41. Scolleta S, Romano SM, Biagioli B, Capannini G, Giomarelli P. Pressure recording analytical method (PRAM) for measurement of cardiac output duriong various hemodynamic states. Br J Anaesth. 2005; 95:159-65. [ Links ]
42. Zangrillo A, Maj G, Monaco F, Scandroglio AM, Nuzzi M, Plumari V, et al. Cardiac index validation using the pressure recording analytic method in unstable patients. J Cardiothorac Vasc Anesth. 2010; 24:265-9. [ Links ]
43. Franchi F, Silvestri R, Cubattoli L, Taccone FS, Donadello K, Romano SM, et al. Comparison between an uncalibrated pulse contour method and thermodilution technique for cardiac output estimation in septic patients. Br J Anaesth. 2011; 107:202-8. [ Links ]
44. Mathews L, Singh K. Cardiac output monitoring. Ann Cardiac Anaesth. 2008; 11:56-68. [ Links ]
45. Jover JL, Soro M, Belda FJ, Aguilar G, Caro P, Ferrandis R. Medición del gasto cardíaco en el postoperatorio de cirugía cardíaca: Validez de la reinhalación parcial de CO2. (NICO®) frente a la termodilución continua mediante catéter de arteria pulmonar. Rev Esp Anestesiol Reanim. 2005; 52:256-62. [ Links ]
46. Gueret G, Kiss G, Rossignol B, Bezon E, Wargnier JP, Miossec A, et al. Cardiac output measurements in off-pump coronary surgery: comparison between NICO and the Swan-Ganz catheter. Eur J Anaesthesiol. 2006; 23:848-54. [ Links ]
47. Keren H, Burkhoff D, Squara P. Evaluation of a noninvasive continuous cardiac output monitoring system based on thoracic bioreactance. Am J Physiol. 2007; 293:H583-9. [ Links ]
48. Squara P, Denjean D, Estagnasie P, Brusset A, Dib JC, Dubois C. Noninvasive cardiac output monitoring (NICOM): a clinical validation. Intensive Care Med. 2007; 33:1191-4. [ Links ]
49. Raval NY, Squara P, Cleman M, Yalamanchili K, Winklmaier M, Burkhoff D. Multicenter evaluation of noninvasive cardiac output measurement by bioreactance technique. J Clin Monit Comput. 2008. [ Links ]
50. Thom O, Taylor DM, Wolfe RE, Cade J, Myles P, Krum H, et al. Comparison of a supra-sternal cardiac output monitor (USCOM) with the pulmonary artery catheter. Br J Anaesth. 2009; 103:800-4. [ Links ]
51. Chand R, Mehta Y, Trehan N. Cardiac output estimation with a new Doppler device after off-pump coronary artery bypass surgery. J Cardiothoracic Vasc Anesth. 2006; 20:315-9. [ Links ]
52. Horster S, Stemmler HJ, Strecker N, Brettner F, Haussmann A, Cnossen J, et al. Cardiac ouput measurements in septic patients: comparing the accuracy of USCOM to PiCCO. Crit Care Res Parct. 2012; 270-631. [ Links ]
53. Monge MI, Estella Á, Díaz JC, Gil A. Monitorización hemodinámica mínimamente invasiva con eco-doppler esofágico. Med Intensiva. 2008; 32:33-44. [ Links ]
54. Sinclair S, James S, Singer M. Intraoperative intravascular volume optimisation and length of hospital stay after repair of proximal femoral fracture: randomised controlled trial. BMJ. 1997; 315:909-12. [ Links ]
55. Conway DH, Mayall R, Abdul-Latif MS, Gilligan S, Tackaberry C. Randomised controlled trial investigating the influence of intravenous fluid titration using oesophageal Doppler monitoring during bowel surgery. Anaesthesia. 2002; 57:845-9. [ Links ]
56. Noblett SE, Snowden CP, Shenton BK, Horgan AF. Randomised clinical trial assessing the effect of Doppler-optimized fluid management on outcome after elective colorectal resection. Br J Surg. 2006; 93:1069-76. [ Links ]
57. Monge MI, Gil A, Estella A, Sainz A, Díaz JC. Acute cardiorrespiratory effects during stepwise lung recruitment maneuver. Intensive Care Med. 2006; 32:S121. [ Links ]
58. Cipolla J, Stawicki S, Spatz D. Hemodynamic monitoring of organ donors: a novel use of esophageal echo-Doppler probe. Am Surg. 2006; 72:500-4. [ Links ]
59. Vallé F, Fourcade O, De Soyres O, Angles O, Sánchez-Verlaan P, Pillard F, et al. Stroke volume variations calculated by esophageal Doppler is a reliable predictor of luid response. Intensive Care Med. 2005; 31:1388-93. [ Links ]
60. Monnet X, Rienzo M, Osman D, Anguel N, Richard C, Pinsky MR, et al. Passive leg raising predicts fluid responsiveness in the critically ill. Crit Care Med. 2006; 34:1402-7. [ Links ]
61. Slagt C, Breukers RM, Groeneveld J. Choosing patient-tailored hemdynamic monitoring. Crit Care. 2010; 14:208. [ Links ]
62. Mesquida J, Borrat X, Lorente JA, Masip J, Baigorri F. Objetivos de la reanimación hemodinámica. Med Intensiva. 2011; 35:499-508. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
lidonmateu@gmail.com
(M.L. Mateu Campos).
















