Meu SciELO
Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Nefrología (Madrid)
versão On-line ISSN 1989-2284versão impressa ISSN 0211-6995
Nefrología (Madr.) vol.32 no.2 Cantabria 2012
Tratamiento con ácido tranexámico de la hematuria incoercible en la poliquistosis renal autosómica dominante
Medical therapy with tranexamic acid in autosomal dominant polycystic kidney disease patients with severe haematuria
Ramón Peces1, Ana Aguilar1, Cristina Vega1, Emilio Cuesta2, Carlos Peces3, Rafael Selgas1
1Servicio de Nefrología. Hospital Universitario La Paz. IdiPAZ. Madrid
2Servicio de Radiología. Hospital Universitario La Paz. IdiPAZ. Madrid
3Área de Tecnología de la Información. SESCAM. Toledo
Este estudio se llevó a cabo, en parte, con una ayuda del Instituto de Salud Carlos III, Ministerio de Ciencia e Innovación (EC08/00236) y el Programa Intensificación Actividad Investigadora (IdiPAZ y Agencia Laín-Entralgo/CM) a R.P.
Dirección para correspondencia
RESUMEN
Antecedentes: En la poliquistosis renal autosómica dominante (PQRAD), la hematuria macroscópica por la rotura de quistes renales es una manifestación habitual, que puede ser espontánea o el resultado de un traumatismo, cálculos renales, un tumor o una infección. El sangrado del quiste puede verse prolongado por la activación local de la fibrinólisis por uroquinasa. El manejo de la hematuria, en la mayoría de los pacientes con PQRAD, suele ser conservador con reposo, transfusiones, corrección de las coagulopatías, uso de desmopresina y agentes estimulantes de la eritropoyesis. En algunos casos de hematuria incoercible, puede ser necesaria la embolización y hasta la nefrectomía. Otras modalidades terapéuticas han tratado de evitar la hospitalización prolongada y la nefrectomía, intentando preservar la función renal con la administración de agentes antifibrinolíticos.
Objetivo: El objetivo del estudio fue analizar, de forma prospectiva, la respuesta a la administración de ácido tranexámico en pacientes con PQRAD y con hematuria masiva incoercible o que no cede con tratamiento convencional.
Resultados: Se evaluó su acción sobre la función renal, así como el desarrollo de efectos secundarios. Un total de ocho pacientes recibieron ácido tranexámico por vía oral o i.v., durante de 2 a 5 días, y en todos los casos la hematuria cedió de forma inmediata o en el plazo de pocos días, manteniendo estables los niveles de hemoglobina y de función renal. No se observaron complicaciones tromboembólicas o de otro tipo. En esta serie de casos, que hasta ahora es el mayor estudio prospectivo que se ha comunicado y el único que incluye diferentes grados de función renal, el ácido tranexámico se confirma como una herramienta prometedora para tratar la hematuria debida a hemorragia quística en la PQRAD.
Conclusiones: El ácido tranexámico puede utilizarse de forma segura para el tratamiento de la hematuria sin respuesta a la terapia convencional en la PQRAD. El tratamiento resultó eficaz, tanto en los pacientes con función renal conservada como en aquéllos con insuficiencia renal crónica. El fármaco puede administrarse por vía oral o i.v., siendo necesario ajustar las dosis según el grado de función renal. La terapia con ácido tranexámico puede preservar la función renal directamente, al parar y espaciar los episodios acumulativos de hematuria, o indirectamente, evitando la embolización y la nefrectomía. Es necesario realizar estudios prospectivos controlados y aleatorizados para obtener conclusiones más definitivas.
Palabras clave: Ácido tranexámico, Antifibrinolítico, Función renal, Hematuria, Hemorragia quística, PQRAD.
ABSTRACT
Background: Gross haematuria is a common manifestation of autosomal dominant polycystic kidney disease (ADPKD). It can be spontaneous or can result from trauma, renal calculi, tumour, or infection. Spontaneous cyst bleeding is important to consider in this particular group of patients, since it can be prolonged by local activation of fibrinolysis by urokinase. The management of haematuria in ADPKD is usually conservative, including bed rest, blood transfusion, correction of coagulopathies, and use of DDAVP, and erythropoietin stimulating agents. In some patients, the management of gross or life-threatening haematuria may require embolization and/or nephrectomy. Nonetheless, other modalities have been tried to avoid prolonged hospitalization and nephrectomy and to preserve kidney function. These include the use of anti-fibrinolytics. Tranexamic acid was recently suggested as a tool to treat gross haematuria in ADPKD, in single isolated cases.
Objective: The aim of this study was to evaluate prospectively the response to tranexamic acid administration in a group of 8 patients with ADPKD and gross haematuria unresponsive to conventional treatment.
Results: The massive bleeding promptly stopped within 2 to 5 days in all patients. The haemoglobin level and renal function subsequently stabilized. There were not side effects including thromboembolic events. In this case series, the largest prospective one study so far published and the only one including different degrees of renal function, tranexamic acid is confirmed as a promising tool for treating haematuria due to intracystic bleeding in ADPKD.
Conclusions: In summary, tranexamic acid can be used safely in some ADPKD patients with chronic renal impairment or preserved renal function to treat severe haematuria poorly responsive to conventional therapy. Tranexamic acid can be administered orally or IV; and dose adjustment for renal impairment is important. Tranexamic acid therapy may preserve renal function in ADPKD, directly, by stopping haematuria episodes, or indirectly, by avoidance of embolization and/or nephrectomy. The major limitation of this study is the small sample size and the lack of an untreated control group. We suggest a prospective, randomized controlled study to confirm the efficacy of this treatment, its long-term safety, and the optimal dosage. Further larger and multicenter studies are needed to evaluate the cost-benefit ratio and the limits of this therapy in the clinical setting.
Key words: Tranexamic acid, Antifibrinolytic, Renal function, Haematuria, Cyst bleeding, ADPKD.
Introducción
La hematuria es un problema frecuente en la poliquistosis renal autosómica dominante (PQRAD), puesto que más del 60% de los pacientes experimentan al menos un episodio de hematuria macroscópica1-4. Estos episodios habitualmente se controlan con tratamiento médico conservador y raramente necesitan intervención quirúrgica. Aunque autolimitados, los episodios acumulativos de hematuria macroscópica pueden tener un impacto desfavorable sobre la función renal a largo plazo3,4. Por otra parte, con la extensión del uso de las técnicas de imagen, como la resonancia magnética (RM) y la tomografía computarizada (TC), pueden observarse hemorragias intraquísticas que en muchos casos habían pasado totalmente desapercibidas. Estos hechos tienen gran importancia, ya que se conoce que los pacientes con PQRAD que presentan frecuentes episodios de hematuria o evidencias de hemorragias intraquísticas tienen una evolución más rápida hacia la insuficiencia renal crónica (IRC)5,6. El tratamiento conservador de la hematuria en la PQRAD consiste en reposo en cama, transfusiones de sangre, líquidos i.v., corrección de las coagulopatías, utilización de vasopresina y factores estimulantes de la eritropoyesis. En la actualidad, en las hematurias incoercibles, aparte de intervenciones invasivas como la embolización o la nefrectomía, no se dispone de tratamiento médico eficaz para estos pacientes7. No obstante, para evitar la hospitalización prolongada, para preservar la función renal y, en algunas ocasiones, evitar la embolización y la nefrectomía, se han ensayado otras modalidades terapéuticas. Éstas incluyen el empleo de agentes antifibrinolíticos, tales como la aprotinina y el ácido épsilon aminocaproico8, y más recientemente el ácido tranexámico9,10.
El ácido tranexámico es un análogo sintético de lisina que tiene fuerte actividad antifibrinolítica y se utiliza habitualmente en el tratamiento de diversas alteraciones que predisponen al sangrado, incluida la IRC11-16. En varios estudios se ha demostrado que reduce la pérdida de sangre en las pacientes con menorragia primaria, y en sujetos sometidos a by-pass cardiopulmonar, prostatectomía, sustitución de cadera y trasplante hepático17. Sin embargo, no se ha establecido el efecto de las dosis bajas de ácido tranexámico en el control del sangrado quístico y en la función renal, en pacientes con PQRAD que presentan función renal relativamente conservada o cierto grado de IRC. Además, debido a que la hiperfibrinólisis sistémica y local puede jugar un papel en el sangrado quístico de la PQRAD13, se administró ácido tranexámico a una serie de pacientes, con distinto grado de función renal, que presentaron hematuria incoercible que no respondió al tratamiento convencional.
Pacientes y resultados
Se trata de un estudio observacional. Entre 2009-2011, ocho pacientes con PQRAD (5 hombres y 3 mujeres, edad 23-51 años), que acudieron a consultar o fueron remitidos por hematuria incoercible con la sospecha de hemorragia quística, recibieron tratamiento con ácido tranexámico (Amchafibrin®, Rottapharm, España). En todos los casos se utilizaron ultrasonografía (US), TC y/o RM para el diagnóstico y el seguimiento. Se revisaron las historias clínicas y las exploraciones de imagen realizadas para detectar el origen de las hemorragias quísticas. En todos ellos, el volumen renal total medido por segmentación manual estaba muy aumentado y las imágenes de RM y/o TC mostraron numerosos quistes con signos de hemorragia intraquística. En el Caso 4, se ensayó un tratamiento inicial con cuatro dosis de factor VII recombinante (Novoseven®, Novo Nordisk, España), resultando ineficaz. El Caso 5 estaba diagnosticado también de hemoglobina con rasgo falciforme y tenía una historia de hematuria recurrente. Tres de los ocho pacientes fueron tratados con ácido tranexámico por vía i.v., líquidos, analgésicos y transfusiones. Tras el cese de la hematuria y la estabilización de los niveles de hemoglobina, fueron dados de alta en uno o dos días. Los otros cinco pacientes recibieron tratamiento ambulatorio con ácido tranexámico por vía oral. En todos los casos la hematuria cedió de forma inmediata o en el plazo de pocos días, manteniendo estables los niveles de hemoglobina y de función renal. No se observaron complicaciones tromboembólicas o de otro tipo. No se produjeron nuevos episodios de hematuria en los tres meses siguientes al alta.
En la tabla 1 se resumen los datos clínicos y evolutivos de los ocho pacientes tratados con ácido tranexámico. En la figura 1 se muestra un ejemplo de quistes renales con signos de hemorragia intraquística.
Tabla 1. Datos clínicos de los pacientes con PQRAD antes y después del tratamiento con ácido tranexámico 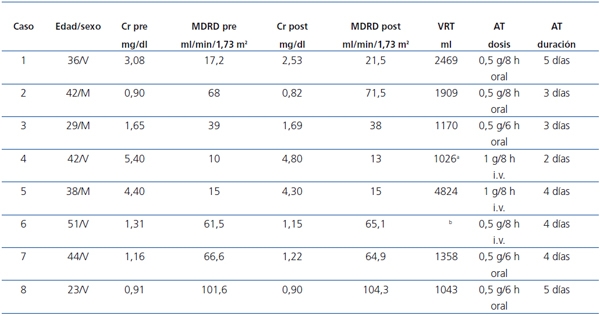
* Riñón único; ** Enormes riñones poliquísticos sin función (Tx renal fucnionante).
AT: ácido tranexámico; Cr: creatinina; MDRD: Modification of Diet in Renal Disease;
PQRAD: poliquistosis renal autosómica dominante; VRT: volumen renal total.

Figura 1. Resonancia magnética del caso 6 mostrando numerosos quistes
renales con signos de sangrado intraquístico y niveles líquido-líquido
Discusión
En la PQRAD, la hematuria macroscópica derivada de la rotura de quistes renales es una manifestación habitual. Así, la hematuria es el signo de presentación en el 35% de los casos, y en el 60% de los pacientes se observa hematuria macroscópica o microscópica1-6. El riesgo de hematuria parece asociarse con la presencia de hipertensión arterial y con el aumento del tamaño de los quistes. Si bien la mayoría de los pacientes refieren posibles causas precipitantes, como traumatismos y ejercicios violentos, no se ha demostrado de forma inequívoca una asociación precisa. Aunque los riñones poliquísticos son poco susceptibles al daño traumático, un traumatismo ligero18-20 puede conducir a hemorragia intrarrenal o a sangrado en el espacio retroperitoneal, acompañándose de dolor intenso, que a menudo requiere el uso de narcóticos para su alivio21,22. Los quistes se asocian con excesiva angiogénesis, evidenciada por vasos frágiles que se extienden a través de sus paredes distendidas23,24. Estos vasos presentan varias malformaciones, como aneurismas y formas espirales. Cuando son traumatizados, o bien espontáneamente, estos vasos pueden perder sangre al interior del quiste, dando lugar a que éste se expanda rápidamente y provoque un dolor intenso. Si el sangrado continúa, el quiste puede romperse en el sistema colector y causar hematuria macroscópica. Alternativamente, el quiste puede romperse en el compartimento subcapsular y de forma eventual disecar a través de la cápsula renal, ocupando el espacio retroperitoneal. En el sangrado masivo, la sangre puede alcanzar la piel que cubre el flanco y el abdomen, donde se reconoce como equímosis subcutánea (signo de Gray-Turner). Las hemorragias intraquísticas en el riñón pueden diagnosticarse utilizando la US, la TC o la RM, sin embargo, el diagnóstico es difícil cuando existe una hemorragia persistente si la misma es extremadamente pequeña. Por otra parte, la tomografía por emisión de positrones-TC permite diferenciar las hemorragias de las infecciones quísticas25-27. Así, las evidencias de los estudios con TC indican que la hemorragia intraquística, manifestada como quiste subcapsular «hiperdenso», ocurre en > 90% de aquellos pacientes con PQRAD28,29. Con frecuencia, docenas de quistes superficiales llevan la marca del sangrado intraquístico. La inspección directa de los quistes «hiperdensos» ha revelado que están llenos de detritos celulares, derivados de la destrucción de productos de la sangre.
Los pacientes con una historia de hemorragia renal, evidenciada por episodios repetidos de hematuria macroscópica, tienen los riñones mayores1-6 y progresan más rápidamente hacia la insuficiencia renal que aquéllos sin esta historia. En un estudio retrospectivo, Gabowet al.1,2 encontraron que los atletas varones que tenían PQRAD y participaron en deportes de contacto tenían más episodios hematúricos y desarrollaron insuficiencia renal más pronto que aquellos que no participaron. Por lo tanto, se puede afirmar que la hemorragia renal causada por rotura de quistes puede ocurrir a cualquier edad y disminuye la calidad de vida del paciente. Además, la hemorragia se asocia con riñones de mayor tamaño y con pérdida acelerada de la función renal. Actualmente, aparte del tratamiento conservador y la utilización de intervenciones invasivas como la embolización y/o la nefrectomía, no se dispone de tratamiento médico para los pacientes con PQRAD con hemorragia severa incoercible de los riñones poliquísticos.
El ácido tranexámico (ácido 4-(aminomethyl) cyclohexanecarboxylic) se utiliza habitualmente en el tratamiento de diversas alteraciones que predisponen al sangrado11-16. Es un análogo sintético de lisina que tiene fuerte actividad antifibrinolítica. El plasminógeno se une a la fibrina para formar plasmina, que degrada la fibrina en productos de degradación de la fibrina. El ácido tranexámico bloquea el sitio de unión de la lisina en el plasminógeno y previene la interacción con la fibrina. Es de 7 a 10 veces más potente que el ácido épsilon aminocaproico en la inhibición de la fibrinólisis. Algunos ensayos clínicos han demostrado que reduce la pérdida de sangre en las pacientes con menorragia primaria y en los sometidos a by-pass cardiopulmonar, prostatectomía, recambio de cadera y trasplante hepático17. Recientemente, se ha comunicado también su eficacia en el tratamiento de la hematuria en pacientes con enfermedad de células falciformes30. El ácido tranexámico, por lo general, es bien tolerado. Aunque se han comunicado algunos casos de necrosis cortical renal31,32, sus efectos colaterales son principalmente gastrointestinales, como náuseas, vómitos, diarrea y dolor abdominal. Sólo en un caso se ha comunicado el desarrollo de mioclonías y encefalopatía, que fue achacado a sobredosis del fármaco33. El ácido tranexámico es excretado por filtración glomerular, por lo que se acumula en presencia de una reducción de la función renal, y en los pacientes con IRC se requiere ajuste de las dosis. Por otra parte, no se ha estudiado la eficacia de la hemodiálisis en la eliminación del fármaco15,16. La dosis habitual es de 10 mg/kg, 3 o 4 veces al día. Sin embargo, Andersson et al.34 han recomendado una reducción de la dosis en los pacientes con deterioro de la función renal. Así, con creatinina sérica de 120-250μmol/l (1,36-2,83 mg/dl), 10 mg/kg i.v. dos veces al día; con creatinina sérica de 250-500μmol/l (2,83-5,66 mg/dl), 10 mg/kg i.v. una vez al día; con creatinina sérica ≥ 500μmol/l (5,66 mg/dl), 10 mg/kg i.v. cada 48 horas. En los pacientes en diálisis con hemorragias del tracto digestivo superior, se han utilizado con éxito dosis similares16.
Las opciones terapéuticas para controlar la hemorragia severa de los riñones poliquísticos son limitadas35-39. Hasta donde conocemos, sólo se han comunicado dos estudios de tratamiento con ácido tranexámico de la hematuria por sangrado quístico en la PQRAD y ambos fueron casos aislados9,10. En uno de los casos, la dosis inicial fue de 20 mg/kg i.v., prolongándose en el tiempo por vía oral9. En el otro caso, tratado en varias ocasiones con ácido tranexámico, la dosis osciló entre 15 mg/kg tres veces al día por vía i.v. a 10 mg/kg una vez al día por vía oral10. La duración del tratamiento también varió de tres a cinco días en uno y varias semanas en el otro. Los resultados del presente estudio, aunque preliminares, sugieren que en los casos más graves de hemorragia incontrolada parece razonable ensayar un tratamiento antifibrinolítico con ácido tranexámico. Nuestros pacientes recibieron dosis en un rango que osciló entre 15 mg/kg tres veces al día i.v. a 10 mg/kg tres veces al día por vía oral, con una duración de 2 a 5 días, y todas fueron igualmente efectivas. En ningún caso se observaron efectos secundarios. No obstante, la recomendación es utilizar el ácido tranexámico oral o i.v. a la dosis más baja posible que sea efectiva, durante la duración más corta, para reducir el riesgo de efectos adversos. Para nuestros pacientes, esta dosis fue 10 mg/kg tres veces al día por vía oral durante 3-4 días. Es posible que la terapia de menos de tres días de duración pueda ser tan efectiva, pero esta pauta no ha sido examinada. Por último, el empleo precoz de ácido tranexámico a domicilio por los pacientes con PQRAD y hematuria recurrente podría ser muy coste-efectivo si así pudiera evitarse la hospitalización. Las principales limitaciones del estudio son que el número de pacientes es pequeño y que no hay un grupo control sin tratamiento.
En resumen, el ácido tranexámico puede utilizarse con seguridad en pacientes seleccionados con PQRAD que presenten hematuria importante o incoercible, que no respondan al tratamiento convencional. El fármaco puede administrarse por vía oral o i.v., siendo necesario el ajuste de la dosis en el caso de presentar insuficiencia renal. El tratamiento con ácido tranexámico en la PQRAD puede preservar la función renal, de un modo directo, al parar el sangrado quístico y disminuir la frecuencia de los episodios de hematuria, o indirecto, al evitar la embolización y/o la nefrectomía.
Conflictos de interés
Los autores declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este artículo.
Referencias Bibliográficas
1. Gabow PA, Duley I, Johnson AM. Clinical profiles of gross hematuria in autosomal dominant polycystic kidney disease. Am J Kidney Dis 1992;20:140-3. [ Links ]
2. Gabow PA, Johnson AM, Kaehny WD, Kimberling WJ, Lezotte DC, Duley IT, et al. Factors affecting the progression of renal disease in autosomal-dominant polycystic kidney disease. Kidney Int 1992;41:1311-9. [ Links ]
3. Johnson AM, Gabow PA. Identification of patients with autosomal dominant polycystic kidney disease at highest risk for end-stage renal disease. J Am Soc Nephrol 1997;8:1560-67. [ Links ]
4. Grantham JJ, Chapman AB, Torres VE. Volume progression in autosomal dominant polycystic kidney disease: the major factor determining clinical outcomes. Clin J Am Soc Nephrol 2006;1:148-57. [ Links ]
5. Masoumi A, Reed-Gitomer B, Kelleher C, Bekheirnia MR, Schrier RW. Developments in the management of autosomal dominant polycystic kidney disease. Ther Clin Risk Manag 2008;4:393-407. [ Links ]
6. Grantham JJ, Torres VE, Chapman AB, CRISP Investigators. Volume progression in polycystic kidney disease. N Engl J Med 2006;354:2122-30. [ Links ]
7. Ubara Y. New therapeutic option for autosomal dominant polycystic kidney disease patients with enlarged kidney and liver. Ther Apher Dial 2006;10:333-41. [ Links ]
8. Zwettler U, Zeier M, Andrassy K, Geberth S, Rambausek M. Treatment of gross hematuria in autosomal dominant polycystic kidney disease with aprotinin and desmopressin acetate. Nephron 1992;60:374. [ Links ]
9. Vujkovac B, Sabovic M. A successful treatment of life-threatening bleeding from polycystic kidneys with antifibrinolytic agent tranexamic acid. Blood Coagul Fibrinolysis 2006;17:589-91. [ Links ]
10. Alameel T, West M. Tranexamic acid treatment of life-threatening hematuria in polycystic kidney disease. Int J Nephrol 2011;203579. Epub 2011 Jun 1. [ Links ]
11. Dunn CJ, Goa KL. Tranexamic acid: a review of its use in surgery and other indications. Drugs 1999;57:1005-32. [ Links ]
12. Mannucci PM. Hemostatic drugs. N Engl J Med 1998;339:245-53. [ Links ]
13. Mezzano D, Panes O, Muñoz B, Pais E, Tagle R, González F, et al. Tranexamic acid inhibits fibrinolysis, shortens the bleeding time and improves platelet function in patients with chronic renal failure. Thromb Haemost 1999;82:1250-4. [ Links ]
14. Downey P, Tagle R, Pereira J, Mezzano D. Tranexamic acid and uremic bleeding: evidence-based treatment recommendations. Nat Clin Pract Nephrol 2007;3:E2. [ Links ]
15. Sabovic M, Zupan IP, Salobir B, Zupan I, Cernelc P, Lavre J, et al. The effect of long-term, low-dose tranexamic acid treatment on platelet dysfunction and haemoglobin levels in haemodialysis patients. Thromb Haemost 2005;94:1245-50. [ Links ]
16. Sabovic M, Lavre J, Vujkovac B. Tranexamic acid is beneficial as adjunctive therapy in treating major upper gastrointestinal bleeding in dialysis patients. Nephrol Dial Transplant 2003;18:1388-91. [ Links ]
17. Rannikko A, Petas A, Taari K. Tranexamic acid in control of primary hemorrhage during transurethral prostatectomy. Urology 2004;64:955-8. [ Links ]
18. Leslie CL, Simon BJ, Lee KF, Emhoff TA, Munshi IA. Bilateral rupture of multicystic kidneys after blunt abdominal trauma. J Trauma 2000;48:336-7. [ Links ]
19. Mufarrij AJ, Hitti E. Acute cystic rupture and hemorrhagic shock after a vigorous massage chair session in a patient with polycystic kidney disease. Am J Med Sci 2011;342:76-8. [ Links ]
20. Reay EK, McEleny K, McDonald S, Thorpe AC. Blunt renal trauma in adult polycystic kidney disease and the use of nephron sparing selective arterial embolization. J Trauma 2009;66:564-6. [ Links ]
21. Bajwa ZH, Gupta S, Warfield CA, Steinman TI. Pain management in polycystic kidney disease. Kidney Int 2001;60:1631-44. [ Links ]
22. Bajwa ZH, Sial KA, Malik AB, Steinman TI. Pain patterns in patients with polycystic kidney disease. Kidney Int 2004;66:1561-9. [ Links ]
23. Bello-Reuss E, Holubec K, Rajaraman S. Angiogenesis in autosomal-dominant polycystic kidney disease. Kidney Int 2001;60:37-45. [ Links ]
24. Wei W, Popov V, Walocha JA, Wen J, Bello-Reuss E. Evidence of angiogenesis and microvascular regression in autosomal-dominant polycystic kidney disease kidneys: a corrosion cast study. Kidney Int 2006;70:1261-8. [ Links ]
25. Chen JH, Wu ST, Wu CC. Autosomal dominant polycystic kidney disease with cystic haemorrhage and infection. Acta Clin Belg 2010;65:446-7. [ Links ]
26. Piccoli GB, Arena V, Consiglio V, Deagostini MC, Pelosi E, Douroukas A, et al. Positron emission tomography in the diagnostic pathway for intracystic infection in ADPKD and "cystic" kidneys. A case series. BMC Nephrol 2011;12:48. [ Links ]
27. Jouret F, Lhommel R, Beguin C, Devuyst O, Pirson Y, Hassoun Z, et al. Positron-emission computed tomography in cyst infection diagnosis in patients with autosomal dominant polycystic kidney disease. Clin J Am Soc Nephrol 2011;6:1644-50. [ Links ]
28. Levine E, Grantham JJ. High-density renal cysts in autosomal dominant polycystic kidney disease demonstrated by CT. Radiology 1985;154:477-82. [ Links ]
29. Gabow PA. Autosomal dominant polycystic kidney disease. N Engl J Med 1993;329:332-42. [ Links ]
30. Davis NF, McGuire BB, Lawlor L, O'Gorman P, O'Malley KJ, Fitzpatrick JM. Oral tranexamic acid as a novel treatment option for persistent haematuria in patients with sickle cell disease. Ann Hematol 2010;89:1179-80. [ Links ]
31. Koo JR, Lee YK, Kim YS, Cho WY, Kim HK, Won NH. Acute renal cortical necrosis caused by an antifibrinolytic drug (tranexamic acid). Nephrol Dial Transplant 1999;14:750-2. [ Links ]
32. Odabas AR, Cetinkaya R, Selçuk Y, Kaya H, Coskun U. Tranexamic-acid-induced acute renal cortical necrosis in a patient with haemophilia A. Nephrol Dial Transplant 2001;16:189-90. [ Links ]
33. Hui AC, Wong TY, Chow KM, Szeto CC. Multifocal myoclonus secondary to tranexamic acid. J Neurol Neurosurg Psychiatry 2003;74:547. [ Links ]
34. Andersson L, Eriksson O, Hedlund PO, Kjellman H, Lindqvist B. Special considerations with regard to the dosage of tranexamic acid in patients with chronic renal diseases. Urol Research 1978;6:83-8. [ Links ]
35. Peces R, Peces C, Cuesta-López E, Vega-Cabrera C, Azorín S, Pérez-Dueñas V, et al. Co-inheritance of autosomal dominant polycystic kidney disease and sickle cell trait in African-americans. Nefrologia 2011;31:162-8. [ Links ]
36. Peces R, Peces C, Pérez-Dueñas V, Cuesta-López E, Azorín S, Selgas R. Rapamycin reduces kidney volume and delays the loss of renal function in a patient with autosomal-dominant polycystic kidney disease. Nephrol Dial Transplant Plus 2009;2:133-5. [ Links ]
37. Peces R, Peces C, Cuesta-López E, Pérez-Dueñas V, Vega-Cabrera C, Azorín S, et al. Low-dose rapamycin reduces kidney volume angiomyolipomas and prevents the loss of renal function in a patient with tuberous sclerosis complex. Nephrol Dial Transplant 2010;25:3787-91. [ Links ]
38. Reay EK, McEleny K, McDonald S, Thorpe AC. Blunt renal trauma in adult polycystic kidney disease and the use of nephron sparing selective arterial embolization. J Trauma 2009;66:564-6. [ Links ]
39. Bae KT, Grantham JJ. Imaging for the prognosis of autosomal dominant polycystic kidney disease. Nat Rev Nephrol 2010;6:96-106. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Ramón Peces,
Servicio de Nefrología,
Hospital Universitario La Paz. IdiPAZ, Madrid
cpeces@varnetmail.com
Enviado a Revisar: 21 Oct. 2011
Aceptado el: 17 Dic. 2011














