Meu SciELO
Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Nefrología (Madrid)
versão On-line ISSN 1989-2284versão impressa ISSN 0211-6995
Nefrología (Madr.) vol.32 no.5 Cantabria 2012
https://dx.doi.org/10.3265/Nefrologia.pre2012.Jun.11486
Valoración del grado de coagulación y del factor anti-Xa al introducir el dializador AN69ST® con heparina impregnada
Evaluation of coagulation and anti-Xa factor using a heparin-coated AN69ST® dialyser
Juan J. Sánchez-Canel, Ramón Pons-Prades, M. Laura Salvetti, Alejandro Seores, Milagros Vázquez, Alejandro Pérez-Alba, Esther Tamarit, Consuelo Calvo-Gordo, Juan Villatoro
Unidad de Nefrología. Hospital General de Castellón.
Dirección para correspondencia
RESUMEN
Introducción: Los sistemas de hemodiálisis tienen capacidad trombogénica, por lo que se utiliza de forma rutinaria la anticoagulación. Su prescripción no se encuentra exenta de riesgos, a pesar de lo cual las recomendaciones respecto a la dosis pautada siguen basándose en criterios muy diversos.
Métodos: Se realizó un estudio experimental aleatorizado y cruzado. Seis pacientes realizaron seis sesiones de hemodiafiltración posdilución con el dializador de polisulfona HF80® y anticoagulación habitual con nadroparina, y seis sesiones con el dializador AN69ST® de poliacrilonitrilo con una cubierta de heparina sin el uso de anticoagulación sistémica. Evaluamos cada hora el grado de coagulación del dializador y del circuito extracorpóreo mediante una escala visual y las variaciones en los parámetros de coagulación, entre los que se incluyó el factor anti-Xa. Nuestro objetivo primario fue valorar las variaciones en la actividad del factor anti-Xa en ausencia de diferencias en la tasa de coagulación masiva entre los dos grupos.
Resultados: No se coaguló el dializador de forma completa o grado 4 en ninguna de las 36 sesiones realizadas con cada dializador. Se produjo una coagulación parcial del dializador inferior del 25% (grado 1-2) en 32 (88,9%) sesiones con AN69ST® y 35 (97,2%) con el dializador habitual, y superior del 25% (grado 3-4) en 4 (11,1%) sesiones con AN69ST® y en 1 (2,8%) sesión con el dializador con heparina. La coagulación del atrapaburbujas arterial no fue superior al 25% (grados 3 y 4) en ninguna de las sesiones estudiadas, y la cámara venosa en sólo 1 (2,8%) sesión con el dializador habitual y 3 (8,4%) con AN69ST® sin diferencias entre los dos dializadores. El valor del tiempo de tromboplastina parcial activada presentó diferencias a las dos horas entre ambas técnicas, relacionadas con la administración de la heparina de bajo peso molecular (33,3 ± 2,7 s con polisulfona y 27,5 ± 2,3 s en AN69ST®, p < 0,05), que continuaron siendo significativas al finalizar la sesión (29,8 ± 2,1 s con polisulfona y 27,2 ± 1,8 s con AN69ST® , p < 0,05). La actividad del factor anti-Xa fue máxima dos horas después de la administración de nadroparina, con diferencias entre ambos dializadores (0,46 ± 0,13 UI/ml en diálisis con polisulfona y 0,04 ± 0,04 UI/ml con AN69ST®, p < 0,005), para ir descendiendo en la determinación de las 4 horas (0,17 ± 0,12 UI/ml en diálisis con polisulfona y 0,02 ± 0,03 UI/ml en AN69ST®, p < 0,05). Un paciente fue excluido del estudio al presentar una reacción adversa caracterizada por prurito generalizado con el dializador AN69ST®, motivo por el que retiró en la primera sesión el consentimiento.
Conclusión: Demostramos la baja trombogenicidad del dializador AN69ST® de forma que permite realizar sesiones de hemodiafiltración posdilución sin necesidad de anticoagulación sistémica, y sin aumentar la frecuencia de eventos de coagulación grave en comparación con el dializador HF80® junto a nadroparina y con menor riesgo de sangrado al no modificar la actividad del factor anti-Xa.
Palabras clave: Factor anti-Xa, Coagulación, Heparina, Hemodiálisis, Membrana de hemodiálisis.
ABSTRACT
Background: Haemodialysis systems are potentially thrombogenic, so anticoagulation is routinely used. Its prescription involves certain risks, despite which the recommendations regarding dosage are still based on very disparate criteria.
Methods: We performed a randomised, crossed pilot study. Six patients underwent six sessions of post-dilution haemodiafiltration with a polysulfone HF80® dialyser and standard anticoagulation with nadroparin, and six sessions with heparincoated poliacrylonitrile AN69ST® membrane without the administration of systemic anticoagulation therapy. The coagulation level of the dialyser and extracorporeal circuit was evaluated every hour using a visual scale along with variation in clotting parameters such as anti-Xa factor. Our primary objective was to assess anti-Xa activity in the absence of differences in the rate of massive coagulation between the two groups.
Results: No complete or grade 4 dialyser clotting occurred in any of the 36 sessions with either dialyser. Partial clotting of the dialyser occurred below 25% (grade 1-2) in 32 (88.9%) AN69ST® sessions and 35 (97.2%) sessions using the standard dialyser, and partial clotting surpassed 25% (grade 3-4) in 4 (11.1%) AN69ST® sessions and 1 (2.8%) dialysis session with heparin. Arterial chamber blood clotting did not surpass 25% (grade 3 and 4) in any of the studied sessions, and venous chamber coagulation occurred in only 1 (2.8%) session with the usual dialyser and in 3 (8.4%) sessions with the AN69ST®, with no significant differences between the two dialysers. The activated partial thromboplastin time at two hours showed differences between the two techniques in correlation with the administration of low molecular weight heparin (33.3±2.7s with polysulfone and 27.5±2.3s in AN69ST®; P<0.05), which remained significant at the end of the session (29.8±2.1s with polysulfone and 27.2±1.8s with AN69ST®; P<0.05). Anti-Xa factor activity reached a maximum at two hours after the administration of nadroparin, with differences between the two dialysers (0.46±0.13IU/ml in dialysis with polysulfone and 0.04±0.04IU/ml with AN69ST®; P<0.05), and levels decreased after 4 hours (0.17±0.12IU/ml in dialysis with polysulfone and 0.02±0.03IU/ml in AN69ST®; P<0.05). One patient on dialysis with AN69ST® had an adverse reaction in the form of generalised pruritus and was excluded from the study, by withdrawing consent for participation in the first session.
Conclusion: We demonstrate the low thrombogenicity of the AN69ST® dialyser, allowing for postdilution haemodiafiltration sessions without systemic anticoagulation therapy and without increasing the frequency of severe coagulation events as compared to the HF80® dialyser with nadroparin, with a lower associated risk of bleeding by not modifying anti-Xa factor activity.
Key words: Anti-Xa, Coagulation, Heparin, Haemodialysis, Haemodialysis membrane.
Introducción
Los sistemas de hemodiálisis (HD) aumentan la biocompatibilidad, pero seguimos sin obtener un flujo laminar que evite la coagulación. Las agujas, líneas, cámaras y membranas tienen capacidad trombogénica, por lo que precisamos anticoagulantes para mantener el circuito extracorpóreo permeable.
Durante las sesiones realizadas sin anticoagulantes, en el 5% se produce una coagulación apreciable del dializador1, con la correspondiente pérdida de 150 ml de sangre que ocupan las líneas y el dializador. Por este motivo, en pacientes sin riesgo de hemorragia se utiliza rutinariamente la anticoagulación, aunque existe una gran disparidad de criterios en su prescripción.
De forma clásica, se ha utilizado la heparina sódica no fraccionada. Su efecto anticoagulante se relaciona con el cambio de conformación de la antitrombina III y la inactivación de factores de coagulación, sobre todo el Xa. Su acción es inmediata, con una semivida de entre 30 min y 2 horas. Se utiliza en forma de bolos, continua o como heparinización regional, y presenta efectos secundarios como el sangrado por exceso de dosis, la trombopenia mediada por inmunocomplejos IgG-heparina y la trombosis asociada a trombopenia. Otros efectos indeseables que pueden aparecer son la hipersensibilidad, la necrosis cutánea y la osteoporosis2.
La heparina de bajo peso molecular (HBPM) constituye la alternativa de anticoagulación. Se obtiene por degradación de la heparina original en fracciones de 4 a 6 KDa. Se utiliza por menor riesgo de sangrado, al no presentar acción antitrombina. Inhibe el factor Xa, XIIa y la calicreína, sin actuar sobre la trombina ni los factores IX y XI. Su vida media es más larga y permite la utilización de una dosis única al inicio de la diálisis. Su dosis se expresa en unidades de anti-Xa. Aunque su coste es mayor, tiene menos efectos secundarios sobre la agregación plaquetaria y menos problemas de sangrado. Las guías European Best Practice la recomiendan como anticoagulante de elección para la diálisis3.
Diferentes factores aumentan la tendencia a la coagulación del circuito, como el flujo sanguíneo bajo, el hematocrito elevado o una tasa de ultrafiltración alta; además, los errores técnicos suponen una causa importante de coagulación. La formación de coágulos aislados es habitual durante las sesiones de HD con heparinización rutinaria. Durante la sesión de HD podremos controlar visualmente los signos de coagulación del dializador y del circuito, de forma que, dependiendo del aspecto global de las fibras, podremos variar la anticoagulación en las próximas diálisis. También se pueden realizar determinaciones analíticas que reflejan el estado de la coagulación del paciente, aunque no del circuito. Podemos determinar el número de plaquetas y el tiempo de hemorragia que mide la actividad de la hemostasia primaria y la función plaquetaria. El tiempo de tromboplastina parcial activada (TTPA) mide la actividad de la coagulación intrínseca y permite controlar el efecto de la heparina no fraccionada. Por último, el factor anti-Xa activado representa una prueba más sensible y permite controlar la coagulación durante el uso de HBPM4.
En la mayoría de unidades de HD no se suelen realizar estas determinaciones. Las recomendaciones respecto a la dosis administrada se basan en el peso corporal, la comorbilidad, el sangrado y la modalidad de HD5,6. En los pacientes con riesgos hemorrágicos elevados se prefiere la realización de HD sin anticoagulante, aunque se está introduciendo el uso de dializadores de poliacrilonitrilo con una cubierta de heparina impregnada. El diseño de la membrana AN69ST® incorpora un polímerode polietilenaminaque neutraliza los grupos polianiónicosyle confiere la capacidad de fijar por interacciones eléctricas heparina en su superficie. La membrana AN69ST® acompañada de una heparinización durante la fase de lavado prediálisis presenta baja trombogenicidad y norequiere lavados salinos durante su utilización en HD libre de heparina.Estos resultados de hemocompatibilidad demuestran que su utilización es segura y no aumenta el riesgo de coagulación masiva del dializador y del circuito extracorpóreo7-10.
Nosotros diseñamos un estudio en pacientes en programa de hemodiafiltración (HDF) con la utilización de dializadores AN69ST® y sin anticoagulación sistémica, con la finalidad de conocer las variaciones en los parámetros de coagulación del paciente, entre los que se incluyó el factor anti-Xa; asimismo, evaluamos cada hora el grado de coagulación del dializador y del circuito extracorpóreo mediante una escala visual. Nuestro objetivo primario fue encontrar diferencias en las determinaciones del factor anti-Xa en ausencia de distinciones en la tasa de coagulación masiva entre los dos grupos.
Material y métodos
Se realizó un estudio experimental aleatorizado y cruzado en el que se incluyeron seis pacientes con enfermedad renal crónica en estadio 5 estables, programa de HD periódica desde hacía más de seis meses. Se realizaron seis sesiones consecutivas de HDF posdilución con un filtro de polietersulfona de alta permeabilidad HF80® (1,89 m2) y anticoagulación con las dosis utilizadas habitualmente en cada paciente de nadroparina intravenosa. También se realizaron seis sesiones con los dializadores AN69ST® de poliacrionitrilo con una cubierta de heparina (2,2 m2) sin el uso de anticoagulación sistémica.
Se aleatorizó la muestra de pacientes y el orden en el que se sucederían los períodos de sesiones. Todos los pacientes firmaron el consentimiento informado. El estudio fue aprobado por el Comité de Bioética Asistencial del Hospital General de Castellón.
En cuanto a los criterios de inclusión, debían ser mayores de 18 años, con estabilidad hemodinámica y una esperanza de vida mayor que el tiempo previsto de realización del estudio. Se les realizaba una pauta de diálisis de tres veces por semana, y presentaban niveles de albúmina sérica superiores a 3 g/dl y hematocrito > 30%. Se establecieron como criterios de exclusión la enfermedad inflamatoria o infecciosa sistémica en fase activa, la enfermedad neoplásica no curada y los pacientes con trastornos de la hemostasia o tratamiento anticoagulante oral en el momento del estudio. Ningún paciente podía recibir la transfusión de hemoderivados en la semana previa al estudio, durante y la semana posterior.
Se incluyeron pacientes portadores de fístula arteriovenosa nativa y fístula protésica. Asimismo, se intentó que no existieran diferencias significativas entre las tasas de flujo sanguíneo de cada paciente con el cambio de modalidad. Durante el tiempo que permanecieron en el estudio, no se modificó la duración de las sesiones ni el tipo de solución empleada, y se mantuvo la misma modalidad de HDF posdilución convencional u on-line y las tasas de convección programadas. Se utilizó el mismo dializador en cada uno de los períodos y la misma dosis de anticoagulación en el período de su dializador habitual.
Previamente al inicio de la sesión se realizaba el purgado del circuito con 2 l de solución heparinizada 5.000 UI/l. cada hora se realizaba la infusión de 100ml de suero fisiológico para apreciar el grado de coagulación del dializador y del atrapaburbujas.
En la sexta sesión, en cada uno de los períodos se realizaron determinaciones de hemograma para valorar el recuento plaquetario y hemostasia: tiempo de protrombina, índice de Quick, TTPA y cuantificación del fibrinógeno, y se midieron los niveles de factor anti-Xa. Las analíticas se recogieron al comienzo de la HD, a las dos horas, tras finalizar la sesión y prediálisis de la siguiente sesión o 44 horas después. También se determinaron las concentraciones plasmáticas de urea, creatinina, glucosa, sodio, potasio, calcio, fosforo, proteínas totales, albúmina, ácido úrico y proteína C reactiva al comienzo de HD y al finalizar la sesión.
Se calculó la dosis de diálisis mediante las siguientes fórmulas:
Kt/V Daugirdas segunda generación: Kt/V= -Ln ([C2/C1] - [0,008*T]) + (4 - 3,5 * [C2/C1]) * UF/peso final.
Kt/V corregido por el rebote: Kt/Vr = Kt/V * (1 -[0,6/T]) + 0,03
Las muestras se remitieron al laboratorio de Hematología y de análisis clínicos del Hospital General de Castellón.
Las extracciones analíticas al finalizar la sesión se obtuvieron a partir de 20 a 25 ml de sangre de la rama arterial, previo enlentecimiento de la bomba arterial a un flujo de 50 ml/min durante un minuto, según los protocolos de la Unidad.
Se valoró la coagulación del circuito cada hora de forma visual mediante una escala fotográfica con 4 niveles de coagulación del atrapaburbujas arterial y venoso:
• 1 = normal.
• 2 = anillo fibroso.
• 3 = formación de coágulo.
• 4 = sistema coagulado.
El dializador se inspeccionó cada hora hasta el final de cada sesión:
• 1 = normal.
• 2 = menor del 25% de los capilares coagulados.
• 3 = 25-50% de los capilares coagulados.
• 4 = dializador totalmente coagulado.
Análisis estadístico
Previamente a la realización del estudio, se calculó el tamaño muestral para obtener una potencia estadística del 80% y un intervalo de confianza del 95% para datos pareados. El tamaño muestral se calculó mediante la comparación de las dos medias del factor anti-Xa obtenidas en estudios de la bibliografía6,10. Se realizó una estimación de la desviación típica de la media de 0,1 según estudios previos. Se definió Epsilon, que es la mínima diferencia entre las medias y que se considera de importancia práctica como 0,2. Se estimaron cuatro sujetos necesarios y una posible pérdida de pacientes del 15%, por lo que se añadieron dos pacientes más.
Se definió el riesgo de eventos de coagulación moderada o grave con heparinización sistémica en el 5% de las sesiones y un margen de no inferioridad del 10%6,11,12. Riesgo α unilateral: 0,95. Resultado (número de sesiones necesarias): 58. Y se estimó una posible pérdida del 15%.
Los datos obtenidos se analizaron por el programa de software SPSS versión 11.5.
Se aplicó el test de Kolmogorov-Smirnov para comprobar si las variables estudiadas se ajustaban a una distribución normal. Para las variables paramétricas con dos mediciones se utilizó el test t de Student para datos pareados y en más de dos mediciones el test de ANOVA. Para las variables con dos mediciones que no presentaran distribución normal se utilizó el test no paramétrico de Wilcoxon para datos pareados y en más de dos mediciones el test de medidas repetidas. Se realizó el test de Χ2 y la prueba exacta de Fisher para la inferencia de proporciones en las variables categóricas. Se valoró la relación bivariada mediante el análisis de regresión lineal y se calculó el coeficiente de correlación de Pearson para valorar la calidad del ajuste.
Se consideró como estadísticamente significativa una p menor de 0,05.
Aspectos éticos
El presente estudio se realizó siguiendo las recomendaciones de la Declaración de Helsinki de 1964, para la orientación de los médicos en relación con la investigación biomédica con seres humanos.
Resultados
Las características demográficas de los pacientes incluidos en el estudio se encuentran descritas en la tabla 1.
Tabla 1. Características demográficas de la población estudiada 
Se utilizó anticoagulación sistémica únicamente durante las sesiones con el dializador convencional. La media de dosis de nadroparina utilizada fue de 2.500 ± 547,7 UI (38,5 ± 8,2 UI/kg).
En nuestro estudio no encontramos independencia en la distribución de los grados de coagulación del dializador al finalizar la sesión entre ambos dializadores. No se coaguló el dializador de forma completa o grado 4 (> 50% de las fibras del dializador coaguladas) en ninguna de las 36 sesiones realizadas con el dializador convencional ni en las 36 realizadas con AN69ST®. Se produjo una coagulación parcial del dializador inferior al 25% (grado 1-2) en 32 (88,9%) sesiones con AN69ST® y 35 (97,2%) con el dializador habitual, y superior al 25% (grado 3) en 4 (11,1%) sesiones sin heparina y en 1 (2,8%) sesión con el dializador con heparina (tabla 2).
Tabla 2. Características técnicas de las sesiones 
HDF: hemodiafiltración; ns: no significativa; PA: presión arterial.
La coagulación del atrapaburbujas arterial no fue superior al 25% (grados 3 y 4) en ninguna de las sesiones estudiadas y la cámara venosa en sólo una (2,8%) sesión con el dializador habitual y tres (8,4%) con AN69ST®. No existieron diferencias entre los dos dializadores.
El valor del TTPA presentó diferencias a las dos horas entre ambas técnicas, relacionadas con la administración de la HBPM (33,3 ± 2,7 s con polisulfuna y 27,5 ± 2,3 s con AN69ST®, p < 0,05), que continuaron siendo significativas al finalizar la sesión (29,8 ± 2,1 con polisulfuna y 27,2 ± 1,8 s con AN69ST® , p < 0,05) (tabla 3).
Tabla 3. Resultados del paciente (parámetros de coagulación y eficacia de diálisis) 
PRU: porcentaje de reducción de urea; TAC: concentración plasmática media de urea;
TP: tiempo de protrombina; TTPA: tiempo de tromboplastina parcial activada.
La medición del factor anti-Xa fue máxima dos horas después de la administración de HBPM, con diferencias entre ambos dializadores (0,46 ± 0,13 UI/ml en diálisis con nadroparina y 0,04 ± 0,04 UI/mlen AN69ST®, p < 0,005), para ir descendiendo en la determinación de las 4 horas (0,17 ± 0,12 UI/ml en diálisis con nadroparina y 0,02 ± 0,03 UI/ml en AN69ST®, p < 0,05) en ambas modalidades. Se estableció una correlación positiva entre el TTPA y el factor anti-Xa en las determinaciones realizadas (ecuación de regresión y = 27,9 + 7,58 x; r = 0,44) (figura 1).
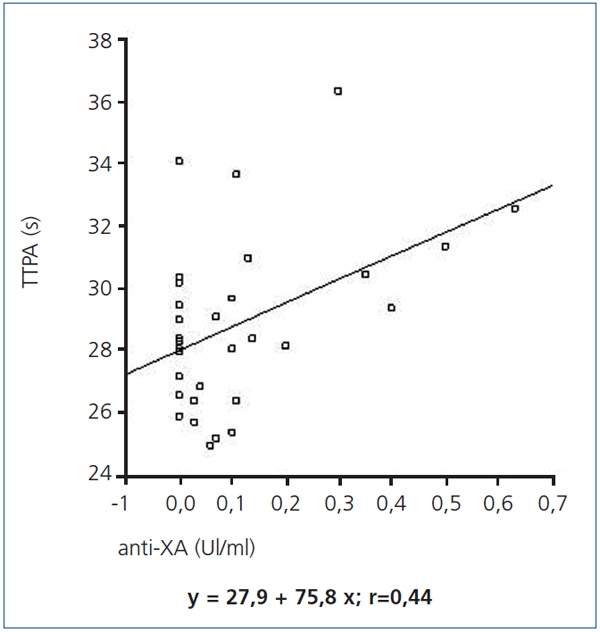
Figura 1. Correlación de TTPA con el factor anti-Xa durante las 4 horas de tratamiento
TTPA: tiempo de tromboplastina parcial activada.
La media del Kt/V fue similar entre las dos modalidades.
Un paciente con el dializador AN69ST® presentó una hipotensión brusca con pérdida de conciencia. Un paciente fue excluido del estudio al presentar una reacción adversa caracterizada por prurito generalizado con el dializador AN69ST®, motivo por el que se retiró en la primera sesión el consentimiento. Otro paciente, a los 15 minutos del inicio de una sesión con AN69ST®, presentó náuseas y malestar general que cedieron con metoclopramida, así que prosiguió la sesión sin más incidencias.
Discusión
El dializador y la modalidad de HD empleados son factores determinantes de los parámetros de trombogenicidad durante la sesión de diálisis. El dializador constituye la superficie mayor expuesta a la sangre. El control del flujo y las presiones del circuito también son otros factores que minimizarán la activación de la coagulación. En nuestro estudio demostramos la baja trombogenicidad del dializador de poliacrilonitrilo AN69ST® utilizado sin necesidad de anticoagulación. Los resultados fueron similares a los encontrados con un dializador convencional de polisulfona de alta permeabilidad utilizado junto a anticoagulación con HBPM en una técnica de HDF con reposición posdilución. Esta modalidad favorece la hemoconcentración a lo largo de los capilares del dializador, ya que la infusión del volumen de reposición es posterior a la ultrafiltración. Los resultados se alcanzaron debido a la presencia de polietilenamina como polímero de recubrimiento que neutraliza las cargas negativas del poliacrilonitrilo, permitiendo la unión de heparina no fraccionada. Las modificaciones de la superficie realizadas junto a la cubierta de heparina aumentan la biocompatibilidad de la membrana del dializador13-15. Este pretratamiento de las membranas disminuye la unión de las moléculas que participan en la activación de contacto en la vía de la coagulación intrínseca.
No se coaguló el dializador ni el resto del circuito extracorpóreo de forma completa en ninguna de las 36 sesiones realizadas con el dializador convencional ni con AN69ST®. Estos hallazgos son compatibles con la bibliografía, según la cual en el 0,5-2% de las sesiones se coagulará el sistema completamente9,16. En ovejas se realizaron sesiones de HD con el dializador AN69ST® cubierto de heparina sin la utilización de anticoagulación sistémica, con la ausencia de coagulación de las líneas durante 6 horas. En las mismas condiciones se producía coagulación masiva del circuito a los 90 minutos de diálisis con el dializador AN69® no cubierto de heparina10. Los estudios en humanos realizados con el dializador AN69ST® requieren una cantidad óptima de heparina sódica (entre 2000 y 3000 UI), administrada de forma intermitente; así, se observó una coagulación parcial en 5/39 sesiones con 2000 UI de heparina y en 2/150 con 3000 UI de heparina (p < 0,008). En cuanto a la necesidad de HBPM, fue de 20 mg de enoxaparina, de forma que no se advirtió ningún episodio de coagulación en las 30 sesiones realizadas. Cuando se disminuía la dosis a 10 mg, se observaba una coagulación parcial del circuito en 7/29 sesiones10.
La experiencia con el dializador AN69ST® sin la administración de heparina y con una adecuada supervisión nos muestra que, en 66 sesiones realizadas, sólo una concluyó por coagulación masiva y 17 se asociaron a coagulación parcial o superior del 25% del dializador10. Previamente al inicio de las sesiones, se realizó un cebado con solución heparinizada en ambos grupos, de forma que la heparina se impregnara en la superficie de la membrana y mantuviera su efecto anticoagulante durante la sesión, sin requerimientos sistémicos de heparina. En un estudio aleatorizado y cruzado de HD sin heparina, con 54 pacientes, se interrumpieron el 6% de las sesiones por coagulación completa con los dos dializadores. El 9% de las sesiones con AN69ST® y el 13% con polisulfona presentaron una coagulación parcial del circuito, con un aumento persistente de la presión venosa11. Al comparar el dializador AN69ST® mediante una escala visual respecto a otro dializador de polisulfona en pacientes a los que se les había reducido la anticoagulación a la mitad de dosis, no se objetivó una menor coagulación del atrapaburbujas venoso15.
La anticoagulación en la HD supone un riesgo para el sangrado activo de los pacientes, tanto al inicio como respecto al empeoramiento del preexistente. La heparinización sistémica estándar se ha asociado con un riesgo de complicaciones hemorrágicas que llega hasta el 26% de los tratamientos realizados17. Diferentes alternativas han sido utilizadas en pacientes con alto riesgo de sangrado. Los lavados intermitentes con suero salino no mejoran los signos visuales de coagulación del circuito ni los parámetros de actividad de la coagulación intravascular en pacientes estables18. Se ha desarrollado su uso en el 90% de los pacientes de la Unidad de Cuidados Intensivos con sólo un 2% de coagulaciones completas del circuito16. La heparinización regional o las pequeñas dosis de heparina controladas han sido utilizadas en diferentes estudios con pacientes con alto riesgo de sangrado19. El uso del dializador AN69ST® permite la reducción del 50% de la dosis de heparina no fraccionada administrada en HD sin aumentar el riesgo de coagulación del circuito7.
En nuestro estudio se establece una relación positiva entre el TTPA y los niveles de factor anti-Xa. Ambos valores aumentaron en las dos horas siguientes a la administración de heparina. Los valores de anti-Xa se mantuvieron estables durante toda la sesión con el dializador AN69ST®, mientras que en las sesiones con heparinización sistémica aumentaron a las dos horas, alcanzando valores que evitan la coagulación del circuito pero que modifican el estado de coagulación del paciente. En las últimas dos horas descendieron, manteniéndose por encima de los valores normales al finalizar la sesión de HD. Están definidos unos valores de la hemostasia que disminuyen el riesgo de coagulación del circuito. Se debe mantener un TTPA > 40 s y un factor anti-Xa > 0,2 mUI/ml en relación con los resultados de la inspección visual del dializador y las cámaras10. En las sesiones con nadroparina, a pesar de utilizar dosis de 38,5 ± 8,2 UI/kg, se mantienen al finalizar la sesión valores de anti-Xapróximos a 0,2, lo cual implica un riesgo hemorrágico que no se advierte en la determinación del TTPA, que ha descendido a valores similares a los del inicio.
Otros estudios con el dializador AN69ST® han determinado diferentes factores como medidas de trombogenicidad durante la sesión de HD, como son el fragmento 1 + 2 protrombina como marcador de formación vascular de trombina, los complejos trombina-antitrombina III o la μ-tromboglobulina como marcador de activación plaquetaria18.
Conclusiones
En nuestro estudio demostramos la baja trombogenicidad del dializador AN69ST®, de forma que nos permite realizar sesiones de HDF posdilución sin necesidad de anticoagulación sistémica, sin que aumente la frecuencia de eventos de coagulación grave y con un menor riesgo de sangrado al no modificar el factor anti-Xa.
Conflictos de interés
Los autores declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este artículo.
Referencias Bibliográficas
1. Sanders PW, Taylor H. Hemodialysis without anticoagulation. Am J Kidney Dis 1985;5(1):32-5. [ Links ]
2. Fort J, Piera L. Anticoagulación y fibrinolisis. In: Jofre R, et al. (eds). Tratado de hemodiálisis. 2.a ed. Barcelona; Editorial Jims; 2006. p. 201-11. [ Links ]
3. European Best Practice Guidelines for Haemodialysis (Part 1). Nephrol Dial Transplant 2002;17 Suppl 7:64-6. [ Links ]
4. Frank RD, Brandenburg VM, Lanzmich R, Floege J. Factor Xa-activates whole blood clotting time (XA-ACT) for bedside monitoring of dalteprain anticoagulation during hemodialysis. Nephrol Dial Transplant 2004;19:1552-8. [ Links ]
5. Sagedal S, Hartmann A, Sundstrom K, Bjornsen S, Fauchald P, Brosstad F. A single dose of dalteparin effectively prevents clotting during hemodialysis. Nephrol Dial Transplant 1999;14:1943-7. [ Links ]
6. Herrero-Calvo JA, González-Parra E, Pérez-García R, Tornero-Molina F, en representación del Grupo de estudio español sobre anticoagulación en hemodiálisis. Estudio español sobre anticoagulación en hemodiálisis. Nefrologia 2012;32(2):143-52. [ Links ]
7. Chanard J, Lavaud S, Maheut H, Kazes I, Vitry F, Rieu P. The clinical evaluation of low-dose heparin in haemodialysis: a prospective study using the heparin-coated AN69ST® membrane. Nephrol Dial Transplant 2008;123:2003-9. [ Links ]
8. Leblanc M, Lafrance JP, Renald A. Dialyzer fiber bundle volumen during hemodialysis using large-surface dialyzers. ASAIO J 2006;52(6):646-51. [ Links ]
9. Lavaud S, Paris B, Maheut H, Randoux C, Renaux JL, Rieu P, et al. Assessment of the heparin-binding AN69 ST hemodialysis membrane: II. Clinical studies without heparin administration. ASAIO J 2005;51(4):348-51. [ Links ]
10. Lavaud S, Canivet E, Wuillai A, Maheut H, Randoux JM, Bonnet JM, et al. Optimal anticoagulation strategy in haemodialysis with heparin coated polyacrylontrile membrane. Nephrol Dial Transplant 2003;18:2097-104. [ Links ]
11. Brunet P, Frances J, Vacher-Coponat H, Jaubert D, Lebrun G, Gondouin B, et al. Hemodialysis without heparin: a randomized, controlled, crossover study of two dialysis membranes (AN69ST and polysulfone F60). Int J Artif Organs 2011;34(12):1165-71. [ Links ]
12. Swartz RD. Hemorrhage during high-risk hemodialysis using controlled heparinization. Nephron 1981;28(2):65-9. [ Links ]
13. Briel RC, Zielke E, Zwirner M. Untersuchungen zur korrelationder anti-faktor-Xa-aktivität von niedermolekularem heparin (fragmin) und der aktivierten vollblutgerinnungszeit im aC-tester. Ärztl Lab 1987;33:237-40. [ Links ]
14. Schulz W, Deuber HJ, Gunthner R, Ohrisch G, Eichhorn M, Werthmann G. Aktueller sand des einsatzes von niedermolekularem heparin in der hä modialyse-therapie. Nieren- u Hochdruckkrankheiten 1995;24:187-97. [ Links ]
15. Sagedal S, Witczak BJ, Osnes K, Hartmann A, Os I, Eikvar L, et al. A heparin-coated dialysis filter (AN69 ST) does not reduce clotting during hemodialysis when compared to a conventional polysulfone filter (F×8). Blood Purif 2011;32(3):151-5. [ Links ]
16. Schwab SJ, Onorato JJ, Sharar LR, Dennis PA. Hemodialysis without anticoagulation. One-year prospective trial in hospitalized patients at risk for bleeding. Am J Med 1987;83(3):405-10. [ Links ]
17. Maher JF, Lapierre L. Regional heparinization for hemodialysis. N Engl J Med 1963;268:451-6. [ Links ]
18. Sagedal S, Hartmann A, Osnes K, Bjornsen S, Torremocha J, Fauchald P, et al. Intermittent saline flushes during hemodialysis do not alleviate coagulation and clot formation in stable patients receiving reduced dosis of dateparin. Nephrol Dial Transplant 2006;21:444-9. [ Links ]
19. Romao JE, Fadil MA. Haemodialysis without anticoagulant: haemostasis parameters, fibrinogen kinetic, and dialysis efficiency. Nephrol Dial Transplant 1997;12:106-10. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Juan J. Sánchez-Canel,
Unidad de Nefrología,
Hospital General de Castellón,
Avda. Benicàsim s/n.,
12004, Castellón
E-mail: sancajj@gmail.com
Enviado a Revisar: 20 Abr. 2012
Aceptado el: 11 Jun. 2012














