Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Nefrología (Madrid)
versión On-line ISSN 1989-2284versión impresa ISSN 0211-6995
Nefrología (Madr.) vol.34 no.5 Cantabria 2014
https://dx.doi.org/10.3265/Nefrologia.pre2014.May.12534
ARTÍCULOS ESPECIALES
Recomendaciones de vacunación frente a neumococo en enfermos renales en España
Recommendations for vaccination against pneumococcus in patients with kidney patients in Spain
José Portolés-Pérez1, María Marques-Vidas2, Juan J. Picazo3, Fernando González-Romo3, Amós García-Rojas4, Emilio Pérez-Trallero5, Pedro Gil-Gregorio6, Rafael de la Cámara7, M. Luisa Morató8, Alejandro Rodríguez9, José Barberán10, Vicente Domínguez-Hernández11, Manuel Linares-Rufo12, Isabel Jimeno-Sanz13, Francisco Sanz-Herrero14, Javier Espinosa-Arranz15, Valle García-Sánchez16, María Galindo-Izquierdo17 y Alberto Martínez-Castelao18
1Sociedad Española de Nefrología. Servicio de Nefrología. Hospital Universitario Puerta de Hierro/REDInREN. ISCIII.
Red 06/0016-12/0021. Madrid
2Servicio de Nefrología. Hospital
Universitario Puerta de Hierro/REDInREN. ISCIII. Red 06/0016-12/0021. Madrid
3Sociedad Española de Quimioterapia, Infección y Vacunas
4Asociación Española de Vacunología
5Sociedad Española de Enfermedades Infecciosas y Microbiología
6Sociedad Española de Geriatría y Gerontología
7Sociedad Española de Hematología y Hemoterapia
8Sociedad Española de Medicina Familiar y Comunitaria
9Sociedad Española de Medicina Intensiva
10Sociedad Española de Medicina Interna
11Sociedad Española de Medicina Preventiva
12Sociedad Española de Médicos de Atención Primaria
13Sociedad Española de Médicos Generales y de Familia
14Sociedad Española de Neumología
15Sociedad Española de Oncología Médica
16Sociedad Española de Patología Digestiva
17Sociedad Española de Reumatología
18Sociedad Española de Nefrología
Dirección para correspondencia
RESUMEN
La enfermedad neumocócica invasiva (ENI) supone un grave problema en algunos grupos de riesgo: los pacientes con enfermedad renal crónica estadios 4 y 5 y aquellos con estadio 3 y tratamiento inmunosupresor, síndrome nefrótico o diabetes. Estos individuos son más susceptibles de adquirir la infección y más propensos a padecer cuadros de mayor gravedad y peor evolución. Entre las estrategias para prevenir la ENI se encuentra la vacunación, aunque las coberturas vacunales en este grupo son más bajas de lo deseable hoy en día. Actualmente, disponemos de dos vacunas para el adulto. La vacuna polisacárida (VNP23), que se emplea en mayores de 2 años de edad desde hace décadas, es la que mayor número de serotipos (23) incluye, pero no genera memoria inmunitaria, provoca un fenómeno de tolerancia inmunitaria y no actúa sobre la colonización nasofaríngea. La vacuna conjugada (VNC13) puede emplearse desde lactantes hasta la edad adulta (la indicación en mayores de 18 años ha recibido la aprobación de la Agencia Europea de Medicamentos en julio de 2013) y genera una respuesta inmunitaria más potente que la VNP23 frente a la mayoría de los 13 serotipos en ella incluidos. Las 16 sociedades científicas más directamente relacionadas con los grupos de riesgo para padecer ENI han trabajado en la discusión y elaboración de una serie de recomendaciones vacunales basadas en las evidencias científicas respecto a la vacunación antineumocócica en el adulto con condiciones y patología de base que se recogen en el documento "Consenso: Vacunación antineumocócica en el adulto con patología de base". En el presente texto se recogen las recomendaciones de vacunación para la población de enfermos renales crónicos.
Palabras clave: Vacunación, Neumococo, Consenso sociedades, Enfermedad renal crónica, Trasplante renal.
ABSTRACT
Invasive pneumococcal disease (IPD) is a serious problem in some risk groups: patients with stage 4 and 5 chronic kidney disease, stage 3 CKD undergoing immunosuppressive treatment, nephrotic syndrome or diabetes. These individuals are more susceptible to infections and more prone to suffering more severe and worsening symptoms. Vaccination is one of the strategies for preventing IPD, although vaccination coverage in this group at present is lower than desired. Currently, there are two vaccinations for adults. The polysaccharide vaccine (PPSV23), used for decades in patients over the age of 2, includes most serotypes (23), but it does not generate immune memory, causing the immune tolerance phenomenon and it does not act on nasopharyngeal colonisation. The conjugate vaccine (VNC13) can be used from infancy until adulthood (advice in patients over 18 years old received approval from the European Medicines Agency in July 2013) and generates a more powerful immune response than PPSV23 against the majority of the 13 serotypes that it includes. The 16 scientific societies most directly associated with the groups at risk of IPD have discussed and drafted a series of vaccination recommendations based on scientific evidence related to pneumococcal vaccination in adults with underlying conditions and pathologies, which are the subject of the document "Consensus: Pneumococcal vaccination in adults with underlying pathology". This text sets out the vaccination recommendations for the chronic kidney disease population.
Key words: Vaccination, Pneumococo, Consensus documents, Chronic kidney disease, Renal transplantation.
Introducción
Desde junio de 2010 se encuentra disponible en España la vacuna conjugada frente a 13 serotipos de Streptococcus pneumoniae, cuya indicación para prevenir la enfermedad neumocócica invasiva (ENI) fue ampliada a adultos de 50 años o más por la Agencia Europea de Medicamentos en octubre de 20111. Durante el año 2012 varias comunidades autónomas2-4, así como algunas sociedades científicas5,6, publicaron la actualización de sus recomendaciones sobre la vacunación antineumocócica en el adulto por indicaciones médicas, o pertenecientes a grupos de riesgo, entre los que la vacuna conjugada podría aportar un importante beneficio.
Finalmente, en 2013, 16 sociedades científicas de Atención Primaria y distintas especialidades elaboraron el documento de consenso sobre vacunación antineumocócica en el adulto con patología de base, en el que se recogen también las recomendaciones referentes a la enfermedad renal crónica (ERC)1.
En el presente documento se resumen las recomendaciones que afectan a pacientes con ERC en distintos estadios y con distintos factores de comorbilidad.
Enfermedad neumocócica: epidemiología
S. pneumoniae constituye una causa importante de morbilidad y mortalidad en el mundo, responsable de la enfermedad prevenible con vacunas que más mortalidad causa7. Según estimaciones de la Organización Mundial de la Salud, es causante de 1,6 millones de muertes anuales, donde los más afectados son los niños más pequeños y los adultos de mayor edad8. En España S. pneumoniae es el agente patógeno más frecuentemente identificado de la neumonía adquirida en la comunidad (NAC), responsable de hasta el 63,7%, según series9. Durante el período 2003-2007 se registraron un total de 75932 muertes por NAC en adultos de, al menos, 50 años de edad10. La mortalidad asociada a la neumonía neumocócica oscila entre <1% en jóvenes adultos y el 10-30% en la neumonía bacteriémica del anciano11.
Cuadros clínicos
La ENI representa la forma más grave de presentación de la infección neumocócica y se define como la presencia de S. pneumoniae en sangre, líquido cefalorraquídeo (LCR) u otro fluido normalmente estéril12. Las tasas de incidencia más elevadas de la ENI se dan en los grupos de edad extremos de la vida13. Según datos de nuestro país (2007-2009), la tasa de incidencia anual media en menores de 2 años es de 49,79 casos/105 habitantes y de 20,76 casos/105 habitantes a partir de los 65 años14.
La ENI se puede presentar de diferentes formas clínicas, siendo la neumonía bacteriémica la más frecuentemente comunicada. En el adulto, el 60-87% de todos los casos de bacteriemia neumocócica es atribuible a neumonías15.
Uno de los principales cuadros clínicos que produce S. pneumoniae es la neumonía, especialmente la NAC. Sin embargo, la documentación microbiológica de los cuadros neumónicos no es siempre posible y además solo un pequeño porcentaje produce bacteriemia, por lo que no todos los casos pueden ser considerados como ENI. La incidencia de NAC en nuestro país en mayores de 65 años se estima de 14 casos por 1000 personas-año (intervalo de confianza al 95% 12,7-15,3) y aumenta conforme lo hace la edad (29,4 casos por 1000 personas-año en mayores de 85 años)16. Además comporta una importante carga, pues hasta el 75% de los casos requiere ingreso hospitalario17.
Factores de riesgo
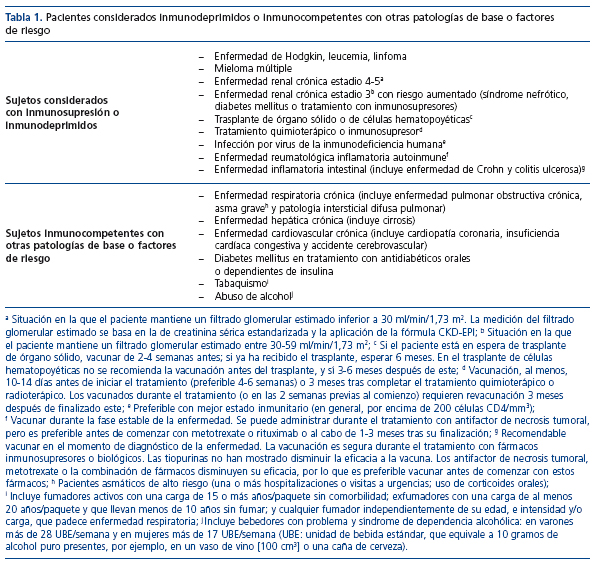
Además de la edad, se ha descrito profusamente que determinadas enfermedades concomitantes aumentan el riesgo de ENI y su evolución (tabla 1). Entre ellas destacan aquellas condiciones médicas que conllevan un estado de déficit inmunitario, tales como la enfermedad renal, hepática, respiratoria y cardiovascular crónica; los pacientes infectados por el virus de la inmunodeficiencia humana (VIH); pacientes en espera de trasplante de órgano sólido (y los ya trasplantados) y pacientes trasplantados de progenitores hematopoyéticos; pacientes bajo quimioterapia por tumor sólido o hematopatía maligna; pacientes con enfermedad autoinmune y tratados con corticoides, inmunosupresores o productos biológicos; pacientes diabéticos; con fístulas de LCR, con implantes cocleares, así como con asplenia anatómica o funcional10,17,18.
La enfermedad subyacente, además de incrementar el riesgo de ENI, puede influir en el tipo de presentación clínica y su posterior evolución, de modo que la tasa de letalidad por ENI aumenta significativamente en pacientes con comorbilidades que comportan inmunosupresión (tabla 1)1.
Enfermedad renal como factor de riesgo para la infección por neumococo
Las infecciones agudas (bacterianas, víricas y fúngicas) contribuyen sustancialmente a las altas tasas de hospitalización y mortalidad de los pacientes con ERC19. Hay numerosos factores que predisponen a los pacientes con ERC a sufrir infecciones y que se relacionan directamente con distintos aspectos de la insuficiencia renal:
- El síndrome nefrótico se ha relacionado con un aumento en el número y la severidad de las infecciones, debido al edema periférico, la pérdida de factores de la vía alterna del complemento y las alteraciones en la función leucocitaria y esplénica20.
- En la ERC, la malnutrición, el aumento del calcio intracelular, la sobrecarga de hierro, las membranas de diálisis y las toxinas urémicas se han relacionado con alteración de la función de los polimorfonucleares.
- En el contexto del fracaso renal agudo, se ha descrito alteración de la función linfocitaria y de monocito-macrófago.
- Aumento de la exposición a patógenos debido a "exceso de uso de instalaciones sanitarias"21.
Aunque no existen estudios que relacionen directamente ambas variables, las tasas de hospitalización aumentan significativamente a medida que progresa la ERC. Por todo lo anterior, parece razonable abordar una política de vacunación específicamente orientada a la ERC, que por otro lado constituye un grupo de población en el que en general se infrautilizan las vacunas disponibles.
Por ello, las guías mundiales KDIGO (Kidney Disease Initiative Global Outcomes) publicadas en 2013 recomiendan que todos los adultos con ERC estadio 4-5 y aquellos en estadio 3 con riesgo aumentado (síndrome nefrótico o diabetes mellitus o tratamiento con inmunosupresores) (tabla 2) reciban una vacuna neumocócica, salvo que esté específicamente contraindicada en su caso21. Sabemos que la respuesta vacunal en estos pacientes está reducida y que la pérdida de títulos es más rápida, lo que debe ser tenido en cuenta para las revacunaciones20.
Vacuna antineumocócica
Vacuna antineumocócica polisacárida 23valente
La vacuna antineumocócica polisacárida 23valente (VNP23) se incluyó en el calendario de vacunación del adulto en España entre los años 2003 y 2005, según las diferentes comunidades autónomas22. La pauta recomendada es de una única dosis a cualquier persona de 60 años, o más, y a aquellos mayores de 2 años de edad que presenten algún factor de riesgo (tabla 1), como: enfermedades crónicas (cardiovasculares, pulmonares [excepto asma] o metabólicas); asplenia anatómica o funcional, insuficiencia renal crónica, cirrosis hepática, diabetes mellitus, alcoholismo, fístulas del LCR, implantes cocleares, infección por el VIH, enfermedades inmunosupresoras y tratamiento quimioterápico23.
Actualmente se recomienda una única revacunación a los vacunados hace más de cinco años (segunda dosis) que cumplan las siguientes circunstancias:
- Mayores de 60 años que fueron vacunados hace más de cinco años por alguna de las indicaciones anteriores antes de esa edad.
- Personas de cualquier edad con alto riesgo de enfermedad neumocócica grave, como: asplenia, insuficiencia renal crónica, síndrome nefrótico o cualquier otra inmunosupresión22.
La VNP23 induce una respuesta inmune independiente de células T en el 80% de los adultos sanos, aunque con distinta magnitud según los serotipos incluidos en la vacuna, así como por la edad y la comorbilidad del sujeto vacunado22. La efectividad vacunal de VNP23 basada en estudios observacionales muestra en un metaanálisis una efectividad en adultos sanos inmunocompetentes del 50-80% en la prevención de enfermedad invasora, sin demostración concluyente de protección frente a la neumonía no bacteriémica24. Sin embargo, los análisis de efectividad de esta vacuna en los grupos de riesgo no han demostrado protección significativa frente a la infección por neumoco, con tasas de respuesta serológicas bajas que no mejoraban tras la administración de la segunda dosis de la vacuna25.
Además, esta vacuna presenta otros inconvenientes:
- Los niveles de anticuerpos disminuyen progresivamente tras la vacunación, hasta alcanzar los valores prevacunales después de un período de 3 a 10 años26.
- Ausencia de memoria inmunitaria o respuesta anamnésica con escaso reclutamiento de linfocitos B de memoria27.
- Inducción del fenómeno de tolerancia inmunitaria o hiporrespuesta con las revacunaciones28. La respuesta inmune a la revacunación frente a la mayoría de los serotipos es inferior a la observada después de la primovacunación, frente a la mayoría de los serotipos. Por lo tanto, la segunda dosis de la vacuna no se considera un refuerzo.
- No actúa sobre la colonización nasofaríngea, factor fundamental en la epidemiología de las infecciones neumocócicas, y por lo tanto no confiere protección significativa frente a las infecciones neumocócicas de la mucosa ni frente a la disminución de cepas neumocócicas resistentes a los antibióticos29.
Vacuna antineumocócica conjugada
La VNC13 es una vacuna antineumocócica conjugada que proporciona protección frente a 13 serotipos de S. pneumoniae1. Los 13 serotipos de neumococo incluidos en esta vacuna (1, 3, 4, 5, 6A, 6B, 7F, 9V, 14, 18C, 19A, 19F y 23F) son responsables de, al menos, el 50-76%18 de los casos de ENI en adultos de 50 años de edad o mayores2.
La VNC13 recibió la autorización de comercialización europea para su uso en lactantes y niños pequeños en diciembre de 2009 y está disponible en España desde junio de 20102. El impacto observado de su uso en nuestro país muestra una reducción en la tasa de incidencia de hospitalizaciones por la ENI del 55% (p<0,001) en niños menores de 15 años, que asciende al 63% (p<0,001) en aquellos entre 12 y 24 meses30.
Además, esta vacuna tiene la ventaja de sensibilizar al sistema inmune para que genere una respuesta booster ante una segunda administración de cualquiera de las dos vacunas y, por tanto, la vacuna conjugada induce memoria inmunológica31.
Pautas/recomendaciones de vacunacion/finaciación
Las pautas de vacunación actuales y el tipo de vacuna que se ha de utilizar en los distintos grupos de riesgo se especifican en la tabla 2.
La Dirección General de Cartera Básica de Servicios del Sistema Nacional de Salud y Farmacia resolvió el 17 de julio de 2012 incluir en la prestación farmacéutica del Sistema de Salud con cargo a fondos públicos la indicación de inmunización activa para la prevención de la ENI causada por S. pneumoniae en adultos de 50 años, o más, con las siguientes indicaciones: inmunosupresión, enfermedad de Hodgkin, leucemia, linfoma, mieloma múltiple, insuficiencia renal, síndrome nefrótico, trasplante de órgano sólido o de células hematopoyéticas, tratamiento quimioterápico e infección por VIH.
Tras la reciente evaluación positiva del Committee for Medicinal Products for Human Use de la Agencia Europea de Medicamentos para la ampliación de indicación a adultos a partir de 18 años, es probable que en un plazo breve el Sistema Nacional de Salud y Farmacia también modifique esta prestación. A su vez, algunas comunidades autónomas han ampliado las mencionadas indicaciones y el rango etario.
Para algunas de las recomendaciones efectuadas en este documento de consenso (tabla 2), no existe en estos momentos financiación pública, por lo que habrán de ser prescritas indicando a los usuarios que deberán abonarlas íntegramente. Adicionalmente nos permitimos recordar que las Guías KDIGO de 2013 recomiendan revacunar cada cinco años a todos los pacientes con ERC ya vacunados, salvo contraindicación22.
Conflictos de interés
Los autores declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este artículo.
Referencias Bibliográficas
1. Ficha técnica Prevenar 13. Accessed: July 15, 2013. Available at: http://www.ema.europa.eu/docs/es_ES/document_library/EPAR-Product_Information/human/001104/WC500057247.pdf. [ Links ]
2. Vacunación Antineumocócica para el Adulto en la Comunidad de Madrid. Comité de Expertos Asesor de Vacunas de la Comunidad de Madrid, 2012. Accessed: 15 July, 2013. Available at: http://www.madrid.org/cs/Satellite?blobcol=urldata & blobheader=application/pdf & blobheadername1=Content-disposition & blobheadername2=cadena & blobheadervalue1=filename=Vacuna_an-tineumococica_adultos_Madrid-2012.pdf & blobheadervalue2=language=es & site=PortalSalud & blobkey=id & blobtable=MungoBlobs & blobwhere=1311043153702 & ssbinary=true. [ Links ]
3. Utilización da vacina antipneumocócica conxugada trecevalente en persoas de 50 ou máis anos pertencentes a grupos de risco. Servicio Galego de Saúde. Xunta de Galicia, 2012. Accessed: July 15, 2013. Available at: http://www.sergas.es/gal/DocumentacionTecnica/docs/SaudePublica/vacunas/PNEUMO_conxugada_adultos_firmada.pdf. [ Links ]
4. Vacuna antineumocócica conjugada en personas de 6 o más años. Indicaciones de dispensación gratuita. Dirección General de Salud Pública. Región de Murcia, 2013. Accessed: July 15, 2013. Available at: en: http://www.murciasalud.es/recursos/ficheros/245766-Indicaciones.pdf. [ Links ]
5. Recomendaciones de Vacunación Antineumocócica en el Adulto por Indicación Médica. Sociedad Española de Medicina Preventiva, Salud Pública e Higiene. Revista de Medicina Preventiva 2012;XVIII:1-33. Accessed: July 15, 2013. Available at: http://www.sempsph.com/images/stories/recursos/pdf/protoco-los/2012/Recom_Vac_Antineumococica_SEMPSPH.pdf. [ Links ]
6. Jiménez Ruiz C, Solano Reina S, Riesco Miranda J, Altet Gómez N, Signes-Costa Miñana J, Lorza Blasco J, et al. Recomendaciones para la vacunación neumocócica en fumadores. Prev Tab 2012;14:174-7. [ Links ]
7. Centers for Disease Control and Prevention. Pneumococcal disease. In: Atkinson W, Wolfe S, Hamborsky J, eds. Epidemiology and Prevention of Vaccine-Preventable Diseases. 12 ed. Washington, DC: Public Health Foundation; 2011. pp. 233-48. [ Links ]
8. World Health Organization (WHO). 23-valent pneumococcal polysaccharide vaccine. WHO position paper. Wkly Epidemiol Rec 2008;83:373-84. [ Links ]
9. Giannella M, Pinilla B, Capdevila JA, Martínez Alarcón J, Muñoz P, López Álvarez J, et al. Pneumonia treated in the internal medicine department: focus on healthcare-associated pneumonia. Clin Microbiol Infect 2012;18:786-94. [ Links ]
10. Gil-Prieto R, Garcia-Garcia L, Alvaro-Meca A, Mendez C, Garcia A, de Miguel AG. The burden of hospitalisations for community-acquired pneumonia (CAP) and pneumococcal pneumonia in adults in Spain (2003-2007). Vaccine 2011;29:412-6. [ Links ]
11. Dransfield MT, Harnden S, Burton RL, Albert RK, Bailey WC, Casaburi R, et al. Long-term comparative immunogenicity of protein conjugate and free polysaccharide pneumococcal vaccines in chronic obstructive pulmonary disease. Clin Infect Dis 2012;55:e35-44. [ Links ]
12. Musher DM. Streptococcus pneumoniae. In: Mandell GL, Bennett JE, Dolin R, eds. Mandell, Douglas, Bennet's principles and practice of infectious diseases. Philadelphia: Churchill Livingstone Elsevier; 2010. pp. 2623-42. [ Links ]
13. Centers for Disease Control and Prevention. 2011. Active Bacterial Core Surveillance Report, Emerging Infections Program Network, Streptococcus pneumoniae, 2010. [ Links ]
14. Gutiérrez Rodríguez M, Varela González A, Ordobás Gavín M, Martín Martínez F, García Marín F, Ramos Blázquez B, et al. Invasive pneumococcal disease: Association between serotype, clinical presentation and lethality. Vaccine 2011;29:5740-6. [ Links ]
15. Musher DM, Alexandraki I, Graviss EA, Yanbeiy N, Eid A, Inderias LA, et al. Bacteremic and nonbacteremic pneumococcal pneumonia. A prospective study. Medicine (Baltimore) 2000;79:210-21. [ Links ]
16. Centers for Disease Control and Prevention. Use of 13-valent pneumococcal conjugate vaccine and 23-valent pneumococcal polysaccharide vaccine for adults with immunocompromising conditions: recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR Morb Mortal Wkly Rep 2012;61:816-9. [ Links ]
17. Ochoa-Gondar O, Vila-Corcoles A, de Diego C, Arija V, Maxenchs M, Grive M, et al. The burden of community-acquired pneumonia in the elderly: the Spanish EVAN-65 study. BMC Public Health 2008;8:222. [ Links ]
18. Chidiac C. Pneumococcal infections and adult with risk factors. Med Mal Infect 2012;42:517-24. [ Links ]
19. US Renal Data System: USRDR 2007 Annual Data Repport: Atlas of Chronic Kidney Disease and End-Stage Renal Disease in the United States. Bethesda: National Institute of Health, National Institute of Diabetes and Digestive and Kidney Diseases; 2007. [ Links ]
20. Vanholder R, Ringoir S. Infectious morbidity and defects of phagocytic function in end-stage renal disease: A review. J Am Soc Nephrol 1993;3:1541-54. [ Links ]
21. K/DIGO panel: Other complications of CKD: CVD, medication dosage, patient safety, infections, hospitalizations, and caveats for investigating complications of CKD. Kidney International Supplements 2013;3:91-111. [ Links ]
22. Casanovas G. Vacunas incluidas en el calendario vacunal. Pediatr Integral 2006;X:23-36. [ Links ]
23. Calendario de vacunación del adulto de la Comunidad de Madrid. Accessed: July 15, 2013. Available at: http://www.ma-drid.org/cs/Satellite?cid=1142427371738 & language=es & pagename=PortalSalud/Page/PTSA_pintarContenidoFinal & vest=1156329829913. [ Links ]
24. Bouza E, Grau I, Torres A. Clinical presentations and serotypes causing community-adquired, healthcare-associated or nosocomial invasive pneumococcal disease in adults in a multicenter clinical surveillance in Spain (2010-2012). In: 23nd European Congress of Clinical Microbiology and Infectious Diseases (ECCMID) 2013. Berlin, Germany; 2013. [ Links ]
25. Andrews NJ, Waight PA, George RC, Slack MP, Miller E. Impact and effectiveness of 23-valent pneumococcal polysaccharide vaccine against invasive pneumococcal disease in the elderly in England and Wales. Vaccine 2012;30:6802-8. [ Links ]
26. Shapiro ED, Berg AT, Austrian R, Schroeder D, Parcells V, Margolis A, et al. The protective efficacy of polyvalent pneumococcal polysaccharide vaccine. N Engl J Med 1991;325:1453-60. [ Links ]
27. Centers for Disease Control and prevention. Recommendation of the immunization practices advisory committee (ACIP). Polysaccharide vaccine for prevention of Haemophilus influenzae type b disease. MMWR Morb Mortal Wkly Rep 1985;34:201-5. [ Links ]
28. World Health Organization. Duration of Protection and Revaccination. Additional summaries of information related to WHO position papers on pneumococcus. Accessed: 15 July, 2013. Available at: http://www.who.int/immunization/PPV23_Additional_summary_Duration_protection_revaccination.pdf. [ Links ]
29. Makela P, Kayhty H. Evolution of conjugate vaccines. Expert Rev Vaccines 2002;1:399-410. [ Links ]
30. Picazo J, Ruiz Contreras J, Casado J. Universal vaccination with PCV7 vs. VNC13: changes in invasive pneumococcal disease incidence rates by clinical presentation and children age. In: 31st Meeting of the European Society for Paediatric Infectious Diseases (ESPID 2013). Milan, Italy; 2013. [ Links ]
31. Paradiso PR. Pneumococcal conjugate vaccine for adults: a new paradigm. Clin Infect Dis 2012;55:259-64. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
José Portolés-Pérez
Sociedad Española de Nefrología
Servicio de Nefrología
Hospital Universitario Puerta de Hierro/REDInREN
ISCiii, Joaquín Rodrigo 1, 28224, Madrid
E-mail: josem.portoles@salud.madrid.org
Enviado a Revisar: 17 Mar. 2014
Aceptado el: 26 May. 2014