Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO  Similares en Google
Similares en Google
Compartir
Nutrición Hospitalaria
versión On-line ISSN 1699-5198versión impresa ISSN 0212-1611
Nutr. Hosp. vol.19 no.6 Madrid nov./dic. 2004
Revisión
Obesidad y sistema inmune
M. Muñoz, R. A. Mazure y J. M. Culebras*
Facultad de Medicina. Universidad de Málaga. *Servicio de Cirugía. Hospital de León.
| Resumen Junto al notable aumento de la prevalencia de la obesidad en los países desarrollados, aparece un incremento paralelo de las enfermedades crónicas asociadas. La morbilidad secundaria al sobrepeso y la obesidad incluye, además de diabetes tipo 2, dislipemia, hipertensión, enfermedad coronaria, enfermedad cerebro vascular, colelitiasis, osteoartritis, insuficiencia cardiaca, síndrome de apnea del sueño, alteraciones menstruales, esterilidad y alteraciones psicológicas, una mayor susceptibilidad a padecer algunos tipos de cáncer e infecciones, hay mayor riesgo de bacteriemia y una prolongación del tiempo de cicatrización de las heridas tras intervenciones quirúrgicas. Todo ello indica que la obesidad ejerce efectos negativos sobre los componentes del sistema inmune y su función. (Nutr Hosp 2004, 19:319-324) Palabras clave: Obesidad. Leptina. Sistema inmune. | OBESITY AND THE IMMUNE SYSTEM Abstract With an increased prevalence of obesity in developed countries, associated chronic diseases rise in a parallel way. Morbidity secondary to overweight and obesity include type 2 diabetes, dislipemia, hypertension, heart disease, cerebrovascular disease, cholelithiasis, osteoarthritis, heart insufficiency, sleep apnoea, menstrual changes, sterility and psychological alterations. There is also a greater susceptibility to suffer some types of cancer, infections, greater risk of bacteremia and a prolonged time of wound healing after surgical operations. All these factors indicate that obesity exerts negative effects upon the immune system. (Nutr Hosp 2004, 19:319-324) Key words: Obesity. Leptin. Immune system.
|
Correspondencia: Prof. M. Muñoz.
GIEMSA.
Facultad de Medicina.Universidad de Málaga.
Campus de Teatinos, s/n.
29071 Málaga.
Recibido: 3-VII-2004.
Aceptado: 20-IX-2004.
Introducción
La obesidad es un problema de salud pública. Algunos autores consideran que alcanza actualmente la dimensión de pandemia en los Estados Unidos1.
En España, la prevalencia de sobrepeso y obesidad -es decir índices de masa corporal (IMC) superiores a 24-, alcanzaría ya el 48,9% de los hombres y el 42% de las mujeres2.
Junto al notable aumento de la prevalencia de la obesidad en los países desarrollados, aparece un incremento paralelo de las enfermedades crónicas asociadas y un comienzo clínico a edades más tempranas. En particular, la diabetes tipo 2, que aparece tradicionalmente en adultos de mediana edad, está comenzando a observarse varias décadas más pronto, al afectar la obesidad a un número creciente de niños y adolescentes, tanto en España y otros países europeos, como en EE.UU3.
La morbilidad asociada al sobrepeso y la obesidad incluyen, además de la diabetes tipo 2, dislipemia, hipertensión, enfermedad coronaria y cerebrovascular, colelitiasis, osteoartritis, insuficiencia cardiaca, síndrome de apnea del sueño, alteraciones menstruales, esterilidad y alteraciones psicológicas.
Además de estas complicaciones, los individuos obesos presentan una mayor susceptibilidad a padecer algunos tipos de cáncer e infecciones, tienen mayor riesgo de bacteriemia y un mayor tiempo de cicatrización de las heridas tras una intervención quirúrgica4.
Todo ello indica que la obesidad ejerce unos efectos negativos sobre los componentes del sistema inmune y su funcionalidad.
Si bien la obesidad se contempla hoy como una enfermedad de origen multifactorial, no es menos cierto que se conocen ya nueve genes implicados en su génesis. Se describió hace 30 años el gen ob/ob que codificaría un factor de saciedad que actuaría sobre un receptor, a su vez codificado por el gen db. Este factor de saciedad se descubrió hace unos quince años, denominándose leptina.
De forma más reciente, se postula un papel adicional para la leptina. En efecto, un déficit de leptina, tanto en humanos como en animales de experimentación, se traduciría en anomalías a nivel del sistema inmunitario, aumentando la susceptibilidad de éstos a la infección.
En esta revisión trataremos de describir las alteraciones inmunitarias que pueden hallarse en relación con la obesidad, y su posible relación causal.
Etiopatogenia
Hasta hace relativamente poco tiempo, habíamos contemplado la obesidad de manera muy simplista. En general, se consideraba que ésta se producía como consecuencia de un aumento de la ingesta, más allá de las necesidades, o de una actividad física inadecuada frente a una ingesta también inadecuada; esto es, como una alteración del balance energético en el que la energía ingerida era mayor que la requerida por el organismo.
Aunque diversos estudios han sugerido que hasta el 70% de la variabilidad del peso corporal puede atribuirse a factores genéticos (e.g., genes de la leptina y del receptor de leptina), éstos no pueden explicar el incremento de la prevalencia de la obesidad registrado en las últimas décadas5. Así pues, el cambio en los hábitos dietéticos y la progresiva falta de ejercicio físico deben jugar un papel importante6. También se han postulado como factores causales la alteración de la regulación de la ingesta a largo plazo (memoria metabólica), la resistencia periférica a la insulina, la alteración de la regulación que ejerce el sistema nervioso central, a diferentes niveles cognitivos, sobre los mecanismos de control del peso corporal (comportamientos obsesivo-compulsivos), la disminución de la termogénesis inducida por la dieta (proteínas desacopladoras, UCP) e incluso infecciones virales7.
Por tanto, la obesidad es una enfermedad enormemente compleja en la que participan una serie de factores fisiológicos, metabólicos, genéticos, económicos, culturales, emocionales, etc. Todos estos factores se imbrican en el mecanismo etiopatogénico, aún no completamente esclarecido, de una enfermedad que ha adquirido unas dimensiones epidémicas, y cuyas consecuencias tienen quizá un alcance que todavía desconocemos8. Sí sabemos que la obesidad se relaciona con una amplia variedad de complicaciones como hipertensión, dislipidemia, enfermedad cardiovascular, diabetes y alteraciones de la coagulación3.
Obesidad y sistema inmune
Sabemos que existe una relación entre el índice de masa corporal (IMC) y tasa de mortalidad, y que ésta es siempre menor en la mujer que en el varón para un mismo IMC. Así, la mortalidad es muy baja cuando el IMC está entre 20 y 25, que sería el IMC óptimo; es baja cuando se sitúa entre 25 y 30, es decir, en una situación de ligero sobrepeso; se hace moderada por encima de 30-50, y es alta o muy alta cuando estamos ante una situación de obesidad mórbida7.
Las complicaciones de la obesidad antes mencionadas pueden estar detrás de este aumento de la mortalidad.
Los cambios inmunológicos que se producen en la obesidad afectan tanto a la inmunidad humoral, sobre todo a la secreción de anticuerpos, como a la inmunidad celular, especialmente al recuento de leucocitos y subpoblaciones linfocitarias y a la proliferación de linfocitos en respuesta a mitógenos9.
En la actualidad se sabe que el tejido adiposo, además de su función de almacenamiento de reservas energéticas en forma de triglicéridos, tiene importantes funciones como órgano endocrino, productor de diversas hormonas y otras moléculas de señalización. Algunas de dichas moléculas secretadas por el tejido adiposo, como la leptina, están activamente implicadas en la homeostasis energética y en la regulación de la función inmune10.
La leptina, principalmente secretada por los adipocitos, pertenece a la familia de las citocinas (estructuralmente similar a IL-5, IL-6 e IL-15) y sus concentraciones plasmáticas se correlacionan con la masa grasa y responden a los cambios en el balance energético. En este contexto, la leptina tendría como principal efecto actuar sobre el sistema nervioso central e inhibir la ingesta para regular los depósitos de energía. Adicionalmente, aumenta el metabolismo basal, estimula la oxidación de ácidos grasos y modula la funcionalidad de la células ß del páncreas. Por ello, se pensó que un déficit de leptina podría ser la causa de la obesidad; sin embargo, se ha observado que la mayor parte de los obesos tienen niveles elevados de leptina. Lo que ocurre es que estos individuos no tienen un déficit de producción de leptina, sino que en muchos casos lo que existe es un fallo en el transportador de leptina desde la sangre al interior del SNC, a través de la barrera hematoencefálica, y/o una resistencia periférica a la leptina11.
Por ello, inicialmente, la leptina fue considerada como una hormona anti-obesidad, pero las evidencias experimentales han demostrado los efectos pleiotrópicos de esta molécula sobre la función reproductora, la hematopoyesis, la angiogénesis, la homeostasis de los órganos linfoides y las funciones de los linfocitos T. Dado que las acciones de la leptina están mediadas a través de su unión a receptores específicos (estructuralmente similares a los receptores de citocinas hematopoyéticas), estos datos indican que no sólo tenemos receptores de leptina a nivel de las células del sistema nervioso, sino que éstos están presentes en otras muchas células de nuestro organismo12.
Más específicamente, la leptina parece constituir un nexo de unión entre la respuesta pro-inflamatoria Th1, el estado nutricional y el balance energético. Así, existen datos que indican que estimula la proliferación y activación de células mononucleares periféricas, estimula la producción de citocinas proinflamatorias (IL-6, TNF-α) por los monocitos circulantes, potencia la activación de linfocitos a agentes mitógenos como fitohemaglutinina o concanavalina A, inhibe la producción de linfocitos T de memoria, aumenta la producción de linfocitos B, y estimula la producción de citocinas tipo Th1 (IL-2, IFN-γ) por los linfocitos13.
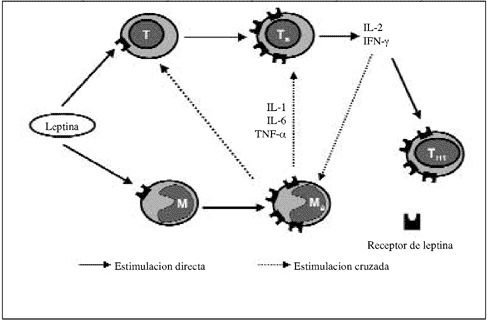
El posible mecanismo de acción de la leptina sobre las células del sistema inmune se esquematiza en la figura 1. La leptina estimula a los monocitos haciendo que expresen más receptores de leptina, y del mismo modo actúa sobre los linfocitos T haciendo que expresen más receptores de leptina y activándolos14. Como consecuencia de ello, se va a producir una liberación de citocinas proinflamatorias por parte de los monocitos; estas citocinas producen una estimulación de los linfocitos T los cuales responden aumentando la producción de IL-2 y de IFN-γ, dos citocinas de la respuesta Th1 (fig. 1). La respuesta Th1 es inmunoprotectora, pero también es proinflamatoria y, por lo tanto, una respuesta Th1 exagerada es perjudicial. Por otra parte, el IFN-γ va a actuar sobre los monocitos aumentando la producción de citocinas proinflamatorias, por lo que podemos considerar que la misma leptina es una citocina proinflamatoria (fig. 1)12,13. Por tanto, podríamos considerar la obesidad como una enfermedad inflamatoria en la cual se observan frecuentemente niveles altos de leptina circulante.
Fig. 1.-Posible mecanismo de activación de las células mononucleares
por la leptina (Modificado de Sánchez-Margalet y cols., 2003)12.
Como ya hemos indicado anteriormente, la leptina se produce fundamentalmente en el tejido adiposo y, por tanto, en aquellos individuos que tienen escaso panículo adiposo los niveles circulantes de leptina serán bajos. De hecho se ha visto que los niños desnutridos tienen niveles bajos de leptina y que esos niveles bajos se correlacionan con una disminución de la respuesta linfoproliferativa ante una agresión15. La hipoleptinemia conduciría a un aumento de la susceptibilidad a la infección debido a una disminución de la activación de los linfocitos T helper y a un efecto directo sobre el timo11. Además, cuando estos niños son realimentados y ganan peso, los niveles de leptina se normalizan, y ello va en paralelo con un aumento en la actividad Th1. Por otra parte, se ha visto que el déficit congénito de leptina se asocia con una mayor incidencia de infecciones y de mortalidad11. Sin embargo, en los pocos individuos que presentan esta deficiencia genética16, la administración de leptina exógena restaura la funcionalidad de sus linfocitos T, lo que viene a demostrar la existencia de un efecto directo de la leptina sobre las células T17-19.
Por el contrario, un exceso de leptina, a través de la estimulación de respuestas Th1, aumentaría la susceptibilidad a las enfermedades autoinmunes, como sugieren algunos estudios experimentales11. Dado que las mujeres son relativamente hiperleptinémicas (al presentar una mayor masa grasa) y tienen una mayor propensión que los hombres a padecer enfermedades autoinmunes, estas observaciones sugieren un papel de la leptina en una susceptibilidad género-dependiente a la autoinmunidad. Al mismo tiempo, abren una posible vía de tratamiento de las enfermedades inflamatorias y autoinmunes mediadas por células mediante la utilización de anticuerpos anti-leptina.
De este modo, los niveles excesivos de leptina, en los individuos con sobrepeso, podrían jugar un papel en el desarrollo de patologías mediadas por una exacerbación de la respuesta inmune12. Así, la leptina, junto con otras citocinas como IL-6 o TNFα, podrían acelerar el desarrollo de arteriosclerosis, diabetes mellitus tipo 2, o Síndrome X; todas ellas enfermedades inflamatorias o inmunológicas20-22.
Por último, pero no menos importante, la forma más común de obesidad humana, caracterizada por una hiperleptinemia que origina una resistencia a la leptina a nivel central y periférico10, se asocia con una incidencia aumentada de infecciones. En este contexto, la desensibilización del receptor de leptina es percibida por las células T como un estado de deficiencia de leptina, lo que conduce a una disfunción del sistema inmune similar a la producida por la malnutrición y el déficit congénito de leptina.
Vemos pues como el sistema inmune puede ser influenciado por los adipocitos, pero lo contrario también es cierto. Esto es, linfocitos y monocitos puede influenciar los depósitos de grasa. En este sentido, se ha observado que los ratones con deficiencia de ICAM-1 desarrollan obesidad en su época adulta y que ésta se asocia con una alteración de la migración de leucocitos a los tejidos periféricos, un aumento de la susceptibilidad a las infecciones, una alteración de la función de las células T y una resistencia periférica a la leptina. Estas observaciones sugieren que las interrelaciones inmuno-endocrinas pueden jugar un papel en la homeostasis de linfocitos y adipocitos, siendo esto también aplicable a las citocinas, como la IL-6 y el TNFα, que median estas interrelaciones11.
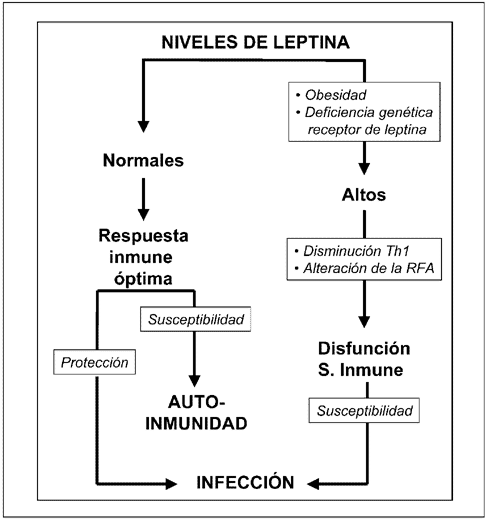
Fig. 2.-Equilibrio entre susceptibilidad a la infección y susceptibilidad a la
autoinmunidad: posible papel de la leptina (Modificado de Materese y cols., 2002)11.
En conclusión, la respuesta inmune puede verse profundamente afectada por la obesidad, jugando la léptina un importante papel, como se muestra en la figura 2. La leptina tendría varias funciones, entre la que destaca la integración de la señal de los depósitos de grasa con la actividad del sistema nervioso central, especialmente a nivel de hipotálamo, y con la actividad del sistema inmune, que:
Sería una señal clave en control de la ingesta. Esto hace que ingiramos alimentos en función de las necesidades; de modo que cuando disminuye su producción o cuando no puede ejercer esta función sobre el sistema nervioso central, por alteraciones en su transporte a través de la barrera hematoencefálica, sobreviene la obesidad.
La leptina está muy relacionada con la patología inflamatoria y autoinmune, de manera que aquellos individuos con IMC muy alto suelen fallecer de enfermedad cardiovascular, cáncer, patología respiratoria, síndrome X, diabetes, mientras que los individuos con IMC muy bajo mueren más por patologías digestivas o respiratorias, que muchas veces son la causa de este bajo peso12. Finalmente, el déficit congénito o adquirido de leptina o la resistencia a la leptina por déficit de receptores o de-sensibilización de los mismos conduce a un aumento de la susceptibilidad a las enfermedades infecciosas.
Efectos de la reducción ponderal sobre las alteraciones inmunitarias
La reducción ponderal, mediante restricción dietética o cirugía bariátrica, tiende a corregir las alteraciones de la funcionalidad del sistema inmunitario inducidas por la obesidad, sugiriendo la reversibilidad de las mismas. Sin embargo y probablemente porque los estudios hasta ahora realizados son escasos, el patrón de reversión es irregular.
Se ha observado que tras una restricción calórica moderada durante 12 semanas, los pacientes obesos presentan una menor respuesta proliferativa a mitógenos, un descenso en la actividad respiratoria oxidativa de los monocitos y un disminución del recuento de células NK, aunque no se modifican los de linfocitos T y B. Estos cambios son atribuibles fundamentalmente al descenso de la ingesta energética más que a una reducción del aporte de micronutrientes23,24. Resultados similares, disminución del recuento de NK y de los niveles de inmunoglobulinas, ya se habían observado en obesas sometidas durante 82 días a una reducción del 50% en su ingesta calórica, lo que produjo una pérdida de peso de 7-9 kg25.
Por otra parte, los periodos de restricción calórica severa o ayuno son frecuentes en los individuos obesos, y estos pueden afectar a la inmunocompetencia. Sin embargo, los resultados de diversos estudios indican que el ayuno ejerce efectos diferenciales sobre las funciones del sistema inmune más que efectos deletéreos generalizados. Así, el ayuno no modifica los recuentos de linfocitos totales y aumenta los de NK y los niveles de IgM, mientras que disminuye la respuesta proliferativa de los linfocitos frente a mitógenos26.
En lo que se refiere a la cirugía bariátrica, Cottam y cols.27 encontraron una serie de alteraciones en el sistema inmune de los individuos con obesidad mórbida, incluyendo niveles elevados de eosinófilos y monocitos CD14 (receptor de LPS), mientras que los de monocitos, neutrófilos, linfocitos T y B y células NK CD62L (L-selectina) estaban descendidos, lo que sustenta la hipótesis de la existencia de un estado inflamatorio crónico en la obesidad mórbida. La disminución de la expresión de selectina probablemente altera la capacidad de los neutrófilos para activarse y migrar a los puntos de inflamación, lo que a su vez puede jugar un papel en la mayor incidencia de infecciones.
Por otra parte, también se ha encontrado en la obesidad mórbida un aumento de la expresión de CD95 (Antígeno FAS, inmunodepresor) en neutrófilos, linfocitos T y B y células NK, lo que podría participar en el mecanismo por el cual se observa una incidencia aumentada de cáncer en los obesos mórbidos26. Sin embargo, estas anormalidades revierten rápidamente con la pérdida de peso inducida por la cirugía de bypass gástrico sobre Y de Roux26,28.
En otro estudio, en el que la técnica elegida fue la gastroplastia anillada ajustable consiguiendo una pérdida masiva de peso (mínimo 20 kg) sin aparente desnutrición, los niveles de proteínas de fase aguda disminuyeron con respecto a los obesos que no perdieron peso, aunque fueron más altos que el los controles sanos29. Además, se produjo una disminución de leucocitos totales, neutrófilos y linfocitos, hasta niveles comparables a los de los controles. Sin embargo, las diferencias en las poblaciones de linfocitos (aumento de CD4 y descenso de CD8) inducidas por la obesidad no se corrigieron tras la pérdida de peso. En otro estudio en el que se utilizó esta misma técnica, pudo observarse una reducción en los niveles séricos de IL-3 y TNF a los 6 meses después de la intervención, cuando los pacientes habían perdido un 25-30% del peso preoperatorio30. Lo más interesante de este trabajo fue que en aquellos pacientes que presentaban niveles preoperatorios altos de TNF, estos descendieron rápidamente tras la cirugía y mostraban valores prácticamente normales a los 14 días de la misma29.
Por tanto, la cirugía bariátrica no solo debemos contemplarla como una intervención para perder peso, sino que además es procedimiento inmuno-restaurador, como parece desprenderse de estos estudios.
Leptina y complicaciones de la cirugía bariátrica
Por otra parte, y en lo referente a las complicaciones de la cirugía bariátrica, es de destacar que inflamación e infección son parte de la patogénesis de la mayor parte de las complicaciones postoperatorias precoces, tales como embolismo pulmonar, infección de la herida y sepsis, sugiriendo que el sistema inmune juega un papel esencial en esta patogénesis. Esto concierne especialmente las complicaciones sépticas, que según opiniones de expertos -no refrendadas por estudios comparativos- serían de curso más grave en obesos mórbidos que en pacientes delgados.
En este sentido, la leptina sería de interés en cirugía bariátrica en cuanto a su propiedad de actuar inicialmente como proteína de fase aguda, para luego sufrir un marcado descenso. Su aumento podría ser resultado directo de incrementos de LPS, TNF-α e IL-1, todas ellas elevadas en esta situación, y susceptibles de inducir producción de leptina. Se postula que su papel aquí sería proteger el organismo contra los efectos autoagresivos del sistema inmune31. Sin embargo, parece que este incremento se invierte a partir del segundo día en que el efecto del ayuno se convertiría en dominante, con lo que la disminución de leptina circulante a partir de entonces propiciaría complicaciones sépticas a través de una disregulación del sistema inmune. Estas consideraciones llevan al planteamiento de la utilidad de la leptina como intervención farmacológica de soporte del sistema inmune en el postoperatorio de la cirugía bariátrica30.
Referencias
1. Kimm sys y cols.: Obesidad infantil: una nueva pandemia en el Nuevo milenio. Pediatrics (Ed esp) 2002, 54:181-85. [ Links ]
2. Moreno Esteban B, Monereo Mejías S, Álvarez Hernández J: Obesidad: la epidemia del Siglo XXI. Ediciones Diaz de Santos, SA, Madrid, 2000. [ Links ]
3. Sinha R, Fisch G, Teague B y cols.: Prevalence of impaired glucose tolerance among children and adolescents with marked obesity. N Engl J Med 2002, 346:802-10. [ Links ]
4. Lamas O, Martí A, Martínez JA: Obesidad e inmunocompetencia. En: Marcos A (ed) Actualización en nutrición, inmunidad e infección. Madrid: Panamericana, 2003: 125-32. [ Links ]
5. Bulló Bonet M. La leptina en la regulación del balance energético. Nutr Hosp 2002, 17:42-8. [ Links ]
6. Tojo Sierra R, Leis Trabazo R: La obesidad, un problema emergente en pediatría. Nutr Hosp 2002; 17:75-9. [ Links ]
7. Farriol M, Nogues R, Benarroch G. Etiopatogenia de la obesidad: actualidad y futuro (Editorial). Nutr Hosp 2001; 16:113-4. [ Links ]
8. Laquatra I. Nutrición para el control del peso. En: Mahan LK, Escott-Stump S (eds) Nutrición y dietoterapia de Krause. Madrid: McGraw-Hill Interamericana, 2001: 527-60. [ Links ]
9. Marcos A, Nova E, Montero A. Changes in the immune system are conditioned by nutrition. Eur J Clin Nutr 2003, 57 (Supl. 1):S66-9. [ Links ]
10. Ahima RS, Flier JS: Adipose tissue as an endocrine organ. Trends Endocrinol Metab 2002, 11:327-32. [ Links ]
11. Friedman JM, Halaas JL: Leptin and the regulation of body weight in mammals. Nature 1998, 395:763-770. [ Links ]
12. Matarese G, La Cava A, Sanna V, Lord GM, Lechler RI, Fontana S y cols.: Balancing susceptibility to infection and autoimmunity: a role for leptin. Trends Immunol 2002, 23:182-7. [ Links ]
13. Sánchez-Margalet V, Martín-Romero C, Santos-Álvarez J, Goberna R, Najib S, González-Yanés: Role of leptin as an immunomodulator of blood mononuclear cells: mechanisms of action. Clin Exp Immunol 2003, 133:11-9. [ Links ]
14. Zarkesh-Esfahani H, Pockley G, Metclafe RA, Bidlingmaier, Wu Z, Ajami A y cols.: High-dose leptin activates human leukocytes via receptor expression on monocytes. J Immunol 2001, 167:4593-9. [ Links ]
15. Palacio A, López M, Pérez-Bravo F, Monkeberg F, Schlesinger L: Leptin levels are associated with immune response in malnourished infants. J Clin Endocrinol Metab 2002, 87: 3040-6. [ Links ]
16. Ioffe E, Moon B, Connolly E, Friedman JM: Abnormal regulation of the leptin gene in the pathogenesis of obesity. Proc Nat Acad Sci USA 1998, 95:11852-7. [ Links ]
17. Lord GM, Matarese G, Howard JK, Baker RJ, Bloom SR, Lechler RI: Leptin modulates the T-cell immune response and reverses starvation-induced immunosuppression. Nature 1998, 394:897-901. [ Links ]
18. Ozata M, Ozdemir IC, Licinio J: Human leptin deficiency caused by a missense mutation: múltiple endocrine defects, decreased sympathetic tone, and immune system dysfunction indicate new target for leptin action, greater central than peripheral resistance to the effects of leptin, and spontaneous correction of leptin-mediated defects. J Clin Endocrinol Metab 1999, 84:3686-95. [ Links ]
19. Farooqi IS, Matarese G, Lord GM, Keogh JM, Lawrence E, Agwu C, Sanna V y cols.: Beneficial effects of leptin on obesity, T cell hyporesponsiveness, and neuroendocrine/metabolic dysfunction of human congenital leptin deficiency. J Clin Invest 2002, 1093-103. [ Links ]
20. Yudkin JS, Yajnik CS, Mohamed-Ali V, Bulmer. High levels of circulating proinflammatory cytokines and leptin in urban, but no rural Indians. A potential explanation for increased risk of diabetes and coronary heart disease. Diabetes Care 1999, 22:363-4. [ Links ]
21. Pickup JC, Chusney GD, Mattock MB: The innate immune response and type 2 diabetes: evidence that leptin is associated with stress-related (acute-phase) reaction. Clin Endocrinol 2000, 52:107-12. [ Links ]
22. Pickup JC, Mattock MB, Chusney GD, Burt D: NIDDM as a disease of the innate immune system: association of acute-phase reactants and interleukin-6 with metabolic syndrome X. Diabetología 1997, 40:1286-92. [ Links ]
23. Tanaka S, Isoda Y, Kimura M, Yamakawa T. T lymphopaenia in relation to body mass index and TNF-alfa in human obesity: adequate weight reduction can be corrective. Clin Endocrinol 2001, 54:347-54. [ Links ]
24. Nieman D, Nehlsen-Cannarella S, Henson D, Butterworth D, Fagoaga O, Warren B y cols.: Immune response to obesity and moderate weight loss. Inter J Obes 1996, 20:353-60. [ Links ]
25. Kelly DS, Daudu PA, Branch LB, Johnson HL, Taylor PC, Mackey B: Energy restriction decreases the number of circulating natural killer and serum levels of immunoglobulins in over-weight women. Eur J Clin Nutr 1994, 48:9-18. [ Links ]
26. Martí A, Marcos A, Martínez JA: Obesity and immune function relationships. Obes Rev 2001, 2:131-40. [ Links ]
27. Cottam DR, Schaefer PA, Shaftan GW, Angus LD: Dysfunctional immune-privilege in morbid obesity: implications and effect of gastric bypass surgery. Obes Surg 2003, 13:49-57. [ Links ]
28. Cottam DR, Schaefer PA, Shaftan GW, Velcu L, Angus LD. Effect of surgically-induced weight loss on leukocyte indicators of chronic inflammation in morbid obesity. Obes Surg 2002, 12:335-42. [ Links ]
29. Hanusch-Enserer U, Cauza E, Spak M, Dunky A, Rosen HR, Wolf H y cols.: Acute-phase response and immunological markers in morbid obese patients and patients following adjustable gastric banding. Int J Obes Relat Metab Disord 2003, 27:355-61. [ Links ]
30. Kyzer S, Binyamini J, Chaimaff C, Fishman P: The effect of surgically induced weight reduction on the serum levels of cytokines: IL-3 and TNF-alfa. Obes Surg 1999; 9:229-34. [ Links ]
31. Nijhuis J, Van Dielen F, Buurman WA, Greve JW: Leptin in Morbidly Obese patients: no role for treatment of Morbid Obesity but important in the postoperative immune response. Obesity Surgery 2004, 14:476-83. [ Links ]