Meu SciELO
Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Nutrición Hospitalaria
versão On-line ISSN 1699-5198versão impressa ISSN 0212-1611
Nutr. Hosp. vol.22 no.1 Madrid Jan./Fev. 2007
ORIGINAL
Efecto de dietas ricas en sacarosa y en lípidos ingeridas en condiciones de vida libre sobre la resistencia insulínica en mujeres con peso normal y exceso de peso
Effect of high-sucrose and high-fat diets ingested under free-living conditions in insulin resistance in normal-weight and overweight women
A. C. Pinheiro Volp*, H. H. Miranda Hermsdorff* y J. Bressan*
*Departamento de Nutrição e Saúde. Universidade Federal de Viçosa. Brasil.
Dirección para correspondencia
RESUMEN
Objetivo: Investigar el efecto de dietas ricas en sacarosa (DRS) y en lípido (DRL), ingeridas en condiciones de vida libre, en la determinación de la homeostasis de insulina, bien como detectar la presencia de asociaciones entre resistencia a la insulina y composición corporal.
Materiales y método: 20 mujeres saludables, 13 con peso normal (Edad 22,5 ± 2,1 años; IMC 22,2 ± 1,9 kg/m2) y 7 con exceso de peso (Edad 21,8 ± 2,8 años; IMC 28,4 ± 3,2 kg/m2), incluidas en los grupos G1 y G2, respectivamente fueron randomizados para ingerir DRS (59% carbohidratos con 23,0% de sacarosa; 28,0% de lípidos; 13,0% de proteínas; 20,2 g de fibras) o DRL (42,0% de carbohidratos con 1,3% de sacarosa; 45,0% de lípidos; 13,0% de proteínas; 22,2 g de fibras) tras evaluación inicial (DB). Fueron realizadas determinaciones antropométricas y de composición corporal y colectas de sangre para determinaciones de glucosa e insulina en ayuno y postprandial.
Resultados: La glucemia, insulinemia y valores de HOMA- IR no se diferenciaron entre G1 y G2 (p > 0,05). En DB los valores de HOMA-IR se correlacionaron positivamente con peso (r = 0,750), IMC (r = 0,929), circunferencia de la cintura (r = 0,750) y porcentaje de grasa corporal total (r = 0,857) para G2. Los valores de HOMA-IR de ayuno en DB fueron significativamente más grandes que en DRL para G1 (p < 0,05). La DRS presentó mayor tasa de carbohidratos total y de sacarosa, comparada a DB y DRL.
Conclusión: Los resultados confirman la relación directa entre HOMA-IR con la grasa abdominal-visceral y grasa corporal, siendo que la dieta puede variar la acción insulínica.
Palabras clave: HOMA-IR. Insulina. Glucemia. Sacarosa. Lípido. Obesidad.
ABSTRACT
Objetive: The purpose of this study was to investigate the effect of high-sucrose diet (HSD) and high-fat diet (HFD) ingested under free-living conditions, on insulin homeostasis, as well verifies the association between insulin resistance and body composition as well.
Research methods and procedures: 20 healthy women, 13 normal-weight (22.5 ± 2.1 years of age; BMI 22.2 ± 1.9 kg/m2) and 7 over-weight (21.8 ± 2.8 years of age; BMI 28.4 ± 3.2 kg/m2), included in 2 groups G1 and G2 respectively, they were randomized to intake HSD diets (59% carbohydrate including 23.0% of sucrose; 28.0% lipid; 13.0% protein; 20.2 g fiber) or HFD (42.0% carbohydrates including 1.3% of sucrose; 45.0% lipid; 13.0% protein; 22.2 g fiber) after initial assessment (BD). It was taken anthropometric measures, body composition and blood samples were obtained for fasting and post-prandial glucose and insulin determinations.
Results: Glycemia, insulinemia and HOMA-IR did not differ between groups (p > 0.05). Although on BD, HOMA-IR correlates positively with weight (r = 0.750), BMI (r = 0.929), waist circunference (r = 0.750) and percentage of total body fat (r = 0.857) for G2 group. The values of fasting HOMA-IR on BD were significantly greater than HFD for G1 group (p < 0.05). On HD the total carbohydrates and sucrose amount are greater than BD and HFD.
Conclusion: The results confirm direct correlation between HOMA-IR, abdominal obesity and body fat. Therefore diet can modulate the insulinemic action.
Key words: HOMA-IR. Insulin. Glucose. Sucrose. Fat. Obesity.
Introducción
La obesidad está corrientemente asociada a un conjunto de enfermedades metabólicas, como hipertensión, aterosclerosis, dislipidemias y diabetes, siendo que los componentes de este síndrome son caracterizados por la hiperinsulinemia y por diferentes intensidades de resistencia a la insulina (RI), que explica la relación entre las diversas anormalidades de la obesidad1. Resistencia a la insulina significa una disminución en la capacidad de la insulina en estimular la utilización de glucosa, sea por reducción del número de receptores de insulina por área de superficie celular o por un falla en los mecanismos de transducción de señales activados después de la interacción del complejo hormona-receptor2. La RI aparece precozmente, antecediendo el aparecimiento de los diferentes componentes del síndrome metabólico, pudiendo ser el factor determinante y desencadenador de este síndrome3.
Determinados modelos de distribución de grasa corporal, independiente del peso y de la adiposidad, parecen ejercer gran influencia en las anormalidades asociadas a la obesidad4. Siendo así, la ocurrencia de RI es más probable en individuos que presentan obesidad central (abdominal visceral), en relación a aquellos con obesidad glúteo femoral5, presentándose más frecuente en obesos, en consecuencia de la aumentada existencia de grasa corporal3,4.
No sólo la composición corporal, pero la dieta también desempeña un papel regulador en la sensibilidad tejidual a la insulina6. Dietas hipocalóricas y pierda de peso reducen niveles insulinémicos y mejoran la sensibilidad a la insulina, mientras el gano de peso convierte los tejidos más insulinorresistentes6,7. Estudios en relación al perfil de los macro nutrientes son todavía controvertidos, y que dietas ricas en lípidos resultan en valores menores de insulina plasmática cuando comparados a otros macro nutrientes de la dieta8,9 o aún, ningún efecto en la insulina plasmática en dietas con diferentes contenidos de lípidos, cuando el peso corporal fue mantenido10. Dietas hiperlípidas están asociadas a menor oxidación lipídica y un perfil metabólico caracterizado por menores niveles de insulina y valores de HOMA-IR, lo cual refleja un aumento en la sensibilidad a la insulina11. Incluso, dietas ricas en lípido pueden estar relacionadas a menores niveles de saciedad y mayores de hambre, causando hiperfagia, principalmente en obesos que tienen preferencias por alimentos con mayor densidad energética9. Ya las dietas ricas en carbohidratos pueden aumentar la insulinemia por el aumento de la glucemia, con consecuente aumento de la captación y asimilación de la glucosa en el tejido adiposo8,12.
El presente estudio tuvo como objetivo investigar el efecto de la ingestión de dietas ricas en sacarosa y en lípido, por 14 días consecutivos, en condiciones de vida libre, en la determinación de la homeostasis de la insulina, determinadas por las concentraciones de glucosa e insulina plasmáticas en ayuno y postprandial, en mujeres con peso normal y con exceso de peso.
Casuística y métodos
Casuística
La selección se llevó a cabo por la divulgación del estudio en carteles repartidos por el campus de la Universidade Federal de Viçosa y en la ciudad de Viçosa (MG – Brasil). Fueron seleccionadas 20 mujeres, 13 con peso normal (edad 22,5 ± 2,1 años; IMC 22,2 ± 1,9 kg/m2) y 7 con exceso de peso (edad 21,8 ± 2,8 años; IMC 28,4 ± 3,2 kg/m2), incluidas en los grupos G1 y G2, respectivamente, según los valores de IMC para cada grupo, definidos por la WHO (1998)13. Todas presentaban peso estable en los últimos tres meses, no fumaban, no practicaban actividad física intensa, no hacían uso de cualquier medicamento (excepto anticonceptivos) y se presentaron saludables de acuerdo con los exámenes bioquímicos realizados (glucosa, colesterol total y triglicéridos séricos) (tabla I). Las determinaciones de los niveles de glucosa, colesterol total y triglicéridos fueron hechos utilizando el equipamiento Accutrend GCT® (Roche Diagnostics, Mannheim, Alemania),con sangre colectado, por punción capilar, en ayuno. El aparato presenta sensibilidad de 20 a 600 mg/dL, 150 a 300 mg/dL y 70 a 600 mg/dL para glucosa, colesterol total y triglicéridos, respectivamente.
La semana que antecedió la primera prueba, las participantes hicieron un registro alimentario de 3 días no consecutivos (dos días típicos de la semana y un día atípico del final de semana) para valoración del consumo calórico y la distribución energética entre los macro nutrientes, lo que caracterizó la dieta basal ingerida por las mismas (DB)14. El contenido energético y de nutrientes (carbohidratos total, sacarosa, proteína, lípido, fibras) de tales dietas fueron analizados utilizando el software DietPro®, versión 4,0. Las mujeres respondieron aún al Three Factor Eating Questionnaire –TFEQ15, que permitió la valoración del grado de restricción alimentario (control consciente de la ingesta alimentaría para gano o pierda de peso corporal), de desinhibición alimentaria (interrupción de este control cognitivo) y de hambre (susceptibilidad al sentimiento de falta del alimento) de las mismas. La clasificación para estos parámetros es dividida en baja, media y alta para cada factor. Los marcadores de clasificación para restricción, desinhibición y hambre son, respectivamente: baja: 0-5; 0-9; 0-4; media: 6-9; 10-12; 5-7; alta: ≥ 10; ≥ 13; ≥ 815.
Las mujeres seleccionadas firmaron un término de consentimiento libre y esclarecido para participación de las mismas en el estudio, previamente aprobado por el Comité de Ética en Investigación con Seres Humanos de Universidade de Federal de Viçosa.
Protocolo de Estudio
Tratase de un estudio prospectivo, randomizado y sencillo. En el período basal (antecedente a las dietas teste), las voluntarias, en estado de ayuno de 12 horas, llegaban al Laboratorio de Composición Corporal y Metabolismo Energético (LCCME) a las 7:00 h de la mañana. Las voluntarias fueron orientadas a evitaren la ingestión de alcohol y el exceso de actividad física en el día anterior al teste16. Fueron realizadas medidas antropométricas (peso, altura, circunferencias de la cintura y cadera, pliegues cutáneos tricipital, bicipital, subescapular, suprailíaca) y determinación de la composición corporal por sumatoria de los pliegues cutáneos y bioimpedancia eléctrica. Fue hecha la primera colecta de sangre (en ayuno) para las dosificaciones de glucosa e insulina y el desayuno fue servido a las 8:00 h. El desayuno presentaba contenido energético equivalente a un tercio del gasto energético basal de cada voluntaria (448,1 ± 59,8 kcal) y composición nutricional balanceada, de acuerdo con el preconizado por la WHO (2003)17, (53,0% ± 4,2 de carbohidratos con 15,0% ± 0,6 de sacarosa; 15,0% ± 0,1 de proteína; 32,0% de lípido y 6,7 ± 1,0 g de fibras) (Dieta Basal – DB). Nuevas muestras de sangre fueron colectadas 30, 60, 180 y 240 minutos, tras la ingesta alimentaria.
Después del día de teste basal, cada voluntaria siguió una de las dietas teste en condiciones de vida libre, por un período de 14 días: dieta rica en sacarosa (DRS) o, rica en lípido (DRL). Las dietas fueron seleccionadas para cada voluntaria de forma aleatoria y, las participantes no fueron esclarecidas a respecto de las diferencias entres las dietas. Después del seguimiento de la dieta teste (día 15), lo mismo protocolo de determinaciones antropométricas, de la composición corporal y colectas de sangre fue hecho. En este día, las voluntarias recibieron dietas (cargas) presentando la misma proporción de macro nutrientes que las dietas teste DRS o DRL y contenido calórico equivalente a un tercio del gasto energético basal.
Las voluntarias, que tenían disponibilidad para seguir en el estudio, hicieron un período de wash out (7 a 10 días) y siguieron la segunda dieta teste. Apenas 8 mujeres recibieron planes alimentarios para dos dietas teste, seguidos de los testes en LCCME.
Períodos de Dietas Teste
Cada voluntaria siguió una de las dietas teste en condiciones de vida libre, por un período de 14 días: DRS o DRL. Las dos dietas teste tenían contenido calórico basado en las necesidades energéticas de cada participante, computadas de acuerdo con la necesidad energética estimada (EER - Estimated Energy Requirement), preconizada por las Dietary Reference Intake- DRI18.
La composición de los macro nutrientes, en los 14 días de ingestión de las dietas teste fue: DRS (59,0% ± 1,3 de carbohidratos con 23,0% ± 0,7 de sacarosa; 28,0% ± 0,7 de lípidos; 13,0% ± 0,4 de proteínas; 20,2 g ± 2,6 de fibras) y, DRL (42,0% ± 1,4 de carbohidratos con 1,3% ± 1,3 de sacarosa; 45,0% ±1,2 de lípidos; 13,0% ± 1,0 de proteínas; 22,2 ± 1,4 g de fibras). La alimentación diaria fue distribuida en 5 a 6 comidas. El consumo de café, infusiones y agua fue permitido, pero en cantidades y número de veces iguales en los períodos de cada dieta16,19.
El programa de análisis de dietas DietPro®‚versión 4,0, fue usado para determinar el consumo energético de nutrientes de las dietas basal y teste. Junto a la dieta prescrita, las voluntarias recibieron un listado de substituciones de alimentos para adecuarse a la dieta prescrita (DRS o DRL) al cotidiano y a la disponibilidad de alimentos de cada participante, siendo su modo de aplicación orientado por una nutricionista. Las mujeres fueron orientadas sobre la importancia de la adhesión y seguimiento de las dietas teste de forma a garantizar resultados fiables. Durante la etapa de ingestión de las dietas teste, se realizaron 3 registros alimentarios para valoración del consumo medio de calorías y nutrientes por las voluntarias14.
Cuando las dos dietas fueron seguidas por la misma participante, la pausa entre ellas fue de 7 a 10 días. Las participantes fueron instruidas para no modificaren el tipo de actividad física y no utilizaren cualquier medicamento, durante o entre los períodos de las dietas teste10.
Valoración Antropométrica y de la Composición Corporal
Las determinaciones antropométricas fueron hechas en el momento basal y después de cada dieta teste. Cada mujer fue evaluada en la misma etapa de su ciclo menstrual. El peso (kg) y la altura (m) corporales fueron medidos por la mañana, después de 12 horas de ayuno, utilizándose una balanza electrónica microdigital eléctrica, con capacidad de 150 kg y precisión de 0,05 kg y un antropómetro vertical milimetrado, con altura máxima de 2,0 m, y precisión de 1 mm. Las circunferencias de la cintura20 y del cuadril fueron realizadas, midiendo la menor circunferencia del abdomen y la más prominente del cuadril, respectivamente, con precisión de 1 mm. La razón entre las mismas también fue calculada21, con objetivo de determinar el tipo de obesidad presentado por las mujeres.
Los pliegues cutáneos tricipital, bicipital, subescapular y suprailíaca fueron contrastadas según la técnica descrita por DURNIN & RAHAMAN (1967)22 y la sumatoria de las mismas fue utilizada para cálculo del porcentaje de GCT, según DURNIN & WOMERSLEY (1974)23.
La composición corporal fue evaluada por la sumatoria de pliegues cutáneos y también fue determinada por bioimpedancia eléctrica de frecuencia simple (50 kHz) (Biodynamics, modelo 310). Se posicionaron 2 conjuntos de electrodos de hoja de aluminio, en la superficie dorsal de las manos y pies, metacarpo y metatarso, respectivamente, y también entre las prominencias dístales del radio y ulna y entre la parte medio lateral del tobillo. Los electrodos externos transmiten la corriente, mientras los internos captan la variación de voltaje (resistencia) y la resistencia capacitiba (reactancia), ambas medidas en ohms, secundarias al pasaje de la corriente. Esta medida fue hecha con el individuo en posición horizontal, sin calcetines y guantes o algún objeto metálico en las manos y pies, y con los miembros extendidos24,25.
Determinaciones Plasmáticas
Las muestras de sangre fueron colectadas antes (día basal) y después de cada dieta (día 15), en ayuno y 30, 60, 180 y 240 minutos tras la ingesta alimentaria. Una comprensión esquemática del protocolo puede ser observada en la figura 1. La sangre fue retirada en la vena anticubital (5 mL) y, acondicionada en tubos con EDTA (4 mL) o Fluoreto de Potasio (1 mL), para centrifugación (Sigma 2-3®) de 15 minutos a 3.000 rotaciones/minuto. El plasma, obtenido de los tubos con EDTA, fue almacenado a temperatura de -20 ºC para posterior determinación de los niveles de insulina. El plasma obtenido de los tubos con fluoreto fue acondicionado a 7 ºC para determinación de la glucosa en el mismo día de la colecta de la sangre.
La determinación de la glucosa sanguínea fue hecha por medio de colorimetría enzimático, con el kit de Bioclin (Lote 025), en el auto analizador paramétrico de bioquímica Clin line 150-Alizé (Ref. 21711188; Lisabio, Francia), en el Laboratorio de Biofármacos, del Departamento de Bioquímica Molecular - UFV.
La determinación de la insulina plasmática se fundó en la técnica de radioinmunoensayo, desarrollada para cuantificar el nivel de insulina humana en el plasma sanguíneo26,27. Esta técnica se basa en la competición de la insulina presente en los modelos y en las muestras con la insulina marcada con I125. Se utilizó el kit Ultra Sensitive Human Insulin RIA (HI- 11K) (LINCO Research, St. Charles, MO, EUA), con sensibilidad de 0,2 µU/mL y especificidad de 100%. Los análisis fueron hechos en el Departamento de Zootecnia – UFV, en centrífuga refrigerada (FR22, FANEM®, São Paulo, BR) y contador gama (CobraTM2 Auto-gamma®, Packard A Packard, Bioscience Company).
Para determinación de la presencia de resistencia a insulina (RI), fue utilizado el índice HOMA-IR (Homeostasis Model Assessment of Insulin Sensitivity- Modelo de Valoración de la Homeostasis de la Sensibilidad a la Insulina), utilizándose la siguiente fórmula: HOMA-IR = [insulina mU/L X glucosa mmol/L / 22,5]28. En mujeres sin parámetros clínicos o biológicos de resistencia a la insulina, el percentil 90º para el índice HOMA-IR es igual o mayor que 3,9, y valores iguales o mayores que este punto de corte es considerado diagnóstico de resistencia a la insulina3.
Análisis Estadísticos
El software utilizado fue el SigmaStat®, versión 3.0. Las estadísticas descriptivas están presentadas en medianía (mínimo-máximo). Los análisis estadísticos se basaron en testes no paramétricos debido al tamaño de la muestra. El nivel de significación usado fue de 5% (p < 0,05).
Los macro nutrientes y calorías de las dietas ofrecidas en el día de teste y determinados en los registros alimentarios fueron comparados por Kruskal-Wallis y teste de Dunn entre DB, DRS y DRL. Las diferencias en la composición nutricional de DRS y DRL, planeadas para seguimiento de las voluntarias, y de las diferencias entre los registros y los planes alimentarios elaborados para DRS y DRL fueron comparados por grupo para cada dieta por Mann-Whitney.
Los datos antropométricos (peso, altura, IMC, circunferencias, pliegues) y de composición corporal (GCT valorando a través de la sumatoria de los pliegues cutáneos y por BIA y masa libre de grasa) fueron comparados entre los grupos por teste de Mann-Whitney y entre dietas por Kruskal-Wallis y teste de Dunn. Las diferencias entre glucosa, insulina y valores de HOMA-IR para los grupos fueron valoradas por Mann-Whitney y, para dietas, por Kruskal-Wallis y Dunn.
Las áreas debajo de la curva relativas de los valores de HOMA-IR de ayuno y postprandial para la determinación de su sumatoria fueron computadas separadamente, para cada individuo por el método trapezoidal, como la diferencia entre la área integrada de la curva respuesta y el área rectangular determinada por los valores basales. Las diferencias entre la sumatoria de la ADCR de HOMA-IR para los grupos fueron estimadas por Mann-Whitney y, para dietas, por Kruskal-Wallis y Dunn.
Las correlaciones entre las variables fueron hechas usando correlación de Spearman, también con nivel de significación de 5% (p < 0,05).
Resultados
Casuística
De acuerdo con TFEQ, G1 presentó alto escore para restricción alimentaria, bajo para desinhibición alimentaria y medio para percepción del hambre, mientras G2 presentó escores medio, bajo y alto, respectivamente (datos no mostrados). El grupo G1, para las dietas DB, DRS y DRL, presentó peso (kg), IMC (kg/m2), circunferencias de la cintura (CC) y cuadril (CQ), pliegues cutáneos, grasa corporal total(GCT) (%) por pliegues cutáneos y valores de GCT(%), GCT (kg), masa libre de grasa (MLG) (kg) y metabolismo de reposo (kcal) por la bioimpedancia eléctrica, significativamente (p < 0,05) menores en relación al grupo G2 (tabla II).
Dietas
Los registros alimentarios hechos para evaluar la dieta basal (DB) y el consumo de las dietas teste en condiciones de vida libre, no muestran diferencia significativa entre DB y DRS, tampoco entre DB y DRL para G1 y para G2 (p > 0,05). Entre DRS y DRL, la ingestión de sacarosa fue significativamente mayor para G1 y G2 para DRS, y la ingesta de fibras fue significativamente mayor para DRS en G2. Para las calorías y otros macro nutrientes no hubo diferencias estadísticas significativas (p < 0,05) (tabla III).
Las dietas elaboradas para los testes de determinación de glucosa e insulina plasmática, también presentaron diferencias significativas (p < 0,05). La cantidad de carbohidratos y sacarosa fue significativamente mayor en DRS que en DRL, para G1 y para G2 (p < 0,05). La sacarosa se presentó en mayor cantidad en DRS que en DB y en esta, por su vez, mayor que en DRL para G1 (p < 0,05). La cantidad de proteína fue mayor en DB que en DRL, para G1 y para G2, y mayor para DB que en DRL, para G1 (p < 0,05). El lípido se presentó en mayor cantidad en DRL que en DRS y en DRL que en DB, para G1 y para G2 (p < 0,05). Por fin, el contenido de fibras estaba en menor cantidad en DRL, comparada a DB, para G1 y G2, y comparada a DRS para G1 (tabla IV).
En relación al consumo de las dietas planeadas en condiciones de vida libre y entregues a las voluntarias, DRS presentó mayor cantidad de sacarosa que DRL para G1 (p < 0,01) y G2 (p < 0,05), mientras que DRL presentó mayores cantidades de carbohidratos total y lípido que DRS, para G1 y para G2 (p < 0,05) (tabla V).
Cuando las cantidades de macro nutrientes permitidas para consumo en carga de sacarosa y lípido fueron comparadas a las estimadas por los registros alimentarios completados por las voluntarias durante los seguimientos de las dietas teste, hubo diferencia significativa entre el calculado y el ingerido. En DRS, las cantidades (en gramos) de sacarosa y lípido, para G1, y de sacarosa, para G2, fueron menores que las indicadas para las voluntarias consumieren, mientras el carbohidratos total consumido fue mayor en los registros que en la dieta planeada, para G1 (p < 0,01). En DRL, las cantidades de lípido y fibras de los registros fueron menores que las indicadas en los planes alimentarios, para ambos los grupos (p < 0,01). Analizadas en % de la ingesta energética total, en DRS la sacarosa planeada para 23%, fue ingerida en 18,37% (8,41 a 22,9%) y 8,82% (5,63 a 18,92%) en G1 y G2, respectivamente, y la cantidad de carbohidratos total planeado para 59% fue ingerido en 65,05% (62,57 a 75,54%) en G1. Y en DRL, el lípido planeado para 45%, representó 36,40% (23,55 a 45,86%) y 31,38% (25,45 a 39,21%) y la cantidad de fibras planeada para 22,2 g representó 13,71 g (12,14 a 17,56) y 11,36 g (5,82 a 13,91) en G1 y G2, respectivamente. Interesante destacar, que en G2, la cantidad de lípido ingerida durante DRL fue muy semejante a DB (29,30%; 26,07 a 34,97) (Valores en medianía).
Glucemia
Las concentraciones de glucosa plasmática de ayuno y postprandiales no diferiron significativamente entre los grupos, para las dietas (p > 0,05), tampoco entre las dietas para G1 y para G2 (p > 0,5) (tabla VI).
Insulina
Los valores de insulina plasmática de ayuno y postprandiales no diferiron significativamente entre grupos, para las dietas (p > 0,05). Pero, en G1, la insulina de ayuno en DB fue significativamente mayor que en DRL (p < 0,05) (tabla VII).
HOMA-IR
Los valores de HOMA-IR de ayuno y postprandiales no diferiron entre los grupos, para las dietas (p > 0,05). Sin embargo, para G1, los valores de HOMA-IR de ayuno en DB fueron significativamente mayores que en DRL (p > 0,05). Cuando analizados los valores de la sumatoria del área debajo de la curva relativa (ADCR) de los valores de HOMA-IR de ayuno y postprandiales, no hubo diferencia significativa entre grupos, tampoco entre las dietas para G1 y para G2 (p > 0,05) (fig. 2).
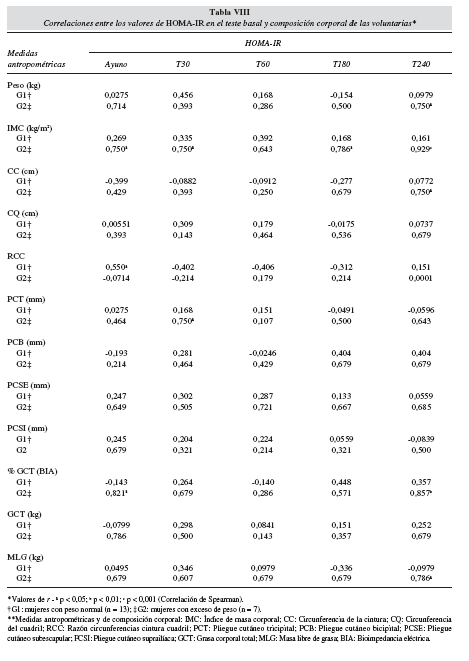
Cuando correlacionado los valores de HOMA-IR de ayuno y postprandiales con las características antropométricas y de composición corporal en el teste basal, algunas correlaciones significativas pudieron ser observadas (tabla VIII).
Cuando correlacionados los valores de HOMA-IR de ayuno y postprandiales con el contenido energético y de macro nutrientes de los registros alimentarios de las voluntarias, en DB, para G1 hubo correlación directa entre valores de HOMA-IR del tiempo de 240 minutos con sacarosa (g) (r = 0,636) (p < 0,05), y el HOMA-IR de 30 minutos con lípidos (g) (r = 0,727) (p < 0,01). Para G2, hubo correlación inversa entre HOMA-IR de 240 minutos con fibras (g) (r = -0,943) (p < 0,05). Para los otros grupos y dietas no hubo correlación significativa con los valores de HOMA-IR (Correlación de Spearman, p > 0,05).
Cuando correlacionados los valores de HOMA-IR de ayuno y postprandiales con el contenido energético y de macro nutrientes de las dietas ofrecidas en el día del teste, no fueron encontradas correlaciones significativas entre valores de HOMA-IR de G1 y G2 con las dietas (Correlación de Spearman, p > 0,05).
Cuando analizados los valores de HOMA-IR de ayuno individualmente, tras DB, 30,76% y 57,14% de las mujeres de G1 y G2, respectivamente, presentaban RI.
Tras DRS, 20% y 60% de las mujeres de G1 y G2, respectivamente, presentaban RI. Por fin, tras DRL 60% de G2 se encontraban con RI (HOMA-IR de ayuno >=3,9).
Discusión
Las diferencias encontradas entre G1 y G2 en la antropometría y composición corporal consistían en parámetro de inclusión de las voluntarias en cada grupo.
Debido a la desistencia e imposibilidad de algunas voluntarias en seguir los dos procedimientos alimentarios, DRS y DRL, la muestra para los testes que evaluaron los niveles de glucosa y insulina plasmáticas fueron menores, cuando comparada a la muestra del teste basal. Además, la inserción de las voluntarias en los grupos de seguimiento de DRS y DRL, después del teste basal, fueron hechas de forma separada, lo que llevó a la presencia de mujeres diferentes en cada grupo. De esta forma, los análisis estadísticos descriptivos de las características antropométricas y de composición corporal fueron hechos separadamente para cada dieta, con la finalidad de valorar la existencia de diferencias entre grupos, lo que podría interferir, como factores confundidores, en las consideraciones a ser hechas sobre los resultados obtenidos. En este sentido, fue utilizado el teste estadístico Kruskal-Wallis, considerando las diferencias de los efectos de las dietas en las variables del estudio como grupos independientes.
Para determinar la presencia de RI individualmente, fue utilizado el método de HOMA-IR, propuesto por MATTHEWS y cols. (1985)28. La cuantificación de RI aún no está bien establecida. El clamp euglicémico hiperinsulinémico es la técnica modelo oro para esta determinación, pero su utilización es restricta en este tipo de estudio, por la necesidad de verificar el efecto de los macro nutrientes de la dieta, sin ninguna interferencia externa. Vale resaltar que el clamp euglicémico hiperinsulinémico posibilita valorar la sensibilidad tejidual a la insulina en el músculo e hígado, y verifica la respuesta de la célula ß a la glucosa en situaciones de glicemia e insulinemia constantes28. Este es un teste conceptualmente simple, aunque técnicamente complejo. Consiste en la infusión sistémica de insulina (40 mU/m2 por minuto), concomitante a una infusión de glucosa endovenosa a 20%. La glicemia es monitorizada con frecuencia, a cada 5 minutos y se utiliza un algoritmo para el control de la velocidad de infusión y manutención de una glicemia constante. Después de un tiempo mínimo generalmente de 2 horas de hiperinsulinemia, la cantidad de glucosa exógena necesaria para mantener una normoglicemia entre 80 a 90 mg/dL corresponde a la medida de sensibilidad a la insulina29. De esta forma, se supone que la insulina endógena y la producción de glucosa hepática estén suprimidas y la cantidad de glucosa infundida corresponde directamente a la utilización de glucosa dependiente de insulina. Pero, debido su mayor coste y complejidad, su utilización se queda restricta en muchos estudios. Por esta razón, medidas indirectas como el método para cálculo a través del índice HOMAIR, fueron elegidos para el presente estudio, pues son útiles para determinación de la sensibilidad a la insulina30. Este índice fue recientemente validado con la técnica del clamp euglicémico hiperinsulinémico por BONORA y cols. (2000)29.
Las concentraciones de glucosa no se diferenciaron significativamente entre los grupos en estado de ayuno y postprandiales, tampoco entre las dietas (p > 0,05). Esto puede ser justificado por el criterio de inclusión en el estudio en que las voluntarias deberían presentar glicemias en ayuno normales, pues la presencia de hiperglicemia, hiperinsulinemia o diabetes podrían también ser factores confundidores en el estudio.
Los valores de insulina plasmática de ayuno y postprandiales no se diferenciaron significativamente entre los grupos para las dietas. La literatura describe que la insulina circula en niveles proporcionales a la cantidad de grasa corporal31. Pero, cabe resaltar que valores normales de insulina son encontrados en personas en situación de homeostasis metabólica, independiente del IMC31-33. De esta forma, estudios demuestran que valores de insulina aumentados serian encontrados en grupos de individuos con mayor grado de obesidad (IMC = 34,7 ± 1,2 kg/m2)10 y (IMC = 37,1 ± 4,8 kg/m2)34 que la presentada por las participantes de este estudio, o donde el desequilibrio en la homeostasis de la glicemia e insulinemia ocurrirían en personas independiente del peso o adiposidad3. Se debe resaltar que en este estudio, el grupo de voluntarias seleccionadas presentó IMC normal o con clasificación de exceso de peso (solamente una voluntaria presentó IMC = 33,0 kg/m2). Incluso, las mismas presentaron glicemias de ayuno normales como criterio de inclusión y que estos mismos criterios no incluyeron valores de insulina plasmática para determinación de los valores de HOMA-IR, hecho este demostrado por variaciones interindividuales encontradas tanto para G1 y para G2, pero sin diferencias estadísticas entre estos grupos.
Cuando correlacionados los valores de HOMA-IR de ayuno y postprandiales con las características antropométricas y de composición corporal en el teste basal, para G1, hubo correlación directa y significativa entre HOMA-IR y RCC. Para los otros parámetros en G1, no fueron observadas asociaciones significativas. Esto puede ser justificado por el hecho de las voluntarias presentaren características antropométricas y grados glicémicos e insulinémicos diferentes en un mismo grupo. Ya para G2, hubo correlación directa y significativa entre los valores de HOMA-IR y peso (kg), HOMA-IR e IMC (kg/m2), HOMA-IR y CC (cm), HOMA-IR y PCT (mm), HOMA-IR y %GCT (BIA) y HOMA-IR y MLG (kg). Se verificó que, cuanto mayor la reserva de grasa corporal, mayores los valores glicémicos e insulinémicos en conjunto, determinando la resistencia a la insulina. Este resultado es interesante a respeto de la relación entre el tipo de distribución de la grasa corporal y los valores de HOMA-IR donde hay correlación expresiva de este con RCC en G1, y con CC en G2, que fue encontrado también en otro estudio3. La explicación para esta relación parece estar asociada al tipo de depósito de grasa corporal. El tejido adiposo subcutáneo, presente en la región glúteo femoral, explica una protección a la resistencia a la insulina, visto a su acción antilipolítica de los receptores alfa en este tejido (mayor sensibilidad tejidual)5,35. Así, nuestros resultados están de acuerdo con los resultados de otros estudios, resaltando que la ocurrencia de RI es más probable en individuos que presentan obesidad central (abdominal visceral), en relación a aquellos con obesidad glúteo femoral5, presentándose más frecuente en obesos, en consecuencia del aumentado estoque de grasa corporal3,4.
A pesar del papel modulador de la composición corporal y adiposidad en la insulinemia y consecuentemente, en los valores de HOMA-IR, ella explica en parte las variaciones de la misma. La composición de la dieta también tiene sido investigado como importante determinante de las concentraciones de insulina y en su sensibilidad tejidual. Estudios en relación al perfil de los macro nutrientes son aún debatidos, en que dietas ricas en lípidos resultaron en valores menores de insulina plasmática cuando comparados con otros macro nutrientes8,9 o aún, ningún efecto en la insulina plasmática en dietas con diferentes contenidos de lípidos, cuando el peso corporal fue mantenido10. La reducción de los niveles de insulina, asociada a la ingesta de dietas ricas en lípidos, está relacionada a menores niveles de saciedad y mayores de hambre, causando hiperfagia9. Ya dietas ricas en carbohidratos pueden aumentar la insulinemia por el aumento de la glicemia, con consecuente aumento de la captación y metabolización de la glucosa en el tejido adiposo8,12. En el presente estudio, las concentraciones de insulina plasmática de ayuno y los valores de HOMA-IR de ayuno en DB fueron significativamente mayores que en DRL para G1 (p < 0,05). Para los otros tiempos, a pesar de las concentraciones de insulina plasmática y de HOMA-IR no haber diferido significativamente entre las dietas para G1 y para G2, fueron, tras el seguimiento de DRL, inferiores para G1, comparados a DB y DRS, confirmando los resultados encontrados por la literatura8,9.
En este estudio, los valores de HOMA-IR no se diferenciaron entre DB y DRS para G1 y para G2. Un estudio realizado por DALY y cols. (1998)12 fue demostrado que la sensibilidad a la insulina fue similar después de 1 día tras la dieta rica en sacarosa o dieta rica en carbohidratos. Sin embargo, en otro estudio con hombres jóvenes eutróficos, la sensibilidad a la insulina aumentó después de 30 días tras el seguimiento de una dieta de alto índice glicémico y rica en sacarosa, comparados a una dieta pobre en sacarosa, aunque estos valores solamente fueron significantes en el pico más alto de la secreción de insulina36. La hipótesis de que la sacarosa reduce la sensibilidad a la insulina en detrimento a los carbohidratos no es confirmada en estos resultados, ni por la literatura científica37.
Dietas hiperlipídicas no son capaces de estimular la secreción de insulina y, todavía aumentan la oxidación de lípido, hecho este demostrado por la captación de glucosa más tardía, por la preferencia en la oxidación de ácidos grasos por el tejido adiposo. Por otro lado, una dieta rica en carbohidrato, independiente de su tipo, puede estimular la secreción de insulina más precozmente, para captación da glucosa en el tejido adiposo, tornando el tejido más insulinosensible19,38-40.
En los análisis de este estudio, la dieta DRS presentó mayor cantidad de carbohidratos total y de sacarosa, específicamente, comparada a DB y DRL, bajo condiciones de vida libre, indicada por los registros alimentarios, y que a DB y DRL, utilizadas en los días de los testes en laboratorio. Esta mayor carga de carbohidratos en DRS puede haber causado mayor efecto en la secreción de insulina para captación de glucosa, pero sin diferencias significativas entre los grupos y entre dietas. La dieta DRL formulada para el día de teste, en contrapartida, presentó cantidad de lípido significativamente mayor que DB y DRS (p < 0,05), mientras la ingestión durante los 14 días en condiciones de vida libre estimada en los registros, no muestra diferencia significativa para G1 y para G2. Se debe señalar que en G2 la cantidad de lípido ingerida durante DRL fue muy semejante a la dieta basal (Medianías: DB- 29,30; 26,07 a 34,97%- DRL- 31,38%; 25,45 a 39,21%). Los menores valores de HOMA-IR después de DRL sugieren que este efecto debe tener relación con la ingestión sutil de la carga de lípido y,no en medio plazo. Ya para los valores de HOMA-IR en ayuno,en DRL, este efecto debe haber relación con la dieta estimada por los registros alimentarios. Quizá, se las cargas tuvieran sido consumidas igualmente a las planeadas, las diferencias entre las dietas podrían ser más evidenciadas.
Aunque las diferencias estadísticas no hayan sido diferenciadas entre G1y G2 para valores de HOMAIR, cuando analizados los valores de HOMA-IR en ayuno individualmente, tras DB, 30,76% y 57,14% de las mujeres de G1 y G2, respectivamente, presentaban RI. Después de DRS, 20% y 60% de las mujeres de G1 y G2, respectivamente, presentaban RI. Por fin, tras DRL 60% de G2 se encontraba con RI. Aunque no significativo, el efecto desencadenado por las dietas en la glicemia e insulinemia en conjunto puede haber contribuido para estos valores de HOMA-IR, aunque se deba resaltar que hubo distribución aleatoria de las voluntarias de G1 y G2 para DRS y DRL, lo que también podría interferir como factores confusos en las consideraciones a ser hechas sobre la diferencia porcentual de presencia de RI. Cabe resaltar que la resistencia a la insulina tiene como mecanismo compensador la hiperprodución de insulina (hiperinsulinemia), estado que puede ser compatible con una glicemia normal. Solamente cuando la hiperinsulinemia compensadora resultar insuficiente para mantener la homeostasis, ocurrirá intolerancia a la glucosa y posteriormente el diabetes41. Por otro lado, nuestros resultados coinciden con otros resultados ya publicados previamente, mostrados por Ferrannini & Balkau (2000)42, que es posible presentar RI sin hiperinsulinemia y, al contrario, es posible presentar hiperinsulinemia sin tener RI. Como un índice indirecto para diagnosticar RI, algunos autores tienen usado los valores de insulina plasmática de ayuno, considerando el percentil 75 (p75: valores de insulina de ayuno > = 12 mU/L) como el punto de corte entre individuos con y sin RI43,44. Otro estudio definió en un grupo limitado de sujetos, la hiperinsulinemia como una insulina de ayuno mayor que 16 mUm/L (p 90)45. Los mismos resultados fueron encontrados en el Estudio Prospectivo de Paris, que consideró hiperinsulinemia como concentraciones plasmáticas de insulina de ayuno superiores a 16mU/L (p 90), valores que multiplican el risco cardiovascular por 1,646. Otro estudio desarrollado por Ascaso y cols. (2001)41 definieron, en un grupo de hombres y mujeres sin parámetros clínicos o metabólicos de insulinorresistencia, sin antecedentes familiares de diabetes, dislipidemias o hipertensión arterial, como valores de percentil 75 de la distribución de la insulina e índice HOMA-IR para 14,6 y 3,2, respectivamente y valores de percentil 90 de la insulina e índice HOMA-IR para 16,7 y 3,8, respectivamente, datos que coinciden con las publicaciones de otros trabajos45-48. En este mismo estudio, solamente para el sexo femenino, los puntos de corte fueron de 15,0 y 3,3 (p 75) y 17,3 y 3,9 (p 90) para valores de insulina de ayuno y de HOMA-IR de ayuno, respectivamente. Siendo así, en el presente estudio fue definido como RI, valores iguales o superiores al punto de corte 3,9 para HOMA-IR en ayuno (p 90), de acuerdo con resultados encontrados por Ascaso y cols. (2001)41 en una población no diabética. De esta forma, se apunta la presencia de mujeres con RI precozmente, precediendo al aparecimiento de los componentes del síndrome metabólica en ambos grupos G1 y G2.
El presente estudio presentó limitaciones: (1) El tamaño de muestras puede haber influenciado la obtención de resultados más conclusivos a respecto de las alteraciones de la glicemia, insulinemia y en la sensibilidad tejidual a la insulina en relación a las dietas y a los tiempos, que fueron observados en los valores absolutos; (2) Las dietas DRS y DRL fueron seguidas por las voluntarias, en condiciones de vida libre y, a pesar de las orientaciones y estímulo a la adherencia a las dietas, los registros indicaron menor cantidad ingerida de sacarosa y mayor de carbohidratos total, en DRS, y menor cantidad de lípido en DRL que el estipulado, pudiendo haber interferido en la magnitud del efecto de estos macro nutrientes en los niveles plasmáticos de glucosa, insulina y valores de HOMA-IR.
En suma, el presente estudio confirma los valores del índice HOMA-IR reducidos en dietas ricas en lípido, bien como su relación con la reserva de grasa corporal. Aunque las limitaciones del estudio, posiblemente, haber subestimado el efecto de los macro nutrientes en la glicemia e insulinemia, fue posible observar menores valores de HOMA-IR tras la carga de lípido y, relación directa de la glicemia e insulinemia en ingesta aumentada de carbohidratos, independiente de ser sacarosa o carbohidrato complejo. Más estudios, con acompañamiento del recibimiento de las dietas en laboratorio y aumento del tamaño de muestras pueden ser necesarios para confirmar el efecto de la sacarosa y lípido en los niveles de glicemia e insulinemia, y para determinar el papel en la homeostasis a través de los valores de HOMA-IR, a largo plazo.
Agradecimientos
Agradecemos a las voluntarias que participaron de esta investigación y el apoyo financiero dado por Fundação de Amparo à Pesquisa de Estado de Minas Gerais (FAPEMIG), Belo Horizonte y Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES).
Referencias
1. Isomaa B. A major health hazard: the metabolic syndrome. Life Sciences 2003; 73:2395-2411. [ Links ] 2. Walker M. Obesity, insulin resistance, and its link to non-insulin-dependent diabetes mellitus. Metabolism 1995; 9(3):18-20. [ Links ] 3. Ascaso JF, Romero P, Real JT, Lorente RI, Martínez-Valls J, Carmena R. Abdominal obesity, insulin resistance, and metabolic syndrome in a southern European population. Eur J Inter Med 2003; 14:101-106. [ Links ] 4. Wajchenberg BL. Subcutaneous and visceral adipose tissue: their relation to the metabolic syndrome. Endocrine Reviews 2000; 21(6):697-738. [ Links ] 5. McCarty MF. A paradox resolved: the posprandial model of insulin resistance explains why gynoid adiposity appears to be protective. Medical Hypotheses 2003; 61(2):173-176. [ Links ] 6. Brehm BJ, Seeley RJ, Daniels SR, Dalessio DA. A randomized trial comparing a very low carbohydrate diet and a calorierestricted low fat diet on body weight and cardiovascular risk factors in healthy women. J Clin Endocrinol Metab 2003; 88(4):1617-1623. [ Links ] 7. Rosenbaum M, Hirsch J, Murphy E, Leibel RL. Effects of changes in body weight on carbohydrate metabolism, catecholamine excretion, and thyroid function. Am J Clin Nutr 2000; 71:1421-1432. [ Links ] 8. Holl MG, Allen LH. Comparative effects of meals high in protein, sucrose, or starch on human mineral metabolism and insulin secretion. Am J Clin Nutr 1988; 48:1219-1225. [ Links ] 9. Fisher K, Colombani PC, Wenk C. Metabolic and cognitive coefficients in the development of hunger sensations after pure macronutrient ingestion in the morning. Appetite 2004; 42:49-61. [ Links ] 10. Havel PJ, Kasim-Karakas S, Mueller W, Johnson PR, Gingerich RL, Stern JS. Relationship of plasma leptin to plasma insulin and adiposity in normal weight and overweight women: effects of dietary fat content and sustained weight loss. J Clin Endocrinol Metab 1996; 81(12):4406-4413. [ Links ] 11. Giacco R, Clemente G, Busiello L y cols. Insulin sensitivity is increased and fat oxidation after a high-fat meal is reduced in normal-weight healthy men with strong familial predisposition to overweight. Int J Obes 2003; 27:790-796. [ Links ] 12. Daly ME, Vale C, Walker M y cols. Acute effects on insulin sensitivity and diurnal metabolic profiles of a high-sucrose compared with a high-starch diet. Am J Clin Nutr 1998; 67:1186-1196. [ Links ] 13. WHO (World Health Organization)/ FAO (Food and Agriculture Organization): Consultation on Obesity. Preventing and managing the global epidemic. Report of a Joint FAO/WHO Expert Consultation. Geneva, 1998. [ Links ] 14. Cintra IP, Von der Heyde MED, Schmtiz BAS, Franceschini SCC, Taddei JAAC, Sigulem DM. Métodos de inquéritos dietéticos. Cad Nutr 1997; 13:11-23. [ Links ] 15. Stunkard AJ, Messick S. The three-factor eating questionnaire to measure to dietary restraint, disinhibition and hunger. J Psychosom Res 1985; 29:71-83. [ Links ] 16. Raben A, MacDonald I, Astrup A. Replacement of dietary fat by sucrose or starch: Effects on 14 D ad libitum energy intake, energy expenditure and body weight in formerly obese and never- obese subjects. Int J Obes 1997; 21:846-859. [ Links ] 17. WHO (World Health Organization)/ FAO (Food and Agriculture Organization): Diet, nutrition and the prevalence of chronic diseases. Report of a Joint FAO/WHO Expert Consultation. Technical Report Series 916, Geneva, 2003. 211 p. [ Links ] 18. Institute of Medicine. Energy. En: Dietary Reference Intakes – Energy, Carbohydrate, Fiber, Fat, Fatty Acids, Cholesterol, Protein, and Amino Acids. Cap 5. The National Academy Press, Washington, DC, 2002. Pt 1:5,1-5,114. [ Links ] 19. Raben A, Astrup A. Leptin is influenced both by prediposition to obesity and diet composition. Int J Obes 2000; 24:450-459. [ Links ] 20. McArdle WC, Katch FI, Katch VL. Fisiologia do exercício.Energia, nutrição e desempenho humano. Koogan, 3.ed, 387-409, Rio de Janeiro, 1991. [ Links ] 21. Kooy KV, Seidell JC. Techniques for the measurement for visceral fat: a practical guide. Int J Obes 1993; 17(4):187-196. [ Links ] 22. Durnin JVGA, Rahaman MM. The assessment of the amount of fat in the human body from measurements of skinfold thickness. Br J Nutr 1967; 21:1-9. [ Links ] 23. Durnin JVGA, Womersley J. Body fat assessed from total body density and its estimation from skinfold thickness: measurements on 481 men and women aged from 16 to 72 years. Br J Nutr 1974; 32:77-94. [ Links ] 24. Lukaski HC, Jonhon PE, Bolonchuk WW, Lykken GI. Assessment of fat-free mass using bioelectrical impedance measurements of the human body. Am J Clin Nutr 1985; 41:810-817. [ Links ] 25. Vaché C, Rousset P, Gachon P y cols. Bioeletrical impedance analysis measurements of total body water and extracellular water in healthy elderly subjects. Int J Obes 1998; 22(6):537- 543. [ Links ] 26. Yalow RS, Berson SA. Immunoassay of plasma insulin in a man. J Clin Invest 1960; 39:1401-1960. [ Links ] 27. Morgan CR, Lazarow A. Immunoassay of Insulin: two antibody system. Plasma insulin levels in normal, subdiabetic and diabetic rats. Diabetes 1963; 12:115-126. [ Links ] 28. Matthews DR, Hosker JP, Rudenski Ss, Naylor BA, Teacher DF, Turner RC. Homeostasis model assessment: insulin resistance and beta cell function from fasting plasma glucose and insulin concentration in man. Diabetologia 1985; 28:412-419. [ Links ] 29. Bonora E, Targher G, Alberiche M y cols. Homeostasis model assessment closely mirrors the glucose clamp technique in the assessment of insulin sensitivity. Diabetes 2000; 23:57-63. [ Links ] 30. Wallace TM, Levy JC, Matthews DR. Use and abuse of HOMA modeling. Diabetes Care 2004; 27(6):1487-1495. [ Links ] 31. Schwartz MW, Woods SC, Porte Jr D, Seeley RJ, Baskin DG. Central nervous system control of food intake. Nature 2000; 404:661-671. [ Links ] 32. Schwartz MW, Baskin DG, Kaiyala KL, Woods SC. Model for the regulation of energy balance and adiposity by the central nervous system. Am J Clin Nutr 1999; 69:584-596. [ Links ] 33. Schwartz MW. Brain pathways controlling food intake and body weight. Exp Biol Med 2001; 226(11):978-981. [ Links ] 34. Farshchi HR, Taylor MA, MacDonald IA. Beneficial metabolic effects of regular meal frequency on dietary thermogenesis, insulin sensitivity, and fasting lipid profiles in healthy obese women. Am J Clin Nutr 2005; 81:16-24. [ Links ] 35. Arner P. Differences in lipolysis between human subcutaneous and omental adipose tissues. Ann Med 1995; 27:435-438. [ Links ] 36. Kiens B, Richeter EA. Types of carbohydrate in an ordinary diet affect insulin action and muscle substrates in humans. Am J Clin Nutr 1996; 63(1):47-53. [ Links ] 37. Raben A, Holst JJ, Madsen J, Astrup A. Diurnal metabolic profiles after 14 d of an ad libitum high-starch, high-sucrose, or high-fat diet in normal-weight never-obese and postobese women. Am J Clin Nutr 2001: 73:177-189. [ Links ] 38. Holt SH, Miller JC, Petocz P. An insulin index of foods: the insulin demand generated by 1.000-kJ portions of common foods. Am J Clin Nutr 1997; 66:1264-1276. [ Links ] 39. Lee B, Wolever T. Effect of glucose, sucrose and fructose on plasma glucose and insulin responses in normal humans: comparison with white bread. Eur J Clin Nutr 1998; 52:924-928. [ Links ] 40. Horowitz JF, Coppack SW, Klein S. Whole-body and adipose tissue glucose metabolism in response to short-term fasting in lean and obese women. Am J Clin Nutr 2001; 73:517-522. [ Links ] 41. Ascaso JF, Romero P, Real JT, Priego A, Valdecabres C , Carmena R. Cuantificación de insulinorresistência com los valoresde insulina basal e índice HOMA em uma población no diabética. Med Clin (Barc) 2001; 117:530-533. [ Links ] 42. Ferrannini E, Balkau B. Insulin: in search of a syndrome. Diabet Med 2000; 19:724-729. [ Links ] 43. McAuley KA, Williams SM, Mann JL, Walker RJ, Ledwis-Barned NJ, Temple LA. Diagnosing insulin resistance in the general population. Diabetes Care 2001; 24:460-464. [ Links ] 44. Ascaso JF, Pardo S, Real JT, Lorente RL, Priego A, Carmena R. Diagnosing insulin resistance by simple quantitative methods in subjects whit normal glucose metabolism. Diabetes Care 2003; 26(12):3320-3325. [ Links ] 45. Ascaso JF, Merchante A, Lorente RI, Real JT, Martínez-Valls J, Carmena R. A study of insulin resistance, using the minimal model, in non-diabetic familial combined hyperlipidemic patients. Metabolism 1998; 47:508-513. [ Links ] 46. Eschwège E, Richard JL, Thibult N y cols. Coronary heart disease mortality in relation with diabetes, blood glucose and plasma insulin levels. The Paris Prospective Study, ten year later. Horm Metab Res Suppl 1985; 15:41-46. [ Links ] 47. Haffner SM, González C, Miettinem H, Kennedy E, Stern MP. A prospective analysis of the HOMA model. The Mexico City Diabetes Study. Diabetes Care 1996; 19:1138-1141. [ Links ] 48. Kashiwabara H, Inaba M, Maruno Y y cols. Insulin levels during fasting and the glucose tolerance test and HOMA’s index predict subsequent development of hypertension. J Hipertens 2000; 18:83-88. [ Links ] ![]() Dirección para correspondencia:
Dirección para correspondencia:
Ana Carolina P. Volp
Departamento de Nutrição e Saúde
Universidade Federal de Viçosa
Av. PH Rolfs, s/n
Campus Universitário
36571-000 Viçosa. Minas Gerais. Brasil
E-mail: anavolp@gmail.com
Recibido: 9-II-2006.
Aceptado: 11-IV-2006.