Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Nutrición Hospitalaria
versión On-line ISSN 1699-5198versión impresa ISSN 0212-1611
Nutr. Hosp. vol.22 supl.2 Madrid may. 2007
Indicaciones, técnicas y resultados del trasplante de intestino delgado
Indications, techniques and outcomes of small bowel transplant
M. López Santamaría y F. Hernández Oliveros
Hospital Universitario La Paz. Departamento de Cirugía Pediátrica. Madrid. España.
Dirección para correspondencia
RESUMEN
Los resultados más recientes del trasplante intestinal (TI), con una supervivencia inmediata al procedimiento superior al 80% de los casos, y una gran proporción de supervivientes que consiguen autonomía digestiva completa y desempeñan actividades acordes con su edad, permiten considerar el TI como el tratamiento de elección en enfermos con fallo intestinal irreversible en los que es previsible una mala evolución con nutrición parenteral.
El daño hepático asociado a la administración de nutrición parenteral es la indicación más frecuente de TI, especialmente en los niños, más susceptibles que los adultos a desarrollar esta complicación. Otras indicaciones aceptadas de TI son el fallo intestinal irreversible asociado a pérdida significativa de accesos venosos profundos, infecciones graves con riesgo vital asociadas al uso de catéteres centrales, y casos de fracaso intestinal que conducen habitualmente a muerte precoz, como cuadros de intestino ultracorto, diarreas intratables, y fallo intestinal asociado a elevada morbilidad y mala calidad de vida.
El TI se practica en clínica humana bajo tres modalidades técnicas: trasplante de intestino aislado, trasplante combinado de hígado intestino y trasplante multivisceral. Refinamientos de las técnicas originales, que incluyen reducciones de los injertos hepáticos y/o intestinales, la opción con injerto de donante vivo, etc. permiten actualmente cubrir las diferentes necesidades, a la vez que incrementar la probabilidad de acceso al trasplante, objetivo especialmente necesario en niños muy pequeños o de muy bajo peso candidatos a trasplante hepatointestinal.
Uno de los aspectos más interesantes de los programas de TI es haber permitido la evolución hacia Unidades de Rehabilitación Intestinal, que integran en un equipo multidisciplinar las tres modalidades de tratamiento: soporte nutricional, farmacoterapia y cirugía. Estas Unidades optimizan los resultados, minimizan los costes y permiten ofrecer un tratamiento individualizado y adaptado a las necesidades individuales.
Palabras clave: Trasplante intestinal. Fallo intestinal. Síndrome de intestino corto.
ABSTRACT
The most recent outcomes on bowel transplantation (BT), with a survival rate immediately after transplant higher than 80% and a great rate of survivors achieving complete digestive autonomy and able to carry out activities according to their age allow for considering BT as the first choice therapy in patients with irreversible intestinal failure in whom poor prognosis with parenteral nutrition is foreseen.
Parenteral nutrition-associated liver damage is the most frequent indication for BT, especially in children that are more susceptible than adults to develop this complication. Other accepted indications for BT are irreversible intestinal failure in association with loss of deep venous accesses, life-threatening severe infections associated with the use of central catheters, and those cases of intestinal failure usually leading to early death, such as ultra-short bowel syndromes, refractory diarrheas, and intestinal failure associated to high morbidity and poor quality of life.
BT is performed in human clinical practice under three technical modalities: isolated bowel transplant, combined liver-bowel transplant, and multi-visceral transplantation. Currently, refinements of original techniques including reduction of liver and/or intestinal grafts, grafts from living donors, etc., allow for overcoming the different needs as well as increasing the likelihood of having access to transplantation, which is a desirable goal specially in very young or very low-weighted children candidate to liver-bowel transplant.
One of the most interesting issues in BT programs is having given access to the Intestinal Rehabilitation Units, which comprise the three therapeutic modalities by means of a multidisciplinary team: nutritional support, pharmacotherapy, and surgery. These Units optimize the outcomes, minimize costs, and allow for offering a management adapted to individual needs.
Key words: Bowel transplant. Intestinal failure. Short bowel syndrome.
Introducción
Aunque la evolución del trasplante intestinal (TI) no ha sido paralela a la de otros trasplantes de órganos sólidos1, los resultados clínicos del procedimiento han mejorado sensiblemente en los últimos 15 años, gracias a una mejor selección de los receptores, sucesivos refinamientos de las técnicas quirúrgicas, importantes progresos en el conocimiento y tratamiento de las complicaciones postoperatorias, así como una mejor comprensión de la inmunología del trasplante, y la estandarización de los grados de rechazo. Todo ello ha permitido que el TI ocupe actualmente un lugar en el tratamiento del fallo intestinal irreversible (FI), y se considere como la opción terapéutica de elección en casos de FI de mala evolución, o en aquellos en los que esta es previsible2.
Siguiendo el programa propuesto en este Curso Avanzado de Nutrición, el objetivo de este capítulo es proporcionar una visión actualizada de las indicaciones, técnicas quirúrgicas y resultados del trasplante intestinal, aspectos que están íntimamente relacionados. En efecto, hoy día la ausencia de función intestinal no es incompatible con la vida, pudiendo ser sustituida mediante la administración de nutrición parenteral, por lo que las indicaciones del trasplante intestinal han de discutirse a la luz de los resultados actuales del procedimiento. Por otra parte, son muchas las causas que pueden conducir a fallo intestinal, y muy diversos también los efectos del FI sobre otros órganos y sistemas, y para adaptarse a las diferentes necesidades ocasionadas, el TI es un procedimiento con una extraordinaria diversidad técnica, inhabitual en otros trasplantes de órganos sólidos. En consecuencia, en las indicaciones de TI, además de precisar los enfermos susceptibles de beneficiarse del procedimiento, se deberá igualmente discutir la técnica adecuada.
En lo que sigue se sobreentiende que el lector está familiarizado con el concepto de fallo intestinal y sus causas, así como con la dificultad que se plantea para alcanzar consensos tanto en su definición, como a la hora de establecer criterios de irreversibilidad, o que permitan discriminar los casos de FI de mal pronóstico3. Parece conveniente sin embargo resaltar que actualmente se carece de parámetros bioquímicos o de otra índole que hayan demostrado utilidad en clínica, y como consecuencia, la mejor definición de fallo intestinal que se propone es "la dependencia de nutrición parenteral para cubrir los requerimientos nutricionales y de crecimiento en el niño"4, definición que es clínica, y está supeditada a las consecuencias del FI, lo que indudablemente supone una dificultad añadida en el proceso de decisión a la hora de sentar la indicación de TI.
Técnicas quirúrgicas de trasplante intestinal
El trasplante de intestino, debido a su escaso tiempo de implantación, es una tecnología en evolución, y ello incluye la técnica quirúrgica5,6. Se describen tres formas principales de TI en clínica humana: trasplante de intestino aislado, trasplante combinado de hígado intestino y trasplante multivisceral7. Todas ellas se basan en el principio de STARZL del "cluster" o racimo, que considera las vísceras abdominales como un racimo que depende de dos ramas principales, el tronco celíaco y la arteria mesentérica superior, y en consecuencia, se puede extraer cualquier parte de este racimo y crear cualquier tipo de injerto siempre que tenga un pedículo que garantice un reflujo arterial y un drenaje venoso adecuados6.
Recientemente las técnicas originales han sido modificadas para adaptarse a las necesidades específicas de los pacientes, y como resultado, diversas nuevas intervenciones han sido implementadas8. En este epígrafe se describirán las técnicas originales y sus modificaciones.
Trasplante de intestino aislado
Es el procedimiento más sencillo, y se usa en enfermos con fallo intestinal no asociado a daño hepático o trastorno de motilidad gástrica9. Se trata del tipo de trasplante más frecuente en adultos; de acuerdo a los datos del Registro Internacional de trasplante intestinal, un 55% de los adultos trasplantados recibieron un trasplante de intestino aislado frente a un 37% en niños10. El injerto incluye la totalidad del intestino delgado, con o sin colon o parte del mismo, aspecto que es controvertido.
La arterialización del injerto se puede hacer desde la arteria mesentérica superior del receptor o la aorta infrarrenal, si la anterior está retraída o es de pequeño calibre, como ocurre en la mayoría de casos con síndrome de intestino corto. En este caso es habitual tener que usar injertos arteriales del donante interpuestos. El drenaje venoso es hacia la vena mesentérica superior, o a la cava inferior, alternativa para casos en los que la primera no es accesible, o cuando existe fibrosis hepática que pudiera comprometer el retorno venoso del injerto. En caso de estar la vena cava inferior trombosada por debajo de las venas renales, como alternativa se puede utilizar la vena renal izquierda o la vena mesentérica inferior11.
Trasplante hepatointestinal
Indicado cuando el fallo intestinal ha producido daño hepático irreversible. Otras indicaciones son la existencia de hipertensión portal, y trombosis portomesentérica. En casos de isquemia intestinal por estados de hipercoagulabilidad estaría también indicado, ya que el trasplante hepático corregiría el trastorno de la coagulación12. Es el tipo de trasplante más frecuente en niños; de acuerdo a los datos del Registro Internacional de Trasplante Intestinal, el trasplante hepatointestinal fue utilizado en el 50% de los niños frente a solo un 21% de los adultos10, siendo la proporción de niños que reciben el hígado con el injerto intestinal todavía mayor, pues no se cuentan los trasplantes multiviscerales. La mayor frecuencia con la que el niño precisa la inclusión del hígado se relaciona con la diferente etiología del fallo intestinal en los dos grupos de edad, pero sobre todo con la mayor susceptibilidad de los niños a desarrollar daño hepático relacionado con la administración de nutrición parenteral (ver más adelante). Actualmente la técnica más utilizada de trasplante hepatointestinal es mediante el procedimiento denominado "en bloque", que incluye con el injerto el complejo pancreático duodenal del donante. Se diseñó este procedimiento para simplificar la cirugía en el donante y receptor, pero sobre todo para evitar las graves y frecuentes complicaciones biliares que ocurrían con la técnica original13.
Habitualmente la arterialización del injerto se hace mediante anastomosis término lateral a la aorta infrarenal o supracelíaca del receptor, generalmente mediante el uso de conductos arteriales del donante interpuestos6, y el drenaje venoso del injerto sigue los mismos principios habituales en trasplante hepático14. Las vísceras abdominales retenidas del receptor han de ser drenadas, bien sea al sistema portal del injerto o mediante anastomosis portocava15.
Trasplante multivisceral
Clásicamente se consideraba como tal el que incluía tres o más vísceras abdominales con el injerto, habitualmente estómago, duodeno, páncreas, hígado, e intestino, pero desde que se ha implantado la técnica del trasplante hepatointestinal "en bloque", el término se utiliza para casos en los que se incluye el estómago o parte del estómago con el injerto10.
El procedimiento es similar al trasplante hepatointestinal (fig. 1). Modificaciones técnicas recientes del trasplante multivisceral permiten utilizar el injerto hepático para trasplantar a un segundo individuo en caso de estar preservada la función hepática en el receptor15. El trasplante multivisceral está indicado en casos de fallo intestinal en los que el estómago y/o el páncreas o ambos han de ser extirpados en el receptor, como casos de dismotilidad gástrica severa, pancreatitis o lesión pancreática; otras indicaciones son algunos casos de tumores no metastatizantes pero localmente agresivos (desmoides habitualmente), traumatismos, y trombosis severa del territorio esplácnico6,7,16.
Restablecimiento de la continuidad intestinal
Cuando se conserva parte del intestino del receptor, como ocurre en los trasplantes de intestino aislado y hepatointestinales, la continuidad intestinal se restablece mediante anastomosis del duodeno o yeyuno del receptor al yeyuno proximal del injerto17. En el trasplante multivisceral, inicialmente se realizaba mediante anastomosis esofago-gástrica, pero se observó que se asociaba a reflujo gastroesofágico severo en un número significativo de casos, por lo que actualmente se prefiere conservar la unión gastroesofágica del receptor, preservando la arteria gástrica izquierda, y haciendo una anastomosis gástrico-gástrica17. La piloroplastia sobre el estómago trasplantado es imprescindible por la pérdida de la inervación vagal.
La reconstrucción distal habitualmente se hace mediante exteriorización del íleon terminal trasplantado, bien sea en forma de ileostomía terminal, latero terminal (Bishop-Koop), o en cañón de escopeta (Mikulicz). La inclusión del colon con el injerto ha sido y sigue siendo un asunto controvertido. Utilizada inicialmente, se desechó por algún tiempo al haberse descrito un incremento de las complicaciones infecciosas graves18; posteriormente algunos grupos han comprobado que la inclusión de la válvula ileocecal mejora sensiblemente la capacidad de reabsorción de líquidos mejorando la diarrea acuosa sin un incremento de las infecciones, por lo que han vuelto a incluir el colon o parte del colon en los casos en los que estuviese indicado, como enfermedad de Hirschsprung, pérdida subtotal del colon etc.17,19.
Cierre de pared abdominal
Los enfermos con síndrome de intestino corto a menudo tienen una cavidad abdominal contraída, en la que el paquete intestinal ha perdido el derecho de domicilio, han sufrido múltiples intervenciones previas, han desarrollado fístulas intestinales, y los problemas infecciosos de pared son frecuentes. Cuando son trasplantados, lo anterior puede hacer extraordinariamente difícil, cuando no imposible el cierre de pared abdominal17. El primer paso para contribuir a un cierre de pared cómodo es la elección del donante, que se recomienda que sea de peso inferior al del receptor. El uso de expansores ha sido aplicado para acomodar previamente al trasplante la cavidad abdominal20. No obstante, cuando no es posible cerrar la cavidad abdominal, se tiene que recurrir al cierre diferido por etapas, cerrando temporalmente la cavidad abdominal con un malla de material protésico (habitualmente de politetrafluoretileno, PTFE, Gore-tex®); otros procedimientos utilizados han sido la colocación de injertos mallados de piel o el uso de colgajos músculo-cutáneos21. El grupo de Miami ha descrito el trasplante de pared abdominal, que incluye piel, tejido celular subcutáneo, músculo y aponeurosis, con un pedículo vascular consistente en las arterias y venas ilíacas, preservando los vasos epigástricos, que son los que aseguran la viabilidad del injerto de pared. Los autores han utilizado este procedimiento en 10 ocasiones, con unos resultados aceptables, pero sin que hayan sido comprobados hasta el momento por ningún otro grupo22.
Técnicas innovadoras de trasplante intestinal
En los últimos años, las técnicas originales han sido modificadas y se han producido refinamientos importantes que permiten cubrir las diferentes necesidades de los pacientes con fallo intestinal que precisan ser trasplantados. Una limitación importante es la escasez de donantes adecuados, especialmente si el candidato es un niño de corta edad o de muy bajo peso. En consecuencia, la estancia en lista de espera es muy prolongada, cercana al año23, y la mortalidad pretrasplante es elevada, estimándose como próxima al 50% en el grupo de candidatos entre 0 y 5 años de edad24. El deterioro físico y nutricional del niño se agrava mientras aguarda el trasplante, siendo frecuente que la progresión de la hepatopatía obligue a cambiar la indicación a trasplante combinado de hígado intestino, procedimiento que es mucho más complejo, más costoso, y cuyos resultados actualmente son inferiores a los del trasplante de intestino aislado. Para romper este círculo vicioso, se han desarrollado diversas estrategias y técnicas quirúrgicas, cuyo objetivo es el de incrementar la probabilidad de acceso al trasplante de este grupo de niños:
• Reducción combinada del bloque hígado-intestino25: de una forma similar a como surgieron las técnicas de reducción en trasplante hepático, esta técnica permite utilizar donantes de un peso hasta 4 veces superior al del receptor en casos de trasplante combinado de hígado-intestino. La reducción hepática es extrahilar, y si tras la revascularización existe problema de espacio, se puede acompañar de una resección más o menos amplia de intestino medio (fig. 2).
• Trasplante secuencial de hígado intestino: también destinada a los niños candidatos a trasplante hepatointestial. Se puede hacer de forma asincrónica o sincrónica. En la primera se trasplanta el hígado, y semanas después el intestino, una vez normalizada la función hepática y mejorada la desnutrición secundaria a la hepatopatía. En la segunda modalidad, en un mismo acto quirúrgico se trasplantan por separado ambos órganos, hígado e intestino26. Esta técnica permite utilizar donantes con una desproporción de peso muy superior (hasta 10 veces), permite la resección del injerto intestinal en caso de rechazo del mismo, conservando el hígado, y abre la posibilidad técnica al trasplante de hígado-intestino con injertos de donante vivo.
• Trasplante de intestino aislado con injertos procedentes de donante vivo: el uso de injertos de donante vivo se ha desarrollado con éxito en el trasplante renal, hepático, pancreático y pulmonar. Recientemente se ha comenzado a aplicar al caso del intestino, con el propósito de expandir el número de donantes disponibles, así como para evitar la progresión de la hepatopatía de los niños en lista para trasplante intestinal. El injerto consiste en un segmento de unos 150 cm aproximadamente de íleon, siempre que la resección sea inferior al 40% de la longitud total de intestino del donante, y conservando un mínimo de 20 cm de íleon terminal27,28. Hasta el momento, existen documentados un total de 30 trasplantes intestinales con injerto de donante vivo10, con unos resultados similares, e incluso superiores a los de donante cadavérico, dada la hipotética ventaja inmunológica por haploidentidad en el caso de utilizar donantes relacionados (padre o madre fundamentalmente). La utilización de injertos de donante vivo implica además una serie de consideracioneséticas y legales que no son aquí discutidas. Hay que señalar sin embargo, que desde la perspectiva del donante, el procedimiento implica un riesgo inferior al de la donación de segmentos hepáticos para trasplante, técnica que especialmente en el ámbito pediátrico, no es cuestionada.
• Trasplante de hígado sin TI: algunos niños con FI secundario a SIC poseen una longitud de intestino residual que podría ser suficiente para alcanzar a largo plazo autonomía digestiva completa, y sin embargo son referidos a centros de trasplante ante la progresión de la hepatopatía hacia enfermedad hepática terminal. Una alternativa posible es el trasplante hepático sin trasplante intestinal asociado, cuyo objetivo es romper el círculo vicioso de la desnutrición por incapacidad de absorción de nutrientes secundaria a la hepatopatía, que interfiere con el proceso de adaptación intestinal29. En el epígrafe de indicaciones de trasplante se abordan otros aspectos de esta estrategia controvertida.
• Uso extendido del trasplante multivisceral9: propuesto recientemente para niños de muy bajo peso, en sustitución del trasplante combinado de hígado-intestino. Los niños con daño hepático irreversible habitualmente tienen una gran esplenomegalia por hipertensión portal; el estómago y duodeno suelen estar dilatados, y con frecuencia han sufrido episodios de pancreatitis. La resección del estómago, duodeno y páncreas nativos extirpa órganos potencialmente disfuncionales, permite una mayor cavidad para el injerto, proporciona un acceso directo a la aorta abdominal y mantiene en continuidad el tracto gastrointestinal, que es trasplantado en forma ortotópica; son precisas menos anastomosis intestinales y vasculares (no es necesario el drenaje venoso de las vísceras abdominales del receptor), y permite el uso de donantes de menor peso. Otra ventaja añadida es el mejor control de la hemorragia en casos de hipertensión portal avanzada, mediante clampaje precoz del tronco celíaco y la arteria mesentérica superior del receptor, retrayendo hacia línea media el bloque bazo-páncreas9.
Indicaciones de trasplante de intestino
Aspectos generales
Inicialmente el TI estaba exclusivamente reservado como procedimiento salvador para enfermos con fallo intestinal que desarrollaban complicaciones en las que existía riesgo vital30,31. Esta limitación en las indicaciones estaba causada por la elevada mortalidad asociada al procedimiento31, pero una mejoría significativa en los resultados, ocurrida en los últimos 15 años, permite actualmente un uso más amplio del trasplante intestinal. De acuerdo al Grupo de Trabajo del último Simposio Internacional de Trasplante Intestinal, celebrado en Bruselas en julio de 2005, el trasplante intestinal estaría indicado para "aquellos enfermos con fallo intestinal irreversible en los que es previsible una mala evolución con nutrición parenteral"32. Implícitamente esta afirmación modifica el criterio anterior (Kaufman y cols., Pediatr Transplantation 2001) de referencia "lo antes posible" de enfermos con fallo intestinal con mala evolución previsible, y se recomienda que sean referidos "inmediatamente" a centros de trasplante para ser evaluados como posibles candidatos, incluso en ausencia de complicaciones relacionadas con la administración de NP. La importancia de la referencia precoz se acentúa aún más si se considera que la mejor selección de los receptores es uno de los factores que más han contribuido a la mejoría de los resultados, como se refleja en los informes del Registro Internacional de Trasplante de Intestino de los años 2003 y 2005.
Indicaciones de trasplante intestinal
Los criterios de trasplante intestinal están actualmente suficientemente consensuados tanto en adultos como en niños e incluyen:
1. Que se haya demostrado la irreversibilidad del fallo intestinal3. En niños con anastomosis duodeno cólicas tras resecciones masivas de intestino, niños con enfermedad de Hirschsprung extensa con menos de 50 cm de delgado normalmente inervado, o niños con trastornos congénitos del epitelio intestinal, la irreversibilidad del fallo intestinal es fácil de anticipar. No obstante, en niños con pseudoobstrucción intestinal, o casos no extremos de SIC, la irreversibilidad del FI no es tan aparente, siendo imprescindible que se hayan agotado todas las opciones terapéuticas convencionales antes de sentar la indicación de TI33.
2. Desarrollo de complicaciones graves relacionadas con la administración de NP. Se aceptan como indicaciones las siguientes:
• Daño hepático irreversible, relacionado con la administración de NP (fig. 3): El daño hepático es la complicación más frecuente y más grave que desarrollan los enfermos con fallo intestinal. Un 40% a 60% de niños que requieren NP de larga duración, y un 15 a 40% de adultos en nutrición parenteral domiciliaria desarrollan daño hepático de intensidad variable34. El espectro clínico de lesiones incluye esteatosis hepática, colestasis, colelitiasis y fibrosis hepática. La progresión hacia cirrosis biliar, hipertensión portal, y fallo hepático es poco habitual en adultos, pero más frecuente en niños y recién nacidos35. La causa es multifactorial, estando implicados la pérdida de tejido linfoide asociado al intestino (en el caso del síndrome de intestino corto), la existencia de sepsis hepatobiliar, manifiesta o larvada, consecuencia de una microflora intestinal alterada36-38, así como la inmadurez hepática propia de los recién nacidos y prematuros, que los hace más vulnerables39. Otros mecanismos importantes incluyen la ausencia de nutrientes en la luz intestinal, que produce una hiposecreción de hormonas gastrointestinales, la reducción del flujo biliar, y el éstasis biliar, que conducen al desarrollo de colestasis, barro biliar y litiasis, quienes a su vez incrementan la disfunción hepática. En recién nacidos pretérminos, un déficit de taurina o cisteína puede contribuir al daño hepático, mientras que en niños mayores y adultos un déficit de colina, las emulsiones de lípidos y toxicidad por manganeso pueden ser factores asociados35. Tienen riesgo incrementado de desarrollar esta complicación los recién nacidos que presentan ictericia precoz (antes del 3º-4º mes de vida), y los casos de intestino corto que han sufrido múltiples laparotomías, intestino ultracorto o casos con ausencia de continuidad intestinal. El desarrollo o aparición de signos de hipertensión portal en enfermos con ictericia es significativo de progresión del daño hepático34. Estructuralmente el daño es progresivo, desde fibrosis en cualquiera de sus grados hasta cirrosis. Recientemente se ha propuesto sustituir el término "daño hepático relacionado con nutrición parenteral" por el de "daño hepático relacionado con el fallo intestinal", más general que el anterior, y que responde mejor a la naturaleza multifactorial del cuadro, pues de hecho los elementos más importantes que inducen el desarrollo de colestasis se relacionan con el empeoramiento de la función intestinal y el sobrecrecimiento bacteriano4. El daño hepático a su vez se agrava con la administración de una NP inadecuada.
• Pérdida de accesos venosos profundos por trombosis (fig. 4): existe consenso en aceptar como indicación la pérdida de la mitad de los accesos convencionales (venas yugulares y femorales en niños pequeños, yugulares, subclavias y femorales en niños mayores)40.
• Sepsis graves relacionadas con el uso de catéteres venosos profundos: Factores como la necesidad de recurrir a accesos venosos profundos, translocación de microorganismos y la pérdida del tejido linfoide asociado al intestino se consideran responsables de la elevada tasa de complicaciones infecciosas que sufren los enfermos con FI. La frecuencia y tasa de mortalidad de estas complicaciones se ha conseguido disminuir sensiblemente y los enfermos con infecciones frecuentes en los que la morbilidad es escasa no deben ser catalogados como fracaso de la NP y en consecuencia no deben ser considerados como potenciales candidatos a TI. Por el contrario, los enfermos que desarrollan complicaciones infecciosas metastásicas, tales como absceso cerebral, endocarditis y fallo multiorgánico deben ser evaluados como candidatos. Igualmente, los enfermos colonizados con gérmenes multirresistentes (ej., Enterococcus faecium vancomicín-resistente) y que desarrollan infecciones a catéter frecuentes con estos gérmenes, deben de ser igualmente considerados candidatos34,40.
• Fallo intestinal que habitualmente conduce a muerte precoz, a pesar de un soporte nutricional óptimo34;se incluyen:
i. Casos de síndrome de intestino ultracorto, como anastomosis duodeno cólicas, casos de intestino no reconstruible, intestino delgado residual inferior a 10 cm en niños pequeños, o inferior a 30 cm en niños mayores, traumatismos graves que lesionan la rama principal de la arteria mesentérica superior, tumoraciones intrabdominales (habitualmente desmoides) que precisan de resecciones intestinales casi totales etcétera. Al no existir posibilidad de adaptación intestinal, se aconseja adelantar la indicación de TI antes del desarrollo de complicaciones relacionadas con la administración de NP34,40,41.
ii. Trastornos congénitos de la mucosa intestinal que cursan con diarrea intratable (fig. 5). Como en el caso anterior, es preferible anticiparse al desarrollo de daño hepático irreversible, que obligaría a un trasplante combinado de hígado-intestino34,40,41.
iii. Fallo intestinal asociado a morbilidad elevada y mala calidad de vida: observado en determinados casos de pseudoobstrucción idiopática crónica intestinal34,40,41.
Indicación del tipo de trasplante: inclusión del hígado en el injerto
Un aspecto a considerar en la indicación se refiere a la técnica de trasplante adecuada (intestino aislado, hepatointestinal, o multivisceral), especialmente si se debe incluir o no el hígado en el injerto. El trasplante de intestino aislado está indicado en casos de ausencia de enfermedad hepática, o cuando la misma sea reversible. La ictericia per se no es indicación de trasplante combinado42, existiendo casos (incluso en nuestra experiencia personal) de trasplante de intestino aislado con cifras previas de bilirrubina sérica superior a 10 mg/dl en los que la ictericia se resolvió espontáneamente tras el trasplante. En ausencia de signos de fallo hepático o de hipertensión portal, la fibrosis hepática, incluso si es confluyente, uniendo espacios porta, para algunos tampoco obliga al trasplante combinado, existiendo casos documentados de buena evolución sólo con trasplante de intestino aislado43, aunque la mayoría de los grupos prefieren el trasplante compuesto en esta situación33. Se indica el trasplante combinado en los casos de daño hepático irreversible, estados de hipercoagulabilidad como déficit de proteína C, S, etc. (la inclusión del hígado con el injerto cura el trastorno de hipercoagulabilidad), y casos de tumoraciones intraabdominales de escasa malignidad (tumores desmoides por ejemplo), que afecten al hígado y al intestino34.
Trasplante hepático aislado en el fallo intestinal
Un aspecto controvertido, ya comentado en el epígrafe de la técnica quirúrgica, es la actitud a seguir con niños con síndrome de intestino corto (SIC) que han desarrollado daño hepático irreversible con signos de insuficiencia hepática, pero que tienen una longitud de intestino residual que hace verosímil que se pudiera conseguir la adaptación intestinal. La necesidad de recurrir al TI (que debería ser combinado incluyendo el hígado) viene determinada por el daño hepático muy evolucionado, quien a su vez, mediante una cascada de acontecimientos que arrastran los unos a los otros, y que incluyen déficit de capacidad de síntesis, hipertensión portal, coagulopatía, hiperesplenismo, desarrollo de varices etc., conduce finalmente a malabsorción, sepsis y hemorragia gastrointestinal, de tal forma que el daño hepático irreversible se convierte en un freno que impide que se produzca la adaptación intestinal3.
Por ello, en casos muy seleccionados, en los que el principal factor limitante a la adaptación intestinal es precisamente el daño hepático severo, se ha propuesto el trasplante de hígado aislado, que tiene claras ventajas sobre la alternativa del trasplante hepatointestinal44: Las técnicas alternativas de trasplante hepático con injertos reducidos están mejor establecidas, y sus resultados están contrastados, hay mayor disponibilidad de órganos, y se requiere de menor inmunosupresión. No obstante, la experiencia con esta estrategia es aún limitada, y los resultados referidos son contradictorios. Serían candidatosóptimos32:
- Niños con enfermedad hepática terminal con probabilidad de adaptación intestinal:
* Edad < 4 años (mayor probabilidad de adaptación).
* Buenas características del intestino residual respecto a longitud, calidad, tipo de intestino residual y motilidad.
* Haber demostrado una tolerancia enteral de aproximadamente 50% de las necesidades.
- Es exigible que este procedimiento sea realizado exclusivamente en centros pediátricos que practican tanto el trasplante hepático como el intestinal (no solo el Tx hepático).
Contraindicaciones de trasplante intestinal
Los criterios de exclusión no difieren de los habituales en otros trasplantes de órganos sólidos, y pueden agruparse en absolutos y relativos34,40,41:
Criterios absolutos:
- Déficit neurológico profundo o progresivo.
- Enfermedad incorregible no gastrointestinal.
- Sepsis activa.
- Malignizaciones.
- Problemas psicosociales, severos e irresolubles.
Criterios relativos:
- Inmunodeficiencia.
- Drogodependencia.
- Imposibilidad de asegurar accesos venosos profundos durante los 6 meses siguientes al trasplante.
- Neoplasias benignas de pronóstico poco claro.
Resultados del trasplante intestinal. Unidades de rehabilitación intestinal
Los datos de la última actualización del Registro Internacional de Trasplante de Intestino proporcionan una referencia de la divulgación actual del procedimiento2. Entre 1 de abril de 1985 y 31 de marzo de 2005, se habían realizado en todo el mundo 1.295 trasplantes intestinales sobre 1.210 pacientes, de los que 658 estaban vivos al final del estudio. Desglosados por años, es solo a partir del año 2001 cuando comienzan a realizarse más de 100 trasplantes por año, y solo tres hospitales en el mundo tenían una experiencia superior a los 100 trasplantes. Los últimos dos años, únicamente 29 hospitales en el mundo habían realizado algún trasplante intestinal.
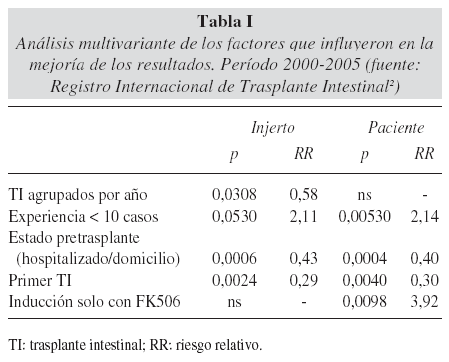
La fuente más fiable para conocer los resultados la proporciona también el Registro Internacional de Trasplante de Intestino, que actualiza sus datos cada dos años, y que permite identificar tendencias difíciles de detectar con los resultados referidos por centros aislados. El último informe fue presentado en Bruselas, en junio-julio de 2005, con motivo del IX Simposio Internacional de Trasplante de Intestino, y entre los resultados más destacados, debe señalarse una mejoría importante producida los últimos años, en términos de supervivencia del injerto y de los enfermos, superior a un 80% al año en el periodo comprendido entre mayo 2003-mayo 2005. Los factores que influyeron en la mejoría de los resultados fueron (tabla I): la experiencia del centro (más de 10 trasplantes), una mejor selección de los receptores (caracterizada por una mayor tasa de enfermos que acuden al trasplante desde su domicilio), y la utilización de algún inductor de la inmunosupresión, ya sea con anticuerpos anti receptores de interleukina 2, timoglobulina o Campath. Más del 75% de los enfermos que sobreviven por encima de 6 meses al trasplante consiguen autonomía digestiva completa, quedando libres de nutrición parenteral, con una calidad de vida buena, medida en el registro por el índice de Karnofsky. Esta mejoría sin embargo se ha conseguido principalmente durante el primer año postrasplante, y los resultados a lago plazo sin embargo, no mejoran tan significativamente con el tiempo. El reto por tanto consiste en incrementar las investigaciones y en desarrollar nuevas estrategias destinadas a prevenir las complicaciones tardías del procedimiento2.
En resumen, los factores que más han contribuido estos últimos 15 años a la mejoría importante que se ha producido en los resultados del trasplante intestinal, y que han permitido su aceptación clínica son los siguientes:
• Refinamientos de la técnica quirúrgica17.
• Progresos en el conocimiento de las complicaciones más frecuentes y en su tratamiento45.
• Estandarización de los grados de rechazo46.
• Reconocimiento de las características atípicas de rechazo47.
• Mejor comprensión de la inmunología del trasplante48.
• Mejor selección de los receptores10.
Unidades de Rehabilitación intestinal
El FI es un problema de una gran complejidad, que requiere de un tratamiento superespecializado, a cargo de profesionales con gran experiencia y muy motivados49. A pesar de ello, son pocos los centros que ofrezcan todas las opciones posibles de tratamiento y que traten todos los estadios del fallo intestinal desde el inicio hasta el trasplante4. Aunque son muchos e importantes los avances que se están produciendo en el terreno del FI, la actividad está muy compartimentada50, especialmente en lo que se refiere a su tratamiento, y es todavía frecuente observar que las diversas opciones actualmente disponibles sean utilizadas de forma descoordinada y con escasa o ninguna interrelación entre los profesionales que las aplican49.
Parece sin embargo verosímil aceptar que la centralización de la casuística en centros que integren todas las opciones terapéuticas sea la mejor herramienta para mejorar los resultados, disminuir la tasa de complicaciones, y reducir los costes extraordinariamente elevados del tratamiento del FI, en cualquiera de sus modalidades4,51.
Uno de los aspectos más interesantes del trasplante intestinal, es el haber permitido la evolución de algunos centros hacia la creación de Unidades de Rehabilitación Intestinal que integren en un equipo multidisciplinar los tres procedimientos básicos de tratamiento del FI: soporte nutricional, farmacología y cirugía, incluido el trasplante intestinal, evolución similar a la que hace dos décadas condujo a la creación de Unidades especializadas de Hepatología a partir de programas consolidados de trasplante hepático52.
La misión de las Unidades de Rehabilitación Intestinal consiste en eliminar o reducir la necesidad de nutrición parenteral de los enfermos con FI, mediante la aplicación de un plan individualizado de medidas dietéticas, médicas y quirúrgicas, tratando simultáneamente de mejorar la calidad de vida y longevidad del paciente, a la vez que minimizando los costes del tratamiento y las complicaciones53. El fundamento se basa en que no existe un procedimiento óptimo único, y que por el contrario las probabilidades de éxito son máximas con una evaluación adecuada, llevado a cabo por un equipo experimentado, multidisciplinar, y que sea capaz de prestar atención a los pequeños detalles53.
Con este propósito las Unidades de Rehabilitación Intestinal integran un grupo multidisciplinar de profesionales con interés en el FI, compuesto por gastroenterólogos, cirujanos con experiencia en reconstrucción autóloga del intestino y trasplante, dietistas, coordinadores, personal de enfermería especializado, psicólogos/psiquiatras, especialistas en ostomías y cuidados de heridas y fístulas, y asistentes sociales53,54.
Entre las tareas clínicas que debe asumir la unidad, son relevantes las siguientes53:
• Evaluación física, bioquímica y radiológica del enfermo.
• Educación e instrucción del paciente y de los cuidadores.
• Soporte nutricional.
• Destete de la nutrición parenteral.
• Tratamiento de las complicaciones del fallo intestinal.
• Soporte psico-social.
• Opciones quirúrgicas, incluyendo reconstrucción autóloga del intestino y trasplante intestinal.
• Opciones farmacológicas de tratamiento del fallo intestinal.
Los beneficios de las Unidades de Rehabilitación Intestinal se extienden a todos los ámbitos4,53-56: optimización de los resultados, disminución de la mortalidad y tasa de complicaciones, reducción de costes, una mayor interacción entre los profesionales y las distintas modalidades de tratamiento, mayor flexibilidad para hacer cambios rápidos, una comunicación más dinámica del enfermo y familiares con los cuidadores, así como la continuidad percibida por el paciente en el tratamiento que recibe. Otras ventajas son la mayor posibilidad del enfermo y sus familiares para relacionarse con pacientes con problemas similares (es deseable la creación de asociaciones de enfermos) y que permite reunir un número suficiente de casos para el desarrollo de trabajos de experimentación clínica.
Finalmente, los elevados costes del tratamiento con soporte nutricional, así como la creación de una población cada vez mayor de enfermos con FI, obligan a la instauración de una política nacional de control y gestión. Los centros que integran todas las opciones terapéuticas mejoran los resultados y optimizan el coste, por lo que el fomento de Unidades de Rehabilitación Intestinal ha de ser una prioridad de la Administración. De hecho, y aunque resulte paradójico, uno de los resultados inmediatos de las Unidades de Rehabilitación nutricional es que disminuyen las necesidades de nutrición parenteral y de trasplante en un número significativo de enfermos, algo que hemos podido comprobar en nuestra propia experiencia, pues la tasa de enfermos evaluados como potenciales candidatos a trasplante intestinal en los que se consiguió autonomía digestiva fue más del doble en los referidos desde otros centros que en los procedentes de nuestro Hospital. Por último, el tratamiento precoz del fallo intestinal en centros de referencia es un elemento clave para reconocer lo antes posible la irreversibilidad del fallo intestinal y permitir realizar el trasplante en el momento más adecuado. Este objetivo cobra especial interés si se considera que la referencia precoz reduce la mortalidad pretrasplante (cercana al 50% en niños menores de 2 años), permite en muchos casos evitar un trasplante combinado que incluya el hígado, y que como corroboran los resultados del Registro Internacional de Trasplante Intestinal, la mejor selección de los receptores (imposible de realizar si no hay referencia precoz) constituye uno de los aspectos que más han influido en la mejoría de los resultados del TI.
Experiencia del Hospital Universitario La Paz
En julio de 1997 el Hospital Universitario La Paz fue autorizado para la práctica del TI, siendo el primer Hospital en nuestro País en obtener la acreditación para este procedimiento. Desde el inicio, el programa se planteó como una Unidad de Rehabilitación Intestinal, de acuerdo a los criterios más arriba expuestos. Desde entonces han sido tratados en nuestro centro 77 pacientes (42 niñas, 35 niños) con FI prolongado, incluyendo este número solo niños evaluados como potenciales candidatos a TI. Se trata por tanto de un subgrupo de enfermos con FI de mala evolución, y no debe considerarse una muestra representativa de la población de niños con FI.
Las causas de FI fueron (tabla II) síndrome de intestino corto 59, trastornos de motilidad 15 y diarreas intratables 3. En 58 casos el FI era de comienzo neonatal, asociado a prematuridad en 20. El 75,3% de los niños (n = 58) fueron referidos de otros centros. Los resultados fueron agrupados en las siguientes categorías: adaptan (n = 16), estables con NP (n = 6), fallecen antes de ser incluidos en lista de TI (n = 4), fallecen en lista de TI (n = 9), en lista para TI (n = 5), presentan contraindicación de TI (n = 3) y trasplantados (n = 34). Quince de los 16 niños que quedaron libres de NP sin necesidad de TI presentaban SIC; en ellos, la autonomía digestiva se alcanzó tras reconstrucción autóloga de intestino en 8, asociada en uno a administración de hormona de crecimiento (HC), optimización de la dieta en 6 y administración de HC en 1. Un niño referido para trasplante por pseudoobstrucción y trombosis extensa del sistema venoso, consiguió autonomía digestiva tras comprobar que padecía una enfermedad de Hirschsprung de todo el colon. Treinta y cuatro niños recibieron un total de 39 aloinjertos: 2 de solo hígado (uno procedente de donante vivo otro de bipartición), 15 de intestino aislado, 16 de hígado-intestino (todos con la técnica "en bloque") y 6 multiviscerales, de los cuales en tres se incluyó el bazo y en uno un riñón con el injerto. En ocho casos de injerto combinado incluyendo el hígado se procedió a reducción del injerto hepático, seguido tras la revascularización en 4 de resección de parte de intestino medio. Veinte de los 34 niños trasplantados (59%) están actualmente vivos, con un tiempo de evolución postrasplante que oscila entre 8 años y 2 meses (mediana 401 días). Diecinueve de los 20 niños vivos están con autonomía digestiva, y libres de nutrición parenteral.
Referencias
1. Starzl TE, Todo S, Tzakis A, Murase N. Multivisceral and intestinal transplantation. Transplant Proc 1992; 24(3):1217-23. [ Links ]
2. Grant D. Small bowel transplant registry. En: Symposium IISBT, ed. Brussels: IXth International Small Bowel Transplantation Symposium, 2005. [ Links ]
3. Goulet O, Sauvat F. Short bowel syndrome and intestinal transplantation in children. Curr Opin Clin Nutr Metab Care 2006; 9(3):304-13. [ Links ]
4. Goulet O, Ruemmele F. Causes and management of intestinal failure in children. Gastroenterology 2006; 130(2 Supl. 1):S16-28. [ Links ]
5. Todo S, Tzakis AG, Abu-Elmagd K y cols. Intestinal transplantation in composite visceral grafts or alone. Ann Surg 1992; 216(3):223-33; discussion 233-4. [ Links ]
6. Starzl TE, Todo S, Tzakis A y cols. The many faces of multivisceral transplantation. Surg Gynecol Obstet 1991; 172(5):335-44. [ Links ]
7. Todo S, Tzakis A, Abu-Elmagd K y cols. Abdominal multivisceral transplantation. Transplantation 1995; 59(2):234-40. [ Links ]
8. Kato T, Ruiz P, Thompson JF, y cols. Intestinal and multivisceral transplantation. World J Surg 2002; 26(2):226-37. [ Links ]
9. Kato T, Tzakis AG, Selvaggi G y cols. Intestinal and multivisceral transplantation in children. Ann Surg 2006; 243(6):756-64; discussion 764-6. [ Links ]
10. Grant D, Abu-Elmagd K, Reyes J y cols. 2003 report of the intestine transplant registry: a new era has dawned. Ann Surg 2005; 241(4):607-13. [ Links ]
11. Mueller AR, Pascher A, Platz KP y cols. Modified surgical technique in clinical small bowel transplantation: donor and recipient management. Transplant Proc 2002; 34(6):2265-7. [ Links ]
12. Grant D, Wall W, Mimeault R y cols. Successful small-bowel/liver transplantation. Lancet 1990; 335(8683):181-4. [ Links ]
13. Sudan DL, Iyer KR, Deroover A y cols. A new technique for combined liver/small intestinal transplantation. Transplantation 2001; 72(11):1846-8. [ Links ]
14. Grant W. Surgical techniques for liver/small bowel and isolated bowel transplants. Curr Opin Organ Transplant 2005; 10:142-146. [ Links ]
15. Abu-Elmagd K, Reyes J, Bond G y cols. Clinical intestinal transplantation: a decade of experience at a single center. Ann Surg 2001; 234(3):404-16; discussion 416-7. [ Links ]
16. Starzl TE, Rowe MI, Todo S y cols. Transplantation of multiple abdominal viscera. JAMA 1989; 261(10):1449-57. [ Links ]
17. Kato T, Tzakis A, Selvaggi G, Madariaga J. Surgical techniques used in intestinal transplantation. Curr Opin Organ Transplant 2004; 9:207-213. [ Links ]
18. Todo S, Reyes J, Furukawa H y cols. Outcome analysis of 71 clinical intestinal transplantations. Ann Surg 1995; 222(3):270-80; discussion 280-2. [ Links ]
19. Goulet O, Auber F, Fourcade L y cols. Intestinal transplantation including the colon in children. Transplant Proc 2002; 34(5):1885-6. [ Links ]
20. Alexandrides IJ, Liu P, Marshall DM y cols. Abdominal wall closure after intestinal transplantation. Plast Reconstr Surg 2000; 106(4):805-12. [ Links ]
21. Carlsen BT, Rudkin GH, Farmer D. Complicated abdominal wall closure in intestinal transplant recipients. Curr Opin Organ Transplant 2005; 10:128-131. [ Links ]
22. Levi DM, Tzakis AG, Kato T y cols. Transplantation of the abdominal wall. Lancet 2003; 361(9376):2173-6. [ Links ]
23. Bueno J, Ohwada S, Kocoshis S y cols. Factors impacting the survival of children with intestinal failure referred for intestinal transplantation. J Pediatr Surg 1999; 34(1):27-32; discussion 32-3. [ Links ]
24. Fryer J, Pellar S, Ormond D y cols. Mortality in candidates waiting for combined liver-intestine transplants exceeds that for other candidates waiting for liver transplants. Liver Transpl 2003; 9(7):748-53. [ Links ]
25. De Ville de Goyet J, Mitchell A, Mayer AD y cols. En block combined reduced-liver and small bowel transplants: from large donors to small children. Transplantation 2000; 69(4):555-9. [ Links ]
26. Fishbein T, Florman S, Gondolesi G, Decker R. Noncomposite simultaneous liver and intestinal transplantation. Transplantation 2003; 75(4):564-5. [ Links ]
27. Testa G, Panaro F, Schena S y cols. Living related small bowel transplantation: donor surgical technique. Ann Surg 2004; 240(5):779-84. [ Links ]
28. Gruessner RW, Sharp HL. Living-related intestinal transplantation: first report of a standardized surgical technique. Transplantation 1997; 64(11):1605-7. [ Links ]
29. Horslen SP, Sudan DL, Iyer KR y cols. Isolated liver transplantation in infants with end-stage liver disease associated with short bowel syndrome. Ann Surg 2002; 235(3):435-9. [ Links ]
30. Abu-Elmagd KM. Intestinal transplantation for short bowel syndrome and gastrointestinal failure: current consensus, rewarding outcomes, and practical guidelines. Gastroenterology 2006; 130(2 Suppl 1):S132-7. [ Links ]
31. Grant D. Intestinal transplantation: 1997 report of the international registry. Intestinal Transplant Registry. Transplantation 1999; 67(7):1061-4. [ Links ]
32. Goulet O. Are the needs and indications for bowel transplantation changing? En: Symposium IISBT, ed. Brussels: IXth International Small Bowel Transplantation Symposium, 2005. [ Links ]
33. Goulet O, Jan D, Brousse N y cols. Intestinal transplantation. J Pediatr Gastroenterol Nutr 1997; 25(1):1-11. [ Links ]
34. Kaufman SS, Atkinson JB, Bianchi A y cols. Indications for pediatric intestinal transplantation: a position paper of the American Society of Transplantation. Pediatr Transplant 2001; 5(2):80-7. [ Links ]
35. Kelly DA. Intestinal failure-associated liver disease: what do we know today? Gastroenterology 2006; 130(2 Supl. 1):S70-7. [ Links ]
36. Wolf A, Pohlandt F. Bacterial infection: the main cause of acute cholestasis in newborn infants receiving short-term parenteral nutrition. J Pediatr Gastroenterol Nutr 1989; 8(3):297-303. [ Links ]
37. Kaufman SS, Loseke CA, Lupo JV y cols. Influence of bacterial overgrowth and intestinal inflammation on duration of parenteral nutrition in children with short bowel syndrome. J Pediatr 1997; 131(3):356-61. [ Links ]
38. Sondheimer JM, Asturias E, Cadnapaphornchai M. Infection and cholestasis in neonates with intestinal resection and long-term parenteral nutrition. J Pediatr Gastroenterol Nutr 1998; 27(2):131-7. [ Links ]
39. Watkins JB, Szczepanik P, Gould JB y cols. Bile salt metabolism in the human premature infant. Preliminary observations of pool size and synthesis rate following prenatal administration of dexamethasone and phenobarbital. Gastroenterology 1975; 69(3):706-13. [ Links ]
40. American Gastroenterological Association medical position statement: short bowel syndrome and intestinal transplantation. Gastroenterology 2003; 124(4):1105-10. [ Links ]
41. Kaufman S. Indications for intestinal transplantation and graft allocation. Curr Opin Organ Transplantation 2004; 9:220-224. [ Links ]
42. Langnas AN. Advances in small-intestine transplantation. Transplantation 2004; 77(9 Supl.):S75-8. [ Links ]
43. Sudan DL, Kaufman SS, Shaw BW, Jr. y cols. Isolated intestinal transplantation for intestinal failure. Am J Gastroenterol 2000; 95(6):1506-15. [ Links ]
44. Gupte GL, Beath SV, Protheroe S y cols. Improved outcome of referrals for intestinal transplantation in the UK. Arch Dis Child 2006. [ Links ]
45. Horslen SP. Optimal management of the post-intestinal transplant patient. Gastroenterology 2006; 130(2 Supl. 1):S163-9. [ Links ]
46. Wu T, Abu-Elmagd K, Bond G y cols. A schema for histologic grading of small intestine allograft acute rejection. Transplantation 2003; 75(8):1241-8. [ Links ]
47. Ishii T, Mazariegos GV, Bueno J y cols. Exfoliative rejection after intestinal transplantation in children. Pediatr Transplant 2003; 7(3):185-91. [ Links ]
48. Tinckam KJ, Sayegh MH. Transplantation tolerance in pediatric recipients: lessons and challenges. Pediatr Transplant 2005; 9(1):17-27. [ Links ]
49. Bianchi A. From the cradle to enteral autonomy: the role of autologous gastrointestinal reconstruction. Gastroenterology 2006; 130(2 Suppl 1):S138-46. [ Links ]
50. Langnas A, KT. Intestinal failure: current and emerging therapies including transplantation. Gastroenterology 2006; 130(Suppl 1):S1-S2. [ Links ]
51. Sudan D. Cost and quality of life after intestinal transplantation. Gastroenterology 2006; 130(2 Supl. 1):S158-62. [ Links ]
52. Schaffner F. The history of liver disease at The Mount Sinai Hospital. Mt Sinai J Med 2000; 67(1):76-83. [ Links ]
53. Brown CR, DiBaise JK. Intestinal rehabilitation: a management program for short-bowel syndrome. Prog Transplant 2004; 14(4):290-6; quiz 297-8. [ Links ]
54. DiBaise JK, Young RJ, Vanderhoof JA. Intestinal rehabilitation and the short bowel syndrome: part 2. Am J Gastroenterol 2004; 99(9):1823-32. [ Links ]
55. Sudan D, DiBaise J, Torres C y cols. A multidisciplinary approach to the treatment of intestinal failure. J Gastrointest Surg 2005; 9(2):165-76; discussion 176-7. [ Links ]
56. Koehler AN, Yaworski JA, Gardner M y cols. Coordinated interdisciplinary management of pediatric intestinal failure: a 2-year review. J Pediatr Surg 2000; 35(2):380-5. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Manuel López Santamaría.
Hospital Universitario La Paz.
Departamento de Cirugía Pediátrica.
Paseo de la Castellana, 261.
28046 Madrid.
E-mail: mlopez.hulp@salud.madrid.org
Recibido: 19-II-2007.
Aceptado: 10-III-2007.