My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Nutrición Hospitalaria
On-line version ISSN 1699-5198Print version ISSN 0212-1611
Nutr. Hosp. vol.23 n.3 Madrid May./Jun. 2008
Resistencia de la hiperhomocisteinemia del paciente renal al tratamiento con dosis suprafisiológicas de ácido fólico parenteral
Resistance of hyperhomocysteinemia in renal patients to treatment with supra-physiological doses of parenteral folic acid
M. Palomares Bayo*, M.ª; J. Oliveras López**, A. Osuna Ortega*, C. Asensio Peinado*, J. J. Quesada Granados**, H. López García de la Serrana**, M.ª; C. López Martínez**
*Servicio de Nefrología. Ciudad Sanitaria Virgen de las Nieves. Granada.
**Departamento de Nutrición y Bromatología. Facultad de Farmacia. Universidad de Granada. España.
Dirección para correspondencia
RESUMEN
Los pacientes en hemodiálisis presentan un aumento de homocisteína plasmática (Hcy), debido a la alteración en la metilación causada por la uremia y déficit de los cofactores necesarios (vitamina B, ácido fólico). Esto se correlaciona con un mayor desarrollo de la enfermedad vascular prematura. El tratamiento, no está consensuado, siendo escasa la respuesta a la administración oral de dosis convencionales de ácido fólico. En este trabajo valoramos la respuesta de la hiperhomocisteinemia de 73 pacientes en programa de hemodiálisis periódica tras la administración de 50 mg de ácido folínico parenteral durante 18 meses. La homocisteína plasmática de los pacientes en el momento de inicio del estudio presentaba unos valores medios de 22,67 (μmol/l). Durante el primer año de suplementación mantuvieron el valor medio de 20μmol/l. A partir del primer año de tratamiento, y hasta finalizar los 18 meses de observación, los niveles medios de homocisteína fueron de 19,58 μmol/l. Aunque con el tiempo de tratamiento encontramos una clara tendencia al descenso de sus valores plasmáticos, no existieron diferencias estadísticamente significativas. Los valores de homocisteína no se normalizaron en ninguno de los pacientes tratados.
Palabras clave: Paciente renal. Ácido fólico. Hemodiálisis. Hiperhomocisteinemia.
ABSTRACT
Hemodialysis patients present an increase in plasma homocysteine (Hcy) due to methylation impairment caused by uremia and the deficiency of the co-factors needed (vitamin B, folic acid). This correlates with a more common development of premature vascular disease. There is no consensus on the therapy, with a poor response to oral administration of conventional doses of folic acid. In this work, we assessed the response of hyperhomocysteinemia in 73 regular hemodialysis patients after the administration of 50 mg of parenteral folinic acid for 18 months. Plasma homocysteine of the patients at the time of the study beginning presented mean values of 22.67 (μmol/L). During the first year of supplementation the mean value was kept at 20μmol/L. From the first year to the end of the 18-months observation period the mean homocysteine levels were 19.58μmol/L. Although we found a clear trend towards a decrease in plasma homocysteine levels during the treatment period, there were no significant differences. Homocysteine levels did not come back to normal in none of the patients treated.
Key words: Renal patient. Folic acid. Hemodialysis. Hyperhomocysteinemia.
Introducción
La homocisteína (Hcy) y su metabolismo (fig. 1) han sido objeto de especial interés a partir de los años sesenta, cuando se describió un defecto genético caracterizado por elevación de la concentración de Hcy en plasma y aumento en su excreción urinaria (homodímero de homocisteína), por lo que se le denominó homocistinuria1. El cuadro clínico cursaba con luxación del cristalino, afectación ósea, neurológica, y trombosis en venas y arterias de todos los calibres. Posteriormente, se demostró que el defecto molecular responsable era el déficit de la enzima cistationina beta sintetasa (C S). En 1969, McCully2 describe el defecto en el metabolismo de la cobalamina (vitamina B12) como causa de elevación de la concentración de homocisteína plasmática. Posteriormente, otros autores3comunican un paciente con deficiencia de la enzima metileno-tetrahidrofolato reductasa (MTHFR) que también presentaba una elevación muy importante de la concentración plasmática de homocisteína, homocistinuria, accidentes tromboembólicos de repetición y marcada afectación del sistema nervioso.
Desde entonces un número creciente de estudios clínicos, epidemiológicos y experimentales han demostrado, que la elevación moderada de la concentración de Hcy plasmática es un factor de riesgo frecuente e independiente de padecer enfermedad cardiovascular en la población general4, 5. En los pacientes con insuficiencia renal crónica, además, su concentración en sangre se encuentra aumentada entre 1,95 y 3,6 veces con respecto a la población normal, relacionándose a la gran prevalencia de morbi-mortalidad cardiovascular de estos enfermos. La homocisteína induce el desarrollo de ateromatosis en el paciente renal a través de distintos mecanismos (fig. 2):
1. Disfunción endotelial: la oxidación del grupo sulfidrilo de la homocisteína, forma anión superóxido y peróxido de hidrógeno6-11. Asimismo, la generación de radicales libres incrementa la oxidación de las lipoproteínas de baja densidad12, 44 y, por lo tanto, su captación por parte de los macrófagos en la pared vascular. La lipoproteína(a) cambia también su estructura13 frente a diversos compuestos sulfhidrílicos y su afinidad por la fibrina aumenta con concentraciones de Hcy tan bajas como 8 mmol/l. Las propiedades vasodilatadoras de la célula endotelial normal también se ven afectadas por la homocisteína, debido principalmente a una disminución en la producción de óxido nítrico14.
2. Alteraciones en la función plaquetaria y factores de coagulación: se han comunicado anomalías del metabolismo del ácido araquidónico con una mayor síntesis plaquetaria de tromboxano A2, tanto in vitro como in vivo. Este incremento podría reflejar una activación plaquetaria que contribuiría a la aparición de los episodios tromboembólicos en estos pacientes. Las células endoteliales en presencia de Hcy, aumentan también la expresión del factor V y la activación de la protrombina15. Y por otra parte, la homocisteína inhibe una importante vía fisiológica anticoagulante como es la activación de la proteína C y la expresión de la trombomodulina en la superficie endotelial. Se han encontrado, además, alteraciones de la antitrombina III16reducción de la unión del activador tisular del plasminógeno a su receptor endotelial, anomalías en la secreción del factor von Willebrand y un aumento de la expresión del factor tisular por parte del endotelio expuesto a la homocisteína17. La homocisteína induce también la proliferación de las células musculares lisas y disminuye la síntesis del ADN endotelial46.
En los pacientes con insuficiencia renal crónica, la concentración de homocisteína en sangre se encuentra aumentada con respecto a los controles18, 19 relacionándose con mayor susceptibilidad a desarrollar enfermedad vascular prematura20. La elevada prevalencia de hiperhomocisteinemia se debe a alteraciones en su metilación causada por el déficit de cofactores necesarios (ácido fólico, vitamina B12) junto con toxinas urémicas que interfieren con el metabolismo extrarrenal normal de homocisteína18, 21, siendo la respuesta al tratamiento polivitamínico muy limitada22, 23.
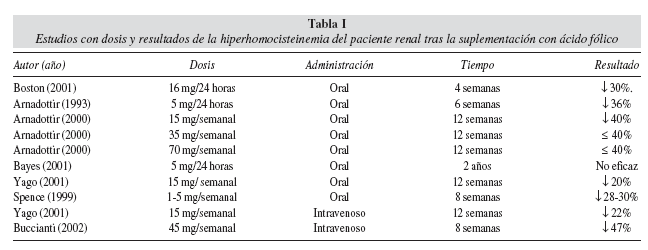
El aporte de 2 a 5 mg por día de ácido fólico durante 2 a 4 semanas, reduce al 30% los niveles de Hcy basales en sujetos normales24 pero no en el paciente urémico, quizá como consecuencia de déficits absortivos, alteraciones en la metabolización o resistencia al efecto del ácido fólico. Estos hechos nos han llevado a considerar, la forma de reposición intravenosa (iv) de la forma activa de la vitamina, el tetrahidrofolato25. La dosis y tiempo de administración efectiva de ácido fólico18, 24, 26, 27 no ha sido establecida (tabla I).
Por ello, nos planteamos como objetivo evaluar la respuesta de la homocisteína tras la administración parenteral prolongada de elevadas dosis de ácido folínico, estableciendo, su utilidad clínica en el paciente urémico.
Material y métodos
En nuestro estudio se incluyeron un total de 73 pacientes de ambos sexos, con insuficiencia renal crónica en programa de hemodiálisis, edad superior a los 18 años y al menos 3 meses de su inclusión en el tratamiento sustitutivo renal.
Todos los pacientes recibieron hemodiálisis con un dializador capilar de un solo uso. La membrana utilizada fue la misma, realizada con un material sintético biocompatible (polisulfona: Polyflux 17 L® fabricada por los laboratorios Gambro y BLS 819® de Bellco SpA), aunque en función a las necesidades de diálisis se utilizó el dializador de alta permeabilidad con mayor coeficiente de ultrafiltración y mejor aclaramiento de grandes moléculas, sin existir diferencias entre los pacientes por el grado de biocompatibilidad de la membrana o técnica de esterilización de la misma. La modalidad de Hemodiálisis era convencional, con dosis, ajustada a las recomendaciones recogidas en las Guías Terapéuticas Internacionales28para mantener valores de KT/V aplicando el modelo cinético de la Urea de Daurgidas (2ª; Generación) iguales o superiores a 1,2, modificándose en función a ello, el tiempo de la sesión de hemodiálisis de los pacientes (de 180 a 270 minutos).
Para realizar esta intervención nutricional, se administró ácido folínico utilizando la vía parenteral para asegurar la adhesión del paciente al tratamiento durante el tiempo del estudio y evitar así déficits absortivos.
La suplementación consistió en dosis de 50 mg iv deácido folínico después de hemodiálisis, en la primera sesión semanal del paciente (lunes y martes según correspondía al turno habitual de hemodiálisis del paciente) mediante ampollas inyectables, para administración iv de folinato cálcico: Folidan® de Almirall Prodesfarma; un vial liofilizado con 50 mg de folinato cálcico DCI, y ampolla disolvente con 5 ml de agua destilada estéril y apirógena.
Cada seis meses medimos los niveles plasmáticos de Vitamina B12, para monitorizar sus valores y descartar déficits que pudiesen interferir en los resultados de nuestro estudio. Además, cada 6 meses medimos los niveles plasmáticos de ácido fólico, así como los niveles de homocisteína, para evaluar la respuesta a la suplementación administrada.
Las muestras de sangre periférica se extrajeron antes de la primera sesión de hemodiálisis semanal del paciente, por parte del personal de enfermería a cargo de la unidad. Bioquímica: 6 ml de sangre en tubo Venojet® II (Terumo; autosep®): para la determinación de vitamina B12 y ácido fólico. Hemograma: 3,0 ml de sangre en tubo Venoject® UT053STK, con 0,06 ml de EDTA (K3E) al 0,235 mmol/L para homocisteína.
La determinación de homocisteína fue realizada con IMX método de fluoroinmunoanálisis según protocolo ABOTT PARK IL 60054. El ácido fólico mediante electroquimioluminiscencia y test realizado en el analizador automático Roche Elecsys 2010 y la vitamina B12 fue medida por inmunoensayo de electroquimioluminiscencia realizado en el analizador automático Roche Elecsys 2010 y en el módulo Elecsys Modular Analytics E-170.
Se ha realizado un estudio de cohortes, y el tratamiento estadístico siguiendo las pautas de otros trabajos similares publicados42 y siempre en función de las características paramétricas o no paramétricas de las distintas poblaciones muestrales. En concreto, después de comprobar el tipo de distribución por la que se rigen las muestras (test de la normalidad de Kolmogorov-Smirnov) se aplicaron indistintamente los test de ANOVA (distribuciones paramétricas) o test de Kruskall-Wallis (en el caso de distribuciones no paramétricas) con el fin de encontrar diferencias estadísticas significativas durante el estudio longitudinal de los casos. Para la realización del estudio se empleó el software informático denominado SPSS v12 de SPSS Inc.
Resultados
La edad media de los pacientes era 53,3 ± 18,69 años, 43 varones y 30 mujeres. El tiempo en programa de hemodiálisis fue de 43 ± 33 meses. La duración media de la sesión, de 246 ± 24 minutos y la dosis media de hemodiálisis administrada fue de 1,37 ± 0,27 (KT/V calculada por fórmula de Daurgidas de 2ª; generación). Se realizaron 219 determinaciones de homocisteína plasmática. De acuerdo a los rangos establecidos por nuestro laboratorio, consideramos niveles normales los inferiores a 9 μmol/l, hiperhomocisteinemia moderada los valores comprendidos entre 9-15 μmol/l, e hiperhomocisteinemia severa, aquellos valores superiores a 15μmol/l27, 29-31.
Los niveles medios fueron de 19,85 μmol/l, con valores mínimos de 3,0 μmol/l y máximos de 41μmol/l. Sólo 9 de las 219 determinaciones realizadas fueron inferiores a 9 μmol/l (4,11%) y por tanto, que se pueden considerar normales según el diseño de nuestro estudio (fig. 3). Sin embargo, un 21,46% de los pacientes presentaron valores de hiperhomocisteinemia moderada (mínimo 10 μmol/l, máximo 14 μmol/l) y un 74,43% (163 pacientes) presentaron hiperhomocisteinemias severas, con cifras que en la mayoría de los estudios se señalan como altamente proaterogénicas (tabla II, fig. 4).
La Hcy plasmática de los pacientes en el momento de inicio del estudio presentaba unos valores medios de 22,67 μmol/l, con valores comprendidos entre 16 y 28μmol/l. Durante el primer año de suplementación con altas dosis de ácido folínico mantuvieron el valor medio de 20 μmol/l. A partir del primer año de tratamiento, y hasta finalizar los 18 meses de observación, los niveles medios de homocisteína fueron de 19,58μmol/l. Aunque con el tiempo de tratamiento encontramos tendencia al descenso de sus valores plasmáticos, no existieron diferencias estadísticamente significativas. Los valores de homocisteína no se normalizaron en ninguno de los pacientes tratados (tabla III, fig. 5).
Por otra parte, se evaluaron los valores plasmáticos de vitamina B12 en estos pacientes, al ser cofactor necesario en el metabolismo de la homocisteína. Los niveles plasmáticos de vitamina B12 de todos los enfermos permanecieron por encima de 225 pg/ml, límite inferior de los niveles de normalidad, sin necesidad de suplementación. Los niveles plasmáticos de vitamina B12 permanecieron normales (326,9 ± 115,2 pg/ml basal; 319,3 ± 128 pg/ml en 12 meses; 334,6 ± 102 pg/ml en 18 meses) sin diferencias estadísticamente significativas durante el estudio (fig. 6).
Los valores normales para niveles plasmáticos deácido fólico establecidos por nuestro laboratorio fueron de 2-19,7 ng/ml. Los niveles de ácido fólico aumentaron durante el tiempo de estudio, con una media inicial (12,57 ± 5,53 ng/ml) considerada normal. El test de Kruskal-Wallis mostró unos valores de p significativos en el análisis las variaciones del ácido fólico durante el primer año de tratamiento, ya que sus niveles aumentaron hasta 15,48 ± 4,73 ng/ml el primer año (p < 0,01), y hasta 17,49 ± 3,47 ng/ml tras los 18 meses de suplementación parenteral (ns) (tabla IV, fig. 7).
En el análisis de la relación entre los niveles plasmáticos de ácido fólico y la homocisteína plasmática encontramos una fuerte correlación entre los valores deácido fólico plasmático y los niveles de homocisteína de los pacientes, aunque sin diferencias estadísticamente significativas.
Discusión
Los resultados de nuestro estudio demuestran la existencia de una elevada prevalencia de hiperhomocisteinemia en los pacientes de hemodiálisis evaluados. Tan sólo 9 de las 219 determinaciones realizadas fueron normales y un 96% de las hiperhomocisteinemias resultaron en unas cifras muy elevadas, ya escritas en estudios previos27, 29-31.
Los valores medios de nuestros pacientes, sin embargo eran inferiores (22,67 y 19,86 μmol/l al inicio y final del estudio respectivamente) a los encontrados por otros autores31, 39. No encontramos diferencias estadísticamente significativas por el sexo o edad de los pacientes, de acuerdo con trabajos anteriores27, 29, 32.
La causa, como ya ha sido comentada, es multifactorial y podría ser debida a varios factores, como la menor excreción renal33, el descenso en su metabolización renal34 y disturbios en las reacciones de metilación causadas por la uremia. Sin embargo, otros autores35han propuesto el déficit de cofactores (folato, vitamina B6, vitamina B12) asociado al descenso del metabolismo extrarrenal por retención de metabolitos aún no identificados, lo que no ha sido constatado en nuestro estudio. Estos metabolitos son inhibidores plasmáticos35que limitarían la actividad de las conjugasas responsables de la transformación de poliglutamato a monoglutamato, el transporte transmembrana del ácido fólico, o disminuirían la absorción del metatetrahidofolato. Por otra parte, la predisposición genética en el paciente renal, se ha visto determinada en idénticas proporciones que la población normal36.
Una inadecuada concentración de cofactores (folato, vitamina B12 y vitamina B6) se consideran factores contribuyentes para hiperhomocisteinemia. Sin embargo, y en concordancia a los datos publicados22, 29, en nuestro estudio las concentraciones de vitamina B12 estaban en el rango de normalidad en todos los pacientes. En este trabajo no se han medido los niveles de vitamina B6 al estar los pacientes rutinariamente suplementados, en cuyo caso no existe ningún estudio que describa valores patológicos en los mismos29. En cuanto a los resultados de los niveles de ácido fólico, los niveles medios de los pacientes eran normales (12,57 ng/ml) antes de iniciar el tratamiento y se elevaron significativamente durante los primeros 12 meses de suplementación (p < 0,05).
En la población general, la administración de ácido fólico (1-2 mg) vía oral, independientemente de los niveles de vitamina B12 y ácido fólico, disminuye los valores de Hcy en la mayoría de los individuos, pero esta dosis es insuficiente en el paciente renal, y a pesar de numerosos estudios, sigue sin estar consensuada la dosis óptima o vía de administración24, 38, 45.
Recientemente, se ha publicado39 cómo el papel de la hiperhomocisteinemia en el paciente renal no es sólo el resultado de la uremia, deficiencia de folatos y riboflavina, relativa resistencia a la acción del folato, de las vitaminas B6 y B12, o a la acumulación de dimetilglicina. La elevación de sus niveles también está genéticamente determinada y es un importante factor de riesgo en las complicaciones cardio y cerebrovasculares, enfermedad cardíaca isquémica y muerte súbita tanto en pacientes urémicos como en la población no urémica. Sin embargo, la relevancia de la hiperhomocisteinemia y su tratamiento en pacientes en diálisis no está aclarada aún39, a diferencia de la población normal. En este sentido, se ha propuesto como hipótesis, una resistencia en los pacientes en diálisis a la posible acción terapéutica del fólico y vitaminas B6 y B12cuando se emplean en dosis habituales. Se ha visto que estos tratamientos pueden reducir, pero no normalizar los niveles plasmáticos de homocisteína de los pacientes39.
Son múltiples los trabajos realizados entorno a la administración de ácido fólico, y en general, no parece existir ningún beneficio con la administración oral de más de 15 mg de ácido fólico18, 21. Esta administración oral tiene escasos resultados en la normalización de los niveles de homocisteína, existiendo gran discordancia en las disminuciones de los valores plasmáticos tras la suplementación al paciente, encontrando ausencia de respuesta31, una respuesta del 30-36%21, 24, 29, 43 o hasta de un 70%29, 40.
Estudios con pacientes tratados con distintas dosis de ácido fólico vía oral durante periodos de seis semanas24, muestran como más de 15 mg no consiguieron efectos más beneficiosos en la homocisteína. Los resultados mostraban cómo la piridoxina y vitamina B12no son útiles en la reducción de Hcy, ya que el 96% de pacientes presentaban niveles elevados de homocisteína (40,8 μmol/L) sin diferencia por edad o sexos. La mayor reducción de los niveles de homocisteína se alcanzó con 15 mg de ácido fólico/vo (30,3 μmol/L) con mínimos de 24,4 μmol/L y máximos 61,6 μmol/L. Los niveles de folato intraeritrocitario fueron superiores a los rangos de normalidad, por ello, se postula que no es racional aumentar esta dosis de administración vía oral.
Otros autores41 han valorado la diferencia de administración oral de ácido fólico y 1-folínico (en las dosis equivalentes de 15 y 20 mg), para evaluar si la ausencia de respuesta se debe a la alteración de la interconversión de uno a otro. Sin embargo, se han encontrado niveles similares de homocisteína (337 ng/ml conácido folínico vs 312 ng/dl con ácido fólico, ns) en ambas formas de administración oral.
Algunos trabajos sugieren que el tratamiento con metabolitos activos del ácido fólico administrados de forma parenteral puedan ser más eficaces25, 32, 40, 47. La ruta iv evitaría el metabolismo intestinal del folato ingerido con la dieta, e intentando mejorar resultados, se plantea la idoneidad de la administración parenteral de ácido fólico. En este sentido, se ha realizado la suplementación29 con 30 mg semanales iv postdiálisis, midiendo homocisteína a los 6 meses y al año. Los niveles iniciales de Hcy plasmática en todos los pacientes estaban elevados (33,3 ± 16,6 μmol/L, para un rango normal bajo (11,8 ± 1,5 μmol/L), y descendieron de forma estadísticamente significativa a 23,5 ± 7,6 después de 6 meses (p < 0,01 vs basal) y a 21,7 ± 5,6 tras doce meses (p < 0,01 vs basal), aunque sólo se consiguió normalizar la hiperhomocisteinemia en 4 de los 128 pacientes tratados. A partir de los 6 meses de tratamiento, ya no existe un descenso significativo de los valores de Hcy.
Con posterioridad, en otros estudios32 administran 45 mg semanales iv de ácido fólico y encuentran reducciones del 47% sobre los valores basales, tras 8 semanas de tratamiento. El estudio llevado a cabo por Touam y cols.40, en el que administran una vez por semana 50 mg iv de ácido folínico (5-formiltetrahidrofolato), inmediato precursor de 5-10 metiltetrahidrofolato (MTHF), describe los mejores resultados postratamiento. Estos autores alcanzaron una reducción del 67% del valor de Hcy a lo largo de un año, con normalización de la misma en el 78% de los pacientes. En nuestro estudio, se han seguido estas condiciones de suplementación, aunque sin llevar a cabo conjuntamente la administración de vitamina B. Dosis más elevadas (105 mg/semana) no mejoran los resultados. Por el contrario, otros autores21, 30 han encontrado refractariedad al tratamiento, con independencia además de la vía y tipo de ácido fólico administrado, si bien, el escaso tiempo de seguimiento (12 semanas) pudo haber influido en los resultados.
Los excelentes resultados descritos previamente32, 40parecían indicar que el uso parenteral de elevadas dosis (50 mg) del precursor inmediato del 5-10 MTHF podría ser muy relevante en la reducción de los niveles de Hcy de este tipo de pacientes. Sin embargo, nuestros resultados mostraron solo un descenso moderado de los niveles de homocisteína durante el tiempo que duró la administración parenteral de dosis suprafisiológicas de ácido folínico. Desde el inicio del estudio (22,67μmol/L), la Hcy plasmática fue disminuyendo, hasta alcanzar niveles de 20,41 μmol/l durante el primer año (ns) y posteriormente, de 19,59 μmol/l (ns). Además, no encontramos normalización de la hiperhomocisteinemia de nuestros pacientes, a pesar del largo tiempo de tratamiento y seguimiento.
Como conclusión, podemos indicar que la administración parenteral de elevadas dosis de la forma activa de ácido fólico, consiguen aumentar significativamente los valores plasmáticos del mismo durante los 12 primeros meses de suplementación, pero este aumento no comporta normalización o disminución estadísticamente significativa en los niveles de homocisteína de los pacientes tratados. Nuestros resultados muestran que este factor de riesgo cardiovascular, especialmente prevalente en la población en diálisis, responde de un modo positivo a dosis suprafisiológicas de ácido fólico parenteral aunque de forma moderada, por lo que su suplementación en el paciente urémico merece mayor investigación.
Referencias
1. Carson NAJ, Neill DW. Metabolic abnormalities detected in a survey of mentally backward individuals in Norther Ireland. Arch Dis Child 1962; 37:505-513. [ Links ]
2. McCully KS. Vascular pathology of homocysteinemia: implications for the pathogenesis of arteriosclerosis. Am J Pathol 1969; 56(1):111-28. [ Links ]
3. Mudd SH, Uhlendorf BW, Freeman JM y cols. Homocystinuria associated with decreased methylenetetrahydrofolate reductase activity. Biochem Biophys Ress Commun 1972; 31,46(2):905-12. [ Links ]
4. Boushey CJ, Beresford SAA, Omenn GS, Motulsky AG. a quiantitative assessment of plasma homocysteine as a risk factor for vascular disease. Probable benefits of increasing folic acid intakes. JAMA 1995; 274:1049-1057. [ Links ]
5. Welch GN, Loscalzo J. homocysteine and atherosclerosis. N Engl J Med 1998; 338:1042-1050. [ Links ]
6. Kitiyakara Q, Gonin J, Massy Z. Non-traditional cardiovascular disease risk factors in end stage renal disease: oxidative stress and hyperhomocysteinemia. Curr Opin Nephrol Hypertens 2000; 9:477-487. [ Links ]
7. Drueke TB, Nguyem Khoa T, Massy ZA y cols. Role of oxidized low-density lipoprotein in the atherosclerosis of uremia. Kidney Int 2001; 59(Supl. 78):S114-S119. [ Links ]
8. Carluccio F, Siems W, Stefanelli G y cols. Homocysteine in chronic renal failure in relation to renal anemia and to oxidative stress parameters 4-hydroxynoneal and malondialdehyde. Clinical Nephrology 2002; 58(Supl. 1):S26-S30. [ Links ]
9. Van Guldener C, Stehouwer CDA. Hyperhomocysteinemia, vascular pathology, and endotelial dysfunction. Sem Thromb Haemost 2000; 26:281-289. [ Links ]
10. Morris ST, Jardine AG. The vascular endothelium in chronic renal failure. J Nephrol 2001; 13:96-105. [ Links ]
11. Van Guldener C. Homocysteine and the kidney. Kidney Int 2005; 6(1):23-26. [ Links ]
12. Galle J, Heinloth A, Wanner C y cols. Dual effect of oxidized LDL on cell cycle in human endothelial cells through oxidative stress. Kidney Int 2001; 59(Supl. 78):S120-S123. [ Links ]
13. Roob JM, Rabold T, Hayn M y cols. Ex vivo low-density lipoprotein oxidizability and in vivo lipid peroxidation in patients on CAPD. Kidney Int 2001; 59(Supl. 78):S128-S136. [ Links ]
14. Upchurch GRJ, Welch GN, Fabian AJ y cols. Homocysteina decreases bioaviable nitric oxide by a mechanism involving glutathiones peroxidase. J Biol Chem 1997; 272:1012-1017. [ Links ]
15. Rodgers GM, Kane WH. Activation of endogeus factor V by a homocysteine-induced vascular endothelial cell activator. J Clin Invest 1986; 75:1909-1916. [ Links ]
16. Palareti G, Coccheri S. Lowered antitrombin III activity and other clotting changes in homocystinuria: effects of a pyridoxine-folate regimen. Haemostasis 1989; 19(Supl. 1):24-28. [ Links ]
17. Borawski J, Naumnik B, Pawlak K y cols. Endothelial dysfuntion marker von Willebrand factor antigen in hemodialysis patients: associations with pre-dialysis blood pressure and the acute fase response. Nephrol Dial Transplant 2001; 16:1442-1447. [ Links ]
18. Bostom AG, Shemin D, Lapane KL y cols. folate status is the major determinant of fasting total plasma homocysteine levels in maintenance dialysis patients. Atherosclerosis 1996; 123: 193-202. [ Links ]
19. Vychytil A, Fodinger M, Wolfl G y cols. Major determinants of hyperhomocysteinemia in peritoneal dialysis patients. Kidney Int 1998; 53(6):1775-82. [ Links ]
20. Selhub J, Jacques PF, Bostom AG y cols. Relationship between plasma homocysteine and vitamin status in the Framingham study population. Impact of folic acid fortification. Public Health Rev 2000; (1-4):117-45. [ Links ]
21. Bostom Ag, Shemin D, Gohh RY y cols. Treatment of hyperhomocisteinemia in hemodialysis patients. Kidney Int 2001; 59(78): S246-S252. [ Links ]
22. Arnadottir M, Bratasm L, Siminsen O y cols. The effect of higdose pyridoxine and folic acid supplementation on serum lipids and plasma homocysteine concentrations in dialysis patients. Clin Nephrol 1993; 40:236-240. [ Links ]
23. Arnadottir M, Berg AL, Hegbrant J y cols. Influence of haemodialysis on plasma total homocysteine concentration. Nephrol Dial Transplant 1999; 14:142-146. [ Links ]
24. Arnadottir M, Gudnason V, Hulberg B. Treatment with different doses of folic acid in haemodialysis patients: effects on folate distribution and aminothiol concentration. Nephrol Dial Transplant 2000; 15:524-528. [ Links ]
25. Hernando L, Aljama P, Arias M y cols. Nefrología clínica. Ed Panamericana. 708.2003. [ Links ]
26. Descombes E, Boulat O, Bersier LF y cols. Difference in the homocysteine-lowering effect of folic acid in haemodialysis patients with and without occlusive vascular disease. Nephrol Dial Transplant 2001; 16:585-589. [ Links ]
27. Suliman ME, Qureshi AR, Bárany P y cols. Hiperhomocysteinemia, nutritional status, and cardiovascular disease in hemodialysis patientes. Kidney Int 2000; 57:1727-1735. [ Links ]
28. Guías Terapéuticas Europeas para el manejo óptimo de la Anemia en la insuficiencia renal crónica. European Renal Association, 2000. [ Links ]
29. Tremblay R, Bonnardeaux A, Geadah D y cols. Hyperhomoysteinemia in hemodialysis patients: effects of 12-month supplementation with hydrosoluble vitamins. Kidney Int 2000; 58(2): 851-8. [ Links ]
30. Yago A, Shemin D, Hsu N y cols. Rapid communication: L-folinic acid versus folic acid for the treatment of hyperhomocysteinemia in hemodialysis patients. Kidney Int 2001; 59(1): 324-7. [ Links ]
31. Bayés B, Pastor MC, Bonal J y cols. Homocysteine and lipid peroxidation in haemodialysis: role of folic acid and vitamin E. Nephrol Dial Transplant 2001; 16:2172-2175. [ Links ]
32. Buccianti G, Raselli S, Baragetti I y cols. 5-Methyltetrahydrofolate restores endothelial function in uraemic patients on convective haemodialysis. Nephrol Dial Transplant 2002; 17:857-864. [ Links ]
33. Hultberg B, Anderson A, Stener G. Plasma homocysteine in renal failure. Clin Nephrol 1993; 40:230-235. [ Links ]
34. Guldener CV, Donker AJM, Jakobs C y cols. No net renal extraction of homocysteine in fasting human. Kidney Int 1998; 54:166-169. [ Links ]
35. Perna AF, Ingrosso D, Galletti P y cols. Membrana protein damage and methylation reactions in chronic renal failure. Kidney Int 1996; 50:358-366. [ Links ]
36. Födinger M, Mannhalter C, Wölfl G y cols. Mutation (677C to T) in the methylenetetrahydrofolate reductase gene aggravates hyperhomocysteinemia in hemodialysis patients. Kidney Int 1997; 52:517-523. [ Links ]
37. Bayés B, Pastor MC, Bonal J y cols. Homocysteine, C-reactive protein, lipid peroxidation and mortality in haemodialysis patients. Nephrol Dial Transplant 2003; 18:106-112. [ Links ]
38. Dierkes J, Domröse U, Ambrosch A y cols. Response of hyperhomocysteinemia to folic acid suplementation in patients with end-stage renal disease. Clin Nephrol 1999; 51:108-115. [ Links ]
39. Hörl WH. Atherosclerosis and uremic retention solutes. Kidney Int 2004; 66:1719-1731. [ Links ]
40. Touam M, Zingraff J, Jungers P y cols. Effective correction of hyperhomocysteinemia in hemocialisis patients by intravenous folinic acid and pyridoxine therapy. Kidney Int 1999; 56:2292-2296. [ Links ]
41. Ghandour H, Bagley PJ, Shemin D y cols. Distribution of plasma folate forms in hemodialysis patients receiving high daily doses of L-folinic or folic acid. Kidney Int 2002; 62(6): 3346-9. [ Links ]
42. Palomares M, Quesada JJ, Osuna A y cols. Estudio longitudinal del Índice de Masa Corporal (IMC) en pacientes en dialysis. Nutr Hosp 2006; 21(2):155-162. [ Links ]
43. Stam F, Van Guldener C, Ter Wee PM y cols. Effect of folic acid on methionine and homocysteine metabolism in end-stage renal disease. Kidney Int 2005; 67(1):259-64. [ Links ]
44. Bayés B, Pastor MC, Bonal J, Romero R. "New" cardiovascular risk factors in patients with chronic kidney disease: role of folic acid treatment. Kidney Int Suppl 2005; (93):S39-43. [ Links ]
45. Sánchez JE, Pérez L, Hernández D y cols. Efficacy and safety of two vitamin supplement regimens on homocysteine levels in hemodialysis patients. Prospective, randomized clinical trial. Nefrología 2005; 25(3):288-96. [ Links ]
46. Cetin O, Bekpinar S, Unlucerci Y y cols. Hyperhomocysteinemia in chronic renal failure patients: relation to tissue factor and platelet aggregation. Clin Nephrol 2006; 65(2):97-102. [ Links ]
47. Alvares VD, Andrade AC, Mocelin AJ y cols. Folic acid therapy reduces plasma homocysteine levels and improves plasma antioxidant capacity in hemodialysis patients. Nutrition 2007; 23(3):242-7. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Herminia López García de la Serrana.
Departamento de Nutrición y Bromatología.
Facultad de Farmacia. Universidad de Granada.
Campus Universitario de Cartuja.
18071 Granada.
E-mail: herminia@ugr.es
Recibido: 2-IV-2007.
Aceptado: 5-XI-2007.