Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Nutrición Hospitalaria
versión On-line ISSN 1699-5198versión impresa ISSN 0212-1611
Nutr. Hosp. vol.24 no.6 Madrid nov./dic. 2009
Validez de la escala MNA como factor de riesgo nutricional en pacientes geriátricos institucionalizados con deterioro cognitivo moderado y severo
Validation of score in MNA scale like nutritional risk factor in institutionalized geriatric patients with moderate and severe cognitive impairment
F. J. Tarazona Santabalbina1, A. Belenguer Varea1, J. R. Doménech Pascual1, H. Gac Espínola2, D. Cuesta Peredo1, L. Medina Domínguez, M.a I. Salvador Pérez1 y J. A. Avellana Zaragoza.
1Servicio de Geriatría. Hospital de la Ribera. Alzira. Valencia. España.
2Servicio de Geriatría. Pontificia Universidad Católica de Chile. Chile.
Dirección para correspondencia
RESUMEN
Introducción: La valoración geriátrica integral incluye el examen del apartado nutricional debido a la alta prevalencia de desnutrición en este tipo de pacientes; especialmente en los pacientes con deterioro cognitivo asociado. Las escalas de cribado del estado nutricional presentan preguntas de autopercepción subjetiva de difícil respuesta en pacientes mayores con demencia.
Objetivo: Estudiar la especificidad, el valor predictivo positivo y la sensibilidad de la escala MNA para la detección de malnutrición en pacientes diagnosticados de enfermedad de Alzheimer con deterioro cognitivo avanzado.
Material y métodos: Se diseñó un estudio descriptivo poblacional con una muestra de 52 pacientes mayores de 70 años, institucionalizados, con enfermedad de Alzheimer grado moderado y severo. Se estudió la sensibilidad, especificidad y valor predictivo positivo de la escala MNA respecto a los parámetros de malnutrición del American Institute of Nutrition (AIN).
Resultados: Los valores de sensibilidad, especificidad y valor predictivo positivo son 60%, 94,7% y 93,8% respectivamente. Existe una correlación significativa (p < 0,001) ente la puntuación obtenida en la escala MNA y la escala de riesgo de caídas Tinneti (r = 0,577), de función Barthel (r = 0,742), de valoración cognitiva MEC (r = 0,651) y los niveles de creatinina (r = 0,402). Más del 50% de la muestra presentó al menos un parámetro de malnutrición AIN alterado.
Conclusiones: La escala MNA presenta una menor sensibilidad y especificidad en estos pacientes. El diseño de una escala de valoración nutricional sin valoraciones subjetivas y sólo con parámetros objetivos podría mejorar la eficacia de la misma en ancianos institucionalizados con deterioro cognitivo moderado y severo.
Palabras clave: Valoración nutricional. Enfermedad de Alzheimer. Institucionalización. Valoración geriátrica integral. Malnutrición.
ABSTRACT
Introduction: comprehensive geriatric assessment includes examination of the nutritional status given the high prevalence of hyponutrition in this kind of patients, particularly in patients with associated cognitive impairment. Scales for screening the nutritional status include questions on self-perception difficult to answer by demented elder patients.
Objective: To study the specificity, the positive predictive value, and the sensitivity of the MNA scale to detect malnutrition in patients diagnosed with Alzheimer's disease with advanced cognitive impairment.
Material and methods: a population-based descriptive study with a sample of 52 patients older than 70 years, institutionalized, and with moderate-severe Alzheimer's disease was designed. The sensitivity, specificity, and positive predictive value of MNA scale were studied regarding the parameters on malnutrition of the American Institute of Nutrition (AIN).
Results: the sensitivity, specificity, and positive predictive values were 60%, 94.7%, and 93.8%, respectively. There was a significant correlation (p < 0.001) between the score obtained with the MNA Scale and the Tinneti's Risk of Fall Scale (r = 0.577), the Barthel's function (r = 0.742), the MCT cognitive assessment (r = 0.651), and creatinine levels (r = 0.402). More than 50% of the sample presented at least one malnutrition parameter altered.
Conclusions: the MNA Scale presents lower sensitivity and specificity in these patients. Designing a nutritional assessment scale without subjective evaluations and only with objective parameters might improve its efficiency in institutionalized elderly patients with moderate-severe cognitive impairment.
Key words: Nutrition assessment. Alzheimer's disease. Institutionalization. Geriatric assessment. Malnutrition.
Introducción
La valoración global del paciente geriátrico incluye el examen del apartado nutricional; justificado por la alta prevalencia de desnutrición en el anciano1. En nuestro medio la malnutrición en este segmento de edad oscila entre el 15 y el 60%2,3. Una de las escalas más utilizadas para valorar el estado nutricional en este segmento poblacional es el Mini Nutritional Assessment (MNA). Los estudios de validación han demostrado su idoneidad respecto al resto de escalas en el paciente geriátrico ingresado en hospitales o instituciones4-5.
Un grupo importante de estos pacientes también asocia deterioro cognitivo en sus distintos estadios evolutivos. Esta alteración del estado cognoscitivo asocia un aumento de incidencia de problemas añadidos como las úlceras por presión o el propio riesgo de desnutrición. De hecho, algunos estudios señalan que el paciente diagnosticado de enfermedad de Alzheimer presenta un alto riesgo de malnutrición proteico-calórica6-8. El motivo, no aclarado, podría estar relacionado con un aporte dietético inadecuado, un aumento de los requerimientos energéticos o a alteraciones metabólicas asociadas9.
El proceso fisiopatológico que desencadena la malnutrición es multifactorial, progresivo, y se refleja en las medidas antropométricas y en las determinaciones analíticas10. Estos parámetros analizados de forma aislada se caracterizan por una baja especificidad11, pudiendo ser influenciados por múltiples situaciones12. De hecho, una pérdida del 4% del peso en un año es factor independiente de morbilidad y mortalidad13.
La malnutrición en el paciente geriátrico se asocia a un deterioro de la actividad y de la condición física general14 y se relaciona con una mayor prevalencia de infecciones15-16, retraso en la cicatrización de heridas y úlceras por presión17, una disminución del rendimiento intelectual18, una reducción del apetito19,20, mayor estancia hospitalaria21,22 y un aumento de la mortalidad23-24. Así, la desnutrición afecta tanto a la esperanza de vida como a la calidad de la misma25-26; correlacionándose, además, con la morbilidad asociada, a pesar de que el riesgo de malnutrición es mayor que la actual prevalencia de desnutrición en pacientes geriátricos27.
La escala MNA ha sido específicamente desarrollada para evaluar el riesgo de malnutrición en el anciano frágil, favoreciendo el desarrollo de intervenciones rápidas que beneficien el estado nutricional y que reduzcan las consecuencias de un mal aporte calórico-proteico4. La versión original consta de 18 preguntas, divididas en cuatro áreas nutricionales, incluyendo medidas antropométricas (Índice de masa corporal (IMC), circunferencia braquial, circunferencia del muslo y pérdida de peso), una valoración global (seis cuestiones relacionadas con el estilo de vida la medicación y el estado físico y mental), una valoración dietética (seis cuestiones relacionadas con el aporte dietético diario, problemas de ingesta y una valoración subjetiva), una cuestión sobre auto-percepción de la suficiencia de la ingesta y una sobre autovaloración de su estado de salud. La puntuación máxima es de 30 puntos. Una puntuación inferior a 17 puntos se relaciona con malnutrición, un contaje entre 17 y 23,5 puntos indica un riesgo potencial de malnutrición y una puntuación de 24 puntos o superior se relaciona con un estado nutricional satisfactorio. El valor predictivo positivo del MNA es de 80,3%, la sensibilidad del 98% y la especificidad del 25%28.
La puntuación en la escala MNA ha sido descrita como factor predictivo de estancia hospitalaria, costes sanitarios y mortalidad29. La escala incluye preguntas de autopercepción difíciles de aplicar a pacientes con demencia en estadios avanzados. Así, nuestro objetivo, al diseñar este trabajo, ha sido estudiar la especificidad, el valor predictivo positivo y la sensibilidad de la escala MNA para el diagnóstico de malnutrición en pacientes diagnosticados de enfermedad de Alzheimer con deterioro cognitivo moderado y severo.
Material y métodos
Para la realización de este artículo, diseñamos un estudio descriptivo transversal en el que se evaluó a los pacientes ingresados en una institución geriátrica (Residencia Jaume II de Tavernes de la Valldigna, Valéncia, España). Se utilizó como único criterio de inclusión el diagnóstico probable de enfermedad de Alzheimer, según criterios de la clasificación DSMIV30 y NINCDS-ADRDA31, en una situación evolutiva comprendida en los niveles 5, 6 ó 7 de la escala GDS (Global Deterioration Scale)32. Fueron excluidos los pacientes que no cumplieron dicho criterio. Se obtuvo una muestra de 56 pacientes (57,73%) sobre el total de 97 pacientes geriátricos ingresados en la institución en el momento de la realización del estudio. Se produjo la pérdida de 4 pacientes que cumplían los criterios de selección (1 por fallecimiento, 1 por ingreso hospitalario durante el desarrollo del estudio que impidió la cumplimentación y 2 por abandonar la institución al finalizar sus estancias temporales antes de la conclusión del estudio y no poder acceder a la información necesaria para completar todas las variables). Así, la muestra final del estudio fue de 52 pacientes. A los pacientes incluidos se les realizó una entrevista programada y una exploración física, circunscritas dentro del programa de seguimiento semestral de la institución y que nos permitió recoger una serie de variables demográficas, físicas y analíticas.
Variables sociodemográficas: Sexo, edad, diagnóstico previo de hipertensión arterial, dislipemia, diabetes, patología oncológica, accidentes cerebro-vasculares, cardiopatía isquémica, insuficiencia cardíaca o insuficiencia renal. Variables funcionales y cognitivas: Puntuación escala MNA, escala funcional de Barthel, la cual mide la independencia en las actividades básicas de la vida diaria (ABVD), los pacientes fueron divididos en 6 grupos según la puntuación 1.- Dependencia (D) total: si la puntuación es inferior a 20 puntos. 2.- D. grave: si oscila entre 20 y 39 puntos. 3.- D. moderada: cuando la puntación fluctúa entre 40 y 59. 4.- D. leve: si la puntuación es varía entre 60 y 79. 5.- D. muy leve: si el rango de puntuación se localiza entre 80 y 89 puntos y 6.- Independencia cuando las puntuaciones son superiores a 90 puntos. Índice de Katz, Miniexamen Cognoscitivo o MEC de Lobo.
Desde un punto de vista estadístico, la escala MNA fue utilizada como variable cuantitativa (puntuación directa) y como cualitativa (estratificada en MNA1, MNA2, MNA3 según la ausencia de malnutrición, la presencia de riesgo, o la detección de malnutrición). La escala de Tinnetti cuya puntuación es indicador del riesgo de caídas, fue incorporada para conocer el nivel de movilidad de los pacientes estudiados.
Variables antropométricas: IMC, peso, circunferencia braquial, presencia de úlceras por presión. Variables analíticas: Colesterol total, proteínas totales, albúmina sérica, glucosa, urea, creatinina, linfocitos totales, transferrina, e índice de saturación de transferrina.
El término malnutrición fue descritos según los criterios del American Institute of Nutrition (AIN), que considera la presencia de cifras anormales en uno de los siguientes cuatro parámetros (IMC, circunferencia braquial, niveles de albúmina y niveles de colesterol) como indicador de afectación del estado nutricional. No obstante, dado que otros indicadores antropométricos y analíticos están relacionados con la desnutrición calórico-proteica, se realizó un segundo cálculo añadiendo a los criterios del AIN los siguientes: cifra de linfocitos, determinación en sangre de transferrina y creatinina.
El criterio para considerar anormal los valores en cada uno de los parámetros estudiados fue: IMC ≤ 20; Circunferencia braquial ≤ 21 cm; albúmina ≤ 3,5 g/dl; colesterol ≤ 150 mg/dl; creatinina ≤ 0,7 mg/dl; transferrina ≤ 200 mg/dl; linfocitos ≤ 1·103 /uL y creatinina ≤ 0,7 mg/dl.
Siguiendo los criterios del AIN, el cálculo de los índices estadísticos señalados se determinó comparando los resultados de los pacientes en la escala MNA respecto a la presencia o ausencia de un único parámetro alterado entre los cuatro señalados con anterioridad.
Se realizó un análisis descriptivo de las variables sociodemográficas, funcionales, cognitivas, antropométricas y analíticas. Para la comparación de medias se utilizó la prueba de la t de Student, la relación entre variables categóricas se valoró mediante la técnica de Chi-cuadrado y la relación entre variables cuantitativas mediante el coeficiente de correlación de Pearson, siempre y cuando se cumplieran las respectivas condiciones de aplicación de cada prueba. En todas las pruebas realizadas se consideró estadísticamente significativos los valores de p inferiores a 0,05. El análisis estadístico fue realizado mediante el programa de software SPSS para Windows versión 15.0.
Resultados
La media de edad de los sujetos incluidos en el estudio fue de 84,46 ± 7,09 años siendo un 20,4% varones y un 79,6% mujeres. De los 52 pacientes estudiados, 41 (78,84%) habían sido diagnosticado de hipertensión arterial, 21 (40,38%) de Diabetes mellitus, 11 (21,15%) de hiperlipemia, 22 (42,31%) habían padecido un accidente cerebrovascular previo, 19 (36,54%) presentaba diagnóstico de insuficiencia cardiaca siguiendo los criterios de Framingham, 5 (9,61%) había sido diagnosticado de cardiopatía isquémica y 2 pacientes (3,85%) habían sido diagnosticados de insuficiencia renal y otros 2 presentaban un proceso oncológico.
La tabla I muestra los principales datos socio-demográficos, antropométricos y bioquímicos. Los pacientes desnutridos y en riesgo de desnutrición presentan respecto de aquellos sin desnutrición, de forma estadísticamente significativa, mayor deterioro funcional (Barthel 20,83 ± 25,34, 50,46 ± 27,83 y 84,22 ± 12,47 respectivamente), mayor riesgo de caídas (Tinetti 10,29 ± 9,95, 18,4 ± 10,34 y 24,67 ± 3,97 respectivamente), peor situación cognitiva (MEC 5,61 ± 5,37, 11,12 ± 4,71 y 17,44 ± 3,4 repectivamente), un peso menor (51,84 ± 7,72, 62,52 ± 12,03 y 81,07 ± 13,34 kg respectivamente), un IMC más bajo (22,26 ± 3,54, 27,69 ± 5,14 y 34,76 ± 7,44 kg/m2 respectivamente) y niveles de creatinina plasmática más bajos (0,78 ± 0,21, 0,87 ± 0,2 y 1,13 ± 0,4 mg/dl respectivamente). La media de fármacos prescritos por paciente fue de 7,13 ± 2,85 (rango 2-15). La tabla II muestra la estratificación de la capacidad funcional medida por la puntuación en la escala de Barthel. Destaca la homogeneidad en la edad, la prevalencia de hipertensión arterial, hiperlipemias y diabetes mellitus. De hecho, del total de la muestra 5 pacientes (9,61%) presentaban cifras de colesterol inferiores al rango normal; en el mismo número de pacientes, 5, se halló linfopenia; en 10 (19,23%) se objetivó anemia; en 8 (15,38%) los niveles de hierro sérico eran compatibles con ferropenia; en 6 (11,53%) los niveles de ácido fólico eran inferiores a los óptimos; 12 (23,07%) presentaban niveles de albúmina sérica inferiores al rango normal; y en 15 (28,84%) se comprobó que las cifras de creatinina eran inferiores a la normalidad.
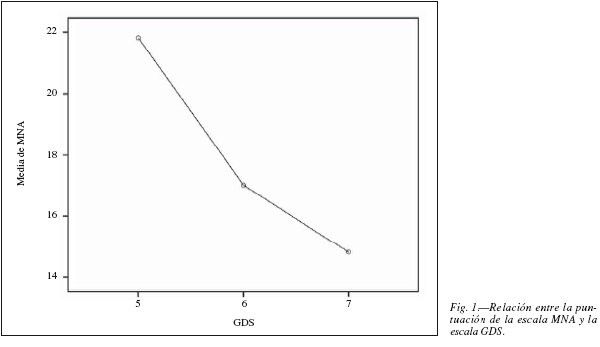
Como se puede observar en la misma tabla I y también en la figura 1, a mayor grado de deterioro cognitivo mayor porcentaje de pacientes con puntuaciones inferiores en la escala MNA. Sin embargo, parte de este puntaje se ve interferido por la ausencia de respuesta en el subgrupo de preguntas de percepción subjetiva de su estado de salud y nutricional. La figura 1 muestra la correlación directa entre la puntuación entre las escalas de estado de nutrición (MNA) y el estado cognitivo (escala GDS), en la leyenda se especifica el número de pacientes con nutrición normal, riesgo de malnutrición y malnutrición para cada categoría del GDS. Se puede observar que los pacientes con GDS 7 presentan casi en su totalidad malnutrición, y que el grupo de individuos estudiados con GDS 5 presenta casi en su totalidad criterios de nutrición normales. Dicha relación es estadísticamente significativa (p < 0,001). La figura 2 muestra la correlación entre la puntuación en la escala MNA y la situación funcional (escala de Barthel), enfatizando la vinculación entre estado nutricional y deterioro cognitivo y funcional.
Se realizó un análisis mediante la prueba estadística del coeficiente de correlación de Pearson entre la puntuación de la escala MNA respecto al IMC, peso, edad, MEC, albúmina, linfocitos, Índice de saturación de transferrina (IST), colesterol, número de fármacos, circunferencia braquial, úlceras por presión (UPP), caídas, y puntuación escalas funcionales de Barthel y Katz y la de movilidad de Tinetti con los resultados que muestra la tabla III. Se objetivó una correlación estadísticamente significativa entre la puntuación en la escala MNA y las siguientes variables; el peso, el IMC, la creatinina, el índice de Katz, el índice de Barthel y la escala de Tinetti. Consideramos de mayor relevancia, por no estar directa o indirectamente incluidas en la escala MNA y por tener un coeficiente mayor de 0,5, a las correlaciones positivas que muestra con la puntuación en la escala de Tinettti, de Barthel y el MEC (0,577, 0,742 y 0,651 respectivamente), y la correlación negativa con el índice de Katz (-0,759).
Para valorar la sensibilidad y especificidad de la escala MNA en este grupo de pacientes, se realizó un cálculo comparativo respecto a los criterios del AIN tal como se detalló en el apartado de Material y Métodos. La tabla IV muestra los valores diagnósticos de la escala MNA comparada con los criterios del AIN, donde la sensibilidad es de un 60%, la especificidad de 94,7%, hay un 5,3% de falsos positivos, un 40% de falsos negativos, el valor predictivo positivo es del 93,8% y el valor predictivo negativo de un 64,3%. El porcentajede pacientes clasificados correctamente, eficiencia de la prueba, es del 75%.
El valor hallado en nuestra muestra para la sensibilidad es inferior al 98% descrito sobre una muestra de 486 pacientes geriátricos, con una media de edad 82,2 ± 8,31, similar a la de nuestro grupo de estudio, y que cumplían criterios de fragilidad38. El cálculo del parámetro estadístico likelihood ratio para un resultado positivo, permite al grupo encabezado por Arellano46 describir una likelihood ratio de 2,79 para el quartil de puntuación más baja en la escala MNA (aquélla que es inferior a 13,5 puntos), sin embargo en el resto de quartiles la likelihood ratio es de 0,47, 1 y 0,07 respectivamente en pacientes con deterioro cognitivo, situando el punto de corte para el diagnóstico del deterioro en una puntuación inferior a 23 puntos en el MEC. En nuestro estudio es de 11,4, siguiendo el criterio del AIN expresado con anterioridad.
Discusión
En nuestro estudio la escala MNA detectó una prevalencia de pacientes desnutridos del 35,41% (17 sujetos), mientras que un 45,83% (22 sujetos) se encontraba en situación de riesgo de desnutrición. Estos resultados son similares a los descritos en un estudio realizado en pacientes geriátricos incluidos en un programa de atención domiciliaria3 y se encuentran dentro del rango entre el 5 y el 60% que muestran otros trabajos elaborados con pacientes geriátricos ingresados en institución2,3. Consideramos aceptables los resultados obtenidos, teniendo en cuenta que nuestros pacientes presentan como criterio de inclusión el diagnóstico de deterioro cognitivo moderado-severo o severo, y en diversos estudios se ha encontrado un mayor riesgo de malnutrición calórico-proteica en este grupo de enfermos6-9. Así, los resultados podrían explicarse porque las medidas nutricionales adoptadas (alimentación triturada específica para los pacientes con disfagia y problemas de deglución, suplementos proteicos para los pacientes con disminución de la ingesta, fraccionamiento de la ingesta en 5-6 tomas, coloración vistosa de las preparaciones trituradas mediante el empleo de vegetales, entre otras medidas) han permitido mantener la prevalencia de malnutrición en este grupo de población dentro del rango de valores descritos en otros estudios realizados sobre población geriátrica general.
Otro punto a reseñar es la diferencia estadísticamente significativa entre los tres subgrupos de MNA y el nivel funcional, cognitivo y la movilidad, calculados mediante la escala de Barthel, el MEC y la escala de Tinetti respectivamente. Así, a mayor grado de dependencia mayor es la prevalencia de problemas nutricionales, estando relacionados ambos factores con el estado cognitivo. Este hecho se objetiva en el porcentaje de pacientes en estadio GDS 7, el cual es mayor en el grupo con problemas nutricionales que en el grupo que tuvo un estado nutricional adecuado.
Los resultados muestran que la sensibilidad de la escala MNA es baja, situación ya descrita en otros estudios realizados con pacientes frágiles y con deterioro cognitivo33. La posible explicación de este resultado puede radicar en la presencia de preguntas subjetivas en el MNA, las cuales resulta difícil cuando no imposible que un paciente en esta situación cognitiva responda de forma adecuada. De hecho, siguiendo el orden de la escala MNA incluida en el anexo, las preguntas a, b, d, o y p requieren la participación expresa del paciente, pues se solicita un examen de la autopercepción respecto a su estado nutricional; si bien es cierto, que la pregunta b puede ser contestada objetivamente mediante el control periódico del peso. No obstante, la falta de colaboración de los pacientes con deterioro cognitivo severo, sus problemas de movilidad, la frecuente postura en flexo de sus miembros inferiores dificultan el cálculo exacto del peso y el empleo de fórmulas de cálculo indirecto del mismo. Estas cuestiones se puntúan con un máximo de 2, 3, 2, 2 y 2 puntos respectivamente y suponen el 36,67% de la puntuación de la escala. Un porcentaje muy elevado teniendo en cuenta las características de este subgrupo de pacientes. Las respuestasj, k, l, y m hacen referencia a los hábitos nutricionales del paciente y la puntuación máxima es 2, 1, 1 y 1 puntos respectivamente, y estos hábitos no siempre son fáciles de precisar pues en las instituciones geriátricas los turnos de trabajo del personal auxiliar dificultan la correcta supervisión de este apartado, al mismo tiempo la valoración del estado nutricional en un ingreso hospitalario o en una consulta externa depende en gran medida del conocimiento del acompañante, el cual no es siempre el cuidador principal. Además, el nivel cognitivo de estos pacientes invalida sus respectivas respuestas en la mayor parte de los casos.
Estas dificultades ya han sido señaladas en otros estudios que resaltan el alto porcentaje de pacientes diagnosticados de demencia que presentan malnutrición proteico-calórica6,7. Resultados similares a los que presentamos en este estudio, donde del total de 52 pacientes que cumplieron el criterio de inclusión, 39 fueron clasificados como riesgo de desnutrición o como pacientes malnutridos mediante la escala MNA. En 20 (38,46%) de los casos, la malnutrición calórico-proteica fue corroborada mediante el criterio validado por el AIN. De hecho, Faxén-Irving7 señala que un 20% de los pacientes institucionalizados con deterioro cognitivo presentan un valor de IMC inferior o igual a 20. En nuestro estudio son 6 los pacientes con esta cifra, lo que representa el 11,53% de la muestra. En el mismo estudio de Faxén- Irving7, se especifica la presencia de un IMC igual o inferior a 23 como determinante de riesgo de malnutrición, siendo la prevalencia del 50% de la muestra estudiada. En nuestro caso, fueron 13 los pacientes con estos valores de IMC lo que correspondía a una prevalencia del 25%, cifras inferiores a este estudio y a otro realizado con pacientes con deterioro cognitivo34. La menor prevalencia en nuestra muestra, como comentamos con anterioridad, puede ser debida a la aplicación específica de medidas encaminadas a reducir los problemas nutricionales en nuestro medio.
Sin embargo, es preocupante que la mitad de estos pacientes fueron falsamente catalogados mediante la escala MNA como pacientes con problemas de nutrición, lo que cuestiona la eficiencia de la escala estudiada como técnica de cribado en los pacientes con deterioro cognitivo moderado-severo y severo.
Existe una versión reducida de la escala MNA conocida como MNA-SF35, sin embargo la inclusión de cuestiones relativas a la autopercepción de su estado de salud perpetúa el problema descrito con la escala completa. Además, teniendo en cuenta la complejidad de la Valoración Geriátrica Integral en estos pacientes, quizá sería conveniente generar una escala específica de valoración nutricional calórico-proteica en la que cobren mayor importancia los valores antropométricos y analíticos y se reduzca considerablemente el componente subjetivo de la escala.
Conclusiones
Los pacientes con deterioro cognitivo presentan una alta prevalencia de malnutrición calórico-proteica.
La escala MNA presenta una baja sensibilidad en pacientes con deterioro cognitivo moderado-severo y severo.
En nuestra muestra, el porcentaje de pacientes con deterioro cognitivo moderado-severo y severo con al menos un parámetro analítico o antropométrico alterado sobrepasa el 50%.
El diseño de una escala específica de valoración nutricional para pacientes con deterioro cognitivo moderado y severo que prescindiera de valoraciones subjetivas relacionadas con la autopercepción podría incrementar la sensibilidad y especificidad de la misma, reduciendo considerablemente las dificultades de administración y las necesidades de tiempo para su cumplimentación.
Referencias
1. Rauscher C. Malnutrition among the elderly. Can Fam Physician 1993; 39: 1395-403. [ Links ]
2. Hernández A, Royo R, Martínez ML, Grana J, López A, Morales M. Malnutrition prevalence in institucionalized elderly people in Valencian Community, Spain. Med Clin (Barc) 2001; 17: 289-94. [ Links ]
3. Ricart Casas J, Pinyol Martínez M, de Pedro Elvira B, Devant Altimir M, Benavides Ruiz, A. Desnutrición en pacientes en atención domiciliaria. Aten Primaria 2004; 34 (5): 238-43. [ Links ]
4. Guigoz Y, Vellas B, Garry PJ. Mini Nutritional Assessment: a practical assessment tool fro grading the nutritional state of elderly patients. Facts Res Gerontol 1994; 2: 15-59. [ Links ]
5. Beck AM, Ovensen L, Osler M. The "Mini Nutritional Assessment" and the "Determine Your Nutritional Health" Checklist (NSI Checklist) as predictors of morbidity and mortality in an elderly Danish population. Br J Nutrition 1999; 81: 31-6. [ Links ]
6. Cronin-Stubbs J, Beckett LA, Scherr PA, Field TS, Chown MJ, Pilgrim DM, Bennet DA, Evans DA. Weight loss in people with Alzheimer's disease: a prospective population based analysis. Br Med J 1997; 314: 178. [ Links ]
7. Faxén-Irving G, Andrén-Olsson B, af Geijerstam A, Basun H, Cederholm T. The effect of nutritional intervention in elderly subjects residing in group-living for the demented. Eur J Clin Nutrition 2002; 56: 221-227. [ Links ]
8. Wallace JI, Schwartz RS, LaCroix AZ, Uhlmann RF, Pearlman RA. Involuntary weight loss in older outpatients: incidence and clinical significance. J Am Geriatr Soc 1995; 43: 329-37. [ Links ]
9. Poehlman ET, Toth MJ, Goran MI, Carpenter WH, Newhouse P, Rosen CJ. Aily energy expenditure in free-living non-institucionalized Alzheimer's disease patients: a doubly labeled water study. Neurology 1997; 48: 997-1002. [ Links ]
10. Vellas B, Guigoz Y, Garry PJ, Nourhashemi F, Bennahum D, Lauque S, Albarede J-L. The mini nutritional assessment (MNA) and its use in grading the nutritional state of elderly patients. Nutrition 1999; 15: 116-122. [ Links ]
11. Charney P. Nutritional assessment in the 1990s: where are we now? Nutr Clin Pract 1995; 10: 131-139. [ Links ]
12. De Onis M, Habicht JP. Anthropometric reference data for international use: recommendations from a World Health Organization expert committee. Am J Clin Nutr 1996; 64: 650-658. [ Links ]
13. Guyonnet S, Nourhashemi F, Andrieu S. A prospective study in the nutritional status of Alzheimer's patients. Arch Gerontol Geriat 1998; 255-62. [ Links ]
14. Unosson M, Ek A-C, Bjurulf P, Larsson J. Demographical, sociomedical and physical characteristics in relation to malnutrition in geriatric patients. J Adv Nurs 1991; 16: 1406-1412. [ Links ]
15. Michael JP, Lesourd B, Conne P. Prevalence of infections and their risk factors in geriatric institutions: a one-day multicentre survey. WHO Bull 1991; 69: 35-41. [ Links ]
16. Paillaud E, Herbaud S, Caillet P, Lejonc JL, Campillo B, Bories PN: Relations between undernutrition and nosocomial infections in elderly patients. Age Ageing 2005; 34 (6): 619-625. [ Links ]
17. Ek A-C, Unosson M, Larsson J, von Schenck H, Bjurulf P. The development of and healing of pressure sores related to the nutritional state. Clin Nutr 1991; 10: 245-250. [ Links ]
18. Berlinger WG, Potter JF. Low body mass index in demented outpatients. J Am Geriat Soc 1991; 39: 973-978. [ Links ]
19. Poulsen I, Rahm Hallberg I, Schroll M: Nutritional status and associated factors on geriatric admission. J Nutr Health Aging 2006; 10 (2): 84-90. [ Links ]
20. Castel H, Shahar D, Harman-Boehm I: Gender differences in factors associated with nutritional status of older medical patients. J Am Coll Nutr 2006; 25 (2): 128-134. [ Links ]
21. Edington J, Boorman J, Durrant ER, Perkins A, Giffin CV, James R, Thomson JM, Oldroyd JC, Smith JC, Torrance AD, Blackshaw V, Green S, Hill CJ, Berry C, McKenzie C, Vicca N, Ward JE, Coles SJ. Prevalence of malnutrition on admission to four hospitals in England. The Malnutrition Prevalence Group. Clin Nutr 2000; 19 (3): 191-195. [ Links ]
22. Planas M, Audivert S, Perez-Portabella C, Burgos R, Puiggros C, Casanelles JM, Rossello J. Nutritional status among adult patients admitted to an university affiliated hospital in Spain at the time of genoma. Clin Nutr 2004; 23 (5): 1016-1024. [ Links ]
23. Payette H, Coulombe C, Boutier V, Gray-Donald K. Weight loss and mortality among free-living frail elders: a prospective study. J Gerontol A Biol Sci Med Sci 1999; 54 (9): M440-445; [ Links ]
Bo M, Massaia M, Raspo S, Bosco F, Cena M, Molaschi M, Fabris F: Predictive factors of in-hospital mortality in older patients admitted to a medical intensive care unit. J Am Geriatr Soc 2003; 51: 529-533. [ Links ]
24. Persson MD, Brismar KE, Katzarski KS, Nordenstrom J, Cederholm TE. Nutritional status using Mini Nutritional Assessment and Subjective Global Assessment predict mortality in geriatric patients. J Am Geriatr Soc 2002; 50: 1996-2002. [ Links ]
25. Amarantos E, Martínez A, Dwyer J. Nutrition and quality of life in older adults. J Gerontol A Biol Sci Med Sci 2001; 56 (2): 54-64. [ Links ]
26. Giner M, Laviano A, Meguid MM, Gleason JR. In 1995 a correlation between malnutrition and poor outcome in critically ill patients still exists. Nutrition 1996; 12 (1): 23-39. [ Links ]
27. Kagansky N, Berner Y, Koren-Morag N, Perelman L, Knobler H, Levy S. Poor nutritional habits are predictors of poor outcome in very old hospitalized patients. Am J Clin Nutr 2005; 82 (4): 784-91. [ Links ]
28. Vellas B, Villars H, Abellan G, Soto ME, Rolland Y, Guigoz Y, Morley JE, Chumlea W, Salva A, Rubenstein LZ, Garry P. Overview of the MNA -Its history and challenges. J Nutr Health Aging 2006; 10 (6): 456-63. [ Links ]
29. Comban B, Di Castri A, Plaze JM & Arnaud-Battandier F. Epidemiological study of malnutrition in elderly patients in acute, sub-acute and long-term care using the MNA1. J Nutr Health Aging 1999; 3: 146-151. [ Links ]
30. American Psychiatric Association. Diagnostic and statistical manual of mental disorders. 4th edition (DSM IV) Washington (DC): APA; 1997. [ Links ]
31. McKhann G, Drachman D, Folstein M, Katzman R, Price D, Stadlan EM. Clinical diagnosis of Alzheimer's disease: report of the NINCDS-ADRDA Work Group under the auspices of Department of Health and Human Services Task Force on Alzheimer's Disease. Neurology 1984; 34 (7): 939-44. [ Links ]
32. Reisberg B, Ferris SH, De León MJ, Crook T. The Global Deterioration Scale for assessment of primary degenerative dementia. Am J Psychiatry 1982; 139 (9): 1136-1139. [ Links ]
33. Arellano M, García-Caselles MP, Pi-Figueras M, Miralles R, Torres RM, Aguilera A, Cervera AM. Clinical impact of different scores of the mini nutritional assessment (MNA) in the diagnosis of malnutrition in patients with cognitive impairment. Arch Gerontol Geriatr Suppl 2004; (9): 27-31. [ Links ]
34. Carver AD & Dobson AM. Effects of dietary supplementation of elderly demented hospital residents. J Hum Nutr Diet 1995; 8: 389-394. [ Links ]
35. Rubenstein LZ, Harker JO, Salva A, Guigoz Y, Vellas B. Screening for undernutrition in geriatric practice: developing the shortform mininutritional assessment (MNA-SF). J Gerontol A Biol Sci Med Sci 2001; 56 (6): M366-372. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Francisco José Tarazona Santabalbina.
Doctor en Medicina. Especialista en Geriatría.
Hospital de la Ribera.
Ctra. de Corbera, s/n.
46600 Alzira, Valencia.
E-mail: fjtarazona@hospital-ribera.com
Recibido: 3-VII-2009.
Aceptado: 26-VIII-2009.