Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Nutrición Hospitalaria
versión On-line ISSN 1699-5198versión impresa ISSN 0212-1611
Nutr. Hosp. vol.25 no.6 Madrid nov./dic. 2010
Prevención del Síndrome de Realimentación
Prevention of the refeeding syndrome
Ma E. Martínez Núñez, B. Hernández Muniesa
Servicio de Farmacia. Hospital Universitario de Getafe. Madrid. España.
Dirección para correspondencia
RESUMEN
El Síndrome de Realimentación puede definirse como el conjunto de alteraciones metabólicas desencadenadas tras la rápida reintroducción del soporte nutricional (oral, enteral o parenteral) en pacientes con malnutrición calórico-proteica. Es un cuadro clínico normalmente infradiagnosticado en el entorno médico no especializado en nutrición, pero potencialmente grave. La principal herramienta para su prevención radica en la correcta identificación de los pacientes en riesgo de desarrollar SR, previa a la instauración del soporte nutricional. El presente caso describe las estrategias a seguir en la práctica clínica para la prevención del SR e instauración del soporte nutricional en un paciente en riesgo de desarrollar este síndrome.
Palabras clave: Síndrome de realimentación. Ayuno. Hipofosfatemia. Prevención.
ABSTRACT
The refeeding syndrome can be defined as the metabolic alterations developed by the rapid nutrition repletion (oral, enteral as well as parenteral feeding) of severaly malnourished patients. Refeeding syndrome is a potentially fatal clinical condition and it is often underdiagnosed on non-specialized nutrition units. The most important key for its prevention is to identify patients at high risk for developing refeeding syndrome, before nutrition repletion. The present case describes the steps to prevent the refeeding syndrome as well as the clinical recommendations to restart nutrition support.
Key words: Refeeding syndrome. Fasting. Hypophosphatemia. Prevention.
Introducción
El Síndrome de Realimentación (SR) puede definirse como el conjunto de alteraciones metabólicas desencadenadas tras la rápida reintroducción del soporte nutricional (oral, enteral o parenteral) en pacientes con malnutrición calórico-proteica1-3. Su principal signo es la hipofosfatemia severa y las complicaciones asociadas3-5. No obstante, se trata de un cuadro clínico complejo, en el que se producen alteraciones en el balance de fluidos, trastornos electrolíticos tales como la hipopotasemia e hipomagnesemia, anomalías en el metabolismo hidrocarbonado, proteico y lipídico, así como déficits vitamínicos, fundamentalmente de tiamina1-5.
El presente caso describe la importancia de la prevención y las principales estrategias para conseguirlo, como son la identificación precoz de la población con alto riesgo de sufrir SR así como la instauración paulatina y progresiva del soporte nutricional.
Caso clínico
Varón de 77 años que acude a urgencias del hospital por vómitos de una semana de evolución asociados a ausencia de deposición, con dolor en la región inguinal derecha de tres días de duración. No presenta deterioro cognitivo pero sí un grave deterioro social. Refiere que desde hace un año sólo ingiere líquidos con una pérdida de 15kg de peso durante este periodo (peso habitual aproximado de 70kg; peso actual al ingreso de 55kg). No sale de casa desde hace quince días con vida cama-sillón, vive con su mujer invidente de 87 años de edad y presenta escasa higiene corporal.
El paciente presenta como antecedentes personales epitelioma basocelular terebrante supranasal no intervenido y ulcus gástrico tratado con cimetidina anteriormente.
En la exploración física al ingreso se objetivan signos de hipoperfusión periférica, caquexia severa y hernia inguinoescrotal derecha irreductible, con probable contenido intestinal y abdomen distendido doloroso a la palpación. Se diagnostica obstrucción intestinal secundaria a hernia inguinal incarcerada por lo que se decide intervenir quirúrgicamente, realizándose resección del segmento intestinal isquémico y perforado con anastomosis latero-lateral y herniorrafia.
Durante la intervención quirúrgica se observa peritonitis difusa e inestabilidad hemodinámica. Ante la presencia de signos de shock y disminución del nivel de conciencia a pesar de estar sin sedación, el paciente ingresa a cargo de la Unidad de Cuidados Intensivos (UCI).
Se comienza tratamiento antibiótico con imipenem presentando una evolución favorable durante los primeros cuatro días, hasta comienzo de aumento progresivo de signos de infección e inflamación (leucocitosis de 38.320 leucocitos/mm3 y PCR de 273 mg/L) sugestivos de sepsis abdominal, con inestabilidad hemodinámica, fracaso renal agudo (estado edematoso, anuria y creatinina sérica de hasta 3,35 mg/dL), anemización brusca (niveles de hemoglobina de 6,2 g/dL y hematocrito de 18,5%), y salida de contenido biliar por los drenajes. Ante tales hallazgos se procede a una nueva intervención quirúrgica.
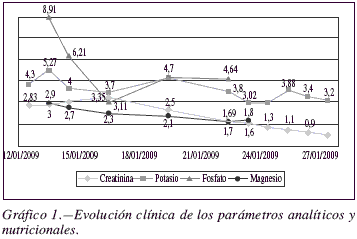
Desde el punto de vista nutricional el paciente presenta una desnutrición calórico-proteica grave, con hipoalbuminemia e hipoproteinemia severas (albúmina 1.4 g/dL y proteina 3.7 g/dL), decidiéndose comenzar, tras estabilización hemodinámica, soporte nutricional por vía iv desde el segundo día de ingreso en la unidad. Inicialmente se prescribe nutrición parenteral total (NPT) con un aporte de macronutrientes correspondiente a un paciente de 70kg con estrés metabólico severo. Desde el Servicio de Farmacia se identifica al enfermo como un paciente con alto riesgo de sufrir SR, dado su estado caquéctico y los antecedentes personales previamente descritos (pérdida > 20% del peso corporal en un año, graves problemas psicosociales y depresión en el anciano). Ante la complejidad añadida del fracaso renal agudo del paciente y el alto riesgo de SR se recomienda un comienzo progresivo del soporte nutricional adaptando el aporte de macronutrientes al peso real y no ideal del paciente. Atendiendo a las recomendaciones de las principales guías clínicas para la prevención del SR6, se recomienda la administración profiláctica de tiamina, y se inicia nutrición parenteral con un aporte calórico de aproximadamente 15 kcal/kg de peso actual (distribución calórica de 39% carbohidratos, 39% lípidos y 22% proteínas), un volumen total de aproximadamente 1500 mL y un seguimiento estrecho de los parámetros nutricionales y analíticos (fundamentalmente iones intracelulares). Se restringe durante los primeros días el aporte de fosfato, potasio y magnesio, debido a la hiperfosfatemia (fosfato 8.91 mg/dL), hiperpotasemia (potasio 5.27 mEq/L) e hipermagnesemia (magnesio 3 mg/dL) desencadenadas por el fracaso renal agudo. En los días consecutivos se incrementa lentamente el aporte calórico-proteico, teniendo especial precaución con el aporte de nitrógeno durante la primera semana debido al fallo renal del paciente. A partir del décimo día se cubren finalmente los requerimientos nutricionales del paciente. El aporte energético es de 30 kcal/kg (distribución calórica de 48% carbohidratos, 30% lípidos y 22% proteínas), con un aporte protéico de 1,6g/kg, adaptándose a la situación metabólica del enfermo.
Durante los primeros días los parámetros analíticos y nutricionales evolucionan favorablemente de forma paralela a la mejoría de la función renal, hasta la aparición de sepsis abdominal y todas las complicaciones descritas anteriormente (gráfico 1).
Dada la edad del paciente, la enfermedad actual y el mal pronóstico de las complicaciones desarrolladas se decide en sesión conjunta la limitación del esfuerzo terapéutico, falleciendo al 17o día de ingreso.
Discusión
El SR es un cuadro clínico normalmente infradiagnosticado en el entorno médico no especializado en nutrición pero potencialmente grave2,7,8.
La verdadera incidencia del SR no está claramente determinada, fundamentalmente debido a la heterogeneidad de los criterios seleccionados para su definición en los distintos estudios realizados1,3. Diversos estudios de cohortes realizados en pacientes con hiperalimentación ingresados en UCI han documentado la incidencia de SR5,9. En un estudio de cohortes de 62 pacientes ingresados en UCI en dieta absoluta durante al menos 48 horas, el 34% experimentó SR en forma de hipofosfatemia severa (concentración plasmática de fósforo < 0,32 mmol/L)10.
La base fisiopatológica del SR se sustenta en la respuesta metabólica y hormonal desencadenada durante el ayuno prolongado. La cetoadaptación permite que determinados órganos vitales, como el cerebro, utilicen los cuerpos cetónicos como principal sustrato energético1, ralentizando el catabolismo proteico con el fin de preservar la masa muscular1,4,5.
En este escenario metabólico, si se reintroduce de forma brusca la alimentación, especialmente basada en hidratos de carbono, se produce una rápida liberación de insulina. La insulina, hormona anabólica por excelencia, desencadena la entrada masiva de fosfato, potasio y magnesio al espacio intracelular, posee un importante efecto antinatriurético e incrementa los requerimientos de tiamina11,12.
Las manifestaciones clínicas del SR se derivan de las alteraciones hidroelectrolíticas y déficits vitamínicos previamente descritos. Estas alteraciones pueden producir complicaciones cardiovasculares (insuficiencia cardíaca, arritmias, cambios electrocardiográficos, muerte súbita), hematológicas (anemia hemolítica, aumento de la afinidad de la hemoglobina por el oxígeno, trombocitopenia), pulmonares (edema pulmonar, insuficiencia respiratoria), neuromusculares (rabdomiólisis, debilidad muscular, necrosis muscular) y nerviosas (parestesias, desorientación, vértigo, coma, encefalopatía de Wernicke, síndrome de Korsakoff, neuritis periférica)2-4,7,13.
La principal herramienta para su prevención radica en la correcta identificación de los pacientes en riesgo de desarrollar SR, previa a la instauración del soporte nutricional13 (tabla I).
Las guías clínicas sobre soporte nutricional especializado (SNE)14,15 recomiendan antes de iniciar dicho soporte, realizar una correcta valoración médica y nutricional del paciente, asegurar la estabilidad hemodinámica, y corregir los posibles trastornos hidroelectrolíticos1,4. La instauración de la nutrición debe ser progresiva y paulatina, especialmente durante los primeros 7-10 días, hasta que el paciente esté metabólicamente estable1,13,15. Con el fin de detectar de forma precoz los signos de SR, es necesario monitorizar de forma estrecha al paciente, analizando constantes vitales, electrocardiograma, frecuencias cardíaca y respiratoria, balance hídrico y bioquímica completa incluyendo electrolitos y minerales.
Las principales recomendaciones a la hora de instaurar el SNE en un enfermo con riesgo de SR son1,5,15:
• Aporte de energía: comenzar con 10-15 kcal/kg/día (aproximadamente 1000 kcal/día). A partir del 4o día se puede aumentar el aporte de energía a 15-20 kcal/kg/día, progresando a 20-30 kcal/kg/día a partir del 7o, hasta cubrir los requerimientos del paciente. Se recomienda una distribución calórica equilibrada (50-60% carbohidratos, 30-40% lípidos y 15-20% de proteínas).
• Electrolitos: monitorizar los niveles plasmáticos antes de comenzar el aporte nutricional, 4-6h después, y posteriormente de forma diaria. Se recomienda administrar fosfato, magnesio y potasio de forma profiláctica (fosfato 0,5-0,8 mmol/kg/día o aproximadamente 10-20 mmol fosfato/1000 kcal, potasio 1-3 mEq/kg/día; magnesio 0,15-0,20 mEq/kg/día), salvo que los niveles basales del enfermo estén elevados.
• Fluidos: se aconseja restringir el aporte hídrico al máximo, garantizando el mantenimiento de la función renal e intentando conseguir balance cero. El aporte se irá adaptando en función del estado de hidratación y la ganancia de peso del paciente, teniendo en cuenta que un aumento de peso superior a 1kg/semana es atribuido a retención hídrica debiéndose disminuir el aporte de fluido.
• Aporte de sodio: se debe restringir el aporte de sodio a < 1 mmol/kg/día, especialmente ante la aparición de edema.
• Vitaminas: se aconseja la administración de 200-300mg de tiamina iv, al menos 30 minutos antes del inicio de la realimentación y continuar con 200-300mg/día durante los 3 primeros días.
En el caso presentado existe una complejidad añadida en el manejo de los iones intracelulares, debido a que el paciente desarrolla un fallo renal agudo que obliga a restringir el aporte de los mismos.
Cuando se instaura un SR es necesario suspender de forma inmediata el SNE, así como tratar las alteraciones electrolíticas asociadas (hipofosfatemia, hipopotasemia e hipomagnesemia).
La prevención, mediante una identificación de los pacientes con riesgo de sufrir SR, así como un soporte nutricional correcto y cuidadoso, es la principal herramienta para evitar su desarrollo y la morbi-mortalidad asociada.
Referencias
1. Temprano Ferreras JL, Bretón Lesmes I, De la Cuerda Compés C, Camblor Álvarez M, Zugasti Murillo A, García Peris P. Síndrome de Realimentación. Revisión. Ver Clin Esp 2005; 205(2): 79-86. [ Links ]
2. Fernández López MT, López Otero MJ, Álvarez Vázquez P, Arias Delgado J, Varela Correa JJ. Síndrome de realimentación. Farm Hosp 2009; 33(4): 183-193. [ Links ]
3. Mehanna HM, Moledina J, Travis J. Refeeding syndrome: what it is, and how to prevent and treat it. BMJ 2008; 336: 1495-8. [ Links ]
4. Kraft MD, Btaiche IF, Sacks GS. Review of the refeeding syndrome. Nutr Clin Pract 2005; 20: 625-33. [ Links ]
5. Crook MA, Hally V, Panteli JV. The importance of the Refeeding Syndrome. Nutrition 2001; 17: 632-637. [ Links ]
6. National Institute for Health and Clinical Excellence. Nutrition support in adults. Clinical guideline CG32. 2006. Disponible en www.nice.org.uk/page.aspx?o-cg032. [ Links ]
7. Gariballa S. Refeeding syndrome: A potentially fatal condition but remains underdiagnosed and undertreated. Nutrition 2008; 24: 604-606. [ Links ]
8. Hearing SD. Refeeding syndrome. BMJ 2004; 328: 908-9. [ Links ]
9. Hayek ME, Eisenberg PG. Severe hypophosphatemia following the institution of enteral feedings. Arch Surg 1989; 124: 1325-8. [ Links ]
10. Marik PE, Bedigan MK. Refeeding hypophosphatemia in an intensive care unit; a prospective study. Arch Surg 1996; 131: 1043-7. [ Links ]
11. Mehanna H, Nankivell PC, Moledina J, Travis J. Refeeding syndrome - awareness, prevention and management. Head Neck Oncol 2009; 1(1): 4. [ Links ]
12. DeFronzo RA, Cooke CR, Andres R, Faloona GR, Davis PJ. The effect of insulin on renal handling of sodium, potassium, calcium, and phosphate in man. J Clin Invest 1975; 55: 845-55. [ Links ]
13. Stanga Z, Brunner A, Leuenberger M, Grimble RF, Shenkin A, Allison SP, Lobo DN. Nutrition in clinical practice-the refeeding syndrome: illustrative cases and guidelines for prevention and treatment. Eur J Clin Nutr 2008; 62: 687-694. [ Links ]
14. National Institute for Health and Clinical Excellence. Nutrition support in adults. Clinical guideline CG32. 2006. Disponible en www.nice.org.uk/page.aspx?o-cg032. [ Links ]
15. National Collaborating Centre for Acute Care, February 2006. Nutrition support in adults: Oral nutrition support, enteral tube feeding and parenteral nutrition. National Collaborating Centre for Acute Care, London. Disponible en www.rcseng.ac.uk/publications/docs/nutrition_support_guidelines.html [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
María Eugenia Martínez Núñez
Hospital Universitario de Getafe
Carretera de Toledo, km. 12.500
28905 Getafe (Madrid), España
E-mail: meugeniamartinezn@gmail.com
Recibido: 20-IV-2010.
1a Revisión: 9-IX-2010.
Aceptado: 15-IX-2010.