Meu SciELO
Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Nutrición Hospitalaria
versão On-line ISSN 1699-5198versão impressa ISSN 0212-1611
Nutr. Hosp. vol.26 no.3 Madrid Mai./Jun. 2011
La glucemia de las primeras 24 horas no es un factor pronóstico de mortalidad en pacientes críticos
Blood glucose levels in the first 24 hours of admission is not a risk factor for mortality in critical care patients
A.L. Blesa Malpica, M. Cubells Romeral, E. Morales Sorribas, A. Tejero Redondo, F. Martínez Sagasti, J. C. Martín Benítez, M.a Garitacelaya Gorrochategui y F. Ortuño Anderiz
Servicio de Medicina Intensiva. Hospital Clínico San Carlos. Madrid. España.
Dirección para correspondencia
RESUMEN
Introducción: Las alteraciones de la glucemia han mostrado ser un factor de riesgo en patologías como la cardiopatía isquémica y el paciente neurológico. La constatación de que su control estricto en niveles estrechos de la normalidad, determinaba una disminución en mortalidad y morbilidad han dado lugar a estudios intentando corroborar los resultados y ampliar a otros campos patológicos.
Objetivos: Determinar si la alteración de la glucemia, per se, era un factor de riesgo para mortalidad en una muestra de pacientes ingresados en una unidad de medicina intensiva, con predominio de pacientes quirúrgico-traumáticos.
Métodos: Se revisan las características demográficas, analíticas y de variables de monitorización habitual en UCI, en una muestra de 2.554 pacientes correspondientes a ingresos entre el 1 de enero de 2004 y 31 de diciembre de 2008. Se extrajeron los datos de un repositorio que adquiere los datos del programa de monitorización en intensivos CareVue®. Se procesaron mediante la aplicación Excel con la utilidad hojas dinámicas, creando las variables glucemia inicial, glucemia promedio de las primeras 24 horas, y número de determinaciones. Del resto de variables analíticas y de monitorización se construyeron las correspondientes al promedio del primer día de ingreso, así como su número de determinaciones realizadas en ese primer día. La glucemia se determino en sangre completa no capilar. Para el estudio estadístico se estratifico la muestra en dos grupos: a) Muestra General (MG) y b) excluyendo a los pacientes con ingreso trás cirugía programada (EQP). En ambos se comprobó el efecto de la glucemia inicial y la promediada. El grupo b se segmento en dos según el número de determinaciones b1) una sola determinación de glucemia (EQP1) y b2) múltiples determinaciones (EQPM). De este grupo sin pacientes quirúrgicos programados, se repitió el estudio en aquellos pacientes con una duración de estancia de 3 o mas días en UCI (EQP3D). Se empleó Chi2 para variables cualitativas y Mantel Haenzel para calculo de ODD ratio; Mann-Whitney para las cuantitativas. En cada nivel de análisis, las variables con p < 0,05 y que tenían una representación superior al 60% en los datos, se incluyeron en análisis de regresión logística, con la mortalidad como variable dependiente. Se empleó el modelo saturado de inicio con backward hasta la ecuación final. Se emplearon las aplicaciones estadísticas SPSS y GSTAT 2. Se estimó como significativo p < 0,05.
Resultados y discusión: Se estudiaron un total de 2.165 pacientes de los 2.554 que ingresaron en el periodo de estudio (96,5%). Los excluidos lo fueron por carecer de determinaciones de glucemia plasmática. En el estudio bivariado, la glucemia de inicio y la promedio mostraron diferencias significativas de mortalidad, ya en cifras absolutas, en la estratificación a tres niveles (< 60 mg/dL; 60-110 mg/dL y > 110 mg/dL) y en la estratificación de normal (60 a 110 mg/dL) frente a valores anormales (< 60 o > 110 mg/dL). Esta significación se pierde al realizar el modelo logístico. Del resto de las variables empleadas, la función renal y el NEMS se muestran como factores de riesgo para la mortalidad en esta muestra.
Conclusiones: La hiperglucemia es un fenómeno prevalente en pacientes graves. La hipoglucemia es menos frecuente, y marca una mayor mortalidad. La glucemia de inicio, per se, no fue factor de riesgo para mortalidad en el estudio multivariado y a ninguno de los niveles estudiados. La glucemia promedio no añadió ningún poder de predicción. Al menos en lo relacionado a las primeras 24 horas, las alteraciones de la glucemia parecen responder más a un proceso de adaptación que marcar per se, un riesgo en el alta del paciente.
Palabras clave: Glucemia. Mortalidad. Factores de riesgo. Regresión logística. Cuidados intensivos.
ABSTRACT
Introduction: Glycemic alterations are known as a risk condition of death in several diseases, such as ischemic cardiovascular and neurological disorders. The fact that its tight control under narrow normality levels decreases mortality and morbidity have led to further studies seeking to confirm the results and expand them to other disease areas.
Objectives: To determine whether glycemic changes by themselves are a mortality risk factor in a sample of patients within an Intensive Care Unit (ICU), among which predominates traumatic-surgical patients.
Methods: Demographic and analytical characteristics were revised, as well as common monitoring variables in an ICU, among a sample of 2,554 patients from admissions between 1st January 2004 and 31 December 2008. Data were obtained from a database which endorsed records compiled with the monitoring ICU patients program "Carevue". They were processed with dynamics sheets included in the Excel software with the following variables: initial glycemia, mean glycemia during the first 24 hours and number of determinations performed. We used the mean value in the admission day of the remaining analytical and monitoring variables and the number of test performed on this first day. The sample was stratified in two groups for the statistical analysis: a) General Sample (MG) and b) sample excluding patients admitted after a programmed surgery (EQP). In both cases the effect of initial and averaged glycemia was checked. Group b was divided in two, according to the number of determinations b1) a single blood glucose determination group (EQP1) and b2) a multiple determination group (EQPM). From this group of non-programmed surgical patients the study was repeated in those patients who stayed at the ICU 3 or more days (EQP3D). Chi-square and Mantel-Haenzel test for the ODD ratio determination were performed for qualitative variables; quantitative variables were examined with the Mann-Whitney test. At each analysis level, logistic regression was performed using mortality as the dependent variable, including those variables with p-values < 0.05 which represented more than 60% of the data. An initially saturated model with backward till the final equation was used. A p-value of 0.05 (i.e. p < 0.05) was set as the significant threshold for all statistical analysis. They were performed with SPSS and GSTAT 2 statistical software.
Results and discussion: A total of 2,165 of the 2,554 admitted patients during the study period were included (96.5%). Exclusion criteria were absence of plasma glucose determinations. In the bivariate analysis, first and mean glucose blood levels showed significant differences in mortality rates in absolute figures and also when data were classified stratified in three levels (< 60 mg/dl; 60-110 mg/dl or > 110 mg/dl) or in two (normal values 60 to 110 mg/dl and unusual figures < 60 mg/dl or > 110 mg/dl). These significant differences were lost when a logistic model was applied. From the remaining variables, renal function and NEMS showed to be mortality risks factors in this sample.
Conclusions: Hyperglycemia is a predominant phenomenon in critically ill patients. Hypoglycemia is less frequent and is associated with higher mortality rates. Initial glucose blood level, by itself, was not a mortality risk factor in the multivariate study and at none of the studied levels. Average glycemia did not add any prediction power. The changes in glucose blood levels seemed to be an adaptation process, which determined by itself a risk for the patient's discharge, at least in the first 24 hours period after ICU admission.
Key words: Glycemia. Mortality. Risk factors. Logistic models. Critical care.
Introducción
La hiperglucemia inicial en enfermos graves se ha identificado como determinante independiente del pronóstico, en pacientes con trauma craneal1,2, con infarto agudo de miocardio (IAM)3-6 y en accidentes vasculares cerebrales (ACVA)7. Su control estricto ha llevado, en un grupo con predominio de pacientes postquirúrgicos cardiacos8, a ser recomendado por sociedades científicas e incluso agencias reguladoras, e instituciones sanitarias con un nivel alto9.
Se ha observado como la hiperglucemia de estrés puede ocurrir durante la fase aguda de la enfermedad en el 5 al 30% de diferentes patologías, ACVA, IAM, sepsis, quemados, trauma, quirúrgicos, entre otras. Su aparición se ha relacionado a un pronóstico peor. El mecanismo por el cual se justifica esta mayor morbi-mortalidad no está suficientemente aclarado. Son diversas las teorías invocadas para explicar la influencia de la hiperglucemia en la alteración de la capacidad de defensa frente a la infección, su influencia en el fenómeno isquémico-reperfusión y el retraso en la curación de las heridas. El aumento del estrés oxidativo, con mayor producción de superóxido, que limpian el NO endógeno, con una mayor inestabilidad eléctrica cardiaca y aumentando el tono vascular periférico al atenuar la dilatación vascular dependiente de la respuesta endotelial al NO. Puede activar la activación leucocitaria, y aumentar la interacción de estos con el endotelio tras isquemia reperfusión. La diabetes-hiperglucemia, puede atenuar el pre-condicionamiento cardiaco posiblemente inhibiendo los canales del K-ATP sensibles, que podrían ser protectores al permitir la activación de la glucólisis en el citosol10-13.
La hiperglucemia en el paciente crítico, puede ser debida a diabetes previa, sea conocida o no; intolerancia-resistencia a insulina; secundaria al estrés; o debida a alteración de la misma en el ayuno. La alteración y su variabilidad en las cifras de glucemia14 parecen ser lesivos en el humano enfermo. Esta variabilidad es mas perniciosa en pacientes no diabéticos, y aun mas la hipoglicemia en el contexto del paciente grave. Con los intentos en mantener un control estricto de glucemia se ha incrementado la aparición de la hipoglicemia. Esta es variable, pero alcanza niveles del 28,6%15. Esto ha llevado a sugerir que un control menos estricto puede conseguir resultados similares, al tiempo de disminuir la incidencia de hipoglucemias16.
Los intentos por normalizar estos "dañinos" niveles han sido objeto de estudio y sus resultados iniciales fueron muy esperanzadores8, si bien las replicas no han confirmado los hallazgos iniciales17-19. La falta de reproductibilidad reside quizás, en el tipo de paciente, postcirugía cardiaca en su mayoría, en los que además se les sometía a un aporte elevado de glucosa por vía parenteral (200-300 gramos/día), con lo que sus niveles de glucemia podrían ser más expresión de la sobrecarga, que respuesta al estrés. Otra crítica vertida sobre este artículo ha sido el elevado número de pacientes sometidos a nutrición parenteral, respecto a la práctica clínica habitual. Los pacientes con más de 3 días de ingreso fueron los más beneficiados.
La falta de eficacia del control estricto de la glucemia en la consecución de las metas propuestas por el grupo belga, podrían residir en el difícil manejo de la hiperglucemia en los límites de la normalidad en el paciente grave o bien en que realmente la hiperglucemia es un fenómeno habitual y necesario en el paciente con estrés y su extrema corrección puede ser inapropiada y contraproducente15.
Con estos antecedentes nos propusimos comprobar el efecto de la glucemia de las primeras 24 horas sobre el pronóstico en nuestra población.
Objetivo
Cuantificar las alteraciones de la glucemia en el primer día de ingreso en UCI, en una población heterogénea y su posible implicación en el pronóstico.
Material y método
Se incluyen en el estudio todos los pacientes que ingresaron en camas con historia clínica informatizada mediante la aplicación Care Vue® de la sección de neuropolitraumatizados del Servicio de Medicina Intensiva del Hospital Clínico San Carlos (8 camas de 14) desde el 1 de enero de 2004 a 31 de diciembre de 2008. Se estudian aquellos pacientes con resultados de glucemia plasmática en el primer día de ingreso. Se utilizan los datos demográficos (edad, sexo), antropométricos (altura, peso, superficie corporal-Dubois, índice de masa corporal (IMC), tipo de ingreso, resultado al alta, motivo de ingreso específico y agrupado, servicio de procedencia, servicio al que se realizaba el alta. Se recogieron variables de laboratorio como la glucemia, creatinina, hemoglobina, bicarbonato, INR, potasio, sodio, lactato, y leucocitos. Parámetros de oxigenación y ventilación: PaO2/FiO2, paO2, FiO2 del ventilador, frecuencia ventilatoria. Parámetros de monitorización: presión arterial invasiva y no invasiva; frecuencia cardiaca, temperatura corporal y finalmente se recogió el Nine Equivalents of Nursing Manpower Use Score (NEMS)20, como expresión de carga de trabajo para la enfermería e indicador de complejidad del paciente.
Todos los datos recogidos se restringieron al primer día de ingreso, salvo la estancia. Fueron importados desde una aplicación informática (SR5). Los valores clínicos son validados por la enfermera y los analíticos por el propio laboratorio antes de su exportación a Care Vue. Para la glucemia se generaron tres tablas: glucemia inicial, glucemia promedio y número de determinaciones. Para el resto de la analítica dos, el promedio y el número de determinaciones de cada variable.
En la glucemia, si solamente había una determinación, la inicial y el promedio eran coincidentes, por ello al objeto de evitar redundancias se utilizó la variable número de determinaciones de glucemia, que separaba a los pacientes en dos grupos: determinación inicial, significando una determinación y más de una determinación, expresión del promedio de la variable. En el estudio estadístico se utilizó la glucemia inicial y el promedio, mientras que en el resto de las variables se utilizó el promedio de las primeras 24 horas, independientemente del número de determinaciones que cada variable fuese estimada. Solo se utilizaron determinaciones plasmáticas de glucemia.
Con la creatinina, el cociente pO2/FiO2; la presión arterial invasiva y no invasiva, la edad, el IMC, el tipo de ingreso, la causa del ingreso y la glucemia se hicieron estratos en dos o tres niveles.
Las variables cuantitativas se estratificaron: la creatinina se estimó como normal en función de su nivel plasmático, cuando este era inferior a 1,2 mg/dL; hasta 2 mg/dL se consideró que podría existir una función renal alterada, y por encima de 2 mg/dL, se definió como fallo renal. Los estratos del índice paO2/FiO2 se definieron según la literatura21 en < 200 mm Hg como síndrome de distrés respiratorio agudo, entre 200 y 300 como lesión aguda pulmonar y por encima de los 300 mm Hg como valor normal. La presencia de valores derivados de la gasometría, están representados en el estudio en un número menor de muestras, por el motivo comentado con anterioridad. Los 60 mm Hg de presión arterial media se estimó como umbral de hipotensión, tanto en la presión arterial invasiva como en la no invasiva22.
Se establecieron niveles de glucemia menores de 60 mg/dL para la hipoglucemia, y superiores de 110 mg/dL para la hiperglucemia, el estrato intermedio correspondió a la normalidad. Se estratificaron también en normal y anormal, donde en este último se recogían ambos extremos de glucemia. Según el número de determinaciones de glucemia en el primer día se establecieron dos estratos: 1 determinación y más de una determinación, siendo el máximo recogido de hasta 5 determinaciones (se refiere a glucemias plasmáticas, no capilares). La elección de estos límites reflejan los niveles de normalidad del laboratorio para el paciente en ayuno. Se ha incrementado de 100 a 110 mg/dL, al ser esta la cifra superior empleada en los estudios de control estricto de la glucemia. A efectos del estudio multivariado se hizo estratificación de la glucemia en seis niveles: 1: de 80 a 110 mg/dL; 2: 111 a 144 mg/dL; 3: 145 a 180 mg/dL; 4: 181- 200 mg/dL; 5: > 200 mg/dL y 6: < 80 mg/dL.
Las variables demográficas solo precisaron una tabla que sirvió de base. Todas las tablas se exportaron a SPSS, y se unificaron mediante el campo común del número de historia clínica.
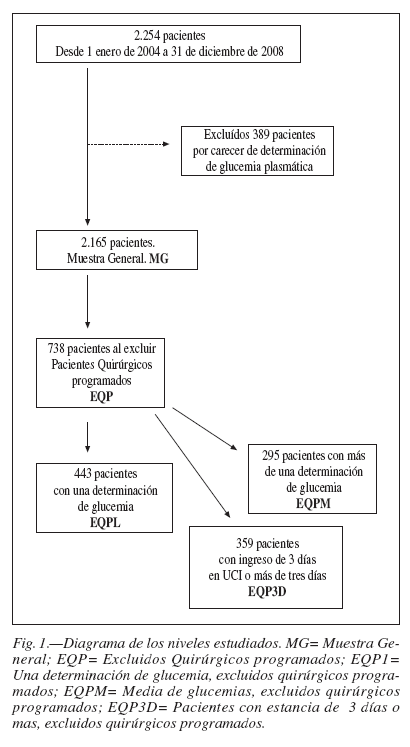
Del total de 2.554 ingresados en ese periodo de tiempo, se excluyeron 389 pacientes, por falta de glucemia plasmática, siendo 2.165 los finalmente estudiados (96,5% del total). Esta falta de datos tuvo múltiples causas: falta de sincronía de las aplicaciones del laboratorio con CareVue por inadecuada codificación en laboratorio; pacientes manejados con glucemias capilares; caídas del sistema informático; cambio en la aplicación informática del laboratorio y demora en la resincronización con CareVue fundamentalmente.
Los diferentes niveles de estudio se esquematizan en la figura 1.
Se realizaron cinco estratos de análisis: Muestra General (MG) (2.165 pacientes); excluidos los pacientes quirúrgicos (EQP) (738); excluidos pacientes quirúrgicos programados con una sola determinación de glucemia (EPQ1) (443) y con múltiples determinaciones de glucemias, excluidos los quirúrgicos programados (EPQM) (295) y uno final de los pacientes que excluidos los quirúrgicos programados, permanecieron 3 o más días ingresados en UCI (EPQ3D) (379).
Se hizo estudio comparativo del comportamiento de las variables en vivos y fallecidos, mediante tablas de contingencia y determinación del Chi2 en las variables cualitativas. Mediante Mantel Haenzels se calculó la Odd ratio cruda. Para las cuantitativas, con distribución no normal, se empleó el test de U de Mann-Whitney. La presentación de los datos se hace mediante porcentajes en relación a la muestra general y la especifica al nivel de estudio, y con la mediana y rango intercuartílico 25-75 (Apéndice). Se estimó un nivel de p < de 0,05 como significación.
Para el estudio multivariado se utilizo la regresión logística de forma que la variable dependiente fuese el alta = exitus. Las independientes fueron todas las variables que resultaron con significación y que superaban el 60% de representación en el nivel de estudio. La glucemia se incluyo de forma obligada, fuese o no significativa en el análisis bivariado, y de forma excluyente, de forma que cuando se utilizaba una expresión de glucemia, por ejemplo glucemia inicial, el resto de las expresiones de glucemia no eran incluidas en ese calculo. En la tabla II, se especifican dentro de la columna inicial las diferentes expresiones de glucemia que se efectuaron; en la segunda, las covariables que se mantenian en cada estudio de regresión. Las columnas siguientes expresan el nivel de significación, la Odd ratio (OR) y el intervalo de confianza (IC) al 95%. Con pequeñas variaciones, la OR y el IC se mantuvo similar con independencia de la glucemia empleada.
Se utilizaron las variables estratificadas sobre las cuantitativas, para la misma variable, siendo excluyentes. En la tabla II se señalan las variables independientes, que en el análisis bivariado mostraron diferencias con significación respecto al resultado del alta (vivo/exitus). Aquellas variables, que aun siendo significativas tuvieron escasa presencia, por ejemplo las derivadas del intercambio gaseoso, fueron retiradas al objeto de contar con suficiente casuística en cada estrato de análisis.
Se utilizó el modelo saturado de inicio con eliminación progresiva de variables hasta las definitorias (backward Wald). Se comprobó la homogeneidad de la muestra mediante la prueba de Hosmer y Lemeshow.
Se emplearon los paquetes estadísticos SPSS 15 para Windows® y G-Stat 2.0®.
Resultados
De los 2.565 pacientes iniciales se estudiaron 2165 en cuya analítica constaban resultados de glucemia plasmática. En la tabla I se muestra las características demográficas de los diferentes estratos. Predominaron en todos los niveles, los hombres, pero mientras que en la Muestra General (MG) eran los quirúrgicos, en las demás lo fueron traumáticos y médicos.
En la MG la distribución por sexo es muy similar con un 54,9% de hombres. Predominan los pacientes quirúrgicos (68,3%); el ingreso programado (55,9%); los jóvenes puesto que el 58,4% era menor de 65 años y con un aceptable buen estado nutricional (80% con IMC entre 20 y 30). Se mortalidad fue del 6,7%, con un 4,4% de casos perdidos. Cuando excluimos a los pacientes programados postquirúrgicos (EQP), la muestra se reduce a 738 pacientes. El 67,1% son varones; el trauma y el paciente medico predomina sobre el quirúrgico; el ingreso en su mayoría es urgente (96,6%), con un incremento en la mortalidad hasta el 16,3% (5,1% casos perdidos), siguen siendo jóvenes y con buen estado nutricional. Al fragmentar este grupo de pacientes en función del número de determinaciones de glucemia (EQP1 y EQPM), se mantienen las características expresadas, salvo en el caso de la mortalidad que es casi un 4% superior en el subgrupo EQPM.
Los 379 pacientes que permanecieron ingresados mas de 3 días y no eran postquirúrgicos programados (EQP3), mostraban características similares a los dos grupos precedentes tanto en el predominio masculino, el ingreso por trauma o causa medica, el carácter urgente del mismo, la frecuente presencia de pacientes menores de 65 años, el buen estado nutricional y la mortalidad similar (17,2% con 5% de pacientes perdidos).
En la tabla II se reflejan los resultados de los diferentes estudios de regresión realizados. En ningún estrato de muestra, ni con ninguna expresión de glucemia empleada se obtuvo un resultado que mostrase a la glucemia como una variable independiente de riesgo de mortalidad. En la MG se utilizó la glucemia estratificada ya fuese inicial o promediada; la glucemia dual (norma/anormal) tanto inicial como promediada y la glucemia estratificada en 6 niveles. Las covariables, en este nivel de estudio, fueron las mas numerosas, pero solo resultaron con significación las derivadas de la función renal, el ingreso urgente, el potasio y el NEMS.
En el nivel EQP con un número semejante de cova-riables, la utilización de estratos de glucemia promediada o inicial, mostraron significación las variables relacionadas con la estratificación de la creatinina, el NEMS, y el ingreso por trauma o medico sobre el quirúrgico. En este nivel cuando se utilizo la estratificación dual o los 6 niveles de glucemia, desapareció la significación para el tipo de motivo de ingreso (trauma, médico), permaneciendo la significación de los estratos de creatinina, y el NEMS.
Para el nivel EQP1 se utilizaron como variables obligadas la dual glucemia inicial, la glucemia inicial, y la glucemia en 6 estratos. Solo NEMS y urea mostraron significación. En el nivel EQPM y utilizando las variables obligadas estrato glucemia promedio, dual promedio, y glucemia en 6 estratos, solo el NEMS resulto con significación. Finalmente en el nivel de EQP3 con cuatro diferentes estudios, lo fueron el NEMS y la urea.
Discusión
Se ha descrito repetidamente en la literatura que la elevación de las cifras de glucemia en el paciente no diabético, es un factor que incrementa la mortalidad y morbilidad en patologías como el trauma craneal1-2, el accidente vascular cerebral7 y el infarto agudo de miocardio3-6. La extensión de la lesión primaria, la determinación de un mayor tamaño del infarto, la pérdida del pre-condicionamiento isquémico, hacen que órganos como el corazón, disfuncionen con mayor intensidad en presencia de hiperglucemia. La hipoglucemia, por otro lado, también ha sido un factor condicionante de morbilidad y mortalidad en pacientes con trauma craneal, determinando un mayor riesgo para la supervivencia23-24.
En nuestro estudio, en un grupo heterogéneo de pacientes ingresados en una UCI cuyos ingresos preferentes son postquirúrgicos programados, no hemos podido encontrar esta relación entre incremento de la glucemia y mayor riesgo de mortalidad. Intentando excluir paciente de menor gravedad y con menor estrés, se excluyeron todos los pacientes quirúrgicos ingresados de forma programada, sin que tampoco pudiésemos encontrar ese mayor riesgo de mortalidad. Existen estudios que como en nuestro caso, no han encontrado relación entre hiperglucemia y mortalidad en diferentes grupos de pacientes "graves".
Los modelos predictivos o de valoración de gravedad (APACHE II, SAPS II, MOF, MARSHALL, LODS, SOFA)25, no contemplan a la glucemia como una variable de peso que requiera ser incluida en ellos. Esto contrasta con los hallazgos de los grupos de pacientes graves en los que sí parece haber una relación pronóstica entre la hiperglucemia y el desenlace final. Solamente en los escores relacionados con pancreatitis26-28, es estimada la glucemia como una variable a considerar y solo en la valoración inicial.
La aparición del estudio Leuven 18 en pacientes de predominio quirúrgicos, fue una llamada de atención, afirmando que el mantener la glucemia dentro de sus límites de normalidad, lo que se dio por denominar como el control estricto de la glucemia, conllevaba una disminución significativa de la mortalidad, una disminución de la disfunción orgánica, y de infecciones entre otros hechos ventajosos. Tras éste, aparecieron nuevos estudios que corroboraban sus resultados29-31, aunque pequeños o retrospectivos con controles históricos. La asunción de la bondad de estos resultados dio lugar a su valoración con alto valor de evidencia y por tanto con un nivel elevado de recomendación. Sin embargo ensayos posteriores, no pudieron corroborar estos prometedores hallazgos, de manera que los estudios Visep17, y Glucontrol19 hubieron de suspenderse con anticipación por los efectos deletéreos con esta práctica (mayor hipoglucemia y mayor violación de protocolo, respectivamente). En el 2006 el mismo grupo belga, no consiguió encontrar resultados similares en pacientes médicos en UCI32. El último ensayo aparecido sobre el tema, Nice Sugar33, determinó que no hay ventaja en la limitación tan estrecha de la glucemia, y que existe riesgo de mortalidad aumentada en el grupo de mayor rigor terapéutico. Aconsejan niveles de control más relajados, evitando hiperglucemia superiores a 180 mg/dL. Esta aproximación más prudente al control estricto de la glucemia hace que en las guías canadienses, en su actualización de 2009 (punto 10.4)1, modifican su recomendación a mantener la glucemia en la vecindad de 8 mmol/L (7-9 mmol/L)2. Si bien algún tipo de pacientes podrían beneficiarse del control estricto, como los pacientes quirúrgicos34.
La justificación de esta disparidad de resultados se puede hallar en las diferencias existentes entre el trabajo del grupo belga, que estudia una muestra tratada especifica de baja mortalidad, aporte fuera de la practica habitual de alta carga hidrocarbonada al inicio, tipo de enfermos, relación enfermera/paciente, alto porcentual de pacientes con nutrición mixta, que en su conjunto se aleja de la practica común en UCI. Mientras que en los otros se argumenta que los beneficios son sobrepasados por la aparición de una inusitada frecuencia de hipoglucemias y su importante repercusión funcional17,19,33. En el Nice Sugar33, trabajo con mayor número de pacientes reclutados hasta la fecha, se vio un incremento de la mortalidad en el grupo de estudio, si bien a los 90 días. Un articulo reciente35, señala estas diferencias importantes que hacen cuestionable la comparación del estudio belga con el Nice Sugar. Básicamente se puede resumir en que mientras que uno es unicéntrico, el otro es multicéntrico; los niveles de glucemia del grupo control son diferentes (180-215 mg/dL frente a 140-180 mg/dL); el número de pacientes en cada estudio; el tipo de los pacientes (predominantemente homogéneo frente a grupo heterogéneo medico-quirúrgico; porcentaje de pacientes que alcanzan el control glicémico deseado (70% frente al 50%); la determinación de las glucemias, el método de dispensa de la insulina, la duración de la terapia y finalmente la diferencia de los resultados en mortalidad y morbilidad. De todas estas diferencias, en nuestra opinión las más relevantes quizás sean los niveles de glucemia del grupo control, pues mientras que en el estudio belga, el nivel de glucemia está dentro del rango claro de lo patológico y dañino, el Nice-Sugar mantiene unos niveles de glucemia que han sido estimados hasta como fisiológicos en el entorno del paciente crítico y por tanto deseables. Probablemente en este punto resida uno de los fundamentos que justifiquen la desigualdad en los resultados obtenidos por cada uno de los estudios.
Aun antes de disponer de los resultados de este estudio, y señalando el precedente, un metanálisis9 concluía que por el momento, no había asociación entre el control estricto de la glucemia y la reducción de la mortalidad o la necesidad de diálisis. Solo los episodios de sepsis eran menos frecuentes, y solo en relación a los pacientes quirúrgicos. Llegan a sugerir la procedencia de revisión de las guías que recomendasen el control estricto de la glucemia, hasta la existencia de resultados más extensos y definitivos, advirtiendo del riesgo cierto en el incremento de los episodios de hipoglucemia, que si bien no es posible relacionar directamente con incremento de mortalidad por su causa, puede ser un factor que la favorezca o bien señale la gravedad de la enfermedad.
No hay pues, por el momento, evidencia suficiente para aconsejar la persecución de control estricto de la glucemia, aunque existan recomendaciones relevantes con tal objetivo, quedando pendiente delimitar el grupo de pacientes, así como el momento y nivel de control, en los que esta estrategia pudiera ser beneficiosa. De forma llamativa la Sociedad Europea de Alimentación Enteral y Parenteral (ESPEN), en relación a este aspecto aconseja en sus guias36 unos niveles menos estrictos de control glicémico, advirtiendo con nivel de recomendación A, la presencia aumentada de la hipoglucemia en pacientes con control estricto de la glucemia.
Finalmente se ha sugerido que la glucemia en las primeras 48 horas expresa más la adaptación del paciente gravemente agredido, que una intolerancia o resistencia a la utilización de la glucemia. Esto podría estar en la base de que durante al menos ese tiempo, no debería modificarse, dentro de límites razonables, comenzando su manipulación farmacológica y/o dietética a partir del tercer día. Tampoco existe evidencia que sostenga esta afirmación, pero en el segundo estudio del grupo belga32, en pacientes médicos, eran estos, los que se mantenían más de tres días en UCI, los que mostraban mejores resultados.
El concepto de resistencia a la insulina, se fundamenta en la intención del organismo lesionado en ofertar el nutriente principal de las células de rápida replicación, posponiendo su utilización por otras células menos relevantes en el centro de la agresión. Un ejemplo clarificador es el muscular que en situación de agresión se vuelve impermeable a la entrada de glucosa, salvo que sea lesionado en cuyo caso se trasforma en "órgano preferencial".
Hay estudios, que como el presente, no encuentran que la glucemia inicial, o la de ayuno o incluso la promediada del primer día, sea indicador de riesgo per se, al menos de forma general para los pacientes en estado critico37-39. Esta hiperglucemia expresa, mas bien, un grado de mayor lesión y es esta intensidad, la que verdaderamente determina el riesgo.
Se ha demostrado que la variabilidad de la modificación de la glucemia puede ser un factor que exprese riesgo, pero esta variabilidad aparece o se calcula con posterioridad, por lo que su valor como indicador pronóstico desaparece14,40.
El trabajo presentado tiene debilidades. Es un estudio retrospectivo con las limitaciones derivadas del mismo; no se han estimado la participación de pacientes previamente diabéticos; ni el tipo de la misma; no hay determinación de la terapéutica empleada que pudiera modificar las cifras de glucemia (esteroides, insulina, antidiabéticos orales...); el tipo de pacientes es variado, predominando pacientes quirúrgicos en la MG, y traumáticos y médicos en los demás niveles.
Tiene sin embargo la ventaja de proceder de un sistema semiautomático, donde los valores de las diferentes variables han sido introducidas de forma automática y auditadas por el personal de enfermería o analistas antes de su incorporación a la base.
La estratificación puede ser discutible, principalmente la relacionada con la glucemia, pero su defecto desaparecería una vez es contemplada en el análisis de regresión como una variable continua y en este caso tampoco señaló un especifico incremento del riesgo de fallecer relacionada con ella. Con una estratificación de la glucemia inicial en 6 niveles, e incluidas en el análisis multivariado, siendo el referente de comparación el estrato de normalidad (80-110 mg/dL) no han mostrado variación alguna en los resultados (datos no mostrados).
La conclusión que se puede sacar del estudio es que la hiperglucemia es frecuente en los pacientes ingresados en UCI, y esta presente ya desde la primera determinación al ingreso. Que habitualmente los pacientes en su mayoría están normonutridos, según el IMC, aunque no se puede descartar la presencia de malnutrición proteica; y que no parece existir una relación directa entre las cifras de glucemia al ingreso y el resultado final del paciente. Ni tampoco el promedio de las glucemias del primer día, parece indicar algo diferente a lo señalado ni aumentan la capacidad de predicción de la glucemia inicial.
La glucemia inicial expresa, posiblemente, más una respuesta "fisiológica" a la agresión que ser un factor de riesgo para la supervivencia del paciente. Y por tanto su control estricto, al menos en la fase inicial de la enfermedad, puede conllevar más riesgos que beneficios.
Queda por determinar si la hiperglucemia mantenida más allá de los primeros días tiene otro significado y cual sería su umbral de inicio en el efecto deletéreo.
Muchas fueron las variables que mostraban, en la comparación bivariada, significación, pero de forma repetida, la variable que permanecía como factor de riesgo per se, una vez se realizaba el ajuste mediante la regresión logística, era el NEMS. Esta variable es utilizada por la enfermería41 para señalar las cargas de trabajo que los pacientes generan y en función de ello, se ha usado para la gestión de personal, e incluso en la decisión del alta de pacientes a niveles asistenciales de menor intensidad. Hay estudios que han correlacionado esta variable con el APACHE II mostrados un r superior a 0,6, y por tanto expresando que aquellos pacientes con mayor gravedad son los que generan una mayor carga de trabajo42, 43. Quizás su contemplación como factor pronóstico mereciese un estudio en mayor profundidad44-46.
Conclusiones
En la muestra analizada no se encuentra una mayor mortalidad relacionada con los niveles de glucemia, ni basal ni la promediada del primer día. Ni en pacientes con predominio quirúrgicos programado (MG), ni en pacientes no quirúrgicos con ingresos en UCI de forma urgente.
Llama la atención que el nivel de carga asistencial, marcado por el NEMS, si lo muestre de forma significativa. Esto sugiere la necesidad de investigar dicho NEMS como factor predictor de mortalidad.
Referencias
1. Margulies DR, Hiatt JR, Vinson D, Jr., Shabot MM. Relationship of hyperglycemia and severity of illness to neurologic outcome in head injury patients. Am Surg 1994; 60 (6): 387-90. [ Links ]
2. Young B, Ott L, Dempsey R, Haack D, Tibbs P. Relationship between admission hyperglycemia and neurologic outcome of severely brain-injured patients. Ann Surg 1989; 210 (4): 466-72; discussion 72-3. [ Links ]
3. Vanhorebeek I, Ingels C, Van den Berghe G. Intensive insulin therapy in high-risk cardiac surgery patients: evidence from the Leuven randomized study. Semin Thorac Cardiovasc Surg 2006; 18 (4): 309-16. [ Links ]
4. Hasin T, Eldor R, Hammerman H. Intensive insulin therapy in the intensive cardiac care unit. Acute Card Care 2006; 8 (4): 181-5. [ Links ]
5. Hahn R. Reduced mortality of intensive care patients by insulin therapy. The effect is especially evident in connection with heart surgery. Lakartidningen 2002; 99 (5): 374-5. [ Links ]
6. Capes SE, Hunt D, Malmberg K, Gerstein HC. Stress hyperglycaemia and increased risk of death after myocardial infarction in patients with and without diabetes: a systematic overview. Lancet 2000; 355 (9206): 773-8. [ Links ]
7. Capes SE, Hunt D, Malmberg K, Pathak P, Gerstein HC. Stress hyperglycemia and prognosis of stroke in nondiabetic and diabetic patients: a systematic overview. Stroke 2001; 32 (10): 2426-32. [ Links ]
8. Van Den Berghe G, Wouters P, Weekers F, Verwaest C, Bruyn-inckx F, Schetz M et al. Intensive insulin therapy in the critically ill patients. N Engl J Med 2001; 345 (19): 1359-67. [ Links ]
9. Wiener RS, Wiener DC, Larson RJ. Benefits and Risks of Tight Glucose Control in Critically Ill Adults: A Meta-analysis. JAMA 2008; 300 (8): 933-44. [ Links ]
10. Groeneveld AJ, Beishuizen A, Visser FC. Insulin: a wonder drug in the critically ill? Critical Care 2002; 6 (2): 102-05. [ Links ]
11. Lipshutz AKM, Grooper MA. Perioperative glycemic control: an evidence-based review. Anesthesiology 2009; 110 (2): 408-21. [ Links ]
12. Preiser J-C. Restoring normoglycaemia: not so harmless. Critical care (London, England) 2008; 12 (1): 116. [ Links ]
13. Thompson LH, Kim HT, Ma Y, Kokorina NA, Messina JL. Acute, muscle-type specific insulin resistance following injury. Mol Med 2008; 14 (11-12): 715-23. [ Links ]
14. Egi M, Bellomo R, Stachowski E, French CJ, Hart G. Variability of blood glucose concentration and short-term mortality in critically ill patients. Anesthesiology 2006; 105 (2): 244-52. [ Links ]
15. Arabi YM, Dabbagh OC, Tamim HM, Al-Shimemeri AA, Memish ZA, Haddad SH et al. Intensive versus conventional insulin therapy: a randomized controlled trial in medical and surgical critically ill patients. Crit Care Med 2008; 36 (12): 3190-7. [ Links ]
16. Azevedo JRAd, Lima ERM, Cossetti RJD, Azevedo RPd. Intensive insulin therapy versus conventional glycemic control in patients with acute neurological injury: a prospective controlled trial. Arq Neuropsiquiatr 2007; 65 (3B): 733-8. [ Links ]
17. Brunkhorst FM, Engel C, Bloos F, Meier-Hellmann A, Ragaller M, Weiler N et al. Intensive insulin therapy and pentastarch resuscitation in severe sepsis. N Engl J Med 2008; 358 (2): 125-39. [ Links ]
18. Finfer S, Chittock DR, Su SY, Blair D, Foster D, Dhingra V, et al. Intensive versus conventional glucose control in critically ill patients. N Engl J Med2009; 360 (13): 1283-97. [ Links ]
19. Preiser JC, Devos P, Ruiz-Santana S, Melot C, Annane D, Groeneveld J et al. A prospective randomised multi-centre controlled trial on tight glucose control by intensive insulin therapy in adult intensive care units: the Glucontrol study. Intensive Care Med 2009; 35 (10): 1738-48. [ Links ]
20. Miranda DR, Moreno R, Iapichino G. Nine equivalents of nursing manpower use score (NEMS). Intensive Care Med 1997; 23 (7): 760-65. [ Links ]
21. Bernard GR, Artigas A, Brigham KL, Carlet J, Falke K, Hudson L et al. The American-European Consensus Conference on ARDS. Definitions, mechanisms, relevant outcomes, and clinical trial coordination. Am J Respir Crit Care Med 1994; 149 (3 Pt 1): 818-24. [ Links ]
22. Antonelli M, Levy M, Andrews PJ, Chastre J, Hudson LD, Manthous C et al. Hemodynamic monitoring in shock and implications for management. International Consensus Conference, Paris, France, 27-28 April 2006. Intensive Care Med 2007; 33 (4): 575-90. [ Links ]
23. Bilotta F, Caramia R, Paoloni FP, Delfini R, Rosa G. Safety and efficacy of intensive insulin therapy in critical neurosurgical patients. Anesthesiology 2009; 110 (3): 611-9. [ Links ]
24. Krinsley JS, Grover A. Severe hypoglycemia in critically ill patients: risk factors and outcomes. Crit Care Med 2007; 35 (10): 2262-7. [ Links ]
25. García de Lorenzo A. Scores pronósticos y criterios diagnósticos en el paciente critico. Majadahonda (Madrid): Ediciones Ergon, S.A., 2002. [ Links ]
26. Anglade D, Letoublon C, Russier Y, Stasia MJ, Lachachi F, Desroche E et al. Is it useful to maintain specific scores for the early determination of the severity of acute pancreatitis?. Ann Chir 2000; 125 (4): 325-33. [ Links ]
27. Blamey SL, Imrie CW, O'Neill J, Gilmour WH, Carter DC. Prognostic factors in acute pancreatitis. Gut 1984; 25 (12): 1340-6. [ Links ]
28. Ranson JH, Rifkind KM, Roses DF, Fink SD, Eng K, Spencer FC. Prognostic signs and the role of operative management in acute pancreatitis. Surg Gynecol Obstet 1974; 139 (1): 69-81. [ Links ]
29. Gabbanelli V, Pantanetti S, Donati A, Principi T, Pelaia P. Correlation between hyperglycemia and mortality in a medical and surgical intensive care unit. Minerva Anestesiol 2005; 71 (11): 717-25. [ Links ]
30. Finney SJ, Zekveld C, Elia A, Evans TW. Glucose control and mortality in critically ill patients. JAMA 2003; 290 (15): 2041-7. [ Links ]
31. Krinsley JS. Effect of an intensive glucose management protocol on the mortality of critically ill adult patients. Mayo Clin Proc 2004; 79 (8): 992-1000. [ Links ]
32. Van den Berghe G, Wilmer A, Hermans G, Meersseman W, Wouters PJ, Milants I et al. Intensive insulin therapy in the medical ICU. N Engl J Med 2006; 354 (5): 449-61. [ Links ]
33. Investigators N-SS, Finfer S, Chittock DR, Su SY-S, Blair D, Foster D et al. Intensive versus conventional glucose control in critically ill patients. N Engl J Med 2009; 360 (13): 1283-97. [ Links ]
34. Griesdale DE, de Souza RJ, van Dam RM, Heyland DK, Cook DJ, Malhotra A et al. Intensive insulin therapy and mortality among critically ill patients: a meta-analysis including NICE-SUGAR study data. CMAJ 2009; 180 (8): 821-7. [ Links ]
35. Scurlock C, Raikhelkar J, Mechanick JI. Critique of normo-glycemia in intensive care evaluation: survival using glucose algorithm regulation (NICE-SUGAR) - a review of recent literature. Curr Opin Clin Nutr Metab Care 2010; 13: 211-4. [ Links ]
36. Singer P, Berger MM, Van den Berghe G, Biolo G, Calder P, Forbes A et al. ESPEN Guidelines on Parenteral Nutrition: intensive care. Clinical nutrition (Edinburgh, Scotland) 2009; 28 (4): 387-400. [ Links ]
37. Christiansen C, Toft P, JØrgensen HS, Andersen SK, TØnnesen E. Hyperglycaemia and mortality in critically ill patients. A prospective study. Intensive Care Med 2004; 30 (8): 1685-8. [ Links ]
38. Ligtenberg JJ, Meijering S, Stienstra Y, van der Horst IC, Vogelzang M, Nijsten MW et al. Mean glucose level is not an independent risk factor for mortality in mixed ICU patients. Intensive Care Med 2006; 32 (3): 435-8. [ Links ]
39. Whitcomb BW, Pradhan EK, Pittas AG, Roghmann MC, Perencevich EN. Impact of admission hyperglycemia on hospital mortality in various intensive care unit populations. Crit Care Med 2005; 33 (12): 2772-7. [ Links ]
40. Egi M, Bellomo R, Reade MC. Is reducing variability of blood glucose the real but hidden target of intensive insulin therapy? Crit Care 2009; 13 (2): 302. [ Links ]
41. Barroso Díaz A, Fuente Juárez AI, López Cid JJ, Millán Vázquez FJ, Rosado Muñoz N, Simón García MJ et al. Analysis of the use of nursing personnel in a general intensive care unit. Situation in other european ICUs. Enferm Intensiva 2001; 12 (3): 127-34. [ Links ]
42. Robas Gómez A, Romero Romero V, García García R, Sánchez Martín R, Cabestrero Alonso D. Is the NEMS scale useful to describe homogeneously a population of patients in Intensive Care?. Enferm Intensiva 2007; 18 (2): 70-7. [ Links ]
43. Gómez Ferrero O, Mateo Marín E, Marín Vivo G, Salas Campos L. Care levels in an intensive care unit. Analysis of therapeutic requirements and severity scales. Enferm Intensiva 1999; 10 (1): 13-21. [ Links ]
44. Iribarren-Diarasarri S, Aizpuru-Barandiaran F, Muñoz-Martínez T, Loma-Osorio Á, Hernández-López M, Ruiz-Zorrilla JM et al. Health-related quality of life as a prognostic factor of survival in critically ill patients. Intensive Care Med 2009; 35 (5): 833-39. [ Links ]
45. Iapichino G, Morabito A, Mistraletti G, Ferla L, Radrizzani D, Reis Miranda D. Determinants of post-intensive care mortality in high-level treated critically ill patients. Intensive Care Med 2003; 29 (10): 1751-56. [ Links ]
46. Moreno R, Miranda D, Matos R, Fevereiro T. Mortality after discharge from intensive care: the impact of organ system failure and nursing workload use at discharge. Intensive Care Med 2001; 27 (6): 999-1004. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Antonio Blesa Malpica.
Hospital Clínico San Carlos. Madrid.
E-mail: ablesamal@gmail.com
Recibido: 3-VIII-2010.
1a Revisión: 20-XI-2010.
Aceptado: 4-III-2011.